猪瘟疫苗在猪场的免疫评估
2018-04-16翟志安崔尚金
翟志安,崔尚金
(中国农业科学院北京畜牧兽医研究所,北京 100000)
通过对近10年来的调查,国内猪场的猪瘟疫苗免疫覆盖率可以说是100%,没有发现哪个猪场不免疫猪瘟疫苗。但免疫程序却有较大不同,次数不同,剂量不同,间隔时间不同,后备猪群:配种前免疫2~3次,1~4头份/次;种猪群大概有2种免疫方式,l)全群免疫:每次1~4头份不等,①全群普免,每年3~4次,每3~4月1次;②春秋普防,3~4月份,免疫2次,间隔3~4周;9~10月份,免疫2次,间隔3~4周;2)跟胎免疫:每次1~4头份不等,①跟胎1次,产后2~4周;②跟胎2次,产后2~4周,间隔3~4周,第2次免疫。商品猪群,有些猪场仍然采取乳前免疫(超前免疫)l头份;仔猪群首免时间,3~5周龄,1~2头份;二免时间:7~9周龄,1~2头份[1]。
在国内猪场,猪瘟疫苗得以广泛应用,但免疫效果到底如何呢?许多中小型猪场基本是通过临床是否发病来判断疫苗效果;集团化、大型猪场大都进行实验室检测予以判定。2017年第2季度对4个不同省份28个猪场的猪瘟抗体检测数据进行分析,结果发现不同胎次组母猪猪瘟抗体水平不同(见表1):4~7胎母猪抗体水平显著低后备母猪和l~3胎母猪。所以说,母猪胎次对猪场猪瘟杭体合格率有重要影响,及时淘汰生产繁殖性能差的老龄母猪不仅有助于提高母猪场生产成绩,也有助于提升猪群猪瘟抗体水平。
同样的这28个猪场,其商品猪群不同周龄段的猪瘟抗体水平也有不同,如表2所示,3~4周龄、6~7周龄段的猪群猪瘟抗体水平偏低。在仔猪首免前的抗体,主要是母源抗体,可见母源抗体在3~4周龄猪群中已有相当大的消失;6~7周龄的猪群猪瘟抗体有所下降,这部分猪群大都是首免1~2周后不等的猪群;10周龄猪群,是首免4~5周不等的猪群,也是加强免疫前后1周左右的猪群。12周龄猪群抗体阳性率最高。这些抗体是疫苗免疫产生还是由野毒感染刺激产生,该检测技术没有进行区分。总体来看,商品猪群猪瘟抗体阳性率并不高。
在2016年对23省份457份血清样品检测(图1,李晓成研究员资料)发现,保育猪群的抗体阳性率最低,其次是生长育肥猪群。

表1 不同胎次母猪抗体水平

表2 不同周龄段猪瘟抗体水平
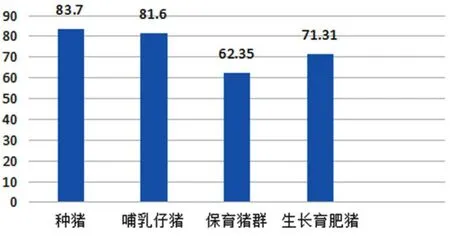
图1 2016年不同生长阶段猪群抗体阳性率
母猪群的抗体阳性率与2017年的数据非常接近,差异较大的是哺乳仔猪群与上述3~4周龄猪群的抗体阳性率。总之,种猪群免疫率100%,阳性率80%以上;保育猪群阳性率较低,低于70%。仔猪群首免(断奶前后)与加强免疫之间,大约有4~5周时间,抗体阳性率比较低,这是个普遍现象。
在这样的免疫状态下,某些猪场虽然猪群100%免疫,但仍有猪瘟发生的情形。说明这样的免疫状态是不安全的,是疫苗质控方面,如抗原含量及批次生产的稳定性,出现了什么问题?还是疫苗冷链管理(疫苗运输、贮存、稀释、注射)出现了漏洞?或许,疫苗毒株保护力对现在猪场野毒保护力下降?免疫程序制定、修订、实施的不够合理、到位?群免疫密度没有达到100%?免疫操作粗放?还是机体免疫应答弱?猪群健康状态(营养、毒素、应激、其他疾病……)不佳?或者猪场生物安全措施管理疏忽?猪群流动管理异常?目前,我们尚没有一个很好的评估机制来全面评估这些问题。一旦出现问题,不容易正确全面地找出原因,很多时候就是采取一个模糊策略,问题解决了以后,也不知道采取的手段哪些是有效的;还有个问题,就是大多数实验室检测的数据是一个时间点,而不是一个连续的动态的线,不能借助检测数据等评估手段正确预警。
当下我们所要做的,就是要制定适合猪群的合理免疫程序,发挥出现有疫苗的应有效果。值得说明的是,免疫程序制定应建立在科学检测的基础上,必须了解:1)猪瘟抗体消长规律;2)猪体排毒方式;3)猪群临床症状;4)猪瘟疫苗起效时间和免疫保护时长以及其他疫苗对猪瘟疫苗的影响;5)存在的其他猪病免疫程序制定后,要对免疫实施后的各生产阶段猪群进行抗体、病原监测,及生产成绩评估,根据这些监测、评估的数据,进行分析,对免疫程序适时做出调整[1];6)是否有其他免疫抑制病的干扰。
那么,如何科学地检测猪瘟疫苗的免疫效果?下面就介绍一下不同试剂盒对猪瘟疫苗免疫效果检测评价。
1 4种检测方法评价疫苗免疫效果
如表3所示,67份猪瘟疫苗免疫血清样品经中和试验、IHA(间接血凝试验)、间接ELISA和阻断ELISA检测后,分别检测出阳性样品55份、48份、56份和59份,阳性率分别为82.09% , 71.64%, 83.58% 和 88.06%,阳性率均大于我国农业部要求的猪瘟群体免疫合格率70.0%的标准,所抽检的猪群猪瘟疫苗免疫合格。
如表4所示,IHA、间接ELISA、阻断ELISA与中和试验的总符合率分别为89.55%、92.53%和94.03%,符合率均较高。其中在阳性抗体的符合率方面,阻断ELISA与中和试验的阳性抗体符合率达100%,而在阴性抗体的符合率方面,IHA与中和试验的阴性抗体符合率达100%。以IHA的符合率最低,敏感性最低,以阻断ELISA的符合率最高,敏感性最强[2]。
2 3种检测试剂盒与中和试验结果评价
中和试验是《中国兽药典》中法定的猪瘟抗体阴性猪筛选方法,可以认为是猪瘟抗体检测的“金标准”,其准确性无需置疑,但该方法需要用猪瘟活毒工作抗原和试验兔进行检测,检测结果易受试验猪个体差异、健康状况和饲养环境等因素影响,且检测周期长、工作量大及成本高。随着现代分子生物学和免疫学技术的快速发展,各种猪瘟抗体检测试剂盒不断得到开发和推广应用,IHA、间接ELISA和阻断ELISA 3种抗体检测试剂盒与中和试验的符合率均在89%以上,3种抗体检测试剂盒均具有良好的准确性。IHA试剂盒检测67份猪瘟疫苗免疫猪血清样品的阳性率为71.64%,明显低于中和试验、间接ELISA、阻断ELISA方法的阳性率,IHA方法采用全病毒作为抗原,受抗原制备过程与病毒纯化等方面的限制,导致了IHA方法敏感性较低,同时该方法还存在血清样品需经过灭活处理,检测结果肉眼判读、误差大等缺陷,但该方法操作简便、检测反应时间短且无需特殊仪器设备,特别适合基层实验室操作。ELISA采用基因工程重组蛋白作为抗原,其检测的敏感性和特异性均大大提高,间接ELISA、阻断ELISA试剂盒检测67份猪瘟疫苗免疫猪血清样品的阳性率分别为83.58%和88.06%,阻断ELISA的敏感性较间接ELISA更高,且ELISA方法具有微量、高通量等优点,特别适合临床大批量样品的检测,但ELISA方法尤其是阻断ELISA方法操作较复杂,操作人员需要具有一定的兽医技术水平,且需要酶标仪等仪器设备,随着我国基层兽医实验室的不断建设与完善,ELISA检测试剂盒将具有广阔的发展空间和应用前景。综合来看,3种检测试剂盒均具有各自的优缺点,不同实验室可根据自身试验条件合理选择,或选择2种检测试剂盒联合使用,确保检测结果的准确与可靠。

表3 4种检测方法的检测结果

表4 与中和试验的抗体阳性符合率
3 新型试剂盒诊断技术
王泽洲博士介绍了应用镧系元素做荧光标记物建立一种既具有金标层析技术简单方便、快捷,又具有ELISA准确、特异、敏感的猪瘟抗体镧系免疫层析检测试剂盒。镧系荧光免疫层析方法(LFICA)是在时间分辨荧光免疫分析基础上建立起来的一种超微量快速免疫检测技术,它集合了酶标记技术、放射标记技术和同位素标记技术的优点,具有灵敏度高、特异性强、稳定性好、无污染,且测定范围宽,试剂盒寿命长,操作简单和非放射性的优点,越来越受到各科学领域科研工作者的关注。
Aruna Ambagala教授介绍了加拿大猪瘟的诊断和研究情况,详细介绍了新开发出的一种快速检测猪瘟的试剂盒,常温保存、60 min出结果,在猪瘟感染后的2 d就可以检测出、非常敏感,唯一的缺点是每次检测的样品数较少,只能检测8个样品[3]。
4 结语
猪瘟疫苗在我国养殖场已经普免,但免疫程序和免疫效果各有不同,还存在许多弊端和隐形的问题需要解决,所以要及时诊断,科学选用疫苗[4],制定科学合理的免疫程序,严格按照使用说明书正确使用疫苗,并利用先进的试剂盒进行免疫效果评估,不断优化免疫程序,不断提高阳性抗体率和抗体维持保护时间。
[1] 朱连德.国内猪场猪瘟免疫现状及控制、净化所面临的主要挑战[J].猪业科学 ,2017,34(11):54-55.
[2] 范振涛.3种猪瘟抗体检测试剂盒的比较与分析[J].中国动物保健 ,2017,19(11):15-17.
[3] 张金辉.2107猪瘟防控技术研讨会精彩报告荟萃[J].猪业科学 ,2017,34(11):36-39.
[4] 胡圣林,张智瞳.猪瘟防控存在的问题及对策措施[J].中国畜牧兽医文摘 ,2017,33(11):139-143.
