粉针剂卤化丁基橡胶塞的风险评估及其控制措施
2018-04-14周华琴
周华琴
(上海上药新亚药业有限公司,上海201203)
0 引言
我司主要生产注射用粉针剂产品,除药物外,产品由抗生素瓶、胶塞与铝(铝塑复合)盖等组成。常见的胶塞为注射用无菌粉末用卤化丁基橡胶塞、覆膜卤化丁基橡胶塞、冻干卤化丁基橡胶塞。其中,注射用无菌粉末用卤化丁基橡胶塞主要用于常见的无菌分装粉针剂;覆膜卤化丁基橡胶塞由卤化丁基橡胶塞和具有阻隔性能的聚四氟乙烯膜组成,主要用于头孢类无菌分装粉针剂;冻干卤化丁基橡胶塞则主要用于冻干粉针剂。由于卤化丁基橡胶具有较低的气体渗透性、良好的弹性、阻隔性,对热、臭氧和化学品有良好的抗耐性[1],同时,卤化丁基橡胶生胶的安全性、化学稳定性、气密性、洁净度都比天然橡胶好,因此卤化丁基橡胶塞(以下简称为胶塞)被广泛应用于粉针剂生产中。
在药品生产过程中,所涉及的胶塞变更主要包括胶塞的材质变更、胶塞供应商变更、胶塞尺寸及形状变更。按常规,可根据《已上市化学药品变更研究的技术指导原则》来变更药品的包装材料和容器。但是,需要全面评估胶塞变更后的药品生产质量,确保变更后的胶塞能适应流水线生产需求,且不会影响产品质量。同时,根据相关药品管理的法律法规向药监部门申请批准变更或备案。
基于胶塞直接与药品接触的特殊性,本文将结合粉针剂的生产工艺,从胶塞的适用性、胶塞的质量可控性和产品的稳定性角度出发,对胶塞进行风险评估,同时提出必要的风险控制措施,旨在将风险降低至可接受范围内,确保产品质量和用药安全。
1 涉及胶塞的工艺流程
在一般的粉针剂生产工艺中,涉及胶塞的工艺流程包括以下几个方面:
1.1 一般无菌分装粉针剂
胶塞供应商确认→胶塞采购入库→检验→外清拆包→进入自动胶塞清洗机进行清洗/灭菌/干燥→装无菌袋→进入分装机进行全压塞→进入轧盖机进行轧盖→成品。
1.2 需抽真空的无菌分装粉针剂
胶塞供应商确认→胶塞采购入库→检验→外清拆包→进入自动胶塞清洗机进行清洗/灭菌/干燥→装无菌袋→进入分装机进行全压塞→进入抽真空压塞箱进行抽真空与压塞→进入轧盖机进行轧盖→成品。
1.3 冻干粉针剂
胶塞供应商确认→胶塞采购入库→检验→外清拆包→进入自动胶塞清洗机进行清洗/灭菌/干燥→装无菌袋→进入液体灌装压塞机进行半压塞→进入冻干机进行冷冻干燥与压塞→进入轧盖机进行轧盖→成品。
2 涉及胶塞的风险点
通过梳理整个粉针剂生产过程中涉及胶塞的工艺流程,可以对涉及胶塞的风险点进行分析。
2.1 胶塞供应商的确认
(1)应对胶塞生产企业进行现场质量审计,确保其具有完善的质量保证体系,具备相应的生产和理化检测能力,确认供应商各项资质和检验报告的真实性,并对胶塞生产所用的原辅料来源、配方一致性进行确认,若胶塞的生产工艺或配方有变更,供应商应提前告知采购方。
(2)确认胶塞是否按2015版《国家药包材标准》进行检验。
2.2 胶塞采购入库检验
(1)胶塞的外包装信息应清晰完整,便于入库验收。
(2)在D级洁净区域取样,进入取样区域时需脱去外箱包装,胶塞的最小内包装信息应完整清晰。同时,应检验胶塞的外观尺寸以及物理指标、化学指标是否符合要求。
(3)质量标准中带*、**的项目(如热原、急性全身毒性试验、溶血)为非每批检验项目,应每年委托第三方权威药包材检测机构进行全检。
2.3 胶塞的清洗/灭菌/干燥
胶塞经自动胶塞清洗机清洗/灭菌/干燥后,在B级背景下的A级RABS中出料装袋,再待转运,其间应重点关注:
(1)确认胶塞清洗时间、清洗用水压力、灭菌纯蒸汽的压力、蒸汽加热时间、冷却干燥抽真空的压力、抽真空时间等工艺参数,确认清洗/灭菌/干燥后的胶塞是否变形粘连,干燥失重和可见异物检测是否符合工艺要求。
(2)RABS装置内的层流单向流风速与装袋封合密封性是否符合工艺要求,这对清洗/灭菌/干燥后胶塞的无菌性有着决定性影响。
2.4 产品的分装、压塞与轧盖
清洗/灭菌/干燥后的胶塞经装袋密封转运至分装机(或液体灌装压塞机)时,通过缓冲装置拆袋后送入胶塞振荡器内,经输送轨道传送胶塞,通过压塞装置对抗生素瓶进行全压塞(或半压塞);再按不同工艺要求,直接轧盖;或进入冻干机冷冻干燥压塞后,再轧盖;或进入真空压塞箱抽真空压塞后,再轧盖。
2.4.1 胶塞的外形尺寸公差
胶塞的外形尺寸公差应与分装机(或液体灌装压塞机)中胶塞振荡器内的定向轨道和输送轨道相适应。
2.4.2 覆膜卤化丁基橡胶塞(以下简称为覆膜胶塞)
覆膜胶塞用于我司生产的抽真空产品,胶塞的涂膜厚度决定了抽真空产品的合格率。由于全压塞后的产品进入真空压塞箱后,若覆膜过薄,则不易在真空状态下起塞再抽真空;若覆膜过厚,则在真空状态下易跳塞,再抽真空后难以压塞。
2.4.3 轧盖
轧盖机对已压塞的产品进行密封性轧盖,胶塞质量好坏对产品的气密封和严密度有一定影响。这是因为在胶塞的制备配方中有硫化剂,其功能是使生胶失去塑性而变得具有弹性和强度,轧盖后的胶塞弹性变形大小尤为关键,弹性变形较大者,其形成的轧盖扭力矩大,反之亦然。因此,弹性变形过大或过小均不能达到密封效果[2]。
2.5 成品
胶塞除主体成分生胶外,还会加入填充剂、着色剂、硫化剂、硫化活性剂等配合剂,清洗硅化工序还会加入甲基硅油,胶塞的各种添加物和反应物可能发生溶出和迁移,胶塞与药物接触可能发生药物吸附,会对药品的安全性、有效性和稳定性造成影响。根据2015版《国家药包材标准》药品包装材料与药物相容性试验指导原则[3],对变更胶塞后生产的制剂成品通过长期、加速试验以及倒置容器确保药物和胶塞充分接触,来重点考察药品的外观、含量、pH值、可见异物、澄清度与颜色、不溶性微粒、有关物质、胶塞外观。
例如,我司生产的注射用头孢曲松钠,对其有澄清度考察要求,根据国家食品药品监督管理局在《关于进一步加强使用卤化丁基胶塞的头孢类注射剂监督管理的通知》中提出的“60℃下倒置5天测定样品溶液的澄清度的相容性加速实验方法”,对注射用头孢曲松钠成品进行了相关试验。
3 风险评估的实施
3.1 胶塞的风险识别
我们使用因果分析图(图1)对可能影响产品质量的胶塞进行风险识别,主要分为以下五个方面:胶塞供应商确认、胶塞采购入库检验、胶塞的清洗/灭菌/干燥、产品的分装/压塞/轧盖、成品。
3.2 潜在的失效模式效果分析(FMEA)
3.2.1 FMEA风险评估方法
FMEA是一种对工艺失败模式及其对结果或产品性能可能产生的潜在影响进行风险评估的方法,其特点是将庞大复杂的工艺分析分解成易于处理的步骤。
3.2.2 FMEA排列标准和风险等级
风险等级=严重性×可能性×可检测性[4]。
根据可能性、严重性、检测性评分标准(表1)对危害源发生的可能性、导致后果的严重性和危害源的可检测性进行评分。其中,风险等级的严重性主要考虑影响产品质量和产品的稳定性。
3.2.3 风险等级对照及应采取的措施
风险等级对照及应采取的措施如表2所示。
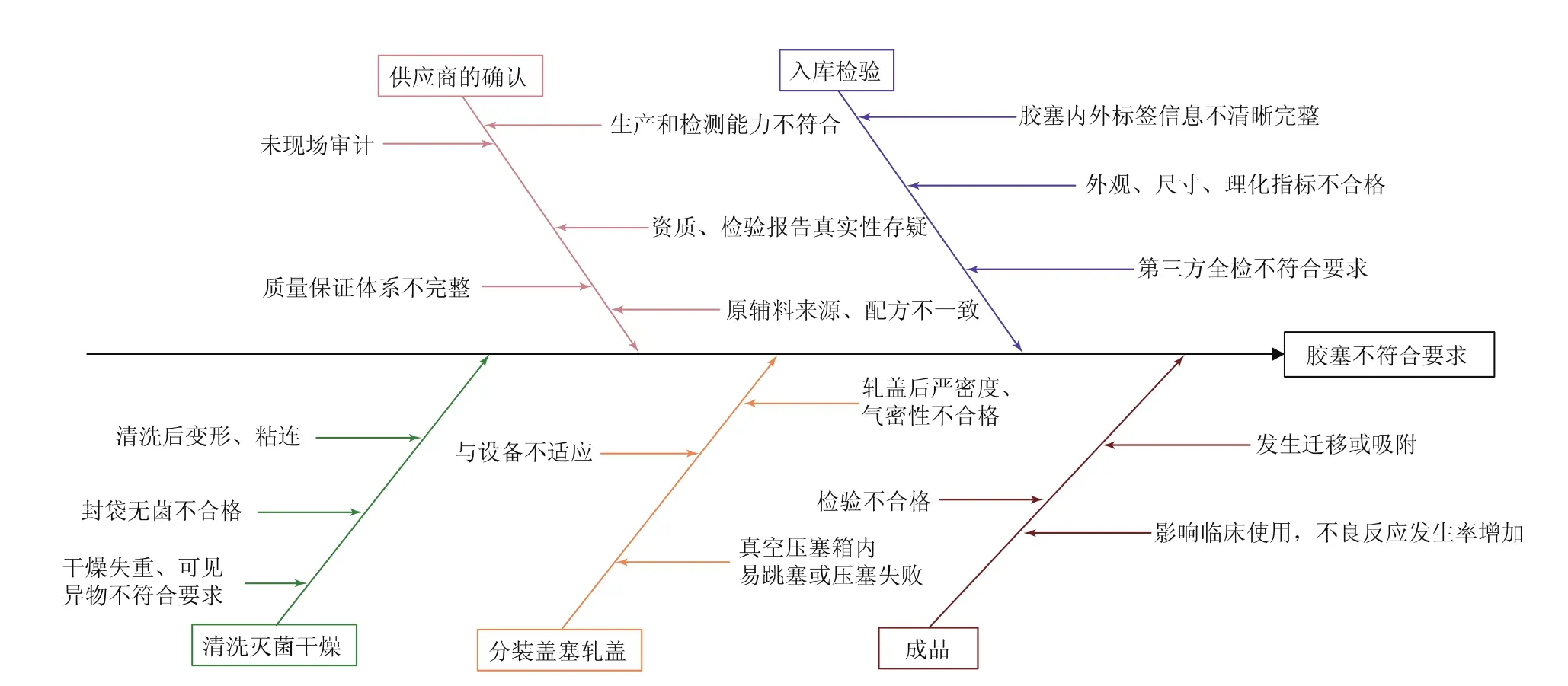
图1 因果分析图

表1 可能性、严重性、检测性评分标准

表2 风险等级对照及应采取的措施
3.3 胶塞潜在的失效模式效果分析结果
通过分析因果图,找到各个风险点,对其进行失效模式效果分析评估,具体结果如表3所示。
4 结语
本文从胶塞供应商确认、胶塞采购入库检验、胶塞的清洗/灭菌/干燥、产品的分装/压塞/轧盖、成品五个方面,对粉针剂生产中涉及卤化丁基橡胶塞的工艺逐一进行了风险分析与评估,对风险等级较高的风险点,提出了必要的风险控制措施。同时,对企业的粉针剂生产用卤化丁基橡胶塞内控标准增加了以下内容:(1)控制胶塞尺寸,以保证产品的密封性能;(2)为避免临床使用中产生穿刺落屑问题,需控制胶塞穿刺部位的厚度;(3)由于胶塞的硅油量可能影响上机效果及密封性能,对产品的澄清度亦有影响,因此应与供应商达成一致,控制硅油含量;(4)应控制覆膜胶塞的覆膜厚度。
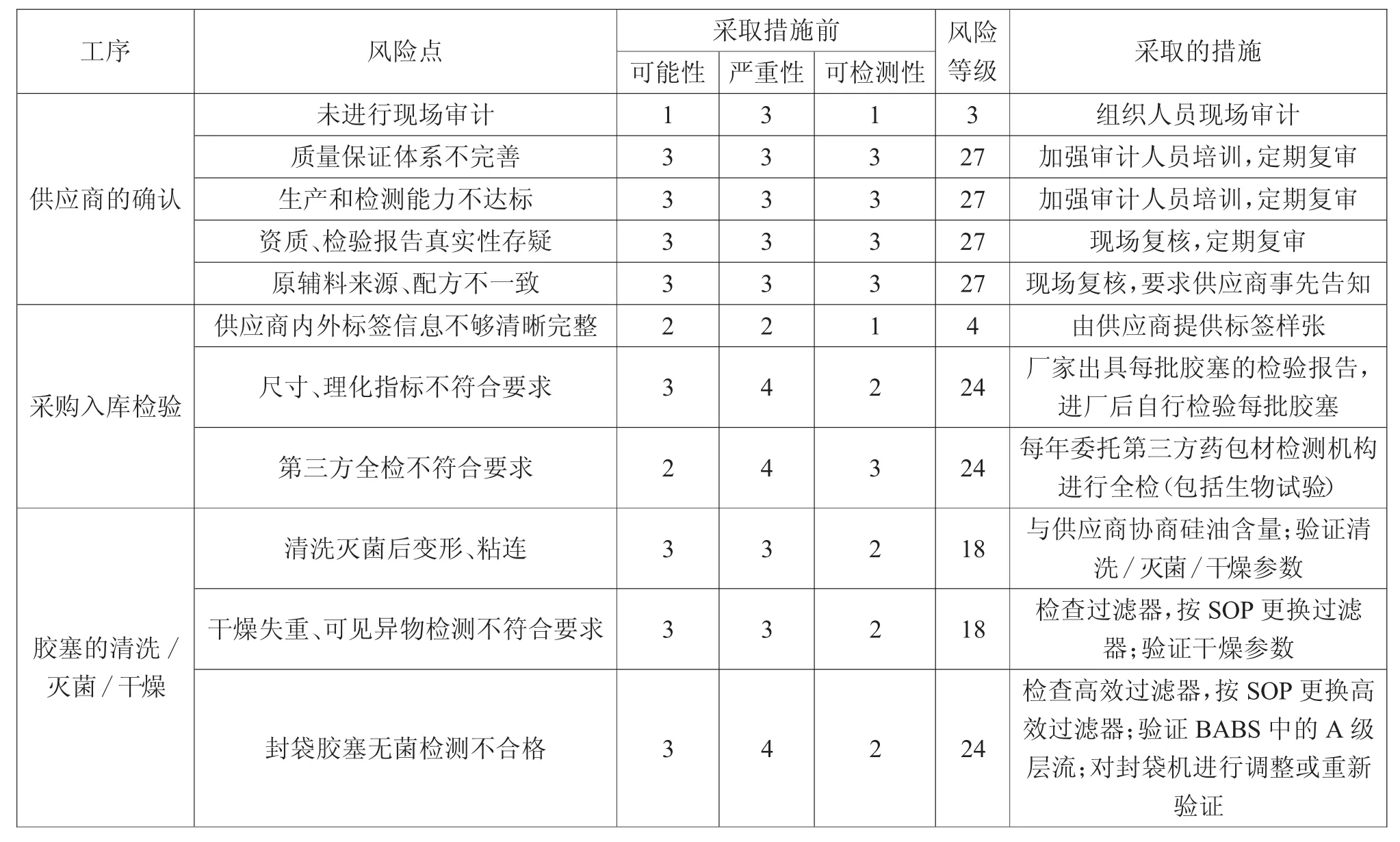
表3 胶塞各工序FM EA分析结果
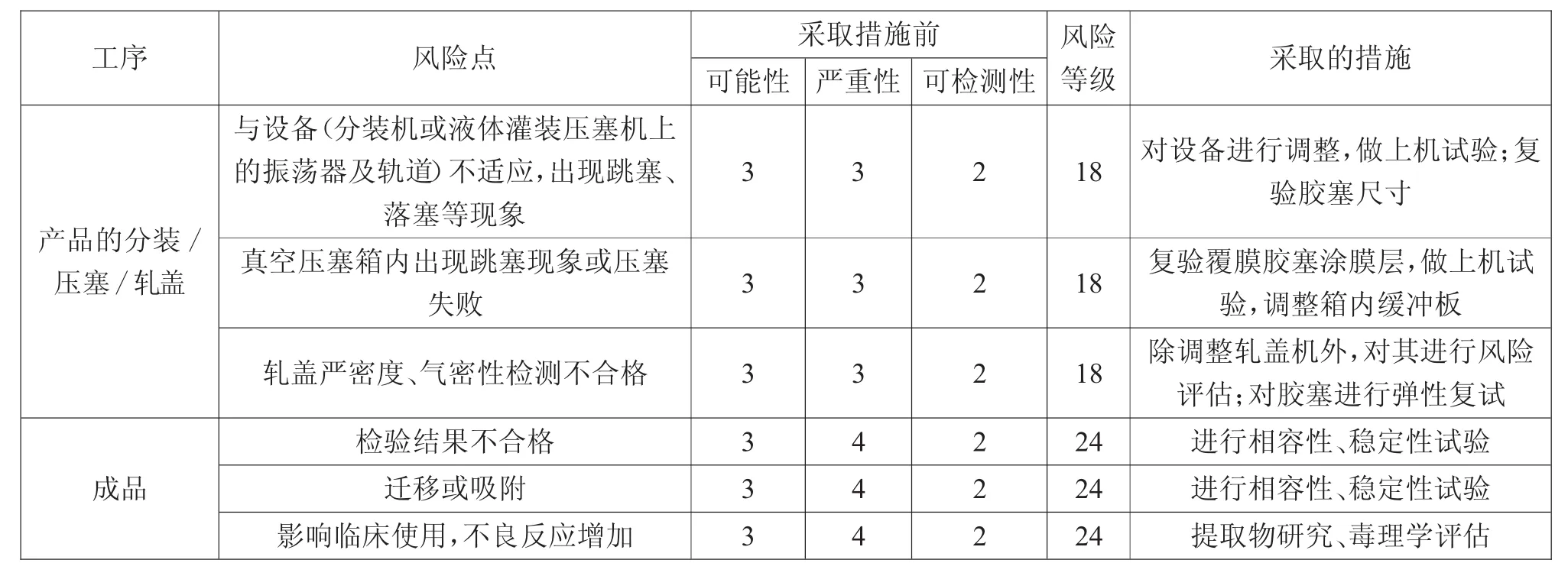
续表
[参考文献]
[1]江镇海.丁基橡胶的开发和应用[J].橡胶参考资料,2013,43(1):6-8.
[2]田耀华.对玻璃瓶轧盖密封性用扭力矩检查方法的探讨[J].机电信息,2014(26):18-20.
[3]中国食品药品检定研究院.国家药包材标准[M].北京:中国医药科技出版社,2015.
[4]国家食品药品监督管理局药品认证管理中心.药品GMP指南 质量管理体系[M].北京:中国医药科技出版社,2011.
