Box-Behnken法优化超声辅助酶法提取灵芝多糖的工艺研究
2018-04-14郑丹婷苑子涵崔佳燕蔡思敏
郑丹婷 苑子涵 崔佳燕 蔡思敏 韩 伟
(华东理工大学中药现代化工程中心,上海200237)
0 引言
灵芝(Ganoderma Lucidum Karst),又称“林中灵”,是孔菌科真菌灵芝的子实体[1]。2015年版《中国药典》收录有赤芝与紫芝两个品种。作为具有数千年药用历史的中国传统药材,灵芝具有很高的药用价值。现代药理学研究也证实,其具有调节免疫、抗肿瘤、抗病毒、抗氧化、保肝、提高耐缺氧能力等功效[2]。
灵芝多糖(Ganoderma Lucidum Polysaccharide)是多孔菌科灵芝属真菌菌丝体的次生代谢产物,存在于灵芝属真菌的菌丝体和子实体中,具有清除体内自由基、提高机体免疫力、降血糖[3]等功效,被认为是灵芝扶正固本的根本[4]。
灵芝多糖存在于灵芝子实体的细胞壁内壁,而子实体结构致密,在提取过程中的传质阻力比较大,且灵芝多糖的相对分子量很大,传统的提取方法主要依靠的是扩散原理[5],因此提取效率较低。超声提取法是一种利用超声波的空化作用、机械作用和热效应等加速细胞内有效物质的释放、扩散和溶解,以此显著提高提取效率的提取方法[6]。酶法提取是一种利用酶解作用,破坏细胞壁结构,以强化胞内有效成分扩散至胞外的传质过程,从而能够最大限度地提高中药有效成分得率的方法。
本文以总多糖得率为指标,采用超声辅助纤维素酶法提取灵芝中的多糖类化合物,在单因素试验的基础上,利用Box-Behnken中心组合法(以下简称Box-Behnken法)对提取工艺进行优化,以期为灵芝多糖的工业化生产提供参考。
1 材料与方法
1.1 材料与试剂
灵芝子实体,购于上海雷允上药店;纤维素酶(活性≥400 U/mg),上海瑞永生物科技有限公司;浓硫酸、苯酚、葡萄糖(均为分析纯),国药集团化学试剂有限公司。
1.2 仪器与设备
试验所用仪器设备如表1所示。
1.3 试验方法
1.3.1 总多糖的测定
(1)葡萄糖标准品配制:精密称取已干燥至恒重的无水葡萄糖20 mg,置100 mL容量瓶中,加去离子水至刻度,摇匀溶解,即得0.2 g/L的葡萄糖溶液。

表1 仪器设备一览表
(2)最大吸收波长的测定:精密量取葡萄糖标准品溶液1 mL,置于10 mL容量瓶中,加1 mL 5%的苯酚溶液,摇匀后迅速加入5 mL浓硫酸溶液,放置10 min,于40℃水浴中保温30 min,取出,放至室温,加去离子水定容至10 mL,摇匀,室温下按照紫外-可见分光光度法在400~600 nm波长范围内扫描,发现在490 nm处有最大吸收峰,故选择490 nm作为本试验的检测波长。
(3)标准曲线的绘制:分别取上述葡萄糖标准品溶液0.0 mL、0.4 mL、0.6 mL、0.7 mL、0.8 mL、0.9 mL、1.0 mL,分别置于10 mL容量瓶中,加1 mL 5%的苯酚溶液,摇匀后迅速加入5 mL浓硫酸溶液,放置10 min,于40℃水浴中保温30 min,取出,放至室温,加去离子水定容至10 mL,摇匀,以第一份溶液为空白溶液,按紫外-可见分光光度法,在490 nm波长处测定吸光度,以葡萄糖质量浓度(mg/mL)为横坐标,吸光度(A)为纵坐标,绘制标准曲线,得到标准曲线的回归方程:A=4.209 6C-0.002 3,R2=0.993 2。
1.3.2 总多糖的单因素提取试验
将灵芝的子实体干燥至恒重,用粉碎机粉碎,装袋于阴凉处备用。精确称取灵芝子实体粉末2 g于圆底烧瓶中,按料液比1∶20、1∶25、1∶30、1∶35和1∶40加入去离子水搅拌均匀,在一定温度(25℃、35℃、45℃、55℃和60℃)下超声提取一段时间(15 min、20 min、25 min、30 min和35 min)后,加入40 mg纤维素酶,在一定温度下(25℃、35℃、45℃、55℃和65℃)水浴保温一定时间(30 min、40 min、50 min、60 min和70 min)后,迅速升温至90 ℃,灭活10 min,自然冷却后,抽滤,得到灵芝多糖提取液。用去离子水于容量瓶中将提取液定容至100 mL,摇匀后精密吸取稀释液1 mL,置于10 mL容量瓶中,在490 nm波长处测定吸光度A。
1.3.3 总多糖得率的测定
根据标准曲线回归方程,按以下公式计算总多糖的得率:

式中A——吸光度;
V——提取液总体积,mL;
n——总稀释倍数;
m——灵芝子实体粉末的质量,g。
1.3.4 Box-Behnken响应面设计试验
在单因素试验基础上,选择对多糖得率影响较大的因素,采用四因素三水平的Box-Behnken中心组合试验设计方法(简称BBD),以料液比(X1)、超声时间(X2)、酶解时间(X3)和酶解温度(X4)为变量,每个变量分别以-1、0、+1表示,设计29个试验点的三次回归组合试验,确定提取的最佳工艺条件,Box-Behnken响应面试验设计如表2所示。25 min、30 min和35 min时的灵芝多糖得率,结果如

表2 Box-Behnken响应面试验设计
2 结果与讨论
2.1 灵芝总多糖提取的单因素试验
2.1.1 料液比
料液比是影响中草药中有效成分得率的主要因素之一,在其他条件固定的情况下,分别考察料液比为1∶20、1∶25、1∶30、1∶35和1∶40时的灵芝多糖提取得率,结果如图1所示。

图1 料液比对多糖得率的影响
由图1可以看出,当料液比低于1∶30时,随着料液比的增大,多糖得率大幅度提高;当料液比高于1∶30后,随着料液比的增大,多糖得率增加缓慢;当料液比大于1∶35后,多糖得率反而降低。这可能是由于溶剂过多,对后续的过滤、转移等操作要求过高,造成了一定的损失。因此,本试验选择1∶35为最佳料液比。
2.1.2 超声提取时间
固定灵芝子实体粉末用量、料液比、超声温度等条件,分别考察超声提取时间为15 min、20 min、图2所示。

图2 超声提取时间对多糖得率的影响
由图2可以看出,多糖得率随超声时间的增加而不断增大,在25 min时达到最高值,这是由于随着超声时间的不断增加,细胞壁的破碎程度不断增大,细胞内的多糖类物质更容易向外扩散,充分溶解到周围的溶剂中去;25 min后,随着超声时间的增加,多糖得率反而下降,可能是由于在长时间的超声波机械作用下,多糖结构遭到破坏,导致部分多糖降解,致使得率降低[7]。因此,本试验确定最佳超声时间为25 min。
2.1.3 超声提取温度
固定料液比和超声提取时间等试验条件,考察超声提取温度为25℃、35℃、45℃、55℃和60℃时的灵芝多糖得率,结果如图3所示。
由图3可以看出,当超声提取温度小于55℃时,多糖得率随超声提取温度升高而增大,至55℃时得率达到最大值。当超声提取温度大于55℃时,多糖得率随温度的升高反而降低,可能是由于温度的升高导致多糖降解。因此,本试验确定超声提取温度控制在55℃为宜。

图3 超声提取温度对多糖得率的影响
2.1.4 酶解温度
称取灵芝子实体粉末2.0 g,在已确定料液比1∶35、超声提取时间25 min以及超声温度55℃的条件下,固定酶解时间为30 min,考察酶解温度为25℃、35℃、45℃、55℃和65℃时的灵芝多糖得率,结果如图4所示。

图4 酶解温度对多糖得率的影响
从图4可以看出,随着酶解温度的升高,多糖得率不断增大,至55℃达到最大值;55℃后,多糖得率随着温度的升高反而降低,可能是因为随着温度的不断升高,酶的反应速率不断增加,但温度过高和过低都会对酶的活性造成影响。因此,本试验确定55℃为最佳酶解温度。
2.1.5 酶解时间
称取2.0 g灵芝子实体粉末,按料液比1∶35加入去离子水70 mL,于55℃条件下超声提取25 min后,加入40 mg纤维素酶,控制酶解温度为55℃,考察酶解时间为30~70 min时的灵芝多糖得率,结果如图5所示。

图5 酶解时间对多糖得率的影响
从图5可以看出,多糖得率随酶解时间的增加而不断增大,60 min时达到最大值,之后随着酶解时间的增加,得率不断降低,可能是由于酶解时间过短,酶促反应不完全,而酶解时间过长会导致多糖结构遭到破坏,得率反而降低[8]。因此,本试验确定最佳的酶解时间为60 min。
2.2 单因素试验的方差分析
由2.1可知,每个因素对多糖得率均有影响,且影响程度各不相同。为减少BBD优化试验的试验次数,降低操作难度,提高优化效率,现对单因素试验的试验结果进行方差分析,结果如表3所示。
一般而言,方差数值越低,表明对应的试验结果波动越小,即该因素对试验结果的影响就越不明显[9]。由表3可知,各因素对总多糖得率影响程度的大小依次为:酶解时间>料液比>酶解温度>超声提取时间>超声提取温度。故在后续的BBD法优化试验中,选择酶解时间、料液比、酶解温度和超声提取时间这四个因素进行优化。
2.3 Box-Behnken法设计优化试验
2.3.1 数学模型的建立与显著性检验
在单因素试验的基础上,选取影响显著的因素,即料液比、超声时间、酶解时间及酶解温度为自变量,灵芝总多糖得率为因变量,BBD优化试验设计及结果如表4所示。

表3 单因素试验的方差分析
分析表4中的各变量对灵芝总多糖得率的影响效果,通过多元回归拟合,可获得多糖得率与自变量料液比、超声时间、酶解时间、酶解温度的编码回归方程:Y=6.06+0.059X1-0.033X2+0.13X3+0.19X4+0.11X1X2+0.58X1X3+0.21X1X4+0.34X2X3+0.28X2X4+1.91X3X4+0.12X12+0.63X22-1.34X32-0.18X42-0.77X12X3-0.59X12X4。

表4 BBD优化试验设计及结果
回归模型的方差分析如表5所示。
从表5可以看出,回归模型极显著(P<0.01),而误差项结果不显著,说明回归方程与实际情况拟合良好,可用此模型对试验结果进行分析和预测。显著性检验表明,各因素对响应值的影响由强到弱依次为:酶解时间(X4)、酶解温度(X3)、料液比(X1)和超声提取时间(X2)。回归模型的可信度分析如表6所示,复相关系数R2=0.916 2(>0.80),说明预测值与实测值之间具有高度的相关性,即该模型可以解释0.916 2的响应值的变化[10]。
2.3.2 Box-Behnken法组合优化结果
在各试验因素的取值范围内,利用Design-Expert(Version 8.0.6)软件预测最优的灵芝多糖提取条件为:超声提取时间27.82 min、料液比1∶36.22、酶解时间68.24 min、酶解温度64.13℃。为便于实际操作,最优的提取条件修正为:超声提取时间28 min、料液比1∶36、酶解时间68 min、酶解温度64℃。在最优提取条件下,灵芝多糖的理论得率为7.34%。依据调整后的提取条件进行操作,重复3次,得到的灵芝多糖得率为7.57%,实际测定值与理论值相接近,说明该拟合模型与实际情况拟合良好。
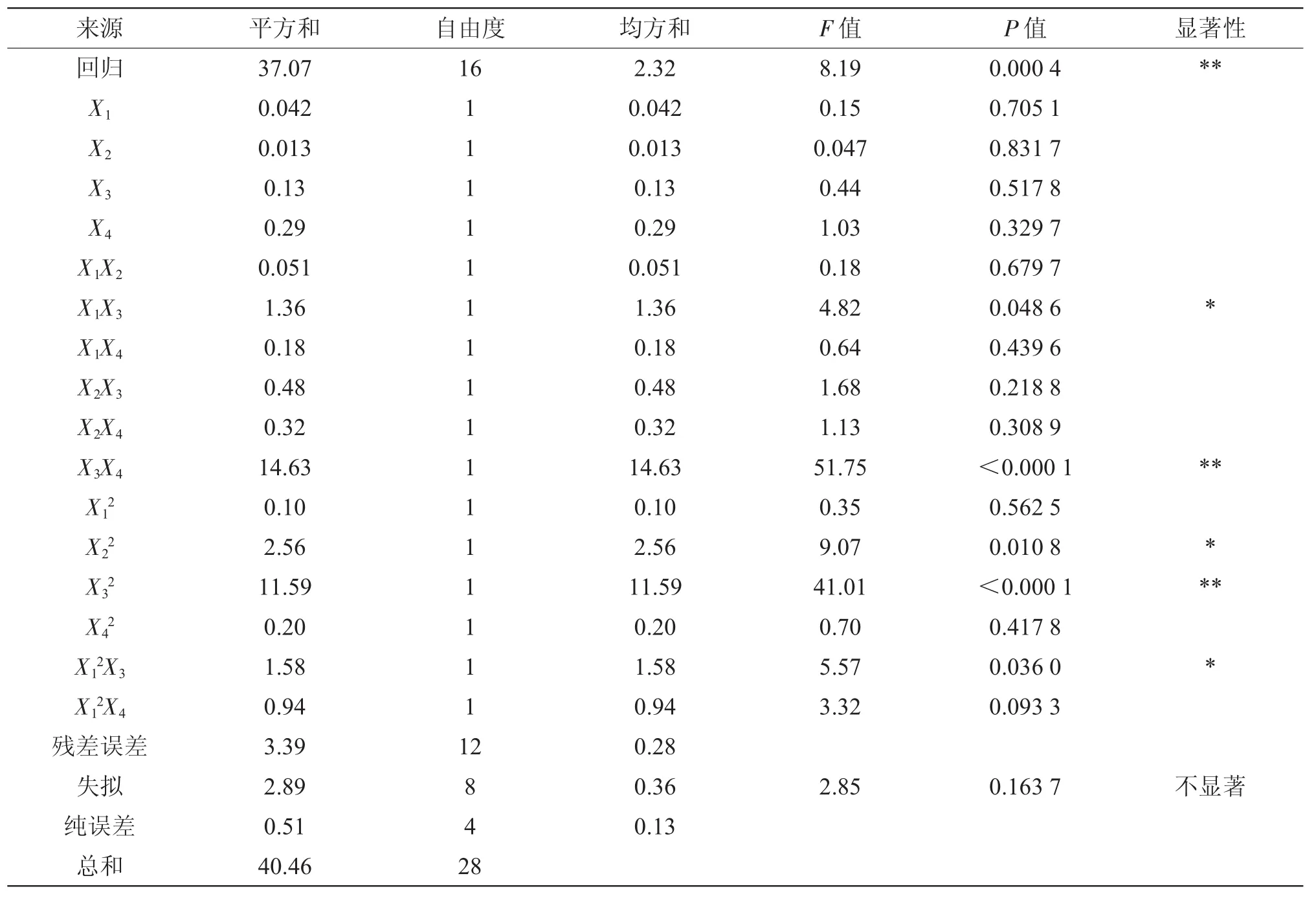
表5 回归模型的方差分析

表6 回归模型的可信度分析
3 结语
(1)采用超声辅助酶法提取灵芝多糖,在单因素试验的基础上,选取对灵芝多糖得率影响较大的四个因素(料液比、超声提取时间、酶解温度和酶解时间),用Box-Behnken法对试验条件进行优化,得到拟合方程为:Y=6.06+0.059X1-0.033X2+0.13X3+0.19X4+0.11X1X2+0.58X1X3+0.21X1X4+0.34X2X3+0.28X2X4+1.91X3X4+0.12X12+0.63X22-1.34X32-0.18X42-0.77X12X3-0.59X12X4,回归方程与实际情况拟合良好。
(2)超声辅助酶法提取灵芝多糖的最优工艺条件为:超声提取时间28 min、料液比1∶36、酶解时间68 min、酶解温度64℃,灵芝多糖理论得率为7.34%,依据最优化提取条件重复提取3次,灵芝多糖的实际得率为7.57%,实际值与理论值拟合良好,且提取工艺简便,条件温和,提取过程安全无污染,与传统的提取方法相比,该方法提取时间短,得率高,可以用于灵芝多糖的工业化生产。
[参考文献]
[1]弓晓峰.黑灵芝元素形态、活性成分及其保健功能研究[D].南昌:南昌大学,2006.
[2]陈伟,马飞,张琳,等.灵芝有效成分提取及药理活性研究进展[J].安徽农业科学,2016,44(8):147-149.
[3]王波.灵芝多糖提取、分离纯化、表征及体外抗氧化活性探究[D].郑州:郑州大学,2016.
[4]YANG Z,CHEN C,ZHAO J,et al.Hypoglycemic mechanism of a novel proteoglycan,extracted from Ganoderma lucidum in hepatocytes[J].European Journal of Pharmacology, 2017,820:77-85.
[5]杨俊红,郭锦棠,朱养妮,等.中草药的不同提取方法与强化传质机理研究[J].化工进展,2002,21(9):660-662.
[6]袁丽娜,金晟君.黄酮类化合物的提取分离纯化研究进展[J].黑龙江科技信息,2013,21(4):55.
[7]吴先辉.苦瓜多糖超声波提取工艺的研究[J].长江蔬菜,2009(24):42-44.
[8]刘成程.高吸水性玉米多孔淀粉的制备及其生物相容性和止血效果的研究[D].西安:西北大学,2010.
[9]施昶,黄海飞,李梦园,等.微波提取山楂中黄酮类化合物的工艺优化[J].生物加工过程,2017,15(1):43-48.
[10]罗文锋,韩伟.Box-Behnken试验设计-响应面优化金针菇多糖的工艺[J].南京工业大学学报(自然科学版),2016,38(4):95-100.
