凡纳滨对虾在二氧化碳麻醉无水保活过程中呼吸代谢及免疫的变化
2018-04-13,,,*,,,,,,,,
,,,*,,,,,,, ,
(1.广东海洋大学食品科技学院,广东湛江 524088;2.广东省水产品加工与安全重点实验室,广东湛江 524088)
凡纳滨对虾(Litopenaeusvannamei)又称南美白对虾,肉嫩味美,具有较高的营养价值,深受国内外消费者的喜爱。凡纳滨对虾以鲜销和冷冻加工为主,其中鲜活虾大约是冷冻虾价格的两倍,因此凡纳滨对虾的保活运输尤为重要。凡纳滨对虾的活体运输方法主要有带水保活和无水保活两种形式,其中无水保活运输操作简便,运载量大,成本低,有利于远距离的运输,具有广阔的前景。无水保活可以通过使用麻醉剂麻醉水产品,使其进入休眠状态。由于二氧化碳(CO2)具有无毒、无残留以及不影响水产品销售的优点,因此CO2麻醉水产品进行无水保活成为一个研究热点[1]。凡纳滨对虾壳较薄,易受外界应激影响造成伤亡,保活运输难度大,对其无水保活研究鲜有报道。
呼吸代谢是动物能量代谢的基本生理活动,通过研究动物呼吸代谢能够了解动物的代谢特征和适应外界环境条件的能力[2]。环境因子大幅度波动和代谢变化都会引起甲壳动物免疫系统变化,从而影响其健康状况[3]。研究凡纳滨对虾无水保活的呼吸代谢及免疫功能变化,了解其新陈代谢特点,有助于完善保活技术,提高存活率。
本研究拟采用CO2麻醉凡纳滨对虾后于常温下进行无水保活,探讨无水保活过程中对虾呼吸代谢酶活力及免疫参数的变化规律,为凡纳滨对虾高值化开发利用以及长途运输提供依据。
1 材料与方法
1.1 材料与仪器
凡纳滨对虾谊林水产公司,随机挑选体质健康、个体大小均一,约600尾凡纳滨对虾,质量(14.1±1.5) g,体长(13.2±0.5) cm,实验前随机分成6组,分别在6个65 L塑料箱内暂养2 h,提供循环水流,水温24 ℃,盐度16‰,溶解氧>5 mg/L;泡沫盒(45.3 cm×45.3 cm×5 cm)、空运专用箱子(49.8 cm×49.8 cm×31.5 cm)湛江机场服务公司;葡萄糖(Glucose,Glu)、柠檬酸、柠檬酸钠均为分析纯,国药集团化学试剂有限公司。
PHST-3F酸度计上海雷磁仪器厂;5810R冷冻离心机德国Eppendorf公司;Varioakan Flash全波长多功能酶标仪美国热电公司;Cary 60紫外可见分光光度计安捷伦科技有限公司;HH·S21-8-S电热恒温水浴锅上海沪粤明科学仪器有限公司;Countstar IC1000自动细胞计数仪上海睿钰生物科技有限公司;CO2麻醉设备由CO2(99.9%)钢瓶、减压阀、气石组成,自行组装。
1.2 实验方法
1.2.1凡纳滨对虾无水保活处理凡纳滨对虾暂养2 h后使用循环冷水机以2 ℃/h 降温,使水温达到18 ℃,再以1 L/min的流量向水中通入CO2至pH6.0,将虾转移到预先铺有PU海绵和冰的泡沫盒(45.3 cm×45.3 cm×5 cm)内,每个泡沫盒装载凡纳滨对虾约100尾。将泡沫盒用充氧的塑料袋密封后,装入空运专用箱子(49.8 cm×49.8 cm×31.5 cm),每箱装载3盒,密封,置于28 ℃恒温室下模拟凡纳滨对虾无水保活8 h。以未处理暂养状态下的凡纳滨对虾为对照组,实验组分别在无水保活的第0、2、4、6 h以及置于水中充氧复苏1 h后取样。
1.2.2样品采集
1.2.2.1对虾鳃的采集用吸水纸吸干对虾的体表水分后,在冰盘上迅速解剖,取鳃,装入1.5 mL的离心管中,迅速放入-80 ℃冰箱保存。取0.1~0.3 g对虾鳃组织,剪碎研磨,加入9倍的4 ℃生理盐水(0.86%),制成10%组织匀浆液,恒温4 ℃下,800×g离心10 min,取上清液分别测定己糖激酶(HK)、果糖磷酸激酶(PFK)、丙酮酸激酶(PK)、琥珀酸脱氢酶(SDH)和乳酸脱氢酶(LDH)等酶活力。
1.2.2.2对虾血淋巴的采集取样时,用1 mL无菌注射器,按照血淋巴与抗凝剂(柠檬酸钠:1.32%(m/v)柠檬酸:0.48%(m/v)Glu∶1.47%(m/v))1∶1的比例,从随机挑选的对虾腹面血窦中采集血淋巴。由于单尾对虾的血淋巴量不足以测定全部免疫指标,因此,将同一时间点的对虾血淋巴两两合并。所取的抗凝血,一部分直接用于血淋巴细胞总数(THC)测定;另一部分在4 ℃,700×g离心20 min,所得上清液用于测定葡萄糖(Glu)和乳酸(LD)浓度、超氧化歧化酶(SOD)和过氧化物酶(POD)活力。
1.2.3指标测定
1.2.3.1呼吸代谢指标测定Glu采用葡萄糖氧化酶法测定,LD采用比色法测定,PK、PFK、HK均采用紫外比色法测定,LDH采用微板法测定,SDH采用比色法测定[4-5]。
1.2.3.2免疫指标测定SOD采用羟胺法测定,POD采用比色法测定,血淋巴细胞总数(THC)使用细胞计数仪计数[4]。
1.3 数据统计与分析
实验中所得结果以平均值±标准差表示(n=5),数据使用SPSS 22.0软件进行差异性分析,通过单因素方差(One-way ANOVA)及Duncan多重比较分析处理。
2 结果与分析
2.1 无水保活对凡纳滨对虾Glu和LD浓度的影响
凡纳滨对虾无水保活过程中Glu和LD浓度的变化如图1(Ⅰ)、(Ⅱ)所示。
从图1(Ⅱ)可看出:无水保活过程中,对虾血糖浓度下降且均低于对照(p<0.05),在第6 h,血糖浓度降到最低值5.11 mmol/L;复苏后,血糖浓度有所上升,但仍显著低于对照(p<0.05)。Lorenzon等[6]研究指出,当动物承受较长时间应激时,血糖会下降。根据Barrento[7]报道,黄道蟹在经过麻醉剂AQUI-S和浸泡冷海水处理后,血糖浓度呈现下降状态。而在Trushenski[8]、Kuo[9]的研究中,经过低温、低氧或者麻醉剂应激的凡纳滨对虾会出现高血糖症。但本实验中血糖浓度一直下降,说明经过CO2麻醉后无水保活过程中对虾没有出现高血糖症,这可能是因为对虾加快Glu消耗以及启动代谢补偿机制,以获得更多能量来适应环境胁迫[10]。无水保活条件下对虾体内Glu降低说明Glu的消耗加快。
从图1(Ⅱ)可看出,无水保活条件下的对虾体内LD浓度从0 h开始显著高于对照组(p<0.05),2 h达到最大值后下降,但在第6 h的浓度约为对照的1.6倍;复苏后,LD浓度仍显著高于对照(p<0.05)。麻醉后对虾体内的LD浓度较高,可能是CO2的刺激作用使对虾LD浓度处于较高水平。因为CO2本身是一种应激介质,会扰乱水产品体内酸碱平衡,导致LD积累[1]。Weber等[11]研究使用不同麻醉剂麻醉Senegalese sole(SoleasenegalensisKaup 1858)的应激反应时指出,麻醉剂能使LD浓度升高。而在无水保活的后期,对虾进行无氧代谢继续生成LD。Samet等[12]研究斑节对虾(Penaeusjaponicus)以及Bernardi等[13]研究美国龙虾(Homarusamericanus)的无水保活时,均认为LD是无氧代谢的最终产物。
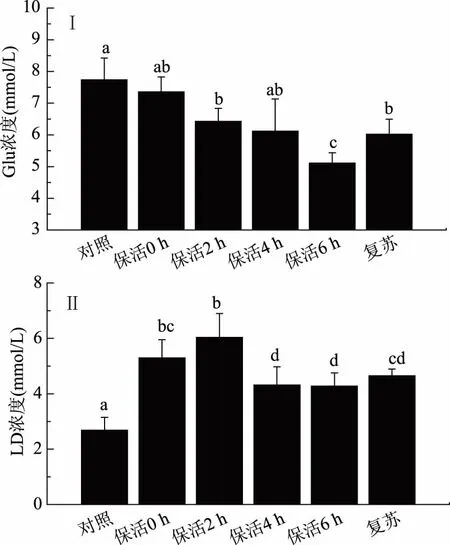
图1 无水保活对凡纳滨对虾中Glu和LD浓度的影响Fig.1 Effects of waterless transportation on Glu and LD concentration of L. vannamei注:不同的字母表示差异显著(p<0.05),图2~图4同。
2.2 无水保活对凡纳滨对虾HK、PFK和PK活力的影响
糖酵解是生物体共同经历的Glu分解代谢的前期途径。HK、PFK和PK是糖酵解限速酶,具有调节糖酵解途径的作用,而且这三种酶活力会根据代谢情况受到转录的控制[14]。无水保活条件下凡纳滨对虾HK、PFK和PK活力的影响如图2(Ⅰ)、(Ⅱ)、(Ⅲ)所示。
在无水保活条件中,对虾鳃HK、PFK和PK活力均高于对照,HK在第4 h达到峰值,并显著高于对照(p<0.05);PFK活力在第2 h后显著高于对照组(p<0.05),并同样在第4 h达到峰值;PK活力一直显著高于对照(p<0.05),在第6 h达到最大值。复苏后,HK和PK活力恢复到对照组水平。三种关键酶活力均高于对照,说明无水保活条件下对虾糖酵解速度加快,这与血糖下降的结果相吻合。遭受温度下降胁迫时,虾(Farfantepenaeuspaulensis)大部分呼吸代谢酶活力会上升[15];在低氧条件下,凡纳滨对虾鳃中的HK、PFK转录表达上调[16-17];温度突变会使凡纳滨对虾PK酶活力发生变化[18]。这些都说明在胁迫条件下,凡纳滨对虾调整糖酵解速度使其能适应变化[19],而糖酵解速度的加快是为了获取更多能量[20]。无水保活条件下,对虾的HK、PFK和PK活力升高说明凡纳滨对虾为了适应不良环境加快糖酵解速度以获得能量。
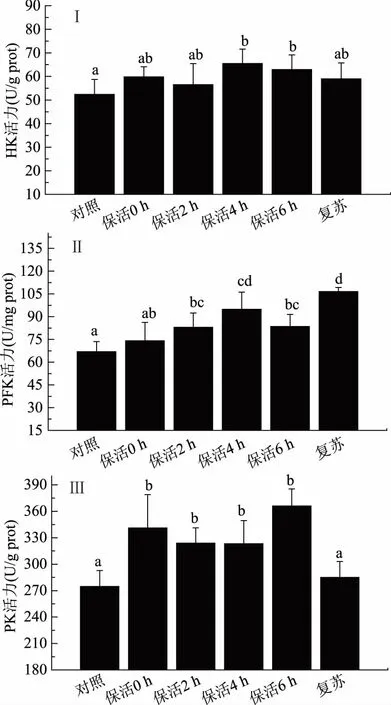
图2 无水保活对凡纳滨对虾HK、PFK和PK活力的影响Fig.2 Effects of waterless transportation on HK,PFK and PK activity of L. vannamei
2.3 无水保活对凡纳滨对虾SDH和LDH活力的影响
SDH是三羧酸循环中唯一嵌入到线粒体内膜的酶,直接连在电子传递链上,影响生物体的氧化磷酸化作用,是有氧呼吸的关键酶[14]。LDH可将丙酮酸转化为LD,是无氧代谢的标志酶。凡纳滨对虾无水保活过程中SDH和LDH含量的变化见如图3(Ⅰ)、(Ⅱ)所示。
无水保活条件下对虾SDH活力呈现下降趋势,在第2 h显著低于对照组(p<0.05),活力下降约14%。而LDH活力一直显著高于对照组(p<0.05),6 h后酶活力显著比对照组高约55%。SDH活力的下降可以归结于外源性应激[21],无水保活过程氧气的供应不足以及其他不良因素使SDH活力下降。当有氧代谢受到抑制时,无氧代谢是主要的供能途径。如凡纳滨对虾受到低氧应激时,LDH同工酶转录上调[22]。无水保活过程中对虾有氧代谢减弱,无氧代谢加强,丙酮酸转化为LD,释放能量以继续给机体提供能量。复苏后,SDH和LDH活力都没有恢复到对照组水平,与复苏后LD浓度仍较高的结果相吻合,这可能与恢复时间较短或两种酶的调控机制有关。
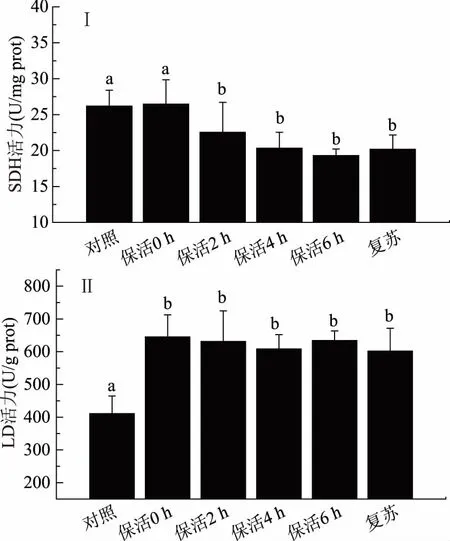
图3 无水保活对凡纳滨对虾SDH、LDH活力的影响Fig.3 Effects of waterless transportation on SDH,LDH activity of L. vannamei
2.4 无水保活对凡纳滨对虾THC、SOD和POD活力的影响
血淋巴细胞在甲壳动物免疫系统中占重要地位,它主要承担着细胞免疫[23]。THC在一定程度上反映机体的免疫应激能力或健康状况[24]。由图4(Ⅰ)可知,保活过程中THC先降低后升高,在第4 h下降到最低点后略有回升。环境的改变会使海洋甲壳动物的免疫系统发生改变,THC总是随着甲壳动物自身的生理状况和外界环境条件变化而变化[25]。研究表明,当凡纳滨对虾受到盐度、铜离子、低氧或者温度等胁迫时,THC会下降[26-27]。无水保活条件下THC显著低于对照(p<0.05),复苏后THC有所增加但仍显著低于对照组(p<0.05),说明在无水保活条件下,对虾的细胞免疫力有所下降。
SOD及POD都是甲壳动物体液免疫相关酶,其活力大小能反映机体的体液免疫机能。由图4(Ⅱ)、(Ⅲ)可知,SOD与POD活力的变化一致:随着保活时间延长,两种酶活力增加。在第6 h,SOD活力比对照组高约56%。复苏后,两种酶活力与对照组没有显著差异。在保活第0 h,SOD和POD活力均显著低于对照组,这可能是CO2麻醉应激导致的[28]。而SOD和POD活力上升可能是对虾体内的氧化-抗氧化平衡没有被打破,并出现呼吸爆炸,产生较多超氧阴离子,超氧阴离子的增多诱导SOD和POD活力的上升,以降低氧化损伤[28-29]。虽然无水保活过程中凡纳滨对虾的THC下降意味细胞免疫力下降,但SOD和POD活力上升说明体液免疫能发挥着清除自由基的作用[25]。复苏后酶活力与对照没有差异,说明在应激下对虾的体液免疫没有受到严重的破坏,在保活后期以及复苏后都能正常发挥作用。Mercier等[30]在研究凡纳滨对虾在遭受到持续应激代谢与免疫变化时,同样发现THC下降,SOD活力上升的情况。
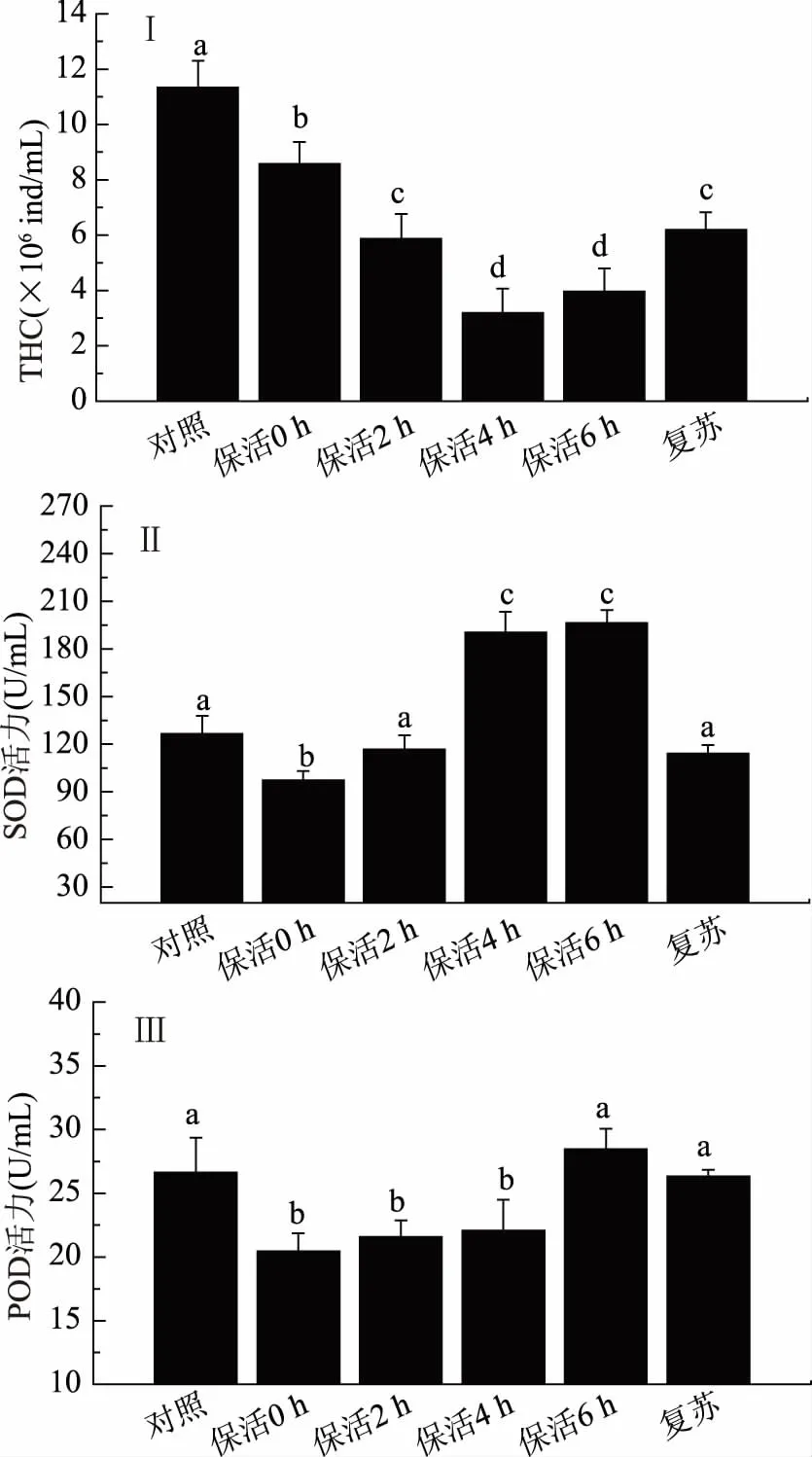
图4 无水保活对凡纳滨对虾THC、SOD和POD活力的影响Fig.4 Effects of waterless transportation on THC,SOD and POD activity of L. vannamei
3 结论
本文初步研究了二氧化碳麻醉凡纳滨对虾无水保活8 h过程中的呼吸代谢及免疫变化规律,证明8 h保活过程中对虾通过有氧代谢转变为无氧代谢获取能量,维持正常生理代谢;免疫相关酶SOD和POD活力升高,细胞免疫正常发挥作用。对虾机体的正常运行,说明8 h的保活时长是可行的。本文可为对虾保活机制提供理论参考。
[1]Trushenski J T,Bowker J D,Cooke S J,et al. Issues regarding the use of sedatives in fisheries and the need for immediate release options[J]. Transactions of the American Fisheries Society,2013,142(1):156-170.
[2]林小涛,张秋明,许忠能,等. 虾蟹类呼吸代谢研究进展[J]. 水产学报,2000,20(6):575-580.
[3]Moullac G L,Haffner P. Environmental factors affecting immune responses in crustacea[J]. Aquaculture,2000,191(1):121-131.
[4]米红波. 鲫鱼和中国对虾的无水保活及冰温保鲜技术研究[D]. 浙江:浙江大学,2014:30-38.
[5]管越强,王慧,李利. 硫化物胁迫对日本沼虾呼吸代谢和能量代谢酶的影响[J]. 生态环境学报,2009,18(6):2017-2022.
[6]Lorenzon S,Giulianini P G,Martinnis M,et al. Stress effect of different temperatures and air exposure during transport on physiological profiles in the American lobsterHomarusamericanus[J]. Comparative Biochemistry and Physiology Part A,2007,147(1):94-102.
[7]Barrento S,Marques A,Vaz-pires P,et al. Cancer pagurus(Linnaeus,1758)physiological responses to simulated live transport:Influence of temperature,air exposure and AQUI-S[J].Journal of Thermal Biology,2011,36(2):128-137.
[8]Trushenshi J T,Bowzer J C,Bowker J D,et al. Chemical and electrical approaches to sedation of cobia induction recovery and physiological responses to sedation[J]. Marine and Coastal Fisheries,2012,4(1):639-650.
[9]Kuo C M,Yang Y H. Hyperglycemic responses to cold shock in the freshwater[J]. Journal of Comparative Physiology B:Biochemical,Systemic,and Environmental Physiology,1999,169(1):49-54.
[10]Pawar H B,Sanaye S V,Sreepada R A,et al. Comparative efficacy of four anaesthetic agents in the yellow seahorse,Hippocampuskuda(Bleeker,1852)[J]. Aquaculture,2011,311(1-4):155-161.
[11]Weber R A,Perez-maceira J J,Peleteiro J B,et al. Effects of acute exposure to 2-phenoxyethanol,clove oil,MS-222,and metomidate on primary and secondary stress responses in Senegalese sole(Solea senegalensis Kaup 1858)[J]. Aquaculture,2011,321(1):108-112.
[12]Samet M,Nakamura K. Relative humidity effects on tolerance of the kuruma prawn exposed to 14 ℃Air[J]. Fisheries Science,1997,63(2):194-198
[13]Bernardi C,Baggian L,Tirloni E,et al. Hemolymph parameters as physiological biomarkers in American lobster(Homarusamericanus)for monitoring the effects of two commercial maintenance methods[J]. Fisheries Research,2015,161:280-284.
[14]王镜岩,朱圣庚,徐长法. 生物化学(第三版).北京:高等教育出版社,2005.
[15]Lemos D,Salomon M,Gomes V,et al. Citrate synthase and pyruvate kinase activities during early lifestages of the shrimp Farfantepenaeus paulensis(Crustacea,Decapoda,Penaeidae):effects of development and temperature[J]. Comparative Biochemistry and Physiology Part B,2003,135(4):707-719.
[16]Sonanez-organis J G,Peregrino-uriarte A B,Sotelo-mundo R R,et al. Hexokinase from the white shrimpLitopenaeusvannamei:cDNA sequence,structural protein model and regulation via HIF-1 in response to hypoxia[J]. Journal of the American Academy of Dermatology,2016,74(5):242-249.
[17]Cota-ruiz K C,Leyva-Carrillo L,Peregrino-uriarte A B,et al. Role of HIF-1 on phosphofructokinase and fructose 1,6-bisphosphataseexpression during hypoxia in the white shrimpLitopenaeusvannamei[J]. Comparative Biochemistry and Physiology Part A,2016,198:1-7.
[18]Guo B,Wang F,Dong S L,et al. The Effects of Rapid Temperature Changes on HK,PK and HSP70 ofLitopenaeusvannameiin Different Seasons[J]. Journal of Ocean University of China,2010,9(3):303-308.
[19]Martinez-quintana J A,Kikutab S,Felix-Portillo M,et al. A novel functional glucose transporter in the white shrimpLitopenaeusvannamei-Lv GLUT2-is up-regulated during hypoxia in hepatopancreas[J]. Marine Environmental Research,2015,112:61-67.
[20]Vijavel K,Balasubramanian M P. Changes in oxygen consumption and respiratory enzymes as stress indicators in an estuarine edible crab Scylla serrata exposed to naphthalene[J]. Chemosphere,2006,63(63):1523-1531.
[21]Sonanez-organis J G,Rodriguez-armenta M,Leal-rubio B,et al. Alternative splicing generates two lactate dehydrogenase subunits differentially expressed during hypoxia via HIF-1 in the shrimpLitopenaeusvannamei[J]. Biochimie,2012,94(5):1250-1260.
[22]Cheng W,Chen J C. Effects of intrinsic and extrinsic factors on the haemocyte[J]. Fish and Shellfish Immunology,2001,11(1):53-63.
[23]Johansson M W,Keyser P,Sritunyalucksana K,et al. Crustacean haemocytes and haematopoiesis[J]. Aquaculture,2000,191(1):45-52.
[24]Moullac G L,Haffner P. Environmental factors affecting immune responses in Crustacea[J]. Aquaculture,2000,191(1):121-131.
[25]Cheng W,Wang L u W L,Cheng J C. Effect of water temperature on the immune response of white shrimpLitopenaeusvannameito Vibrio alginolyticus[J]. Aquaculture,2005,250(3):592-601.
[26]Yehs T,Liu C H,Chen J C. Effect of copper sulfate on the immune response and susceptibility toVibrioalginolyticusin the white shrimpLitopenaeusvannamei[J]. Fish and Shellfish Immunology,2004,17(3):437-446.
[27]Li C C,Chen J C. The immune response of white shrimpLitopenaeusvannameiand its susceptibility toVibrioalginolyticusunder low and high pH stress[J]. Fish and Shellfish Immunology,2008,25(6):701-709.
[28]Zheng C Q,Jeswina J,Shen K L,et al. Detrimental effect of CO2-driven seawater acidification on a crustacean brine shrimp,Artemiasinica[J]. Fish and Shellfish Immunology,2002,96(2):181-190.
[29]Mercier L,Palacios E,Campa-cordova A I,et al. Metabolic
and immune responses in Pacific white leg shrimpLitopenaeusvannameiexposed to a repeated handling stress[J]. Aquaculture,2006,258(1):633-640.
[30]Kniffin C D,Burnett L E,Burnett K G. Recovery from hypoxia and hypercapnic hypoxia:Impacts on the transcription of key antioxidants in the shrimpLitopenaeusvannamei[J]. Comparative Biochemistry and Physiology Part B,1973,10(1):9-85.
