石灰性紫色土硝化作用及硝化微生物对不同氮源的响应*
2018-04-13赵伟烨王智慧曹彦强刘天琳罗红燕蒋先军
赵伟烨 王智慧 曹彦强 刘天琳 罗红燕 朱 波 蒋先军†
(1 西南大学资源环境学院,重庆 400715)
(2 中国科学院成都山地灾害与环境研究所,成都 610041)
氮(N)素是地球所有生物所必需的营养元素[1]。农业生产过程中大量氮肥的投入虽然增加了作物的产量,但也引起了水体污染及温室气体排放等环境问题[2]。硝化作用作为农田生态系统氮素损失的主要途径之一,是氨经过亚硝酸盐最终转化为硝酸盐的氧化过程,由氨氧化和亚硝酸氧化两步组成,分别由氨氧化细菌(Ammoniao x i d i z i n g b a c t e r i a,A O B)、氨氧化古菌(Ammonia-oxidizing archaea, AOA)和亚硝酸盐氧化细菌 (Nitrite-oxidizing bacteria, NOB)驱动完成[3]。由于氨氧化是硝化作用的限速步骤[4],同时NOB相比于AOB和AOA更难在实验室环境中生长[5],因此多年来人们研究的方向主要集中在氨氧化微生物上,对AOB和AOA在生态系统中的分布[6-8]、在土壤硝化作用中 的相对贡献[9]、影响因子[10-11]以及不同氮源下氨氧化微生物的群落组成变化[12]等进行了大量深入研究。NOB利用亚硝酸盐氧化酶将亚硝酸盐氧化为硝酸盐,亚硝酸盐是其唯一氮源[13]。亚硝酸盐作为硝化作用的中间产物,能够通过氨氧化细菌和亚硝酸盐氧化细菌之间的紧密配合立刻转化为硝酸盐[14],然而,有时氨氧化细菌和亚硝酸盐氧化细菌不同的生长速率会打破这种合作机制导致亚硝酸盐的累积[15]。研究发现[16],温度、pH、溶解氧等因子对NOB活性具有显著影响,也会导致亚硝酸盐的累积。最近,科学家们报道了一种单步硝化螺菌属细菌能够执行全程硝化(complete nitrification)过程[17-18],即先前被人们认知的仅仅能够催化亚硝酸盐氧化的亚硝酸盐氧化细菌。全程氨氧化微生物(Comammox)的发现为土壤硝化作用的研究开创了全新的领域。
氮肥施入土壤后会导致土壤局部环境的变化[19],在实际的农业生产应用中,氮肥的施用也必然会导致其他离子进入土壤,对土壤硝化作用产生影响[19]。石灰性紫色土主要发育在亚热带地区石灰性紫色砂页岩,pH较高,土质较为疏松,氮素含量较低。由于高pH土壤相比于低pH土壤硝化作用强,更容易造成氮素的损失,因此本文以石灰性紫色土为研究对象,采用室内培养试验以表征石灰性紫色土在硫酸铵、氯化铵和尿素三种不同底物下的硝化作用强弱差异,通过实时荧光定量 PCR技术分析AOB和AOAamoA基因拷贝数在培养过程中的变化并通过高通量测序分析石灰性紫色土加入不同底物后的物种进化及硝化细菌群落组成。从微生物层面探究石灰性紫色土硝化作用发生机制,以期为合理施肥,提高氮素利用率提供资料。
1 材料与方法
1.1 供试土壤
供试土壤采自中国科学院成都山地灾害与环境研究所盐亭紫色土农业生态观测研究站,东经105°28′,北纬31°16′,年均气温17.4℃,年均降水826 mm,为亚热带季风气候。供试土样为石灰性紫色土,种植作物为小麦。于2016年9月用土钻按五点取样法钻取0~20 cm耕作层土壤,带回实验室后均匀混合,去除枯枝落叶等杂物后自然风干,过2 mm筛储存于4℃冰箱用于培养实验,其余过1 mm筛用于土壤理化性质的测定。供试土壤pH 8.33,有机质15.62 g kg-1,全氮1.29 g kg-1,全磷0.81 g kg-1,全钾17.63 g kg-1,速效氮71.91 mg kg-1。
1.2 试验设计
试验采用室内培养的方法,培养前测定土壤含水量,根据土壤含水量称取过2 mm筛的鲜土(以10.00 g干土计)置于150ml的玻璃广口瓶。试验设计添加不同氮源的4个处理,分别为CK、(NH4)2SO4、NH4Cl和CO(NH2)2,各3个重复,所加氮源浓度均为 N 100 mg kg-1,通过均匀添加超纯水调节土壤水分含量至田间持水量(WHC)的60%,用保鲜膜将瓶口封住,用针头在保鲜膜上扎5~6个小孔,使广口瓶处于通气状态,将广口瓶置于28℃恒温培养箱中,并在培养过程中每隔3 d以称重法补充蒸发损失的水分以保持土样的水分含量恒定。在培养的第0、14、28天进行破坏性取样,测定培养土样的铵态氮、硝态氮,同时将剩余土样保存于-20℃用于AOA和AOBamoA基因拷贝数测定及高通量测序。
1.3 项目分析与测定
pH采用玻璃电极测定(1∶2.5的土水比);有机质用重铬酸钾容量法测定;全氮用半微量凯氏法测定;全磷用钼锑抗比色法测定;全钾用火焰光度法测定;速效氮用碱水解法测定;铵态氮和硝态氮用靛酚蓝比色法和紫外分光光度法 测定[20]。
土壤DNA的提取:本实验采用FastDNA®SPIN Kit for soil(MP Biomedicals)试剂盒进行,分别称取0.5 g从-20 ℃冰箱去取出的土样,按试剂盒操作步骤进行,在Fsat PrepTMFP120核酸提取仪中以6 m s-1的速度裂解40 s,提取后的DNA在-20 ℃下保存,用于AOA和AOBamoA基因拷贝数的测定。
定量PCR分析:实时荧光定量PCR使用大连宝生物工程有限公司的SYBR Premix Ex TaqTM试剂盒在CFX96 Optical Real-Time PCR System(Bio-Rad Laboratories, Hercules,CA)扩增仪上进行分析。PCR反应总体系为20 μL,包含模版 DNA、上下游引物和 Taq DNA聚合酶。AOBamoA基因片段(491bp)上下引物分别为amoA-1F和amoA-2R[21],AOAamoA基因片段(635bp)上下引物分别为archamoAF和arch-amoAR[22]。
AOB和AOAamoA功能基因及16S rRNA基因-Miseq 测序:(1)目的基因的扩增及纯化。①将提取的DNA样品分别用特异引物(amoA-1F和amoA-2R)、(arch-amoAF和arch-amoAR)及通用引物(515F和907R)进行扩增,每个样本3个重复,DNA 水平的 PCR 扩增体系主要包括: 25 μL的SYBR@Premix EX TaqTM(TaKaRa 公司),上下引物各1.0 μL,加入 1.0 μL的DNA 模板和20.5μL无菌水。PCR扩增条件均为:95℃,5 min;27 循环×(95 ℃,30 s;55 ℃,30 s;72 ℃,45 s);72 ℃,10 min;保持 4 ℃,得到PCR产物。②获得土壤DNA水平的基因扩增产物后,将PCR 产物用2%的琼脂糖凝胶电泳检测,切胶,利用Agarose Gel DNA Fragment Recovery Kit Ver. 2.0 试剂盒(Takara)纯化,纯化产物溶解于25 μL DNase-free H2O。③纯化后的PCR 产物通过1.2% 琼脂糖凝胶电泳检测纯化效果,利用微量紫外分光光度计(NanoDrop ND-1000 UV-Vis)测定扩增产物的浓度。(2)进行Illumina PE250 文库构建,测序由上海美吉生物科技有限公司完成,amoA功能基因测序得到大于 1万条的测序数据量,16S rRNA基因测序得到 大于3万条的测序数据量。(3)数据处理:测序后提取出的数据以fastq 格式保存,数据每个样本有 fq1 和 fq2两个文件,里面为测序两端的序列,序列按顺序一一对应。测序原始数据根据PE 序列之间的重叠关系,将成对的序列拼接,对序列中低质量序列(<50 bp)进行剔除,据序列首尾两端的条码和引物序 列区分样品得到有效序列,并校正序列方向。利用Usearch软件按照>97%进行OTU聚类分析,进行多样性指数分析,基于分类学信息,可以在各个分类水平进行群落结构的统计,进行一系列群落结构和系统发育等深入的统计学和可视化分析。
1.4 数据处理
利用SPSS 18软件对数据进行统计分析。硝态氮、铵态氮、AOB、AOAamoA基因拷贝数及AOB和NOB在属水平上的百分比等在Excel中处理后采用Origin 8.1作图,系统发育树采用Mega 4.0等软件完成。
2 结 果
2.1 土壤中NO3--N、NH4+-N含量的变化
土壤中NO3--N、NH4+-N在0 d和28 d的含量变化如图1所示。CK、(NH4)2SO4、NH4C l和CO(NH2)2四种处理在0 d时的硝态氮含量分别为N 7.22、6.54、7.77和7.91 mg kg-1,经过28 d培养后,土壤中硝态氮的累积量变为N 31.40、115.2、101.3和122.5 mg kg-1,而铵态氮的变化由0 d时的N 5.91、95.95、95.86和93.98 mg kg-1减少为0.41、0.01、5.31和0.35 mg kg-1。与CK相比,(NH4)2SO4、NH4Cl和CO(NH2)2作为氮源加入后显著促进了硝态氮的累积(p<0.05),由图1看出,NH4Cl处理中硝态氮的累积量在培养结束时,硝态氮的累积量显著低于(NH4)2SO4和CO(NH2)2处理(p<0.05),而铵态氮含量在28 d培养结束时,除NH4Cl处理外,CK、(NH4)2SO4和CO(NH2)2处理铵态氮含量均消耗殆尽,28 d结束时,NH4Cl处理中铵态氮的含量显著高于其余处理(p<0.05),与硝态氮含量变化相对应。

图1 土壤硝态氮、铵态氮含量随时间的变化Fig. 1 Variation of soil NO3- -N and NH4+-N contents with time
2.2 土壤氨氧化细菌(A O B)和氨氧化古菌(AOA)amoA基因拷贝数变化
AOB和AOAamoA基因拷贝数随时间的变化如图2所示。从图2看出,CK、(NH4)2SO4、NH4Cl和CO(NH2)2四种处理中AOBamoA基因拷贝数在培养过程中均呈显著变化趋势(p<0.05),除NH4Cl处理外,CK、(NH4)2SO4和CO(NH2)2处理中AOB丰度均呈现出先显著增加后显著降低的趋势(p<0.05)。(NH4)2SO4和CO(NH2)2处理中AOB丰度在14 d时达到最大值,分别为3.38×107g-1干土和3.55×107g-1干土,到28 d减少至1.46×107g-1干土和1.69×107g-1干土,可能由于随着底物浓度的消耗殆尽, AOB丰 度也随之减少 。而NH4Cl处理中AOB丰度呈现增长趋势,从图2看出,在14 d时,NH4Cl处理的土壤A OB丰度显著低于(NH4)2SO4和CO(NH2)2处理的土壤中AOB丰度(p<0.05),而在28 d时,NH4Cl处理的土壤AOB丰度显著高于(NH4)2SO4和CO(NH2)2处理土壤中AOB的丰度(p<0.05),可能由于NH4Cl处理延缓了铵态氮的消耗,在培养过程中可以持续为AOB提供充分底物。由图2 明显看出CK、(NH4)2SO4、NH4Cl和CO(NH2)2四种处理中AOAamoA基因拷贝数在培养过程中无显著变化(p>0.05)。
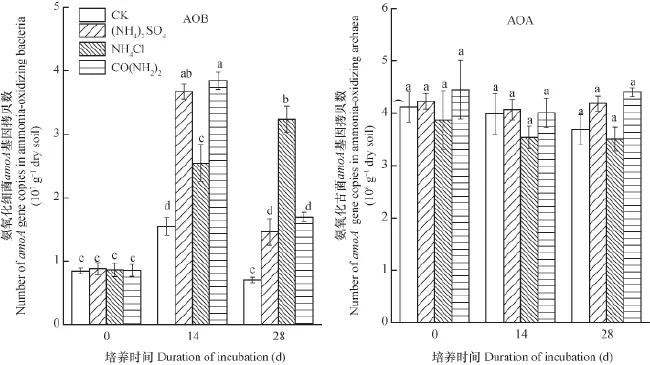
图2 氨氧化细菌(AOB)和氨氧化古菌( AOA)amoA基因拷贝数变化Fig. 2 Variation of number of amoA gene copies in ammonia oxidizing bacteria (AOB) and archaea(AOA)
2.3 土壤氨氧化细 菌(A O B)和氨氧化古菌(AOA)amoA功能基因系统进化
AOB和AOAamoA功能基因系统发育树如图3和图4所示。对amoA功能基因进行相似性分析,按照>97%相似性进行OTU分类。石灰性紫色土AOBamoA功能基因在0 d和28 d的测序结果分析分别得到7个和8个OTU,系统发育分析发现,CK、(NH4)2SO4、NH4Cl和CO(NH2)2处理下AOBamoA功能基因类群均属于Cluster 3 。分析发 现OTU 1所含序列占比最大,且CK、(NH4)2SO4、NH4Cl和CO(NH2)2处理下的序列数占比由0 d时的14%、16%、15%和9%变为28 d时的28%、79%、72%和76%,序列数显著增加,且与Nitrosospirasp.Nsp2(AJ298719)有密切的亲缘关系。而OTU 2 中CK、(NH4)2SO4、NH4Cl和CO(NH2)2处理下的序列数占比下降幅度较大,经过分析发现与Nitrosolobusmultiformis(X90822)有密切的亲缘关系。石灰石性紫色土AOAamoA功能基因在0 d和28 d的测序结果分析分别得到9个OTU,系统分析发现,CK、(NH4)2SO4、NH4Cl和CO(NH2)2处理下AOAamoA功能基因类群Group 1.1b占主要,说明石灰性紫色土中AOAamoA功能基因类群主要属于Group 1.1b 。

图3 石灰性紫色土AOB amoA功能基因系统发育树Fig. 3 Phylogenetic tree of AOB amoA functional genes in the calcareous purple soil
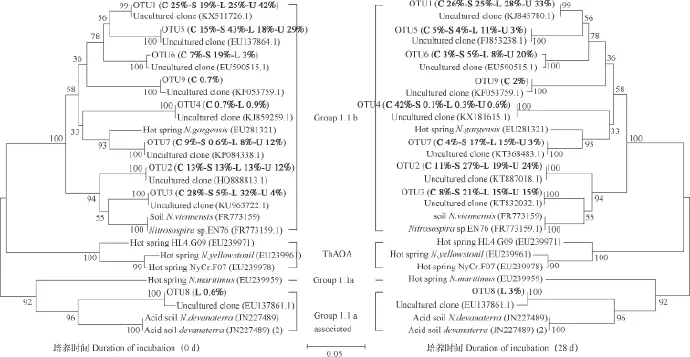
图4 石灰性紫色土AOA amoA功能基因系统发育树Fig. 4 Phylogenetic tree of AOA amoA functional genes in the calcareous purple soil
2.4 硝化细菌群落组成
CK、(NH4)2SO4、NH4Cl和CO(NH2)2四种处理在0 d时的样本16S基因测序得到41 109、31 654、38 918和39 187条序列,28 d时的样本16S基因测序得到36 212、33 822、32 807和40 295条序列。从所有序列挑出属于AOB和NOB的序列,在属水平上AOB和NOB序列占总序列的百分比如图5所示。从图5看出CK、(NH4)2SO4、NH4Cl和CO(NH2)2四种处理在0 d时AOB分别占总序列的0.12%、0.08%、0.12%、0.13%,NOB分别占总序列的0.61%、0.58%、0 .60%、0.61%,经过28 d培养过程,CK、(NH4)2SO4、NH4Cl和CO(NH2)2四种处理中AOB分别占总序列的0.12%、0.28%、0.33%、0.20%,NOB分别占总序列的0.76%、1.14%、1.02%、1.26%,而且CK、(NH4)2SO4、NH4Cl和CO(NH2)2四种处理下NOB占总序列的比例明显高于AOB占总序列的比例。除CK外,添加氮源经过28 d培养后,AOB和NOB占总序列的比例明显增长。(NH4)2SO4、NH4Cl和CO(NH2)2处理中,经过28 d培养,AOB和NOB占比相比于0 d分别增加3.50倍、2.75倍、1.54倍和1.97倍、1.70倍、2.07倍。

图5 AOB和NOB属水平占总微生物的百分比Fig. 5 Percentages of AOB and NOB in total number of microorganisms at the genus level
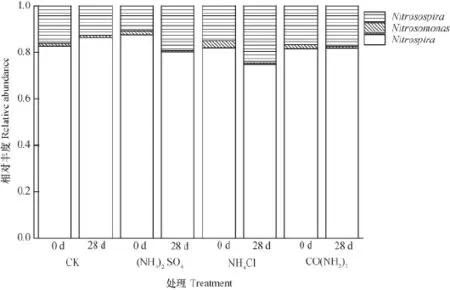
图6 AOB和NOB在每个cluster的相对丰度Fig. 6 Relative abundanceof AOB and NOB in each cluster
AOB和NOB在每个cluster的相对丰度如图6所示,从中得出,CK、(NH4)2SO4、NH4Cl和CO(NH2)2四种处理中AOB主要以Nitrosospira为主,NOB主要以Nitrospira为主。0 d时,CK、(NH4)2SO4、NH4Cl和CO(NH2)2四种处理中AOB的相对丰度分别为0.17、0.12、0.18、0.18,经过28 d培养,AOB相对丰度分别为0.14、0.20、0.25、0.20,CK处理经过28 d培养AOB的相对丰度有所下降,其余各处理的相对丰度有所上升。0 d时,CK、(NH4)2SO4、NH4Cl和CO(NH2)2四种处理中NOB的相对丰度分别为0.83、0.88、0.82、0.82,经过28 d培养,NOB 相对丰度变为0.87、0.80、0.75、0.82,其中NH4Cl处理中NOB的相对丰度有所下降。
3 讨 论
本试验供试土壤为石灰性紫色土,pH较高,与CK相比,(NH4)2SO4、NH4Cl和CO(NH2)2处理均刺激土壤硝化作用的发生。NH3是自养氨氧化微生物的唯一能量来源。土壤中H+的浓度决定了土壤中NH3的存在状态,如果土壤中H+的浓度较高,那NH3以AOA和AOB不能利用的NH4+离子态存在。已有研究表明pH在4.8~8.5的范围内时,土壤 中硝化速率随着pH的增加而增强[23-25],这与前人研究一致[1]。但是三种不同底物之间的硝化作用强弱不一,其中NH4Cl处理延缓了 硝态氮的累积,抑制了铵态氮的减少,这可能是由于不同氮源引入了不同的阴离子,对土壤硝化作用产生了影响。前人研究表明,SO42-对硝化作用具有促进作用;Cl-对硝化作用的抑制效果也进一步被肯定[26],可以降低氮素损失,就如同在农业生产过程中施用硝化抑制剂 来有效降低土壤的硝化速率[27-28],以提高氮肥利用率。
氨氧化作用是硝化作用的第一步,也是限速步骤,是全球氮循环的中心环节。AOA的发现为氨氧化作用的研究开启了新方向[29]。大量研究表明AOB和AOA在不同生境的硝化作用中发挥着重要作用[30-31]。本试验所用石灰性紫色土,pH大于7,amoA功能基因拷贝数变化表明,AOB的丰度在整个培养过程中变化显著,而且与底物浓度变化相吻合,而AOA的丰度在CK、(NH4)2SO4、NH4Cl和CO(NH2)2处理下均无显著变化,说明AOB是石灰性紫色土硝化作用的主要推动者,这与高pH下土壤硝化作用主要由AOB主导的研究相一致[32]。碱性土壤中AOB较AOA更为活跃,AOB参与了13CO2的固定和氨氧化过程[33]。Shen等[12]的研究也表明施肥对碱性土壤中AOB的影响要大于对AOA的影响且AOB的丰度与pH(8.3~8.7)和土壤的潜在硝化势显著相关。本试验借助实时荧光定量PCR技术,通过amoA功能基因拷贝数得出,NH4Cl处理的土壤中AOB的丰度在培养过程的第14天时显著低于其他两个处理(p< 0.05),而AOA在整个培养过程中的amoA基因拷贝数也低于其他两种氮源处理,但差异不显著(p> 0.05),这可能因为AOA主要在低pH、寡营养等环境的硝化作用中发挥作用[1],因此在高pH的石灰性紫色土硝化作用中不起主导作用,进而氮源的加入对AOA并无明显刺激,但amoA功能基因拷贝数变化暗示Cl-对AOB产生了抑制。Darrah等[34]在1985年运用Monod方程模拟氯化铵对硝化细菌的响应得出,添加氯化铵N超过7.3 μmol g-1就产生抑制效果。苏天明等[35]研究也得出了氯化铵的施用减少了亚硝酸细菌的数量,降低了硝酸盐的含量。Jooste和van Leeuwen[36]关于含氯消毒剂对亚硝酸盐累积的研究中得出了含氯消毒剂通过抑制亚硝酸氧化菌降低了硝酸盐的积累。以上研究均表明了氯通过抑制硝化微生物进而抑制了硝酸盐的累积。本试验进化分析表明CK、(NH4)2SO4、NH4Cl和CO(NH2)2处理并未改变AOBamoA功能基因类群,属于亚硝化螺菌属(Nitrosospira)Cluster 3 ,而AOAamoA功能基因类群主要是Group 1.1b ,这与许多重要研究结果相互印证[37],为认识氨氧化微生物的关键驱动因子提供资料补充。
亚硝酸氧化是硝化作用的第二步,由NOB主导完成。由于氨氧化作用被认为是硝化作用的限速步骤,同时AOA的发现[29]以及NOB在实验室环境中相比AOB和AOA更难生长[5],因此多年来人们对硝化作用的研究主要集中在氨氧化作用。硝化微生物对底物的利用范围十分有限,AOB、AOA和NOB共存于复杂的环境中,这意味着这些微生物对资源利用有不同的方式。最近一项惊奇的研究发现属于硝化螺菌属NitrosospiraSublineageⅡ的菌群能够催化全程硝化作用,与其他硝化微生物不同的是,这类全程氨氧化微生物(Comammox)含有催化氨氧化和亚硝酸氧化的全部基因,且从已发表的宏基因组数据库中分析发现这种全程氨氧化微生物广泛分布于稻田和其他农业土壤、森林土壤、稻田水域、淡水环境如湿地,河床,含水层和湖泊沉积物,以及工程系统(活性污泥和饮用水处理厂),ComammoxNitrospira是自然系统微生物群落中常见的硝化细菌[17-18]。全程氨氧化微生物的发现也符合单步硝化能够释放更多自由能的热力学理论[5]。氨氧化微生物(AOM)将氨氧化为亚硝酸盐能够产生6个电子,较NOB将亚硝酸盐氧化成硝酸盐产生的电子多三倍,由于氨氧化微生物代谢时氨单加氧酶活化氨需要2个电子,因此氨氧化微生物每转化一个单位的氮真正 释放的能量实际上只比亚硝酸氧化细菌释放的 能量多2倍,这就意味着环境中AOM的数量应该较NOB多[38-40]。本试验通过16S rRNA基因测序发现,土壤中NOB占总微生物的比例却高于AOB占总微生物的比例,并且以Nitrospira为主,推测供试土壤可能存在全程氨氧化微生物,也可能NOB较AOB具有更高的生长和新陈代谢转化速率。Wang等[41]利用13CO2稳定性同位素标记技术对四种水稻土的培养试验结果表明,被标记的Nitrospira丰度也远高于AOB和AOA,这与我们的试验结果相似。Daims等[5]认为相同环境中Nitrospira的丰度高于AOB和AOA预示着全程氨氧化微生物的存在。
4 结 论
(NH4)2SO4、NH4Cl和CO(NH2)2处理均刺激石灰性紫色土硝化作用的发生,但是相比于(NH4)2SO4和CO(NH2)2处理,NH4Cl处理延缓了硝态氮的累积,对硝化作用有抑制效果。石灰性紫色土硝化作用的主要推动者为AOB,但氯离子对AOB有抑制。石灰性紫色土中AOB的优势种群为NitrosospiraCluster 3,AOA的优势种群是Group 1.1b,NOB的优势种群为Nitrospira。石灰性紫色土中NOB占土壤总微生物的比例高于AOB,可能存在全程氨氧化微生物。
[ 1 ] 贺纪正,张丽梅. 氨氧化微生物生态学与氮循环研究进展. 生态学报,20 09,29(1):406—415 He J Z,Zhang L M.Advances in microbial ecology and nitrogen cycling in ammonia oxidation(In Chinese).Acta Ecologica Sinica,2009,29(1):406—415
[ 2 ] 朱兆良. 农田中氮肥的损失与对策. 土壤与环境,2000,9(1):1—6 Zhu Z L. Loss of nitrogen fertilizer in farmland and countermeasures(In Chinese). Soil and Environment,2000,9(1):1—6
[ 3 ] Ushiki N,Jinno M,Fujitani H,et al. Nitrite oxidation kinetics of twoNitrospirastrains:The quest for competition and ecological niche differentiation.Journal of Bioscience and Bioengineeri ng,2017,123(5):581—589
[ 4 ] Kowalchuk G A,Stephen J R. Ammonia—oxidizing bacteria:A model for molecular microbial ecology.Annual Reviews in Microbiology,2001,55(1):485—529
[ 5 ] Daims H,Lücker S,Wagner M. A new perspective on microbes formerly known as nitrite—oxidizing bacteria. Trends in Microbiology,2016,24(9):699—712
[ 6 ] Hyman M R,Arp D J.14C2H2and14CO2—labeling studies of the de novo synthesis of polypeptides byNitrosomonaseuropaeaduring recovery from acetylene and light inactivation of ammonia monooxygenase.Journal of Biological Chemistry,1992,267(3):1534—1545
[ 7 ] Francis C A,Beman J M,Kuypers M M M. New processes and players in the nitrogen cycle:The microbial ecology of anaerobic and archaeal ammonia oxidation. The ISME Journal,2007,1(1):19—27
[ 8 ] Prosser J I,Nicol G W. Relative contributions of archaea and bacteria to aerobic ammonia oxidation in the environment. Environmental Microbiology,2008,10(11):2931—2941
[ 9 ] Taylor A E,Zeglin L H,Wanzek T A,et al.Dynamics of ammonia—oxidizing archaea and bacteria populati ons and contributions to soil nitrification potentials. The ISME Journal,2012,6(11):2024—2032
[10] Jiang X J,Hou X Y,Zhou X,et al. pH regulates key players of nitrification in paddy soils. Soil Biology &Biochemistry,2015,81:9—16
[11] He J Z,Shen J P,Zhang L M,et al. Quantitative analyses of the abundance and composition of ammonia—oxidizing bacteria and ammonia—oxidizing archaea of a Chinese upland red soil under long—term fertilization practices. Environmental Microbiology,2007,9(9):2364—2374
[12] Shen X Y,Zhang L M,Shen J P,et al. Nitrogen loading levels affect abundance and composition of soil ammonia oxidizing prokaryotes in semiarid temperate grassland. Journal of Soils and Sediments,2011,11(7):1243—1252
[13] 张星,林炜铁,朱雅楠. 硝化细菌中亚硝酸盐氧化还原酶的研究进展. 微生物学通报,2008,35(11):1806—1810 Zhang X,Lin W T,Zhu Y N. Research progress of nitrite oxidoreductase in nitrifying bacteria(In Chinese).Journal of Microbiology,2008,35(11):1806—1810
[14] Randall C W,Buth D. Nitrite build—up in activated sludge resulting from temperature effects. Water EnvironmentFederation,1984,56(9):1039—1044
[15] Smith R V,Doyle R M,Burns L C,et al. A model for nitrite accumulation in soils. Soil Biology &Biochemistry,1997,29(8):1241—1247
[16] Philips S,Laanbroek H J,Verstraete W. Origin,causes and effects of increased nitrite concentrations in aquatic environments. Reviews in Environmental Science and Biotechnology,2002,1(2):115—141
[17] Daims H,Lebedeva E V,Pjevac P,et al. Complete nitrification byNitrospirabacteria. Nature,2015,528(7583):504—509
[18] van Kessel M A H J,Speth D R,Albertsen M,et al. Complete nitrification by a single microorganism.Nature,2015,528(7583):555—559
[19] 佟德利,徐仁扣. 三种氮肥对红壤硝化作用及酸化过程影响的研究. 植物营养与肥料学报,2012,18(4):853—859 Tong D L,Xu R K. Effects of three kinds of nitrogen fertilizer on nitrification and acidification of red soil(In Chinese). Journal of Plant Nutrition and Fertilizer Science,2012,18(4):853—859
[20] 杨剑虹,王成林,代享林. 土壤农化分析与环境监测.北京:中国大地出版社,2008 Yang J H,Wang C L,Dai X L. Soil agrochemical analysis and environmental monitoring(In Chinese).Beijing:China Earth Publishing House,2008
[21] Beman J M,Francis C A. Diversity of ammonia—oxidizing archaea and bacteria in the sediments of a hypernutrified subtropical estuary:Bahía del Tóbari,Mexico. Applied and Environmental Microbiology,2006,72(12):7767—7777
[22] Rotthauwe J H,Witzel K P,Liesack W. The ammonia monooxygenase structural gene amoA as a functional marker:Molecular fine—scale analysis of natural ammonia—oxidizing populations. Applied and Environmental Microbiology,1997,63(12):4704—4712
[23] Wood P M. Mechanisms for biological ammonia oxidation//Cole J A,Ferguson S J. The nitrogen and sulphur cycles. UK:Cambridge University Press,1988:219—243
[24] Killham K. Nitrification in coniferous forest soils.Plant and Soil,1990,128:31—44
[25] Paul E A,Clack F E. Soil microbiology and biochemistry. San Diego:Academic Press,1989
[26] 张树兰,杨学云,吕殿青,等. 温度、水分及不同氮源对土壤硝化作用的影响. 生态学报,2002,22(12):2147—2153 Zhang S L,Yang X Y,Lü D Q,et al. Effects of temperature,moisture and different nitrogen sources on nitrification in soil(In Chinese). Acta Ecologica Sinica,2002,22(12):2147—2153
[27] McGeough K L,Watson C J,Müller C,et al.Evidence that the efficacy of the nitrification inhibitor dicyandiamide(DCD)is affected by soil properties in UK soils. Soil Biology & Biochemistry,2016,94:222—232
[28] Guo Y J,Di H J,Cameron K C,et al. Effect of application rate of a nitrification inhibitor,dicyandiamide(DCD),on nitrification rate,and ammonia—oxidizing bacteria and archaea growth in a grazed pasture soil:An incubation study. Journal of Soils and Sediments,2014,14(5):897—903
[29] Leinin ger S,Urich T,Schloter M,et al. Archaea predominate among ammonia—oxidizing prokaryotes in soils. Nature,2006,442(7104):806—809
[30] Francis C A,Roberts K J,Beman J M,et al.Ubiquity and diversity of ammonia—oxidizing archaea in water columns and sediments of the ocean.Proceedings of the National Academy of Science,2005,102:14683—14688
[31] Nugroho R A,Röling W F M,van Straalen N M,et al. Changes in nitrification and bacterial community structure upon cross—inoculation of Scots pine forest soils with different initial nitrification rates. Soil Biology & Biochemistry,2009,41:243—250
[32] Jia Z J,Conrad R. Bacteria rather than Archaea dominate microbial ammonia oxidation in an agricultural soil. Environment Microbiology,2009,11:1658—1671
[33] Xia W,Zhang C,Zeng X,et al. Autotrophic growth of nitrifying community in an agricultural soil. The ISME Journal,2011,5(7):1226—1236
[34] Darrah P R,Nye P H,White R E. Modelling growth responses of soil nitrifiers to additions of ammonium sulphate and ammonium chloride. Plant and Soil,1985,86(3):425—439
[35] 苏天明,顾明华,黎晓峰,等. 尿素配施氯化铵对菜薹硝酸盐积累的影响. 中国蔬菜,2005(9):7—9 Su T M,Gu M H,Li X F,et al.Effect of urea ammonium chloride on nitrate content inBrassica campestris(In C hinese).Chinese Vegetables,2005(9 ):7—9
[36] Jooste S H J,van Leeuwen J. Induction of nitrite build—up in water by some common disinfectants.Water SA.,1993,19(2):107—112
[37] 贺纪正,张丽梅. 土壤氮素转化的关键微生物过程及机制.微生物学通报,2013(1):90—108 He J Z,Zhang L M.Key microbial processes and mechanisms of soil nitrogen transformation(In Chinese). Microbiology China,2013(1):90—108
[38] Aleem M I H. Generation of reducing power in chemosynthesis III. Energy—linked reduction of pyridine nucleotides inThiobacillusnovellus. Journal of Bacteriology,1966,91(2):729—736
[39] Ferguson S J. Is a proton—pumping cytochrome oxidase essential for energy conservation inNitrobacter? Febs Letters,1982,146(2):239—243
[40] Hagopian D S,Riley J G. A closer look at the bacteriology of nitrification. Aquacultural Engineering,1998,18(4):223—244
[41] Wang B,Zhao J,Guo Z,et al. Differential contributions of ammonia oxidizers and nitrite oxidizers to nitrification in four paddy soils. The ISME Journal,2015,9(5):1062—1075
