黄药子中毒导致肝损伤的机制研究
2018-04-13王少珍廖联明
王少珍 廖联明
黄药子为薯蓣科植物黄独(dioscorea bublifera L,DB)的干燥块茎,广泛分布于亚洲的热带和亚热带地区。作为传统中药,它被广泛用于治疗喉痛、甲状腺肿和甲状腺瘤。此外,印度和巴西还将黄药子用于治疗糖尿病[1-2],孟加拉国北部地区将其用于麻风病[3]。黄药子虽具有独特的疗效,但在过去30多年里,因长期和大量服用黄药子及其制剂而出现肝损害的病例屡见报道[4-5],大大限制了黄药子的临床应用。由于黄药子在机体内的作用机制尚不明确,故对其解毒药物的选择仍存在较大争议。如阿魏酸[6]和黄芩素[7]可通过抑制核因子-κB(nuclear factor kappa B,NF-κB)信号通路,提高机体的抗氧化能力,缓解炎症反应,从而保护黄药子毒性成分黄毒素B诱导的肝损伤;甘草可通过提高细胞色素450酶(cytochrome P 450,CYP450酶)活性,抑制CYP2E1、CYP3A4的mRNA表达,从而预防黄药子对肝脏的损害作用[8];黄芩和黄柏配伍后可通过提高肝脏的谷胱甘肽(glutathione,GSH)水平和抗氧化水平,减少肝组织细胞损伤,从而达到保肝的效果[9]。近年来,新一代测序技术的出现实现了高通量序列测定和测序成本降低,并大大提高了新基因或新生物标志物的识别速度和效率[10-12]。数字化基因表达(digital gene expression,DGE)是一个基于reads的转录组测序技术,可用于基因表达的定量分析,且在允许少量偏差存在的情况下实现基因表达谱的比较分析,从而提高了转录组测序的灵敏性和准确性[13-14]。由于小鼠的全基因组序列测定已完成,利用小鼠进行分子水平相关研究有很大的优势[15]。目前DGE技术已被广泛地用于药物肝毒性作用机制的研究,如Chen等[16]通过DGE分析发现,偏苯三酸三辛酯(trioctyl trimellitate,TOTM)诱导的小鼠肝损伤涉及细胞周期调节相关通路、脂质代谢通路和氧化应激系统。本研究中,笔者采用黄药子水提取物诱导小鼠肝损伤,利用从肝脏中提取的总核糖核酸(ribonucleic acid,RNA)建立DGE文库,通过对比正常组DGE文库,将差异表达基因进行基因本体论(gene ontology,GO)功能注释和京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)通路分析,以期通过对黄药子诱导的肝脏相关差异表达基因的分析,了解黄药子致肝毒性的作用机制,为寻找更高效的解毒药物提供参考信息。
资料与方法
一、实验动物与材料
1.实验动物:SPF级雌性[17]昆明小鼠40只,4~6周龄,体重(20±2)g,购自上海斯莱克实验动物有限责任公司(合格证编号2015000533474),常规饲养在福建中医药大学实验动物中心SPF饲养室。所有动物实验均遵循实验动物伦理要求,并获得伦理委员会的批准。
2.主要试剂:黄药子饮片(江西樟树天齐堂中药饮片有限公司,生产批号:1609004);TRIzol试剂(美国Invitrogen,15596018)、焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)处理水(美国Solarbio,R1600)、苏木素染色液(美国Solarbio,G1140)和伊红染色液(美国Solarbio,G1100)。
3.主要实验仪器:AU 2700全自动生化分析仪(日本OLYMPUSA公司)、旋转蒸发仪RE-52(上海亚荣生化仪器厂)、可见分光光度计(美国Thermo公司)、高速冷冻离心机(德国Eppedndorf公司)和RM2235组织切片机(德国徕卡公司)、HiSeqTM 2000 测序仪(Illummina公司)。
4.主要分析软件:用于比对分析的STAR 2.5.1b;用于定量分析的HTSeq 0.6.0、featureCounts 1.5.0和RSEM 1.2.28;用于差异分析的DESeq 2 1.10.1和edgeR 3.12.1;用于富集分析的clusterProfiler 3.0.5;用于可变剪接分析的rMATS 3.2.1;用于变异分析的GATK 3.2.1和snpEff 4.2;用于融合基因发现的SOAPfuse 1.27和star-fusion 0.7.0。
二、方法
1.药物制备:参考文献[18],取干燥黄药子饮片400 g,捣碎后按体积加入10倍量水,室温浸泡120 min,然后于水浴锅中100℃回流提取60 min,滤过。滤渣加8倍量水继续提取1次,合并两次滤液。将混合液在1 000 r/min下离心20 min,倾出上清液至干净瓶中,于(45±5)℃下真空减压浓缩至含生药量1.2 g/mL。浓缩液置4℃保存,备用。
2.实验动物分组与建模:将40只实验小鼠按随机数字表法分成4组:对照组、低剂量组、中剂量组和高剂量组,每组10只。每组小鼠连续灌胃给药21 d。低、中、高剂量组黄药子提取物浓缩液的每日给药量分别相当于临床成人日荐最高剂量(15 g)的2倍、4倍和8倍,即6 g/kg、12 g/kg和24 g/kg;对照组给予相同体积纯水。末次给药后,小鼠禁食不禁水。
三、观察指标
1.小鼠体重增长值:实验期间,各组小鼠每隔3 d 称重一次,末次给药的次日再次称重。依据首末次称重体重计算小鼠体重增长值,计算公式为:
小鼠体重增长值(g)=末次称量体重(g)-首次称量体重(g)(1)
2.血清生化指标检测:末次称重后,眼球采血,置1.5 mL EP管中,室温下静置2 h后,于4℃离心机中3 000 r/m离心20 min,吸取上清液转移到新的EP管中,置冰盒中送至福建省第二人民医院检验科,采用全自动生化分析仪检测各组小鼠血清中的丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)的活性。
3.肝脏指数:各组小鼠眼球采血后以脱颈椎法处死,迅速完整地剖取小鼠肝脏,称量小鼠肝湿重。计算给药期间各组小鼠的肝脏指数,计算公式为:
肝脏指数=肝脏重量(g)/末次称量体重(g)×100%(2)
4.肝组织的形态变化:肝脏称重后剪取肝左叶投入到4%多聚甲醛内固定36 h后,用自来水漂洗至无甲醛味,自肝左叶距边缘5 mm处修剪0.5 cm×0.5cm×1cm的组织块,经常规脱水、石蜡包埋、HE染色后,于普通光镜下观察小鼠的肝组织形态学变化,并于200×视野下摄取图像。
5.DGE文库信息分析
(1)RNA提取、建库和测序:肝脏称重后取肝小叶迅速置于液氮中速冻,放入-80 ℃冰箱保存备用。根据试剂盒厂家说明书,采用Trizol提取小鼠肝脏总RNA,经紫外分光光度计检测样本中的RNA质量合格后,寄往北京诺禾致源生物有限公司进行测序。样品检测合格后,用带有多聚胸腺嘧啶寡核苷酸[Oligo(dT)]的磁珠富集原核生物带有polyA尾的信使核糖核酸(messenger ribonucleic acid,mRNA)。随后在NEB Fragmentation Buffer中用二价阳离子将得到的mRNA随机打断。以片段化的mRNA为模版,随机寡核苷酸为引物,在M-MuLV逆转录酶体系中合成互补脱氧核糖核酸(complementary deoxyribonucleic acid,cDNA)第一条链,随后用核糖核酸酶H(ribonuclease H,RNaseH)降解RNA链,并在脱氧核糖核酸聚合酶Ⅰ(deoxyribonucleic acidpolymeraseⅠ,DNApolymerase Ⅰ)体系下,以三磷酸脱氧核糖核苷酸(deoxy-ribonucleotide triphosphates,dNTPs)为原料合成cDNA第二条链,随后利用AMPure XP beads纯化双链cDNA。纯化后的双链cDNA经过末端修复、加A尾并连接测序接头,用AMPure XP beads筛选200bp左右的cDNA,进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,并再次使用AMPure XP beads纯化PCR产物,最终获得文库。
文库构建完成后,先使用Qubit 2.0进行初步定量,稀释文库至1ng/μl,随后使用Agilent 2100对文库的插入片段进行检测,插入片段符合预期后,使用定量实时聚合酶链锁反应(quantitative real time polymerase chain reaction,Q-PCR)方法对文库的有效浓度进行准确定量(文库有效浓度>2nM),以保证文库质量。文库质检合格后,使用HiSeqTM 2000 测序仪进行测序。
(2)质控分析:经测序错误率检查、鸟嘌呤核苷酸和胞嘧啶核苷酸(guanine nucleotide and cytosine nucleotides,GC)含量分布检查及原始测序数据过滤,剔除带有接头、带有N碱基和测序质量低的reads,获得clean reads以供后续分析。采用STAR软件将获得的clean reads对比到基因组或转录组中,根据比对结果,分别统计reads在基因组外显子区域、内含子区域以及基因间区所占的比例,最后使用HTSeq进行基因水平的定量分析,用公式计算基因表达水平:
RPKM:RPKM=106R:(NL/103)(3)
设RPKM(A)为基因A的表达量,则R为唯一比对到基因A的reads数,N为比对到唯一参考基因的总reads数,L为基因A的碱基数[19]。
(3)差异表达基因的筛选:筛选2个DGE文库,即对照组(Normal组)和高剂量组(DB诱导组),分析差异表达基因,对差异检验的P值作多重假设检验校正,padj为多重假设检验校正后的P值。采用edgeR软件进行表达差异显著性分析,以padj<0.05,差异倍数(foldchange)的绝对值>2作为差异有统计学意义的标准。padj值越小,差异倍数越大,表明基因表达水平差异越显著。当log2(foldchange)≥1 时,表示该基因表达上调;log2(foldchange)≤-1时,表示下调表达;当|log2(foldchange)<1| 时,表示基因表达差异无统计学意义。采用火山图、文氏图(Venndiagram)等方式展示差异表达基因。
(4)GO功能富集和KEGG(http://www.kegg.jp/)富集分析:使用clusterProfiler 3.0.5 软件对2个DGE文库筛选出的差异表达基因进行GO功能富集分析,将差异表达基因映射到相应条目,计算每个条目的差异表达基因数目。再使用KEGG通路富集对基因涉及的通路进行聚类,获得差异表达基因所参与的主要通路。
四、统计学分析
结 果
一、不同剂量黄药子对小鼠体重增长值和肝脏指数的影响
与对照组相比,低剂量组和中剂量组小鼠的体重增长、肝脏指数的差异均无统计学意义(P均>0.05);高剂量组小鼠的体重增长值降低,肝脏指数增高,差异均有统计学意义(P均<0.05)。见图1,2。
二、不同剂量黄药子对小鼠血清中ALT和AST酶活性的影响
各给药小鼠血清中的ALT和AST酶活性均高于对照组,且两种酶的活性变化呈剂量依赖性,即随着黄药子给药剂量的升高而增强。相比对照组,中、高剂量组小鼠ALT酶活性的变化均有统计学意义(P均<0.05),但只有高剂量组的AST酶活性变化差异有统计学意义(P<0.05)。见图3。
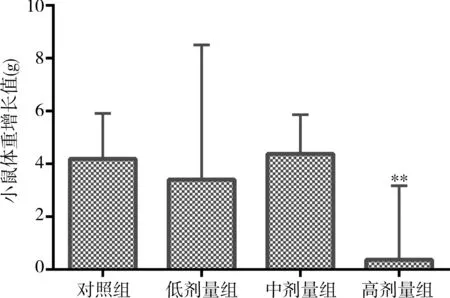
注:低、中、高剂量组黄药子提取物浓缩液的每日给药量分别为6g/kg、12g/kg和24g/kg,对照组给予同体积纯水;与对照组比较,**P<0.05
图1不同剂量黄药子灌胃对小鼠体重增长值的影响
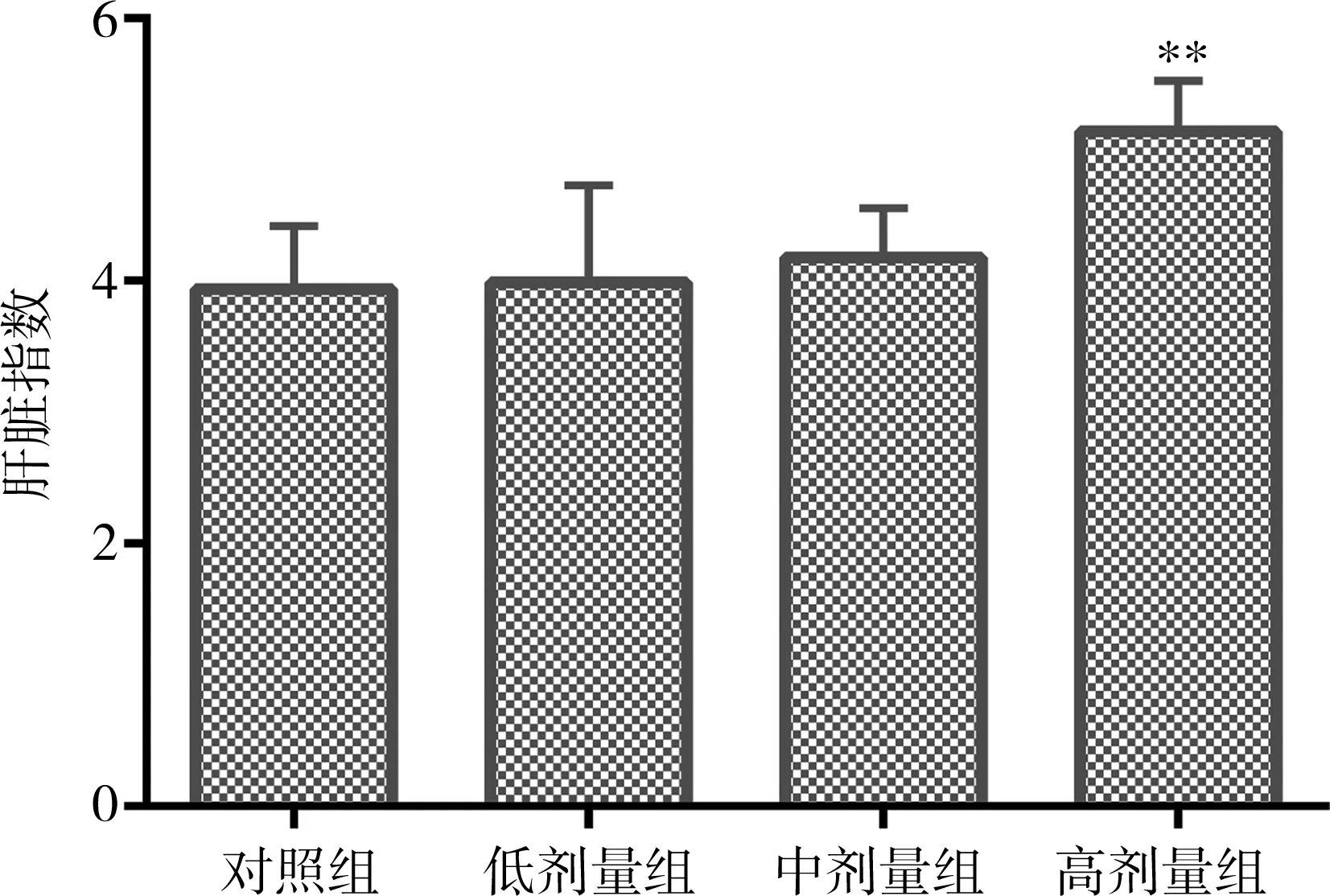
注:低、中、高剂量组黄药子提取物浓缩液的每日给药量分别为6g/kg、12g/kg和24g/kg,对照组给予同体积纯水;与对照组比较,**P<0.05
图2不同剂量黄药子灌胃对小鼠肝脏指数的影响
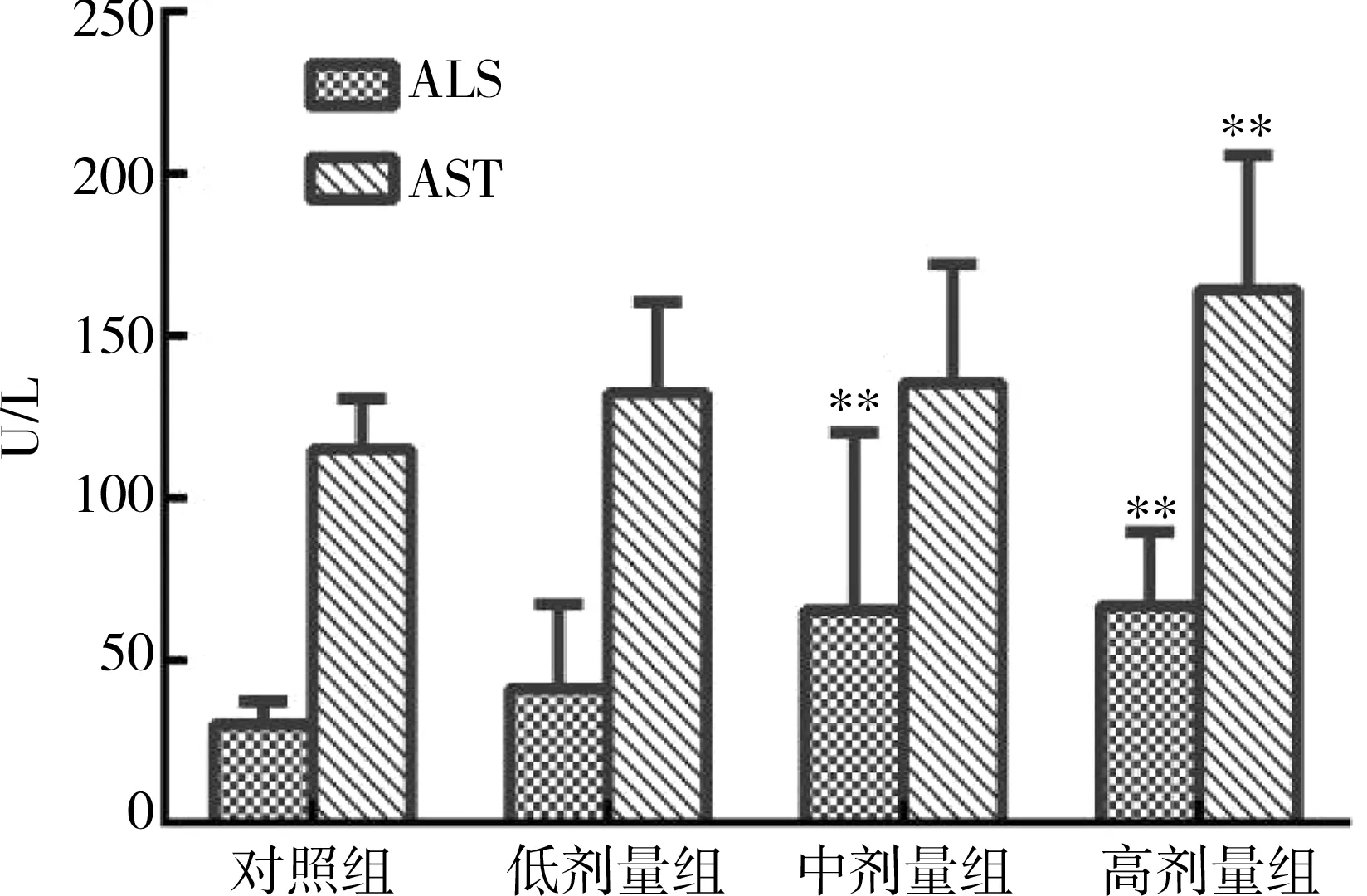
注:ALT为丙氨酸氨基转移酶,AST为天冬氨酸转氨酶;低、中、高剂量组黄药子提取物浓缩液的每日给药量分别为6g/kg、12g/kg和24g/kg,对照组给予同体积纯水;与对照组比较:**P<0.05
图3不同剂量黄药子灌胃对小鼠血清ALT和AST酶活性的影响
三、不同剂量黄药子对小鼠肝组织形态变化的影响
肝细胞以中央静脉为中心呈放射状排列,肝索排列整齐,肝小叶结构正常,细胞核明显,肝脏未见肝脏病理改变(图4a)。与图1相比,肝小叶结构正常,肝索排列较整齐,细胞核较明显,较接近对照组,但见汇管区有少量炎性细胞浸润(图4b)。个别细胞发生肿胀,汇管周围散在大量点灶状肝细胞坏死(图4c)。肝组织的正常结构明显被破坏,肝索受压紊乱,肝细胞明显肿大(胞浆疏松化),呈气球样变性,小叶内有较多中性粒细胞浸润(图4d)。

注:a为对照组,b为低剂量组,c为中剂量组,d为高剂量组;低、中、高剂量组黄药子提取物浓缩液的每日给药量分别为6 g/kg、12 g/kg和24 g/kg,对照组给予同体积纯水
图4不同剂量黄药子灌胃对小鼠肝组织形态学变化的影响(HE染色,×200)
四、DEG文库分析结果
(一)DEG文库质量分析
对Normal组和DB诱导组小鼠的肝脏RNA进行转录组测序(RNA-sequencing,RNA-Seq)测序与分析,从构建的2个DGE文库中分别检测出13 214 893和11 124 617条碱基序列(raw reads)。去除带接头(adaptor related)、带N碱基(containing N)和测序质量低(low quality)的reads后,2个文库分别得到12 819 933和10 786 300条序列(clean reads)。将clean reads比对到基因组或转录组是后续分析的基础。采用STAR软件对RNA-seq测序数据进行比对分析,将clean Reads 分别比对到参考基因和参考基因组。唯一匹配比对的reads在80%以上,证明RNA-Seq的测序质量较好。
使用皮尔逊相关系数(Pearson coefficient)分析样品间基因表达水平相关性,这是检验实验可靠性和样本选择是否的重要指标。结果显示,Normal组和DB诱导组两样本间的相关系数为0.975,大于理想的理论值0.92,说明样本间的差异较小,测序数据可靠,可用于下一步分析。
(二)基因组不同区域分布情况
已知物种是昆明小鼠,为了解测序reads在基因组上的比对情况,分别统计reads在基因组外显子区域、内含子区域以及基因间区所占的比例。结果显示,Normal组reads在基因组外显子区域、内含子区域以及基因间区所占的比例分别为93.13%、4.51%和2.36%,DB组分别为93.36%、4.5%和2.14%。其比对到外显子区域的比例最高,说明物种的基因注释较为完善,仅有少量前体mRNA或可变剪接事件滞留的内含子,非编码核糖核酸(non-coding ribonucleic acid,ncRNA)或少许脱氧核糖核酸(deoxyribonucleic acid,DNA)片段污染小。
(三)差异表达基因的聚类分析
如图5(a)所示,根据2个DGE文库中基因表达的比较结果,以padj<0.05为标准,筛选出了312个显著差异表达的基因,DB诱导组与Normal组比,表达显著上调基因(UP)和下调基因(DOWN)个数较接近,分别为148个和164个。提示这些差异表达基因可能对黄药子水提取物诱导的小鼠肝损伤具有重要影响。将所有表达基因按DB组和Normal组划分后,结果如图5(b)所示,DB组和Normal组均表达的高质量序列有9537个,仅在DB组表达的有702个,仅在Nomal组表达的有539个。可见黄药子的诱导作用严重影响了小鼠肝脏的相关功能基因的表达。
(四)显著差异表达基因的GO功能分析
DB组和Noma组DGE文库中差异表达基因经功能注释后主要归类为生物学过程和分子功能两个条目。生物学过程涉及的GO种类更多,各种类中的基因数也相对较均衡,其中含较多基因的为甲烷单加氧酶活性、血红素结合过程、四吡咯结合过程和氧化还原酶活性等生物功能;分子功能中含相对较多基因的为一元羧酸代谢过程、脂肪酸代谢过程、先天免疫反应和细胞因子反应过程等。见表1。
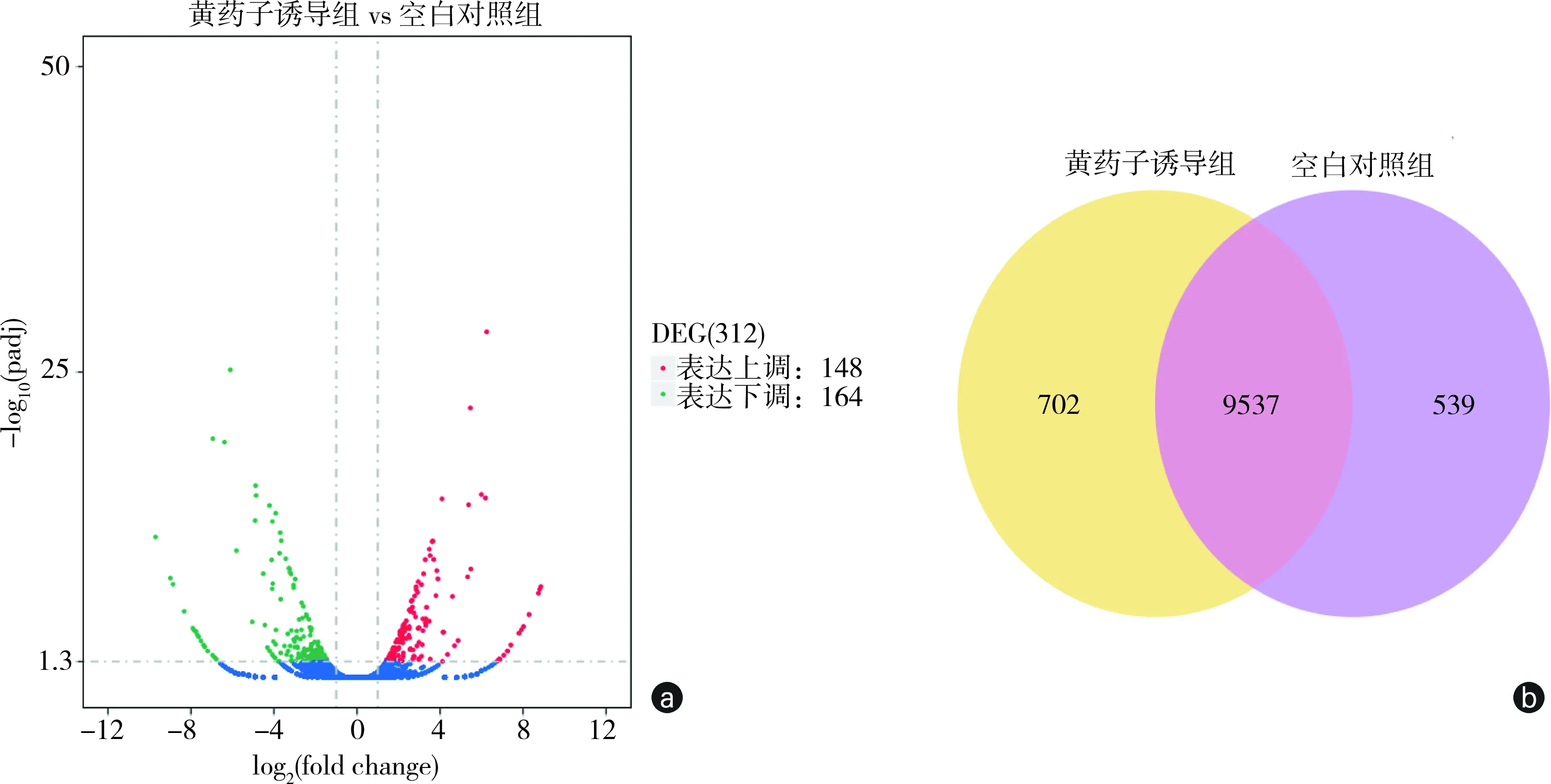
注:a为差异基因聚类火山图。红色区域表示基因上调表达,绿色区域表示基因下调表达,蓝色区域正常表达结果。b差异基因聚类Venn图

图5 正常对照组与黄药子诱导组小鼠的差异基因聚类分析

GO功能GOIDpadj基因数GO分支分子功能GO:00044970.00000017甲烷单加氧酶活性monooxygenaseactivityGO:00200370.00000016血红素结合过程hemebindingGO:00469060.00000016四吡咯结合过程tetrapyrrolebindingGO:00083950.00000710类固醇羟化酶活性steroidhydroxylaseactivityGO:00040270.0000088酒精性磺基转移酶活性alcoholsulfotransferaseactivityGO:00167050.00001016氧化还原酶活性oxidoreductaseactivityGO:00081460.0000238磺基转移酶活性sulfotransferaseactivityGO:00083910.0000238花生四烯酸单氧酶活性arachidonicacidmonooxygenaseactivityGO:00055060.00002313铁离子结合过程ironionbindingGO:00015170.0000237N-乙酰氨基葡糖活性N-acetylglucosamineactivityGO:00043940.0000237硫酸乙酰肝素-2-O-磺基转移酶活性heparansulfate-2-O-sulfotransferaseactivityGO:00162320.0000237HNK-1-磺基转移酶活性HNK-1sulfotransferaseactivityGO:00170950.0000237硫酸乙酰肝素-6-O-磺基转移酶活性heparansulfate6-O-sulfotransferaseactivityGO:00187210.0000237反式-9R,10R-二氢菲二醇磺基转移酶活性trans-9R,10R-dihydrodiolphenanthrenesulfotransferaseactivityGO:00187220.00002371-邻二氮菲磺基转移酶活性1-phenanthrolsulfotransferaseactivityGO:00187230.00002373-邻二氮菲磺基转移酶活性3-phenanthrolsulfotransferaseactivityGO:00187240.00002374-邻二氮菲磺基转移酶活性4-phenanthrolsulfotransferaseactivityGO:00187250.0000237反式-3,4-二氢菲二醇磺基转移酶活性trans-3,4-dihydrodiolphenanthrenesulfotransferaseactivityGO:00187260.00002379-邻二氮菲磺基转移酶活性9-phenanthrolsulfotransferaseactivityGO:00187270.00002372-邻二氮菲磺基转移酶活性2-phenanthrolsulfotransferaseactivityGO:00191110.0000237邻二氮菲磺基转移酶活性phenanthrolsulfotransferaseactivityGO:00349300.00002371-邻二氮菲磺基转移酶活性1-hydroxypyrenesulfotransferaseactivityGO:00506980.0000237蛋白多糖磺基转移酶活性proteoglycansulfotransferaseactivityGO:00519220.0000237胆固醇磺基转移酶活性cholesterolsulfotransferaseactivity
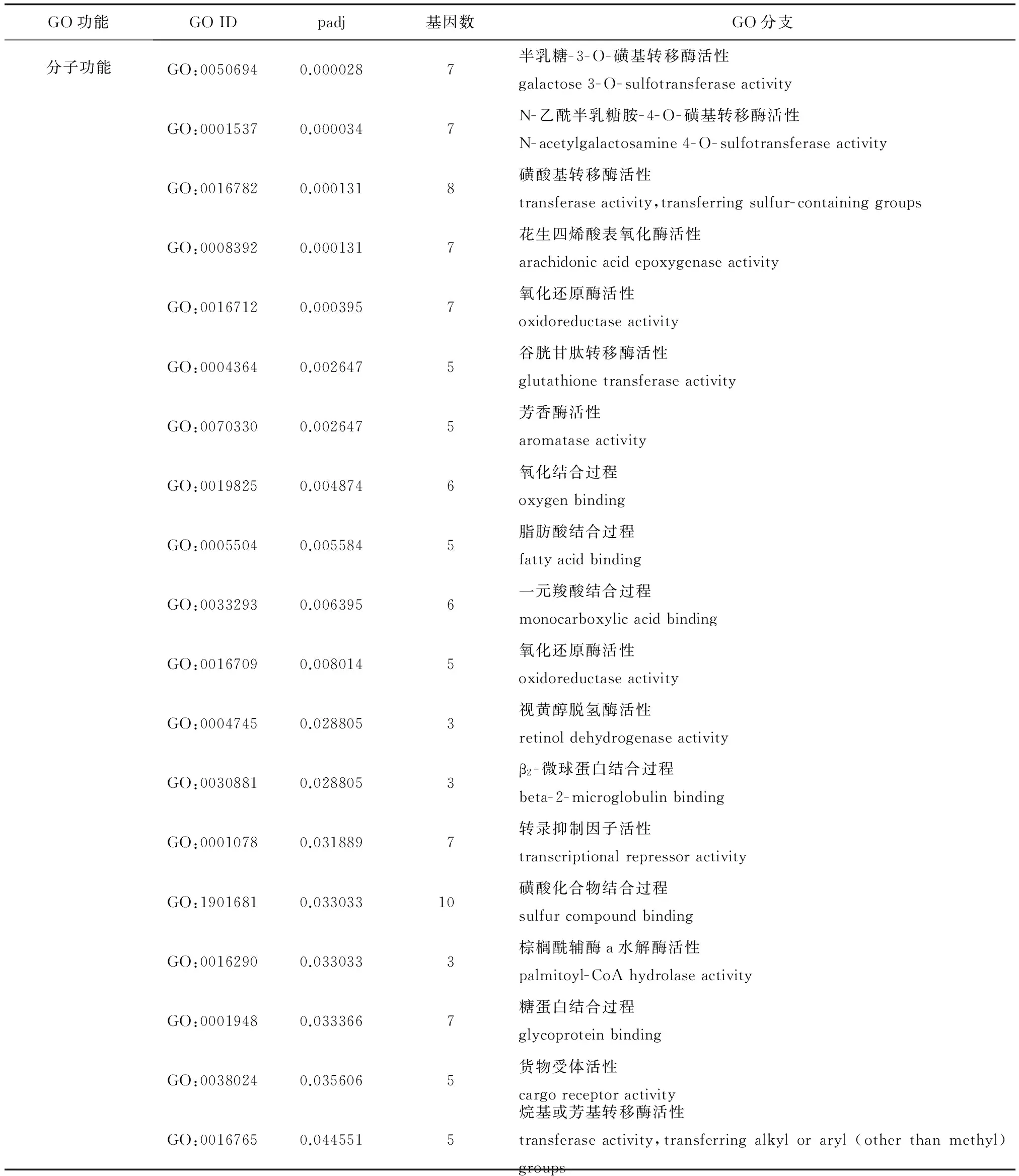
GO功能GOIDpadj基因数GO分支分子功能GO:00506940.0000287半乳糖-3-O-磺基转移酶活性galactose3-O-sulfotransferaseactivityGO:00015370.0000347N-乙酰半乳糖胺-4-O-磺基转移酶活性N-acetylgalactosamine4-O-sulfotransferaseactivityGO:00167820.0001318磺酸基转移酶活性transferaseactivity,transferringsulfur-containinggroupsGO:00083920.0001317花生四烯酸表氧化酶活性arachidonicacidepoxygenaseactivityGO:00167120.0003957氧化还原酶活性oxidoreductaseactivityGO:00043640.0026475谷胱甘肽转移酶活性glutathionetransferaseactivityGO:00703300.0026475芳香酶活性aromataseactivityGO:00198250.0048746氧化结合过程oxygenbindingGO:00055040.0055845脂肪酸结合过程fattyacidbindingGO:00332930.0063956一元羧酸结合过程monocarboxylicacidbindingGO:00167090.0080145氧化还原酶活性oxidoreductaseactivityGO:00047450.0288053视黄醇脱氢酶活性retinoldehydrogenaseactivityGO:00308810.0288053β2-微球蛋白结合过程beta-2-microglobulinbindingGO:00010780.0318897转录抑制因子活性transcriptionalrepressoractivityGO:19016810.03303310磺酸化合物结合过程sulfurcompoundbindingGO:00162900.0330333棕榈酰辅酶a水解酶活性palmitoyl-CoAhydrolaseactivityGO:00019480.0333667糖蛋白结合过程glycoproteinbindingGO:00380240.0356065货物受体活性cargoreceptoractivityGO:00167650.0445515烷基或芳基转移酶活性transferaseactivity,transferringalkyloraryl(otherthanmethyl)groups
注:geneID为注释到GO编号上的差异基因的ID;padj为矫正后的P-Value,一般情况下,Corrected_pValue<0.05该功能为显著富集项;基因数:差异基因中与该通路相关的基因数
(五)显著差异表达基因的KEGG通路分析
为确定这些差异表达基因所参与的生物代谢通路和信号转导途径,利用KEGG数据库进行富集。结果显示,这些差异表达基因所参与的生物学通路总数为140条,其中显著富集通路有8条。统计这8条显著富集的通路,以及参与这些通路的差异表达基因。其中,视黄醇代谢通路、花生四烯酸代谢通路、过氧化物酶体增殖物激活受体信号通路、不饱和脂肪酸的生物合成过程均涉及脂质代谢。此外,除了谷胱甘肽代谢通路和不饱和脂肪酸的生物合成通路外,均有细胞色素P450(cytochrome P450,CYP450)酶系的参与。因此可以确定黄药子致肝损伤与脂类、CYP450酶系、谷胱甘肽代谢息息相关。见表2。
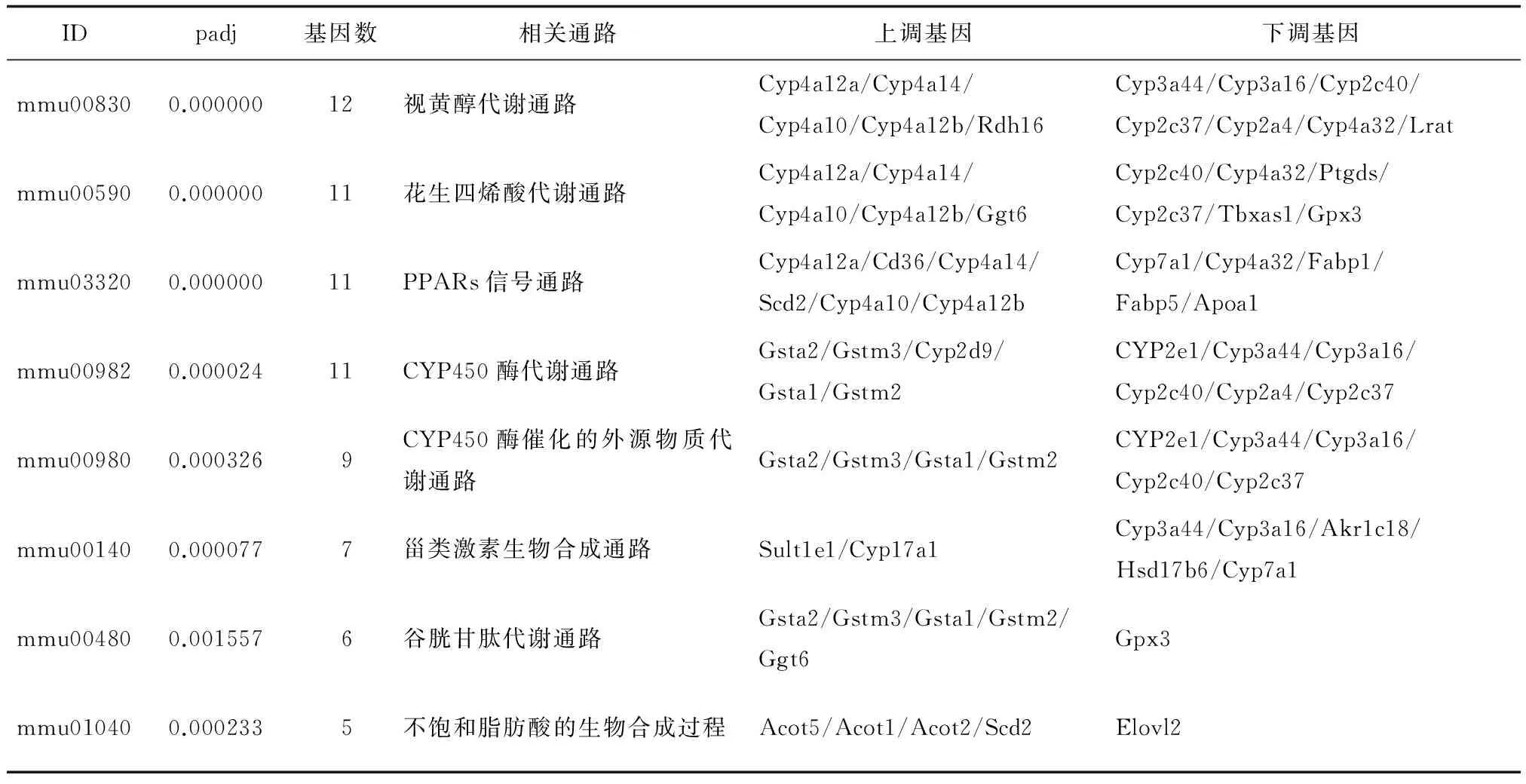
表2 正常对照组与黄药子诱导组小鼠差异表达基因最显著富集的KEGG通路统计表
讨 论
黄药子为临床常用中药,近年来,虽然其所致的肝损伤引起了广泛的关注,但相关的物质基础和毒性作用机制尚不明确。在本研究中,首先用不同剂量的黄药子水提取物诱导小鼠肝损伤,通过评估各组小鼠体重变化、肝脏指数、血清生化指标ALT和AST酶活性以及肝组织形态学变化,明确了可导致明显肝损伤的给药剂量。最后对DB诱导组和正常对照组小鼠的DGE文库进行比较分析,确定黄药子致肝损害涉及的代谢通路。
与对照组相比,只有高剂量组小鼠的体重增长值、肝脏指数差异具有统计学意义。该结果显示,以高剂量黄药子水提取物灌胃可能诱导了小鼠肝损伤,导致肝脏肿大。图3中与对照组相比,同样仅高剂量组小鼠的ALT和AST酶活性变化具有统计学意义,中剂量组仅有ALT酶活性变化差异有统计学意义。从组织形态学分析结果来看,黄药子所致肝损害的病理变化程度呈剂量依赖性,即给药剂量越高,肝组织病理变化越显著,其中高剂量组的病变程度最显著。经综合分析,在给定的实验期间,只有高剂量黄药子水提取物灌胃才会导致小鼠出现明显的肝损伤。
在后续研究中分别用从对照组(Normal组)和高剂量组(DB组)小鼠的肝脏中提取的总RNA建立了cDNA文库并测序对比。结果发现DB组和Normal组的高质量reads都大于108个,唯一匹配比对的reads的百分比>80%。经定量分析,相比Normal组DGE文库,DB组的DGE文库中有148个基因表达上调,164基因表达下调。经GO功能分析和KGEE通路分析,发现有8条显著富集的通路。根据两组差异表达基因的功能注释归类推测,黄药子可通过引起生物分子的代谢紊乱而导致肝损伤,其原因可能是黄药子或其代谢产物直接参与了肝脏的生物大分子的生物学过程,如氧化还原反应,或通过影响相应酶的活性而间接使各生物代谢过程受到影响;而两组显著差异表达基因富集的视黄醇代谢通路、花生四烯酸代谢通路、PPARs信号通路以及不饱和脂肪酸的生物合成过程均涉及脂质代谢,且除谷胱甘肽代谢通路和不饱和脂肪酸的生物合成通路外,均有CYP450酶系的参与,因此可以确定黄药子致肝损伤可能与脂质、CYP450酶以及谷胱甘肽的生物过程息息相关。
PPARs对脂肪酸的转运和氧化、胆固醇的分解代谢以及脂肪的转运具有调控作用,是维持脂类代谢稳态的重要调节因子[20]。PPARs与配体结合激活后,可与靶基因启动区域的过氧化物酶增值物反应元件结合,从而影响脂质的分解代谢过程,如调整过氧化物酶活性、线粒体脂肪酸的β氧化和脂肪酸的摄取等[21-22]。本研究与对照组的比较结果中,DB组有多个与PPARs信号通路相关的基因表达显著上调,如CYP450酶4a亚型(Cyp4a12a、Cyp4a14、Cyp4a10、Cyp4a12b)、Cd36和硬脂酰-辅酶A去饱和酶2(stearoyl-CoA desaturase2,Scd2)。CYP450酶4a亚型可促进ω不饱和脂肪酸的氧化;Cd36是B类清道夫受体家族的一种多功能糖蛋白,可促进血循环中的脂肪酸异常转运至肝细胞内,导致肝脏内脂质异常积聚[23];Scd2也在不饱和脂肪酸的生物合成过程中起着重要的调节作用,是饱和长链脂肪酸转化为多不饱和脂肪酸的速率限制酶[24]。本研究中,BD组Scd2表达显著上调,可能使得脂类代谢异常。因此黄药子水提取物可通过上调CYP450酶4a亚型、Cd36、Scd2基因表达,使小鼠的脂类代谢的稳态失衡,引起肝内脂肪蓄积,并增强肝脏的脂肪酸氧化反应,从而导致肝损伤。
CYP450酶系是最重要的药物代谢酶系统之一,在许多外源性生物(如临床常用药物、有毒化学物质、致癌物和环境污染物)和内源性化合物(如脂肪酸、胆汁酸和前列腺素)的生物转化起着关键性作用[25-26]。人体内90%以上的药物代谢是由CYP450酶介导的,CYP1a2、CYP2a6、CYP2e1和CYP3a44等CYP450酶亚型具有促进大多数临床药物生物转化的作用[27]。肝脏是机体最大的代谢器官,大多数药物进入体内后会在肝脏内被分解成小分子物质,在肝脏中也含有十分丰富的CYP450酶。与肝内CYP450酶有关的药物毒性形成机制主要有3种:(1)药物在肝内经 CYP450 酶代谢后,会产生一些亲电子基、自由基的代谢产物,这些代谢产物与细胞膜或其它细胞成分发生化学反应,引起脂质过氧化,最终导致肝细胞坏死;(2)药物的代谢产物可与DNA及各种蛋白质分子结合,诱导自身抗体生成,引起免疫病理损伤;(3)由于未代谢的药物蓄积导致代谢该药物的CYP450亚型活性降低,使药物无法被转变为无毒性的代谢产物,导致肝损伤。如表2所示,在经KEGG富集的CYP450酶代谢通路、CYP450酶催化的外源物质代谢通路中,DB组CYP450酶超级家族的Cyp2e1、Cyp3a44亚型基因表达显著上调,这与前期的研究结果相一致[28-29]。此外,CYP450酶的下游基因,谷胱甘肽转移酶(glutathione S-transferase,Gst)表达显著上调。这表明了黄药子水提取物可能会诱导CYP2e1和CYP3a44酶的活性,产生带有自由基的代谢产物,从而破坏机体氧化系统与抗氧化系统的平衡。因此,黄药子的肝毒性形成的作用机制可能为上述的机制(1)。
谷胱甘肽是最常见的抗氧剂和自由基清除剂,Gst和谷胱甘肽过氧化物酶(Glutathione peroxidase,Gpx)是与谷胱甘肽相关的抗氧酶。Gst可催化氧化应激反应过程中的亲电子化合物与谷胱甘肽结合,而Gpx具有将谷胱甘肽作为供电基团,清除自由基及其衍生物,减少脂质过氧化物的形成,增强机体抗氧化能力的作用。在表2的谷胱甘肽代谢通路中,Gpx基因表达显著下调,机体抗氧化应激能力减弱。由此证明,黄药子水提取物经代谢后可能会产生一些氧自由基,增加机体的氧化应激损伤,从而损害小鼠肝脏。
综述所述,黄药子在肝内经CYP450酶代谢后,产生带有自由基的代谢产物,使胞质膜和细胞器的脂质过氧化,同时减弱机体的抗氧化能力;黄药子还可通过影响肝内脂质代谢、增强肝脏脂肪酸氧化反应致肝损伤。通过本研究促进了对黄药子致肝损伤的分子作用机制的认识,在后续的研究中,我们将对相关基因进行一一验证。由于小鼠与人类同源共享一套保守基因序列,因此可通过黄药子诱导小鼠肝毒性的作用机制来解释黄药子引起临床肝损害不良反应的原因,并为寻找有效的临床解毒物质提供理论依据。
1Rêgo Tde S,Ash Lda S,Pessoa L,et al.The intake of yam (Dioscorea bulbifera Linn) attenuated the hyperglycemia and the bone fragility in female diabetic rats[J].Nutr Hosp,2014,29(2):370-375.
2Ghosh S,More P,Derle A,et al.Diosgenin from Dioscorea bulbifera:novel hit for treatment of type II diabetes mellitus with inhibitory activity against alpha-amylase and alpha-glucosidase[J].PLoS One,2014,9(9):e106039.
3Murray RDH,Jorge ZD,Khan NH,et al.Diosbulbin D and 8-epidiosbulbin E acetate,norclerodane diterpenoids from Dioscorea bulbifera tubers[J].Phytochemistry,1984,23(3):623-625.
4张利平,周慧萍.黄药子致死亡1例[J].医药导报,2009,28(8):1097.
5施海优,王志雄.黄药子致肝损害2例[J].浙江中西医结合杂志,2005,15(3):63-64.
6Wang JM,Sheng YC,Ji LL,et al.Ferulic acid prevents liver injury and increases the anti-tumor effect of diosbulbin B in vivo[J].J Zhejiang Univ Sci B,2014,15(6):540-547.
7Niu C,Sheng Y,Yang R,et al.Scutellarin protects against the liver injury induced by diosbulbin B in mice and its mechanism[J].J Ethnopharmacol,2015,164:301-308.
8赵艳,朴宏鹰,褚晓杰,等.黄药子与甘草配伍对大鼠肝脏CYP_3A_1、CYP_2E_1 mRNA表达的影响[J].中国中医药科技,2011,18(4):304-305.
9王秋红,杨欣,王蒙,等.黄芩与黄柏协同保护黄药子致肝毒性的实验研究[J].中国中药杂志,2016,41(5):898-903.
10王旭东,鞠少卿.新一代测序技术在肿瘤精准医学中的应用[J].中华临床实验室管理电子杂志,2015,3(3):139-145.
11孟宪欣,肖华胜.新一代测序技术在罕见病致病基因研究中的应用[J].生命科学,2015,27(7):960-967.
12王曦,汪小我,王立坤,等.新一代高通量RNA测序数据的处理与分析[J].生物化学与生物物理进展,2010,37(8):834-846.
13Ekblom R,Galindo J.Applications of next generation sequencing in molecular ecology of non-model organisms[J].Heredity(Edinb),2011,107(1):1-15.
14Deng X,Pan L,Miao J,et al.Digital gene expression analysis of reproductive toxicity of benzo[a]pyrene in male scallop chlamys farreri[J].Ecotoxicol Environ Saf,2014,110:190-196.
15Hewitt SC,Li L,Grimm SA,et al.Research resource:whole-genome estrogen receptor alpha binding in mouse uterine tissue revealed by ChIP-seq[J].Mol Endocrinol,2012,26(5):887-898.
16Chen XH,Ma L,Hu YX,et al.Transcriptome profiling and pathway analysis of hepatotoxicity induced by tris(2-ethylhexyl) trimellitate(TOTM) in mice[J].Environ Toxicol Pharmacol,2016,41:62-71.
17Wang J,Liang Q,Ji L,et al.Gender-related difference in liver injury induced by Dioscorea bulbifera L.rhizome in mice[J].Hum Exp Toxicol,2011,30(9):1333-1341.
18Wang JM,Ji LL,Branford-White CJ,et al.Antitumor activity of Dioscorea bulbifera L.rhizome in vivo[J].Fitoterapia,2012,83(2):388-394.
19Mortazavi A,Williams BA,Mccue K,et al.Mapping and quantifying mammalian transcriptomes by RNA-Seq[J].Nat Methods,2008,5(7):621-628.
20Kakuma T,Lee Y,Unger RH.Effects of leptin,troglitazone,and dietary fat on stearoyl CoA desaturase[J].Biochem Biophys Res Commun,2002,297(5):1259-1263.
21Ijpenberg A,Jeannin E,Wahli W,et al.Polarity and specific sequence requirements of peroxisome proliferator-activated receptor(PPAR)/retinoid X receptor heterodimer binding to DNA.A functional analysis of the malic enzyme gene PPAR response element[J].J Biol Chem,1997,272(32):20108-20117.
22Kersten S,Desvergne B,Wahli W.Roles of PPARs in health and disease[J].Nature,2000,405(6785):421-424.
23Kawano Y,Cohen DE.Mechanisms of hepatic triglyceride accumulation in non-alcoholic fatty liver disease[J].J Gastroenterol,2013,48(4):434-441.
24Pawlak M,Lefebvre P,Staels B.Molecular mechanism of PPARalpha action and its impact on lipid metabolism,inflammation and fibrosis in non-alcoholic fatty liver disease[J].J Hepatol,2015,62(3):720-733.
25Chen C,Wang DW.Cytochrome P450-CYP2 Family-Epoxygenase Role in Inflammation and Cancer[J].Adv Pharmacol,2015,74:193-221.
26Mcdonnell AM,Dang CH.Basic review of the cytochrome p450 system[J].J Adv Pract Oncol,2013,4(4):263-268.
27Samer CF,Lorenzini KI,Rollason V,et al.Applications of CYP450 testing in the clinical setting[J].Mol Diagn Ther,2013,17(3):165-184.
28华碧春,黄智锋,刘娇,等.黄药子与甘草配伍对大鼠肝脏CYP450基因表达的影响[J].福建中医药大学学报,2014,24(1):19-21.
29Lin D,Li C,Peng Y,et al.Cytochrome p450-mediated metabolic activation of diosbulbin B[J].Drug Metab Dispos,2014,42(10):1727-1736.
