量子点/硅质体编码纳米载体的制备
2018-04-12赵桂红孙清江
陈 伟 赵桂红 孙清江
(东南大学生物科学与医学工程学院, 南京 210096)(东南大学生物电子学国家重点实验室, 南京 210096)

本文通过实验室合成硅质体,混合以功能化修饰的脂质体,利用薄膜水化法将绿色油溶性量子点包埋在硅质体的疏水双层中,将红色水溶性量子点包埋在硅质体空腔内,通过预编码和后编码方式调节绿色、红色量子点的荧光强度,制备的量子点/硅质体纳米载体在模拟细胞环境中结构稳定,且荧光性质稳定.
1 材料与方法
1.1 实验试剂及仪器
实验中硅质体通过多步反应合成得到[10].二硬脂酰基磷脂酰胆碱(DPPC)和二硬脂酰基磷脂酰胆碱(DSPC)、磷脂聚乙二醇羧基(DSPE-PEG-COOH)分别购自Sigma Aldrich和Avanti公司.量子点根据文献[11-12]中方法制备,实验室合成水溶性配体(DHLA-PEG-400),对红色量子点进行改性.AR级氯仿购自南京化学试剂有限公司.实验室配置PB缓冲液(pH=7.4),所用的去离子水经过Pall Cascade AN超纯水系统处理,电阻率为18.2 MΩ.
实验中使用的主要仪器包括:F-7000型荧光分光光度计(日本Hitachi公司);JEM-2100型透射电子显微镜(日本JEOL公司);Ultra Plus型扫描电子显微镜(德国Zeiss公司);OSB-2100型旋转蒸发仪(美国EYELA公司);ZS90型粒度电位分析仪(美国Malvern公司);TSC-SP8型共聚焦显微镜(德国Leica公司);CT18RT型离心机(美国Techcomp公司);KQ-500DB型超声波振荡仪(中国昆山市超声仪器有限公司).
1.2 空白硅质体和量子点/硅质体的制备
采用薄膜水化法制备空白硅质体,取2 mg 硅质体单体在酸性乙醇中25 ℃恒温孵育,抽真空待用.采用适量的氯仿溶解于试管中,45 ℃减压旋转蒸发制成均匀薄膜.薄膜抽真空过夜干燥后加入2 mL PB缓冲液,50 ℃水化20 min,超声处理30 min 后,得到空白硅质体悬液.
采用薄膜水化法制备量子点/硅质体.步骤与空白硅质体的制备相似,取2 mg硅质体在酸性乙醇中25 ℃ 恒温孵育,抽真空待用.采用一定量的氯仿溶液溶解(同时可加入绿色油溶量子点),45 ℃ 减压旋转蒸发制成均匀薄膜.薄膜抽真空过夜干燥后加入2 mL PB缓冲液(同时可加入红色水溶量子点),50 ℃水化 20 min,超声处理30 min后, 在6×103和1×104r/min条件下差速离心10 min,利用PB缓冲液复溶,在1×104r/min条件下离心,沉淀得到尺寸均一的量子点/硅质体悬液.功能化磷脂掺杂的量子点/硅质体制备过程同上.本文研究了掺杂不同种类磷脂和不同摩尔比的硅质体、DPPC、DSPE对结构的影响.
1.3 预编码量子点/硅质体的制备
采用薄膜水化法制备预编码量子点/硅质体,步骤与量子点/硅质体的制备相似.通过在制备过程中优化绿色油溶量子点和红色水溶量子点的浓度,预先设计固定发射峰为505 nm的 CdSe/ZnS绿色量子点的浓度为4 mg/mL.然后,改变发射峰为612 nm的CdSe/CdZnS/ZnS红色水溶量子点的浓度,将其设定为1,2,4 mg/mL,制备出绿色和红色荧光强度比为2∶1,1∶1,1∶2的编码量子点/硅质体纳米载体.
1.4 后编码量子点/硅质体的制备
采用薄膜水化法制备后编码量子点/硅质体,步骤与量子点/硅质体的制备相似.首先,按照预编码量子点/硅质体的制备原理,制备出绿色、红色量子点荧光强度比为1∶2的量子点/硅质体,加入5 nmol/L 铜离子,观测35 min内绿色、红色荧光强度比变化,得到后处理的编码量子点/硅质体.
1.5 形态学表征
利用动态光散射仪测定各种硅质体的粒度和Zeta电位.将样品沉积在铜网上,采用2%的钨酸盐溶液进行负染,室温干燥后利用透射电镜对尺寸和量子点包埋情况进行观察.将样品滴涂在铜片上,自然干燥后利用扫描电镜观察粒子形貌,采用元素分析法测定硅质体Si的含量.
1.6 荧光性能表征
利用荧光分光光度计对量子点/硅质体进行荧光测量试验时,选用光电倍增管电压为400 V,狭缝宽度为5 nm,量子点选用的激发波长为380 nm.将样品滴在载玻片上附加盖玻片,倒置放入共聚焦显微镜,观察量子点/硅质体荧光及形貌.
1.7 稳定性实验
为了证明量子点/硅质体在生物医学领域应用的优越性,研究了pH值、生物交联剂以及模拟细胞环境中离子、生物大分子条件对量子点/硅质体荧光强度的影响.
2 实验结果
2.1 空白硅质体和量子点/硅质体的粒径和形态学表征
通过观察空白硅质体和量子点/硅质体在电镜下的形貌可以验证纳米囊泡结构的完整性和立体性.由图1(a)和(b)可知,均匀分布的空白硅质体纳米囊泡粒径为80~130 nm,水合直径为(126.3±5.3) nm.由图1(c)和(d)可知,包覆双色量子点的硅质体仍能保持良好的球形形貌,且量子点清晰可见,大小均一,粒径略有增加,在100~150 nm之间,水合直径为(143.7±6.4) nm.

(a) 空白硅质体TEM

(b) 空白硅质体SEM

(c) 量子点/硅质体TEM
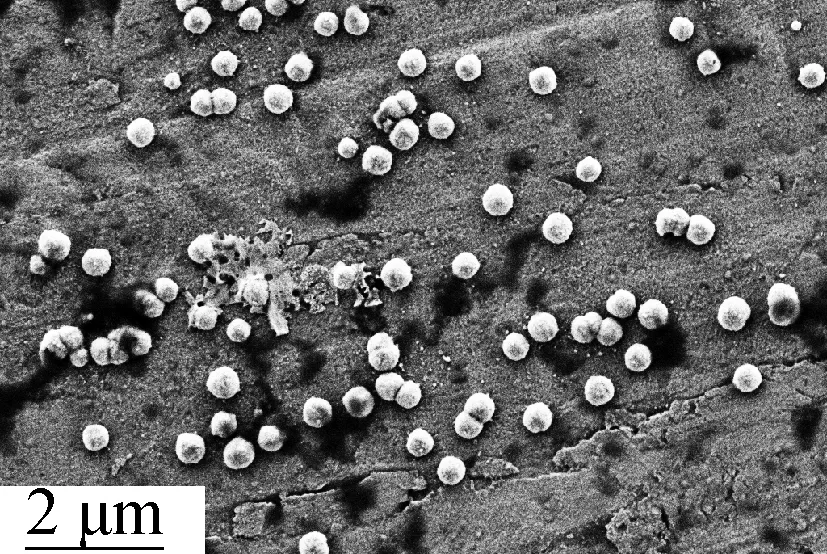
(d) 量子点/硅质体SEM
图1空白硅质体和量子点/硅质体的形态学表征
2.2 功能化磷脂掺杂对硅质体结构的影响
为了提高量子点/硅质体的生物相容性和表面功能化,首先掺杂了20%的DSPC,其电镜结果见图2(a).由图可知,部分纳米球形结构破裂,分析原因在于相变温度较低,成球过程中脂质体不能与硅质体融合均匀,造成塌陷破损.
然后,利用电镜下观察掺杂DPPC和DSPE含羧基官能团(掺杂百分数分别为42.5%和20%)的样本,结果见图2(b).由图可知,球形结构完整并能观察到双分子层结构,尺寸均一,粒径与空白硅质体相似,为80~130 nm.
提高含羧基官能团DSPE磷脂的掺杂百分数,可以提高该纳米载体的表面功能化效率(见表1).当硅质体与DPPC的摩尔比为1∶1时,分别掺杂25%和30%的DSPE,包覆双色量子点后的透射电镜结果见图2(c)和(d).掺杂30%DSPE的量子点/硅质体球型结构不稳定,存在挤压变形,掺杂25%DSPE的量子点/硅质体球型结构饱满,大小均一,粒径为100~150 nm.

(a) 掺杂20% DSPC

(b) 掺杂20% DSPE

(c) 掺杂25% DSPE

(d) 掺杂30% DSPE
图2掺杂功能化磷脂的量子点/硅质体的TEM照片
表1掺杂功能化磷脂的硅质体的Zeta值

ρ/%n纯水PBS201∶1∶1.5-42.7±0.7-8.9±0.4251∶1∶2.0-41.6±0.9-7.4±0.3301∶1∶2.5-39.5±0.7-5.9±0.5注:ρ为DSPE的掺杂百分数;n为硅质体、DPPC和DSPE的摩尔比.
2.3 预编码量子点纳米载体
利用掺杂25%DSPE磷脂的硅质体进行量子点编码.图3给出了预编码方式制得的3种荧光比例量子点/硅质体纳米载体的荧光光谱图.通过调节2种颜色量子点的浓度,可实现量子点/硅质体的绿色与红色荧光强度比分别为2∶1,1∶1,1∶2.通过荧光共聚焦显微镜观察,对应量子点/硅质体分别显示出绿色、黄色和红色荧光.
2.4 后编码量子点纳米载体
利用后编码方式实现对量子点/硅质体的荧光编码.由图4中的荧光光谱变化可知,在预编码方式制备的绿色与红色荧光强度比为1∶2的量子点/硅质体悬液中加入5 nmol/L Cu2+,10 min时荧光强度比变为1∶1,30 min时荧光强度比变为2∶1,且荧光强度趋于稳定.随着Cu2+浓度的提高,其淬灭效率也逐步增强.
2.5 稳定性实验
将预编码方式制备的绿色和红色荧光强度比为1∶1的量子点/硅质体作为稳定性实验样本.如图5(a)所示,在24 h内,pH=5~9的条件下,其荧光强度基本不变.在常用生物交联剂(如可溶于水的碳二亚胺(EDC)、N-羟基琥珀酰亚胺(NHS)、亲和素(AV)和链霉亲和素(SA)等)存在的条件下,量子点/硅质体仍能保持良好的荧光稳定性(见图5(b)).在模拟细胞环境中,各种离子强度和生物大分子对量子点的荧光影响见图5(c).由图可知,除了部分重金属离子(如Cu2+)的微弱影响外,荧光强度比基本稳定,说明包覆硅质体可以提高量子点对环境的抗干扰能力.

(a) 2∶1编码

(b) 1∶1编码

(c) 1∶2编码

图4 后编码量子点/硅质体的荧光性能
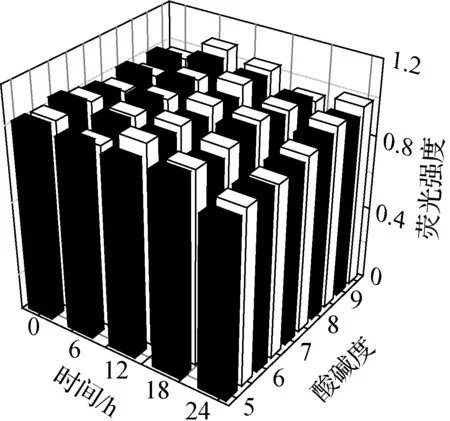
(a) pH稳定性

(b) 生物交联剂稳定性

(c) 模拟细胞环境的稳定性
3 结果分析
硅质体具有独特的双分子层结构特点,是一种由一层或多层类磷脂分子自组装而成的囊泡.在水溶液中,硅质体单体自然排列成一个密闭的球形,疏水端在膜内侧,亲水端在膜的两侧,可以实现对不同性质纳米材料的包覆.量子点比率荧光技术[13]是以2种荧光强度比作为输出信号的检测技术,具有内部矫正信号、提高检测限等优点.因此,将2种不同性质、不同颜色的量子点分别包覆在硅质体膜内与腔内,可构建出比率荧光检测平台.
多元检测是生物医学分析中的重要方法.实验中通过调节2种不同颜色量子点在硅质体内的荧光强度比,构建多种颜色编码,为多元检测提供编码纳米载体[14].利用传统的预编码方式,通过固定绿色油溶量子点的浓度,改变红色水溶量子点的浓度,制备出绿色和红色荧光强度比为2∶1,1∶1,1∶2的不同编码的量子点/硅质体纳米载体.
量子点表面配体的电荷或组成成分变化会影响核内电子-空穴的再复合,从而影响量子点的发光效率和荧光强度.基于能量转移和电荷转移等机制,某些重金属离子(如Cu2+)在靠近量子点时会导致量子点荧光淬灭[15].根据这一原理,本文提出了一种后编码的方式[16],通过在预编码方式制备的绿色与红色荧光强度比为1∶2的量子点/硅质体中调控加入Cu2+的浓度,降低红色量子点荧光强度,改变绿色与红色量子点荧光强度比,从而实现对量子点/硅质体的编码.
4 结论
1) 利用薄膜分散超声法制备掺杂25%DSPE的量子点/硅质体纳米荧光载体,粒径约100~150 nm.通过硅质体对量子点的包覆,使双色量子点在保持优异光学性能的同时也提高了抗环境干扰能力,有利于将量子点应用于生物医学分析领域.
2) 利用预编码和后编码方式灵活准确地对量子点/硅质体进行编码,为后续多元检测奠定基础.掺杂带有功能化基团的磷脂DSPE-PEG-COOH,可以在其表面进行纳米组装并构建多功能量子点荧光传感器,在细胞成像方面具有广阔的发展前景.
参考文献(References)
[1] Yue X, Dai Z. Recent advances in liposomalnanohybrid cerasomes as promising drug nanocarriers[J].AdvColloidInterfaceSci, 2014,207: 32-42. DOI:10.1016/j.cis.2013.11.014.
[2] Katagiri K, Ariga K, Kikuchi J I. Preparation of organic-inorganic hybrid vesicle “cerasome” derived from artificial lipid with alkoxysilyl head [J].ChemistryLetters, 1999,28(7): 661-662.
[3] Katagiri K, Hashizume M, Ariga K, et al. Preparation and characterization of a novel organic-inorganic nanohybrid "cerasome" formed with a liposomal membrane and silicate surface[J].Chemistry, 2007,13(18): 5272-5281. DOI:10.1002/chem.200700175.
[4] Liang X, Gao J, Jiang L, et al.Nanohybrid liposomal cerasomes with good physiological stability and rapid temperature responsiveness for high intensity focused ultrasound triggered local chemotherapy of cancer[J].ACSNano, 2015,9(2): 1280-1293. DOI:10.1021/nn507482w.
[5] Feng S, Ma F, Liu R, et al. Highly efficient removal of trace leveldieldrin from water resources utilizing a cerasomal strategy[J].JournalofMaterialsChemistryA, 2016,4(26): 10263-10273. DOI:10.1039/c6ta00969g.
[6] Ma Y, Dai Z, Gao Y, et al. Liposomal architecture boosts biocompatibility ofnanohybrid cerasomes[J].Nanotoxicology, 2011,5(4): 622-635. DOI:10.3109/17435390.2010.546950.
[7] Grecco H E, Lidke K A, Heintzmann R, et al. Ensemble and single particle photophysical properties (two-photon excitation, anisotropy, FRET, lifetime, spectral conversion) of commercial quantum dots in solution and in live cells[J].MicroscopyResearchandTechnique, 2004,65(4): 169-179. DOI:10.1002/jemt.20129.
[8] Uyeda H T, Medintz I L, Jaiswal J K, et al. Synthesis of compact multidentate ligands to prepare stable hydrophilic quantum dot fluorophores[J].JAmChemSoc, 2005,127(11): 3870-3878. DOI:10.1021/ja044031w.
[9] Chan W C, Nie S. Quantum dot bioconjugates for ultrasensitive nonisotopic detection[J].Science, 1998,281(5385): 2016-2018. DOI:10.1126/science.281.5385.2016.
[10] Zhou G, Li L, Xing J, et al. Redox responsive liposomalnanohybrid cerasomes for intracellular drug delivery[J].ColloidsSurfB:Biointerfaces, 2016,148: 518-525. DOI:10.1016/j.colsurfb.2016.09.033.
[11] Bae W K, Char K,Hur H, et al. Single-step synthesis of quantum dots with chemical composition gradients [J].ChemistryofMaterials, 2008,20(2): 531-539. DOI:10.1021/cm070754d.
[12] Xie R, Kolb U, Li J, et al. Synthesis and characterization of highly luminescent CdSe-core CdS/Zn0.5Cd0.5S/ZnS multishell nanocrystals[J].JAmChemSoc, 2005,127(20): 7480-7488. DOI:10.1021/ja042939g.
[13] Wu L,Guo Q S, Liu Y Q, et al. Fluorescence resonance energy transfer-based ratiometric fluorescent probe for detection of Zn2+using a dual-emission silica-coated quantum dots mixture[J].AnalChem, 2015,87(10): 5318-5323. DOI:10.1021/acs.analchem.5b00514.
[14] Gerion D, Pinaud F, Williams S C, et al. Synthesis and properties of biocompatible water-soluble silica-coated CdSe/ZnS semiconductor quantum dots [J].TheJournalofPhysicalChemistryB, 2001,105(37): 8861-8871.DOI:10.1021/jp0105488.
[15] Medintz I L, Clapp A R, Mattoussi H, et al. Self-assembled nanoscale biosensors based on quantum dot FRET donors[J].NatMater, 2003,2(9): 630-638. DOI:10.1038/nmat961.
[16] Wu C, Zheng J, Huang C, et al. Hybrid silica-nanocrystal-organic dye superstructures as post-encoding fluorescent probes[J].AngewChemIntEdEngl, 2007,46(28): 5393-5396. DOI:10.1002/anie.200700847.
