核苷类及5'位磷酸酯修饰药物的研究进展
2018-04-12葛晓斌张晓辉
葛晓斌, 张晓辉
(大连大学 环境与化学工程学院,辽宁 大连 116622)
1 背景介绍
在医疗健康领域中,癌症让每一个人都心惊胆战,国家癌症中心发布的《2017中国癌症报告》显示:癌症是影响中国发病率和死亡率的主要原因,中国是癌症大国,癌症病人占全球癌症病人总量的将近40%,近几年,我国癌症患者的发病率每年都在增加,2014年,世界新发病例约1409万。在2000年到2011年之间,全球约22%的新发癌症和27%的癌症死亡发生在中国[1]。更加有效的抗癌药物的研发刻不容缓。
在生命的发展过程中,核酸在生物大分子中起决定性的作用。除病毒外所有物种的遗传物质都是DNA,RNA的生物学功能在于转录和翻译遗传信息。当DNA碱基和核苷受到损坏就会产生癌症,癌症已成为人类生命的最大威胁[2]。由于核苷类似物独特的结构,并且可以参与、干扰细菌(病毒)的生物过程的作用,所以很有可能发展成为抗肿瘤、抗病毒的潜在药物[3]。
一种抗疱疹病毒药物—阿昔洛韦(Aciclovir)是由美国药理学家Gertrude Belle Elion合成的,也因此于1988年获诺贝尔生理学奖和医学奖。引起了众多化学家的广泛关注,得到了许多经修饰的核苷类似药物[4-6]。例如,司他夫定(D4T),齐多夫定(AZT),恩曲他滨(NRTIs)等[7]。因此,核苷类似物已逐渐成为潜在的药物[8-9]。
2 核苷类药物的研究进展
病毒的变异性以及繁殖能力让它很难被消灭,免疫学能够提供一些病毒的治疗方法,但是有些病毒很难找到适合的疫苗,从而限制了此类方法的发展。抗病毒化学疗法取得极大进展是在1962第一个核苷类药物碘苷( IDU) 获得成功之后,这种药物是用于治疗疱疹性角膜炎。到2002年,核苷类药物有了很大发展,用于临床治疗的此类药物达到19种之多[13]。如临床使用的抗HIV-1药物-恩曲他滨,由美国Emory大学研制,Gilead Science和Royalty Pharma公司于2003年7月联合在美国申请上市;Atripla是2006年7月12日经FDA快速审批通道批准上市的一种抗艾滋病的新复方制剂,患者只需每天服用一次,每次1片。在核苷类化合物进行5位取代产生新的核苷类药物作为抗病毒、抗肿瘤药物已被广泛应用于临床[10],如5-氟脱氧尿苷(FdU)、5-溴脱氧尿苷(BrdU)、5-碘脱氧尿苷(IdU),可用作为抗病毒、抗肿瘤药物的增敏剂[11,12]。如图1。
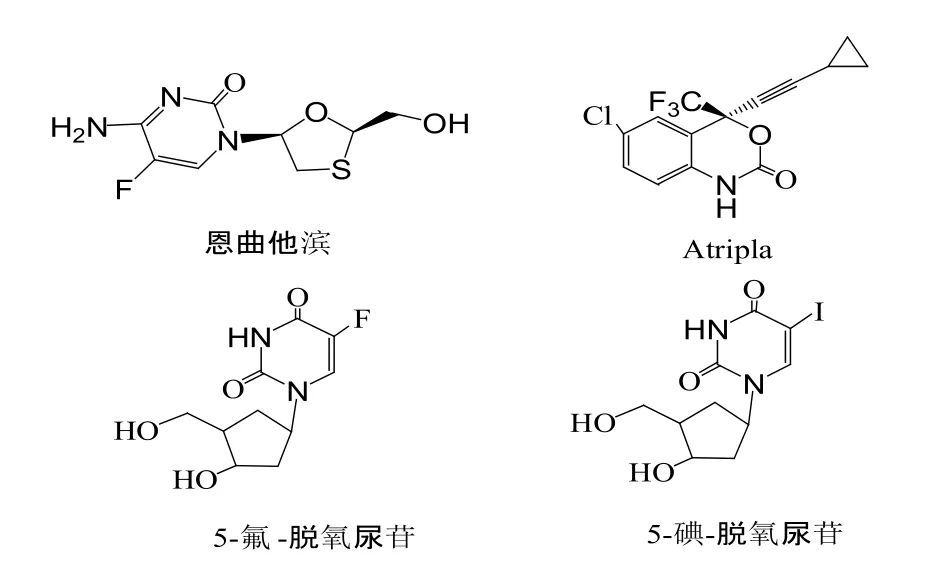
图1 几种核苷类药物
糖基和碱基是核苷类化合物的两大组成部分,近年来对糖基和碱基的改造修饰成为一大热点,主要原因是核苷类化合物与天然核苷在化学结构上基本相似,进入生物体内很难被察觉,以达到代替天然核苷的作用。
2.1 糖基的修饰
通过对糖基的修饰改造可以使得核苷类药物表现出更好的抗癌、抗病毒效果,同时糖基改造完成后的核苷类药物的毒副作用大大减少,对核苷类药物糖基的修饰改造是对抗病毒药物的有效衍生。
糖基改造可以在D-或L-型呋喃糖基上进行脱氧、取代、引入杂原子等,比如在2'、3'位上改造的D-或L-型核糖核苷:一是糖基的2'、3'位羟基被叠氮基、卤素、氨基、亚甲基、乙炔基、氰基、羟甲基取代,如图2所示:
二是2'、3'位二脱氧以及在此基础上形成2'、3'-双键的核苷。另外在呋喃糖基上引入杂原子也是糖基修饰的一种重要方法,糖基5'位氧原子改造成硫原子,但未表现出一定的生物活性。如图2所示。
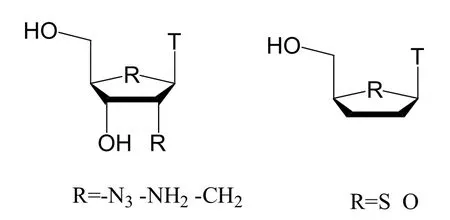
图2 核苷类化合物糖基的修饰
另外一类糖基的改造体现在将呋喃糖基变成吡喃糖、四元氧杂糖,如图3所示,以及碳环型、开环成为无环型,
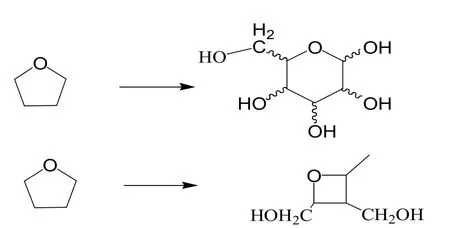
图3 核苷类化合物糖环改变
糖基的改造修饰为核苷类药物的衍生、发展开拓了新的途径,为抗癌、抗病毒药物的筛选提供了新的方法,其中不乏有一些生物活性很好的核药物,糖基的改造远远没有完成,需要进行更加深入的探索。
2.2 碱基的修饰
碱基在核苷的组成中处于决定性作用,碱基的修饰改造也直接影响着核苷类药物的抗癌、抗病毒活性。因此研发新的核苷抗药物的道路上,碱基的修饰很有意义。
碱基的主要修饰部位体现在嘧啶环或嘌呤环的碳原子被取代,这种情况主要在尿嘧啶环的5位,如抗HSV的IDU,BVDU等[14];还可以在胞嘧啶环的5位,及胸腺嘧啶环的6位;嘌呤环的2位和8位上进行。另外碱基羰基氧原子的杂原子取代也是一条重要的修饰改造途径,在咪唑核苷当中最重要的化合物是bredinin以及5位取代的衍生物,如图4所示。
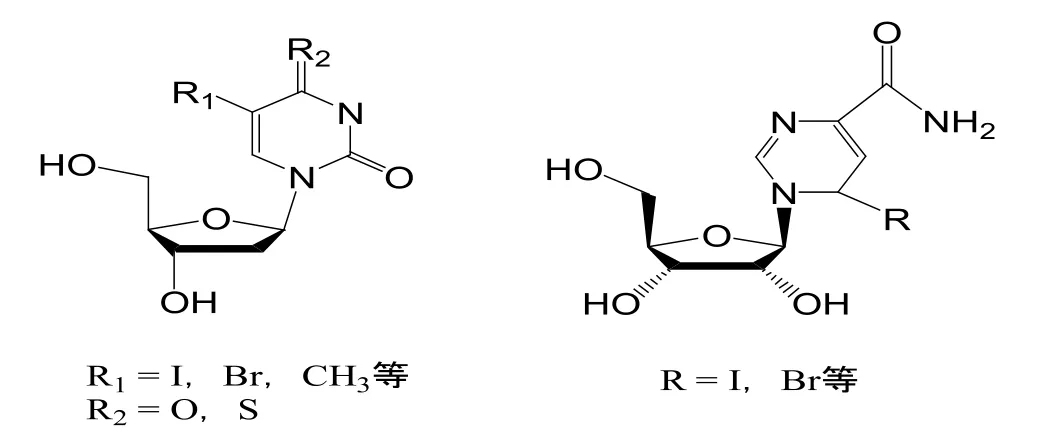
图4 核苷类化合物碱基的修饰
总之,核苷类药物的高效、低毒研究已成为现阶段抗病毒的主要途径。
3 核苷类药物磷酸酯化的研究概况
近年来,通过化学的方法对核苷化合物预先磷酸化大大拓宽了核苷结构修饰的范围,并为对付病毒耐药性提供了新途径。经研究发现,核苷类化合物及其类似物作为一种药物来治疗癌症、以及某些病毒疾病如艾滋病等,药物进入细胞发挥作用的往往是其5'磷酸化产物,如5-氟尿苷进入细胞中发挥活性的是其5'单磷酸化产物。以及目前的抗艾滋病病毒(HIV)药物如:叠氮胸苷,双脱氧肌苷和双脱氧胞苷等自身无法抑制HIV病毒的复制,发挥作用的同样是进入细胞后代谢成的5'磷酸酯[15],这些核苷类似物均可以称为我们所说的前体药物[16],从大量的探究可以发现,核苷类似物发挥其内部活性必须要经过细胞酶代谢为磷酸酯产物。并且我们知道DNA、RNA在人体内的作用机制,核苷类逆转录酶抑制剂是核苷或核苷酸结构衍生物,逆转录酶的存在使得HIV病毒无法复制,限制了HIV DNA的合成。另外,如果核苷类似物的糖基3'位缺乏羟基,在DNA复制时将不能再进行与5'-3'磷酸二酯键的结合,这样就阻止了病毒DNA链的延长,使其无法复制[17-19]。
3.1 减少给药时间
经研究发现,核苷类化合物作为药物到达病变部位的过程中要经过被细胞多种激酶的作用,进行三步磷酸化的阶段,最终转化成核苷类5'三磷酸酯,从而对肿瘤细胞DNA产生作用,破环其DNA,抑制癌细胞的复制,从而发挥其生物活性。在这个过程中单磷酸化即第一步磷酸化为整个过程的决速步骤[20],转化的时间也大大超过后两步,并且在有些细胞中核苷激酶的活性很低[21-25],核苷类药物的单磷酸酯化更只有少部分进行,直接影响了药效,因此,对核苷类化合物通过化学方法预先单磷酸化修饰,不用在细胞内进行药物的单磷酸化过程,可以极大提高药物到达病变部位的时间,提高活性,也是当前一个研究热点[26]。如抗HBV新药:替诺福韦酯(TDF)如图5,是一种单磷酸腺苷的无环磷酸化的核苷酸类似物,进入细胞中被细胞激酶磷酸化为二磷酯,与5'三磷酸脱氧腺苷竞争发挥作用。
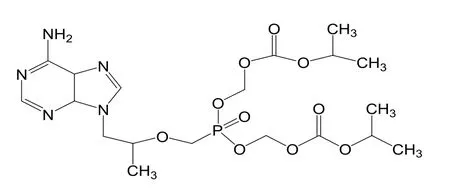
图5 替诺福韦酯
3.2 改善核苷酸药代动力学
核苷酸在体内的分解以及排泄很快,进行磷酸酯的修饰后可以改善核苷酸的药代动力学,并且在给药过程中,口服相对注射为更加对病人有利的给药方式。日本研制出的治疗白血病的药物磷酸酯化阿糖胞苷,如图6。该化合物在肝脏缓慢释放阿糖胞苷(Ara-C),口服300 mg/d,连续5 d给药,血中Ara-C浓度相当于以15~20 mg/d剂量连续注射Ara-C[27]。化合物1和2等的类似物的初步抗肿瘤活性研究也已经报道[28]。核苷类化合物的磷酸酯修饰对癌症的治疗进展有了很大的促进。
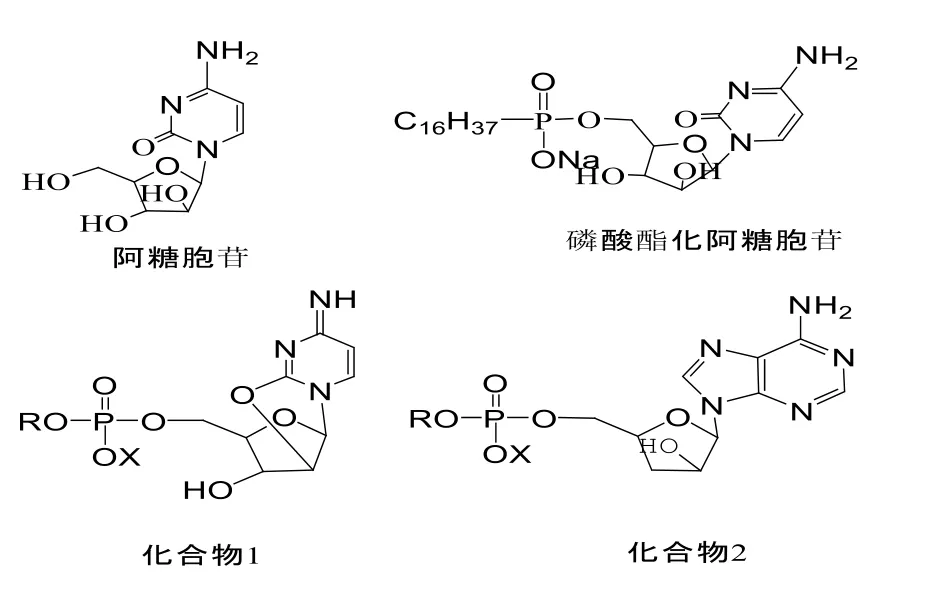
图6 磷酸酯化的核苷类药物
3.3 改善核苷酸药对细胞膜的穿透性
药物到达给药位置的过程,细胞膜的阻碍作用非常明显,核苷类化合物自身难以透过细胞膜,使得药物不能及时到达指定位置,通过化学方法的修饰把核苷类药物制成其5'磷酸酯可很大程度上改善细胞膜对药物的透过作用。患有P388白血病的鼠,腹腔注射化合物3(如图7)有效,但注射化合物3的母体效果不明显,这表明化合物3比母体对细胞膜有更好的穿透性[29]。
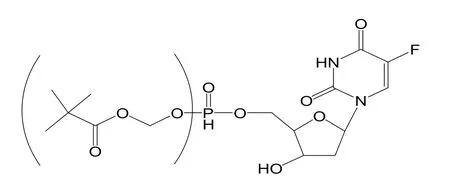
图7 化合物3
经磷酸酯修饰的核苷类化合物在没有进入细胞时分解慢,甚至不分解,这样使得药物在给药过程中极大的减少了其损失,更大程度的作用于病变部位,间接提高抗病毒、肿瘤活性。
选择对核苷类化合物进行磷酸酯化的一个很重要原因是人体核酸的组成部分含有大量的磷酸基团,是一种对人体无害的物质。同时核苷类化合物的磷酸化合成方法有很多种,原料易得,可以满足实验室和工业化的不同要求。
4 4-硫代核苷及其衍生物的研究进展
4.1 4-硫代核苷及其衍生物作为药物在癌症治疗上的应用
目前,癌症的主要治疗方法有外科治疗、放射治疗、化学治疗、分子靶向治疗和免疫治疗等[30]。一般来说,初期病人只接受手术治疗,而晚期病人需要多种治疗方法相结合。肿瘤具有复发转移的特点,特别是存在微转移的现象[31],使得治疗难度不断加大。同时癌症患者的预后仍然不达不到预期效果,病人还要遭受治疗的副作用和经济压力。因此,人们需要一些继续研发更高效的抗癌药物以及需要一些精确、高效、副作用小、经济性好的新疗法作为补充,协助癌症的传统治疗,以获得最大的治疗效益。
光动力学疗法是一种新兴的癌症治疗方法,其原理是,将光敏剂注入患者病变部位,然后用特定波段激光照射患病区域使光敏剂受到激发。光敏剂被激发之后把能量转移到周围的氧中,产生高活性的单态氧,其和周围的生物大分子发生反应,使其氧化,从而能对破坏细胞,产生毒性作用,进而导致细胞受损乃至死亡[32]。相对于传统的化疗、放疗治疗方式,由于其超高的选择性,不会对正常细胞造成伤害,在治疗的过程中,减轻了患者的痛苦。
当前研制出的光敏药物已发展到第三代,即第一代的血卟啉衍生物,第二代的5-氨基酮戊酸,第三代的天门冬酰基二氢卟酚和酞青类。有些尚处在动物研究阶段[33,34]。但现有的光敏药物存在很多缺点,例如会产生光毒反应、影响生理代谢等[35]。因此寻找新的光敏药物变得尤为重要。
研制光敏药物非常有效的方式之一是在核苷类化合物中对碱基进行修饰[36]。自从Lipsett[37]从大肠杆菌分离出4-硫尿嘧啶核苷酸之后,含硫碱基和硫代核苷吸引人们的关注。与正常DNA相比,在亲脂性方面,硫代嘧啶碱基正常的嘧啶核苷具有一定的提高,且嘧啶环上含有巯基,常常具有强的抗癌活性[38-39]。例如可治疗儿童白血病的6-硫唑嘌呤和可治疗炎性病症的6-硫鸟嘌呤[37,40]。但是这些药物具有明显的副作用,常常会提高皮肤病的患病率[41-45]。通过研究还发现,6-硫鸟嘌呤会起到延迟细胞中毒的作用[46-47]。但其副作用极强,会把癌细胞和正常细胞一并杀死,使患者及其痛苦。
我们课题组联合英国的徐耀忠教授课题组,合成了一系列新型4-硫核苷类药物,如下图所示
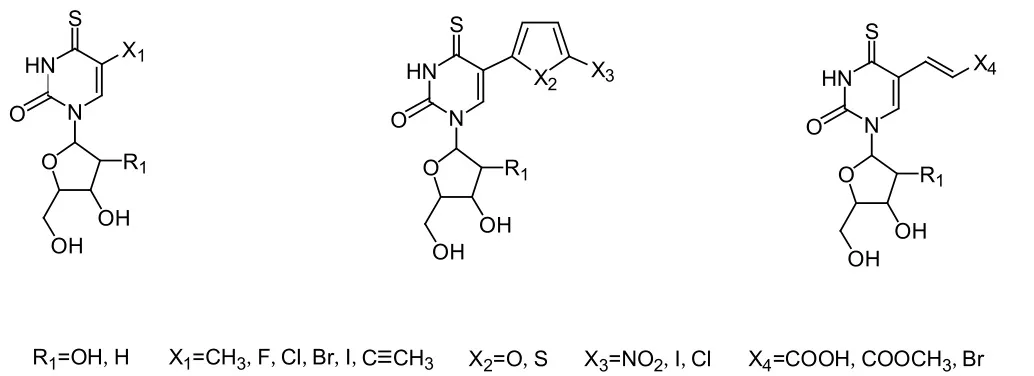
图8 新型4-硫核苷类似物
4.2 近紫外光辅助硫胸苷(UVA/4-thiothymidine)优点
新兴起的近紫外光辅助辅助硫代胸苷疗法具有传统抗癌疗法不具备的其他优点:
(1)毒性低:4-硫胸苷是对近紫外光较为敏感的化学物质,而其不曝露近紫外光时,对细胞是无毒害作用的,在原位动物模型实验中,通过膀胱给药或静脉注射给药,4-硫胸苷没有明显进入皮肤和眼睛组织的DNA,然而这两个组织最容易受到光敏感作用[48-49]。这说明此法较安全,而化疗中使用的其它抗癌药物几乎都具有很高的细胞毒性。
(2)能量低:与放疗中所需要用的X-射线(约1 nm)和γ-射线(0.01 nm)相比,近紫外光(310~360 nm)的波长更长,因此在应用时与X-射线和γ-射线相比,近紫外光(UVA)的能量是远远低于它们的。与细胞中大部分物质的吸收波长相比,近紫外光的波长是远远大于它们的,例如DNA碱基是在260~270 nm有吸收峰,氨基酸残基是在低于220 nm波长处有吸收峰;此外,近紫外光的能量远远低于这些生物成份所需要的激发能量,故低能量的近紫外光是对人体细胞无毒害作用的。
(3)高选择性:由于癌细胞较正常细胞的TK含量多,4-硫胸苷能够代替正常胸苷整合到DNA中,在UVA的照射下,药物能够损伤DNA,从而诱导细胞的死亡。正是由于胸苷激酶在正常细胞与癌细胞中作用强度不同,造成了4-硫胸苷在肿瘤细胞中的取代程度是正常细胞的3~10倍,故该药对正常细胞是几乎没有影响的。此外,在对正常细胞无毒害作用的低剂量,即4-硫胸苷(10 um/L)和近紫外光(5 kJ/m2),对癌细胞生长有了显著的抑制作用[48,49],实验结果表明4-硫胸苷协同近紫外光可治疗皮肤癌和(老鼠)膀胱癌。
近UVA/S4TdR疗法作为新兴的癌症治疗方法,它具有靶向杀死癌细胞的优点,4-硫核苷药物就是靶向抗癌药物。
4.3 4-硫核苷类化合物的磷酸酯化
以4-硫胸苷为基础,进行新的结构修饰和取代,使硫代化合物的吸收波长向可见光区发展,在临床上配合光导纤维的发展,意味着今后也可应用在深源性的肿瘤治疗上。而核苷类化合物糖环上磷酸酯化有很好的前景,磷酸酯化后的抗肿瘤,抗病毒前药最重要的作用就是提高药物的靶向作用,使得药物顺利进入病变部位,减少了对正常细胞、组织的毒害。除此之外,磷酸酯前药还可以使药物更加易溶,优化药物的治疗给药途径,对药物稳定性也可以产生一定的作用[50]。并且4-硫胸苷衍生出的新的硫代核苷酸,作为一种近紫外光敏剂,其自身不会对细胞产生任何毒性,能够靶向性的选择癌细胞,以核苷酸的形式嵌入到细胞DNA链中,却能在近紫外(UVA)光的辅助下,表现对癌细胞的高致死作用,这可能成为一类在近紫外光辅助下的一种潜在的介于细胞毒类药物和分子靶向类药物的新型抗癌药物靶向抗肿瘤药物的应用前景非常广泛,对新的抗肿瘤药物的研究也有重要意义。
5 展望
核苷类化合物的修饰如4-硫胸苷、4-硫-5-溴-脱氧尿苷、4-硫-5-碘-脱氧尿苷、4-硫-5-(2-噻吩)尿苷等,这些硫代核苷类似物与UVA相辅助,在治疗癌症方面已经取得了一些成果,能特异性的杀死癌细胞,而核苷化合物的磷酸酯化修饰又能突破细胞膜的阻碍更加快速的到达预定给药位置,因此可以预见4-硫代核苷类化合物的磷酸酯化修饰能更好的体现核苷类药物的活性,是一个非常有前景的研究方向。
