慢性心力衰竭与维生素D缺乏、甲状旁腺激素水平的相关性
2018-04-12郁娃林王彦涵徐南娇
郁娃林, 白 剑, 王彦涵, 徐南娇, 王 涟
(南京医科大学鼓楼临床医学院 心血管内科, 江苏 南京, 210029)
在心血管疾病中,心功能不全已经成为了一个重大的健康问题,是导致死亡的主要原因之一[1]。维生素D是一种人体所必需的微量元素,经人体吸收后通过肝脏作用转化为25羟基维生素D[25(OH)D], 并在肾脏中转化为1, 25-二羟维生素D[1, 25-(OH)D],在体内与特异的维生素D受体结合,通过自分泌和旁分泌作用调节细胞功能、参与多种器官的生长分化[2-3]。研究[4]表明,维生素D缺乏与心衰、高血压、心肌梗死等心脏相关疾病发病率增加有关。甲状旁腺激素(PTH)是一种多肽类激素,参与机体钙磷代谢。血液中维生素D的主要成分为25(OH)D, 细胞内1, 25-(OH)D水平取决于血液中 25(OH)D浓度,所以通过测定25(OH)D浓度可以评估维生素D水平。本研究探讨维生素D、甲状旁腺激素与心力衰竭严重程度的相关性,现报告如下。
1 资料与方法
1.1 一般资料
选取南京市鼓楼医院2017年 9月—2018年1月心内科收治的心力衰竭患者97例。以25(OH)D水平进行分组,血清中25(OH)D≥30 μg/L为正常组,20~<30 μg/L为不足组, <20 μg/L为缺乏组。根据纽约心功能分级(NYHA)的判定标准将患者分为NYHA 1~2级、3级、4级。
入选标准: 符合2014中国心力衰竭诊断和治疗指南心衰诊断标准,射血分数(EF)<40%的射血分数下降的心衰(HFrEF)患者。排除标准: ① 最近3个月内有补充钙或者维生素D; ② 既往有原发性甲旁亢、结核、结节病、恶性肿瘤或高钙血症; ③ 贫血、肺功能不全或甲状腺功能亢进导致的心力衰竭; ④ 严重肾功能不全[肾小球滤过率(eGFR)<30 mL/min]。
1.2 研究方法
所有观察者为住院患者,入院后次日清晨抽取空腹静脉血,离心收集血清后,用电化学发光法检验25(OH)D3水平、化学发光法测甲状旁腺激素(PTH)水平。入院后收集患者基本信息,包括静息心率、糖尿病、高血压、吸烟史、用药情况(ACEIARB,β受体阻滞剂、利尿剂、醛固酮受体拮抗剂药物)、血清25(OH)D3、血钙、PTH、脑钠肽(BNP)、eGFR、低密度脂蛋白、心脏超声指标[左心室射血分数(LVEF)、左室舒张末直径(LVEDd)]等。
1.3 统计学处理
采用SPSS 22.0统计软件进行数据分析处理,计量资料以均数±标准差表示,计数资料以百分比表示,比较采用t检验, Spearman相关性分析评价心功能与维生素D、甲状旁腺激素水平以及两者比值的相关性。P<0.05为差异有统计学意义。
2 结 果
2.1 一般情况比较
3组在性别比例、年龄、心衰原因、BNP、EF值、LVEDd、NYHA分级,静息心率、高血压、糖尿病、吸烟、肌酐、肾小球滤过率、低密度脂蛋白、甘油三酯,及使用ACEI/ARB、β受体阻滞剂、醛固酮受体拮抗剂等药物治疗方面无显著差异(P>0.05), 在血钙、25(OH)D3/PTH、BNP、利尿剂方面有显著差异(P<0.05)。见表1。

表1 不同维生素D水平患者基线资料比较
2.2 相关性分析
以Spearman相关性分析评价心功能与维生素D、甲状旁腺激素水平以及二者比值的相关性,可以得到NYHA分级与维生素D存在负相关(r=-0.210,P=0.039); NYHA分级与PTH存在正相关(r=0.356,P=0.000); NYHA分级与VD/PTH存在负相关(r=-0.388,P=0.000)。
2.3 不同心功能患者VD、PTH、VD/PTH单因素比较分析
由于心功能NYHA 1级人数较少,下面的检验中将NYHA 1级与2级进行合并进行检验。根据NYHA分级将患者分为3组,比较3组维生素D、PTH、VD/PTH水平是否存在差异。结果表明,心功能越差, PTH水平越高, VD/PTH比值越低,差异有统计学意义(P<0.05),维生素D水平也随着心功能减低而下降,但差异无统计学意义(P>0.05)。见表2。
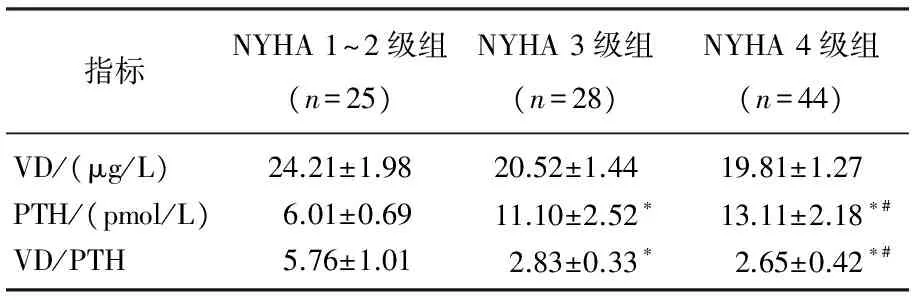
表2 不同心功能患者VD、PTH、VD/PTH比较
与NYHA 1~2级组比较, *P<0.05;
与NYHA 3级组比较, #P<0.05。
3 讨 论
心力衰竭(HF)是心脏结构性或功能性异常继发的复杂综合征,至2018年,中国约有400万患者受到慢性心力衰竭的影响,尽管近年来心衰的治疗方案取得了实质性的进展,但预后没有实质性变化, 5年存活率仍低。HF的发病机制涉及多种机制,包括血流动力学异常、神经激素激活、炎症反应增强等[5]。
维生素D是一种固醇类激素,主要是以维生素D2和维生素D3的形式存在,日常维生素D的摄取来源于日光诱导的皮肤产生以及饮食摄入。 维生素D被人体吸收后,首先是在肝脏中形成25-羟基维生素D3, 然后进入肾脏中进一步转化为1, 25羟维生素D。其活性形式1, 25-(OH)D 通过与特异的维生素 D 受体结合作用于靶组织发挥生物学效应[6]。维生素 D受体在包括骨骼、肾、肠道、心肌细胞、血管平滑肌、免疫细胞等超过36种不同组织上有表达,作用于不同器官组织。除了调节钙磷代谢以外,维生素D是肾素-血管紧张素-醛固酮系统(RAAS)的负性调节剂,低维生素D水平可以促进RAAS活性增加[3, 7]。有动物实验[8]表示, VDR基因敲除小鼠表现出RAAS活性增加,可以导致血压增高,心脏肥大,水钠潴留,进而影响心功能。此外,维生素D可以作用于心肌细胞中的钙通道,能激活钙离子 ATP 酶活性,诱导钙迅速流入,增强心肌细胞收缩力。维生素D也可以直接作用于心肌细胞,调节它们的增殖、生长和分化。此外,维生素D参与了动脉粥样硬化斑块的形成,低维生素D水平促进血管钙沉积,进而引起血管钙化[9]。
甲状旁腺激素(PTH)是甲状旁腺合成分泌的肽类激素,与维生素D共同参与调节钙磷代谢。在骨中,甲状旁腺激素作用于破骨细胞,促进钙磷向血液转运; 在肾脏中, PTH起到促进钙吸收,减少磷酸盐重吸收和激活维生素D代谢的作用; 在肠道中,甲状旁腺激素促进1, 25-二羟基维生素D的产生,进而增强钙和磷重吸收[4, 10]。如果甲状旁腺激素分泌过量或不足,进而会导致钙稳态的改变,影响心肌细胞钙内流,也会减少血管平滑肌细胞中的钙内流,进一步引起心血管疾病[11]。体外研究发现,甲状旁腺激素也可以直接作用于心肌细胞,影响心肌顺应性及收缩力,并可以产生直接的促心肌肥厚效应。甲状旁腺激素通过选择性激活腺苷酸环化酶以增加心肌内向电流,或者通过刺激cAMP的产生增加Ca2+流入心肌细胞,增加心率、改变心肌细胞顺应性; 也可激活蛋白激酶C途径,从而对心肌细胞产生直接的肥大效应[12]过量的甲状腺激素通过促进炎症反应,激活RAAS系统,调节激酶及细胞凋亡途径,促进心肌纤维化、心肌肥大、心肌重构,影响脂质代谢等引起不良后果[13]。
研究证实维生素D缺乏、PTH增高的患者心衰发病率和死亡率均显著增加。2014年在J Am Heart Assoc杂志发表的一项观察性研究,随访了大数据的无心血管疾病的社区住户,得出的结论是心衰发病风险与高PTH水平相关,但与维生素D没有明显相关性[14]。2015年PLOS ONE杂志发表一项前瞻性研究,入选了170个HFrEF患者,随访3.3年得出了维生素D与PTH比值是预测心衰死亡率的独立指标的结论[15]。2016年JACC杂志上发表了一项随机、双盲、安慰剂对照的临床研究,入选维生素D缺乏的HFrEF患者共229例,在优化抗心衰治疗的基础上每日口服补充维生素,1年后左室射血分数(LVEF)增高8%, 较安慰剂组显著提高,同时左室直径/容积显著减小[16]。但国内的维生素D、PTH与心衰的相关研究较少,且大部分未剔除射血分数保留的心衰患者,而根据2016年ESC心衰指南中的最新标准[17], 目前根据射血分数将心衰患者分为射血分数降低的心衰、射血分数中等范围的心衰与射血分数保留的心衰,三类心衰患者的病理生理机制、改善预后的药物等情况存在差异,故本研究选取了EF<40%的患者进行研究。
本研究探讨中国住院的射血分数降低心衰患者是否存在维生素D缺乏,以及心功能严重程度是否与维生素D及PTH水平相关。研究表明,在射血分数减低的心衰患者中,绝大部分患者存在维生素D缺乏; 对不同程度的维生素D水平患者进行分组分析后,发现其心功能严重程度无显著差异。但是通过相关性分析可以得到,患者心功能越差,维生素D水平越低,甲状旁腺激素水平越高,这两者的比值越低; 且比起单独的维生素D水平变化, 25(OH)D3与PTH比值在不同心功能水平的变化更为明显,说明这二者的比值更能表明心衰的严重程度。
综上所述,维生素D以及PTH都参与了心力衰竭的病理生理过程,并且与心功能的严重程度相关,但本研究为单中心研究,样本数量较小,尚需扩大样本量,进一步进行大型多中心研究,并在后续研究中完善长期随访调查情况。
[1] Ponikowski P, Voors A A, Anker S D, et al. 2016 ESC Guidelines for the Diagnosis and Treatment of Acute and Chronic Heart Failure[J]. Rev Esp Cardiol (Engl Ed), 2016, 69: 1167-1175.
[2] Jhund P S, Macintyre K, Simpson C R, et al. Long-term trends in first hospitalization for heart failure and subsequent survival between 1986 and 2003: a population study of 5.1 million people[J]. Circulation, 2009, 119(4): 515-523.
[3] D′Amore C, Marsico F, Parente A, et al. Vitamin D deficiency and clinical outcome in patients with chronic heart failure: A review[J]. Nutr Metab Cardiovasc Dis, 2017, 27(10): 837-849.
[4] Gruson D, Buglioni A, Burnett JC Jr. PTH: Potential role in management of heart failure[J]. Clin Chim Acta, 2014, 433: 290-296.
[5] Rauchhaus M, Doehner W, Francis D P, et al. Plasma cytokine parameters and mortality in patients with chronic heart failure[J]. Circulation, 2000, 102(25): 3060-3067.
[6] Tomaschitz A, Pilz S, Ritz E, et al. Independent association between 1, 25-dihydroxyvitamin D, 25-hydroxyvitamin D and the renin-angiotensin system: The Ludwigshafen Risk and Cardiovascular Health (LURIC) study[J]. Clin Chim Acta, 2010, 411(17/18): 1354-1360.
[7] Wang T J, Pencina M J, Booth S L, et al. Vitamin D deficiency and risk of cardiovascular disease[J]. Circulation, 2008, 117(4): 503-511.
[8] Li Y C, Qiao G, Uskokovic M, et al. Vitamin D: a negative endocrine regulator of the renin-angiotensin system and blood pressure[J]. J Steroid Biochem Mol Biol, 2004, 89/90(1/2/3/4/5): 387-392.
[9] Demer L L, Tintut Y. Vascular calcification: pathobiology of a multifaceted disease[J]. Circulation, 2008, 117(22): 2938-2948.
[10]Marx S J. Hyperparathyroid and hypoparathyroid disorders[J]. N Engl J Med, 2000, 343(25): 1863-1875.
[11]Brown S J, Ruppe M D, Tabatabai L S. The Parathyroid Gland and Heart Disease[J]. Methodist Debakey Cardiovasc J, 2017, 13(2): 49-54.
[12]Schierbeck L L, Jensen T S, Bang U, et al. Parathyroid hormone and vitamin D-markers for cardiovascular and all cause mortality in heart failure[J]. Eur J Heart Fail, 2011, 13(6): 626-632.
[13]Melamed M L, Eustace J A, Plantinga L C, et al. Third-generation parathyroid hormone assays and all-cause mortality in incident dialysis patients: the CHOICE study[J]. Nephrology Dialysis Transplantation, 2008, 23(5): 1650-1658.
[14]Bansal N, Zelnick L, Robinson-Cohen C, et al. Serum parathyroid hormone and 25-hydroxyvitamin D concentrations and risk of incident heart failure: the Multi-Ethnic Study of Atherosclerosis[J]. J Am Heart Assoc, 2014, 3(6): e001278-e001287.
[15]Gruson D, Ferracin B, Ahn S A, et al. 1, 25-Dihydroxyvitamin D to PTH(1-84) Ratios Strongly Predict Cardiovascular Death in Heart Failure[J]. PLoS ONE, 2015, 10(8): e0135427-e0135436.
[16]Zittermann A, Ernst J B, Prokop S, et al. Effect of vitamin D on all-cause mortality in heart failure (EVITA): a 3-year randomized clinical trial with 4 000 IU vitamin D daily[J]. Eur Heart J, 2017, 38(29): 2279-2286.
[17]Ponikowski P, Voors A A, Anker S D, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC[J]. Eur J Heart Fail, 2016, 18(8): 891-975.
