棉花硫氧还蛋白基因GhWCRKC2-5参与开花调控的功能研究
2018-04-12李云飞桑娜刘慧于秀立张亭亭黄先忠
李云飞,桑娜,刘慧,于秀立,张亭亭,黄先忠
(石河子大学生命科学学院/特色植物基因组学实验室,新疆 石河子832003)
开花不仅是植物的生理现象,也是作物的重要性状,不仅影响着农作物的生长发育和生物量,而且对农作物的产量和品质也影响很大。正确的开花时机具有适应性,早花对缩短植物的生命周期具有重要的生理意义。编码磷脂酰乙醇胺结合蛋白(phosphatidylethanolamine-binding protein,PEBP) 的Flowering Locus T(FT)位于开花调控网络的中心,不仅参与植物的开花转变的调控,而且还参与更多的植物生长发育调控[1-4]。FT 基因在植物叶片中表达,其翻译成蛋白(成花激素)后会经韧皮部进行长距离运输到植物的顶端分生组织,之后与Flowering Locus D (FD)蛋白形成复合物,促进植物下游开花通路中关键基因如APETALAL(AP1),LEAFY(LFY),SUPPERSSOR OF OVEREXPRESSION OF CONSTANS1(SOC1)和FRUITFULL(FUL)等的表达,进而促使植物早花[5-8]。相关研究发现,拟南芥FT同源基因AtFT可以使拟南芥的花期提前,而缺失FT基因的拟南芥突变体ft-10则会使拟南芥的花期延迟[9-10]。我们前期从陆地棉品种新陆早33 中克隆到了一个FT同源基因GhFT1基因,在野生型拟南芥中及ft-10突变体中过量表达GhFT1,转基因植株要比野生型明显提早开花,并且可以挽救ft-10极度晚开花表型;转基因拟南芥植株中AtFT下游开花相关基因AP1、SOC1、LFY和FUL明显上调表达[11-12]。
为了进一步研究FT 蛋白的分子生物学功能,许多研究者利用酵母双杂交的方法来筛选FT 结合的蛋白[13]。近年来研究人员通过体外酵母双杂实验筛选出许多能与FT 蛋白结合,并在植物体内影响植物开花的蛋白,其中比较重要的有FD[14],14-3-3[15],FT-INTERACTION PROTEIN 1(FTIP1)[16]和BRANCHED1(BRC1)[17]等。我们前期构建了新陆早33 号棉花叶片和花混合组织的酵母双杂cDNA 文库,文库筛选获得了一个与GhFT1 互作的硫氧还蛋白类似蛋白,测序分析发现该蛋白含有WCRKC 保守氨基酸基序,命名为GhWCRKC2-5 (未发表资料)。硫氧还蛋白(thioredoxin,Trx)是瑞典科学家于1964年在埃希氏菌属大肠杆菌B 中首次发现并提取出来的,作为脱氧核糖核苷酸还原过程中的电子供体在DNA 合成过程中发挥作用,是一类分子量较低的可溶性蛋白[18]。Trx 分子量一般在12 kDa 左右,是一种无处不在的抗氧化酶,Trx 家族基因分为典型和非典型两大类。典型的硫氧还蛋白包括H 亚族、F 亚族、M 亚族和TDX 亚族等,它们都有活性位点WCGPC。非典型的Trx 家族包括Trx-like 亚家族等,Trx-like 亚族包括WCRKC 和WCRVC 两 类[19]。
研究开花时间的分子机制一直是科学家和农作物育种家关注的焦点。棉花不仅是世界上最有价值的经济作物之一,而且是研究多倍体化、细胞伸长和细胞壁生物合成的优秀模型系统[20-22]。开花转变及时间的早晚对棉花霜前皮棉产量和纤维长度尤为重要,而纤维发育一直是棉花育种研究的重中之重。棉花原产于热带地区,对温带地区的低温和土壤条件非常敏感。开花提前是大多数棉花育种项目的一个重要目标[23]。目前,对棉花Trx 家族Trx-like亚家族的相关研究少见报道。棉花中存在的非典型的Trx 具有什么样的特点,其功能如何,是值得研究的问题。本研究在前期研究的基础上,首先克隆完整的GhWCRKC2-5基因完整阅读框cDNA,酵母双杂进一步验证GhWCRKC2-5 与GhFT1 蛋白互作,并且利用陆地棉全基因组分析了棉花的Trx 蛋白;分析了GhWCRKC2-5基因的组织表达及在纤维不同时期的表达特征;通过拟南芥中异位过量表达及在棉花中的病毒介导的基因沉默 (Virus-induced gene silencing,VIGS)分析了基因在开花调控中的功能。本研究为深入分析GhWCRKC2-5基因在棉花中的功能,探索棉花适应环境的开花时间调节机制奠定了基础。
1 材料与方法
1.1 材料
1.1.1 植物材料
实验所用新疆陆地棉品种为新陆早33。在棉花三片真叶期(种植22 d)采集了根、茎、叶片和顶端分生组织(shoot apical meristems,SAM)样品,在棉花开花当天采集花样品。在棉花开花前3 天和开花当天以及开花后第3 天、第5 天采集胚珠组织样品,在棉花开花后第8 天、第12 天、第15 天、第20 天、第25 天和第30 天采集纤维组织样品。拟南芥哥伦比亚生态型(Col-0)由本实验室保存。
1.1.2 菌株和载体
酵母pGBKT7 和pGADT7 菌种购自Clontech 公司。含pGBKT7-BD-FT 载体的AH109 菌液、含pGBKT7-BD 载体的AH109 菌液、AH109 酵母菌株均为本实验室保存。pTRV1 和pTRV2 载体由德克萨斯农工大学植物基因组学与生物技术研究所的Ping He 教授馈赠。
1.2 方法
1.2.1 RNA 的提取和cDNA 的制备
采用EASYspin Plus 植物RNA 快速提取试剂盒(Aidlab Biotech,Beijing,China) 提取陆地棉不同组织的总RNA,利用M-MLV Reverse Transcriptase(Promega)反转录制备cDNA 第一链。
1.2.2 载体构建
根 据CottonGen (https://www.cottongen.org/)陆 地棉 (TM-1)Gh_A05G2534基 因ORF 序 列,结 合pGADT7 载体酶切位点设计验证酵母互作引物;结合pCAMBIA2300-OCS (本实验室保存)植物表达载体酶切位点设计基因克隆引物;结合pTRV2 载体酶切位点设计VIGS 基因克隆引物(表1)。利用Primer Premier 5.0 软件设计引物,由北京华大基因公司合成。使用带相应酶切位点引物扩增的20 μL 的反应体系为:模板0.2 μL,KOD Plus Buffer 2 μL,KOD dNTPs 2 μL,KOD Mg2+0.8 μL,正反向扩增引物各0.5 μL,KOD Plus 0.4 μL,ddH2O 13.6 μL。反应程序为:94 ℃变性2 min 后94 ℃15 s,58 ℃30 s,68 ℃37 s,35 个循环后72 ℃延伸10 min。PCR产物在1% (W/V)琼脂糖凝胶上检测并利用Promega公司凝胶回收试剂盒回收,将回收产物连接到pBluescript II KS (本实验室保存)载体上,转化大肠杆菌DH5α。通过蓝白斑筛选,挑选白斑过夜摇菌并提取质粒进行酶切鉴定,鉴定正确的阳性克隆进行测序分析。
1.2.3 酵母双杂交验证
以诱饵质粒pGBKT7-GhFT 和空质粒pGADT7作对照,将筛选得到的文库质粒和诱饵质粒pGBKT7-GhFT 回转AH109 酵母菌株,转化产物划线涂SD/-Leu/-Trp(DDO)二缺平板和SD/-Ade-His-Leu-Trp(QDO)四缺平板。可根据生长菌落的大小来判断相互作用的强弱。一般认为,菌落大的,相互作用强,反之则弱。
1.2.4 非典型GhTrx 基因家族和GhWCRKC2-5基因的生物信息学分析
从陆地棉(TM-1)全基因组数据库中鉴定GhTrx基 因 家 族。 在 下 载 自 CottonGen (https://www.cottongen.org/) 的TM-1 基因注释结果中进行BLAST比对分析,最高e 值设为1×10-15。所查找到的蛋白提交到PFAM (http://pfam.xfam.org/)和NCBI 的保守功能区域 (conserved domains) 分析程序(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测蛋白保守结构功能域;MegAlign 软件进行序列比对分析;ExPASy (https://web.expasy.org/protparam/)软件推断编码蛋白的分子量和等电点;MEGA5.0 软件进行蛋白系统进化分析,进化树构建使用Neighbor-Joining 方法[24];TMHMM2.0 (http://www.cbs.dtu.dk/services/TMH MM-2.0/) 软件推测蛋白跨膜结构域;ProtScale(https://web.expasy.org/protscale/)软件预测蛋白的亲疏水性;SOPMA (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.plpage=npsa_sopma.html)软件预测蛋白的二级结构。
1.2.5 基因表达分析
采用qRT-PCR 对目的基因进行表达分析,基因特异引物是GhWCRKC2-5-qrt-F 和GhWCRKC2-5-qrt-R,内参基因棉花UBQ7(Gene ID:107924595)的引物为UBQ7F 和UBQ7R (表1)。根据Fast SYBR Mixture (CWBIO 公司),反应程序为:95 ℃预变性20 s 后95 ℃变性3 s,60 ℃退火/ 延伸30 s,40个循环,每个样品3 次重复。使用7500 Fast 实时荧光定量PCR 仪 (Life Technologies) 检测目的基因和UBQ7内参基因的Ct 值,每种样品进行3 次PCR 重复,采用2-ΔCt法分析试验数据[25]。利用Microsoft Excel 2007 软件处理数据,Origin 2017 软件作图。
1.2.6 拟南芥的遗传转化
过表达载体35S:GhWCRKC2-5重组质粒经热激法转化农杆菌GV3101,将带有35S:GhWCRKC2-5的农杆菌利用侵花法(Floral dipping)侵染拟南芥[26]。收获的T0代拟南芥种子在超净台上消毒后均匀地点种在含有30 mg/L 卡那霉素的1/2 MS 培养基上,4 ℃下春化处理3 d 后,在22 ℃光照培养箱中培养10~13 d,发现每皿中有大量白苗,几乎都是两片白色的叶子,根部也没有生长;同时有少量绿苗出现,并且大多有3-4 片叶子,根部生长良好,把这些绿苗移栽到含有营养土和蛭石(体积比为1∶1)的盆钵中,然后放置到16 h 光照、8 h 黑暗光照培养间里培养。用CTAB 法提取植株基因组DNA,进行PCR 检测并且提取检测结果为阳性的拟南芥植株的总RNA,利用qRT-PCR 检测目的基因的转录水平。待植株开花时,统计植株的开花时间和开花当天的莲座叶数目,观察植株的生长状态。
1.2.7 棉花VIGS
在陆地棉人工气候室(昼/ 夜温度25 ℃/25 ℃,光/ 暗周期16 h/8 h)培养供试的棉花材料,13 d 后以子叶完全展平的棉花幼苗为试验接菌材料。以VIGS 沉默棉花CLOROPLASTOS ALTERADOS1(CLA1) 表现出的白化性状作为表型对照。构建含GhWCRKC2-5基因的VIGS 重组载体,转化农杆菌GV3101。挑取含农杆菌GV3101 的单菌落,接种到3 mL LB 液体培养基(含kan 50 mg/L,Rif 25 mg/L和Gen 40 mg/L)中,28 ℃,180 r/min 培养24 h,菌落检测后,取1 mL 接入50 mL LB 液体培养基,28 ℃,180 r/min 培养12 h,至菌液OD600为1.0 左右;8000 r/min 离心5 分钟收集菌体细胞,将菌体重新悬浮于VIGS 侵染液中 (10 mmol/L MgCl2;10 mmol/L MES;200 μmol/L AS),将侵染液终浓度调至OD600为1.5 左右;于室温下静置3 h 以上,将pTRV1 分别与pTRV2、pTRV2-GhCLA1、pTRV2-GhWCRKC2-5的重悬液均按体积比1∶1,混匀注射棉花子叶[27]。

表1 实验所用引物Tab.1 Primers used in the study
2 结果与分析
2.1 GhWCRKC2-5 与GhFT1 蛋白酵母双杂验证
构建酵母双杂交载体pGADT7-GhWCRKC2-5,挑取在SD-Trp-Leu(DDO)培养基上生长的pGBKT7-BD-GhFT1+pGADT7-GhWCRKC2-5 菌落和对照pGBKT7-BD+pGADT7-GhWCRKC2-5 菌落,分别稀释10 倍、100 倍和1000 倍,分别吸取2.5 μL 点在DDO 固体培养基和SD-Trp-Leu-His-Ade (QDO)固体培养基上,观察酵母菌落生长。发现pGBKT7-BD-G hFT1+pGADT7-GhWCRKC2-5 和pGBKT7-BD+pGADT7-GhWCRKC2-5 在DDO 培养基上都正常生长,而pGBKT7-BD-GhFT1+pGADT7-GhWCRKC2-5 在 QDO上正常生长,pGBKT7-BD+pGADT7-GhWCRKC2-5 在QDO 上不生长。同时菌斑大小、密度相对于对照pGBKT7-BD+pGADT7-GhWCRKC2-5 酵母菌落无明显差异 (图1)。结果表明陆地棉GhWCRKC2-5 与GhFT1 蛋白能够发生相互作用。

图1 酵母中GhWCRKC2-5 与GhFT1 蛋白间相互作用分析Fig.1 Analysis of the interactions between GhWCRKC2-5 and GhFT1 proteins in Yeast
2.2 GhWCRKC2-5 基因的克隆与分析
测序后分析目的基因的序列长度为612 bp,包含起始密码子ATG 和终止密码子TGA,为完整的开放阅读框。BLAST 比对分析表明,该基因为Gh_A05G2534基因,编码203 个氨基酸,与其他植物WCRKC 类的硫氧还蛋白具有较高的相似性。生物信息学分析发现GhWCRKC2-5 蛋白的跨膜螺旋数目为0,没有明显的跨膜区,在膜外出现的可能性高于在膜内出现的可能性;GhWCRKC2-5 属于亲水蛋白;GhWCRKC2-5 蛋白α-螺旋 (alpha helix) 占32.51%;延伸链(extended strand)占22.17%;β- 转角(beta turn) 占6.90%;无规卷曲(random coil)占38.42%。在整个GhWCRKC2-5 蛋白质空间结构中,无规卷曲和α- 螺旋是其主要的结构元件。
2.3 非典型GhTrxs 家族基因结构分析
利用全基因组比对分析,从陆地棉基因组中一共比对出46 个非典型的GhTrxs 基因,包括Atypical CYS HIS rich thioredoxin (ACHT)亚族、Tetraticopeptide Domain-containing Thioredoxin (TDX)亚族、Thioredoxin 2 (Trx2)亚族、Trx-like 亚族、PDI11 亚族、NADPH-dep endent thioredoxin reductase C(NTRC)亚族和Thioredoxin superfamily protein(TSP)亚族(图2)。
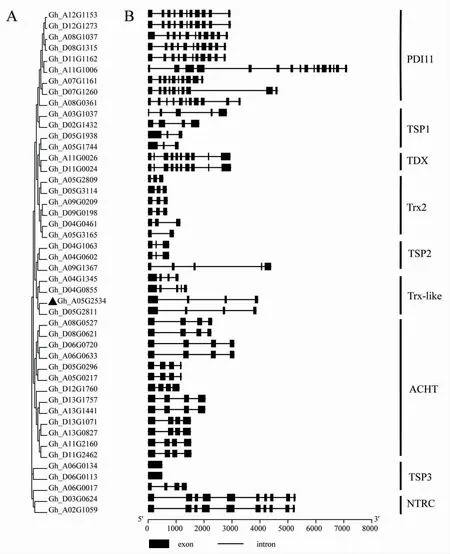
图2 陆地棉46 个非典型GhTrxs 的进化关系及基因结构Fig.2 Phylogenetic relationships and gene structures of the 46 atypical GhTrxs
2.4 GhWCRKC2-5 氨基酸相似性及进化分析
用Clustal X2 软件对GhWCRKC2-5 基因编码的氨基酸序列与GenBank 数据库中的其他物种硫氧还蛋白基因编码的氨基酸序列进行相似性比较。与可可(Theobroma cacao,EOY18725)、木薯(Manihot esculenta,XP_021626636)、麻疯树(Jatropha curcas,XP_01208 0950)、巴西橡胶树(Hevea brasiliensis,XP_021672622)、番木 瓜 (Carica papaya,XP_021897880)、核 桃(Juglans regia,XP_018828849)、芸苔属甘蓝(Brassica oleracea var.oleracea,XP_013613223)、 拟 南 芥 (Arabidopsis thaliana,CAC05508)氨基酸序列一致性比较,相似性分 别 为 84.0% 、62.6% 、74.5% 、77.7% 、61.4% 、74.1%、60.8%和56.0%。其中GhWCRKC2-5基因编码的氨基酸序列与同为锦葵目(Malvales)的可可相似性最高,与拟南芥的相似性最低,且各种植物都具有保守的基序WCRKC (图3)。对亚洲棉、雷蒙德氏棉、可可、木薯等物种进行进化关系分析,构建系统进化树(图4)。结果表明,陆地棉与可可进化关系最近,与拟南芥亲缘关系最远。
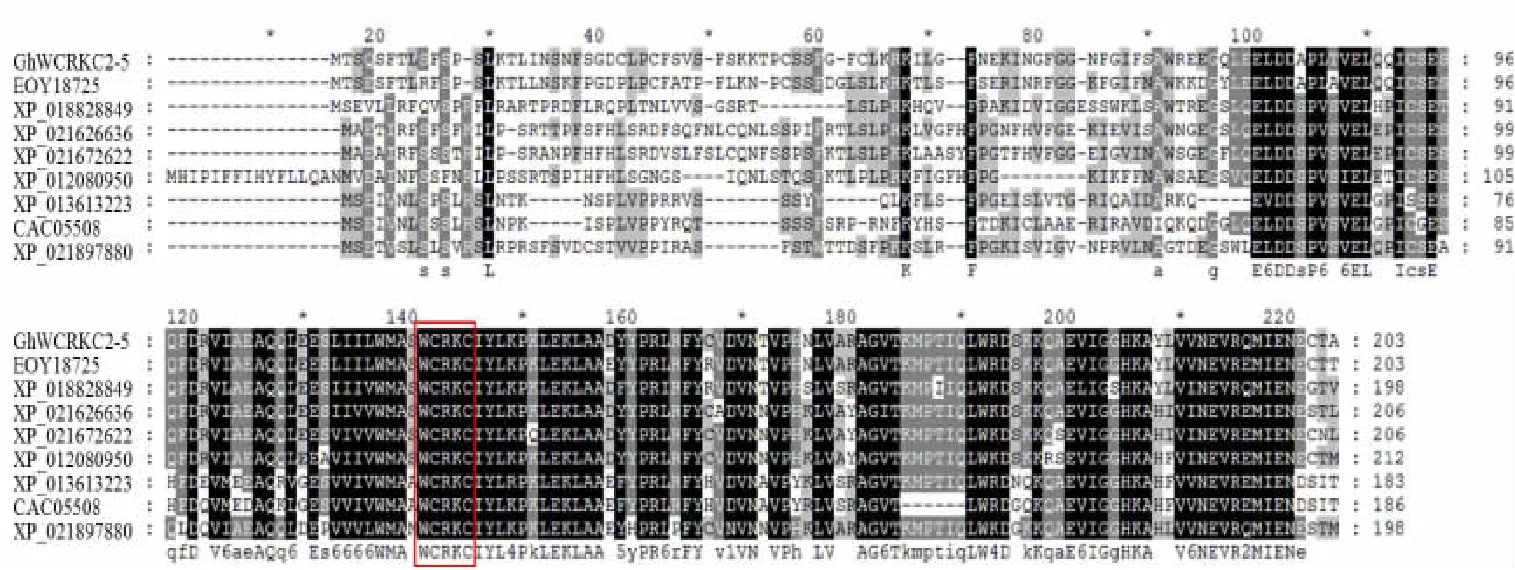
图3 植物WCRKC2-5 蛋白氨基酸序列的多重序列比对Fig.3 Multiple sequence alignment of amino acid sequence of plant WCRKC2-5 proteins
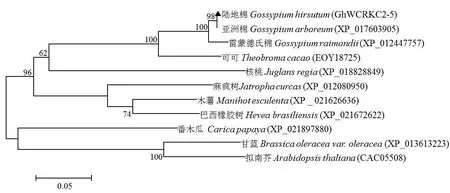
图4 GhWCRKC2-5 与其他物种同源序列的进化树分析Fig.4 Phylogenetic tree analysis of homologous proteins of GhWCRKC2-5 with other plant species
2.5 GhWCRKC2-5 基因的表达分析
qRT-PCR 分析表明,GhWCRKC2-5 基因在根、茎、叶、花和SAM 等不同组织中均有表达,但在根和花中的表达量高于茎、叶和SAM。在纤维发育的不同时期,GhWCRKC2-5基因表达呈现出降低- 升高- 降低的趋势,在开花前3 天到花后第3 天,GhWCRKC2-5基因的表达不断降低。花后第3 天到第25 天,GhWCRKC2-5 基因的表达不断升高,并且在花后第25 天时的纤维表达水平最高,但花后第25天到第30天,表达又开始降低(图7)。GhWCRKC2-5基因的表达特征暗示该基因可能在棉花开花和纤维发育过程中发挥着一定的作用。
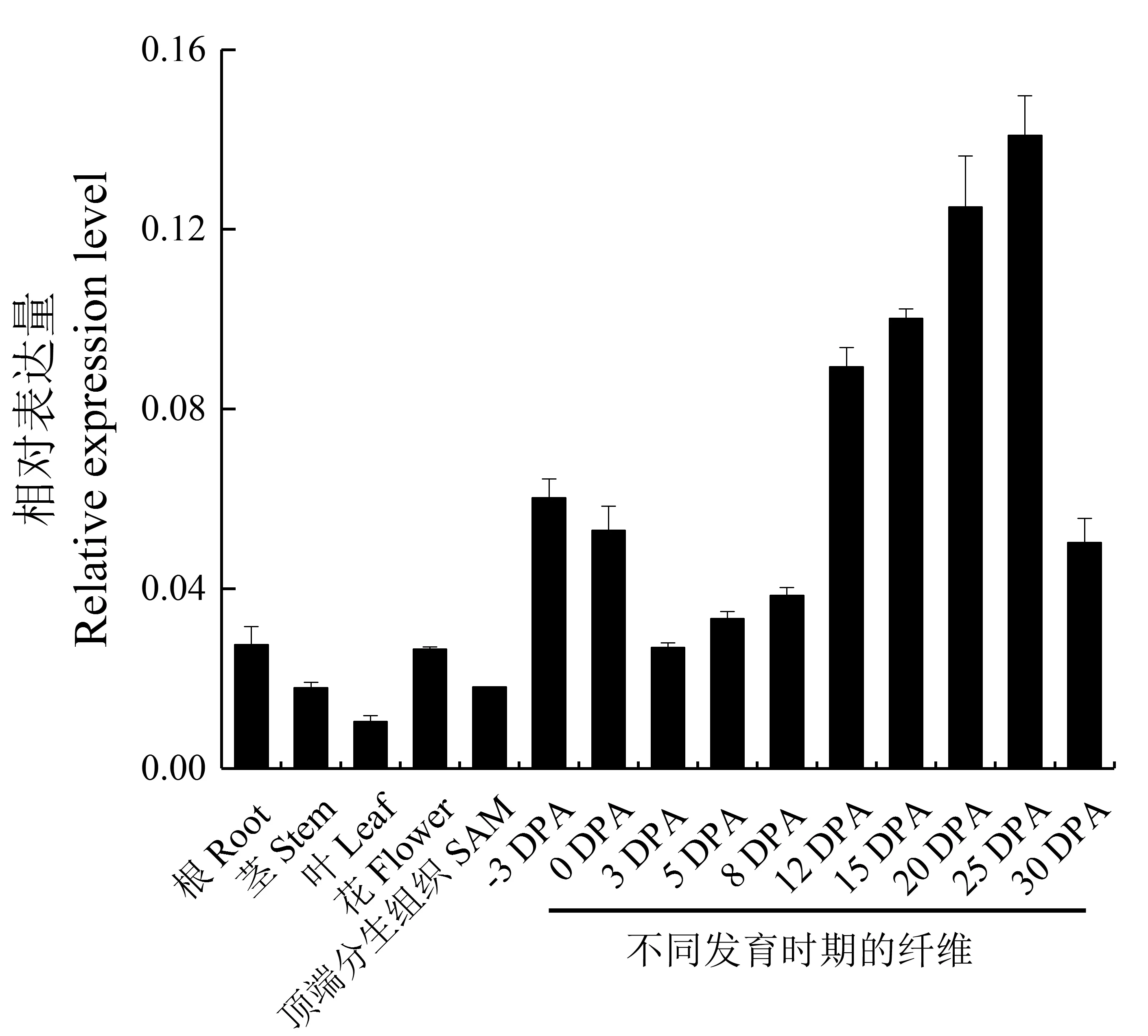
图5 GhWCRKC2-5 基因的组织和纤维发育不同时期的表达Fig.5 Expression patterns of GhWCRKC2-5 gene in different tissues and different fiber development stages of cotton
2.6 拟南芥过量表达GhWCRKC2-5 基因促进开花研究
经卡那霉素筛选和PCR 鉴定,获得了4 个独立的T2 代转GhWCRKC2-5基因拟南芥阳性植株。统计T2 代阳性植株的开花时间发现四个株系L15、L21、L28 和L31 的平均开花天数分别为25.1、19.2、25.9 和22.6,明显少于非转基因(Col-0)植株的30.0天(表2)。统计开花时期莲座叶片的数量,L15、L21、L28 和L31平均莲座叶分别为11.3、7.8、11.9 和7.9,明显少于Col-0 的16.7 片(表2)。检测拟南芥花发育相关基因FT和SOC1 的表达,结果表明转GhWCRKC2-5基因拟南芥中AtFT和AtSOC1 的表达量明显高于Col-0 (图6),说明GhWCRKC2-5基因参与调节植物的开花转变。
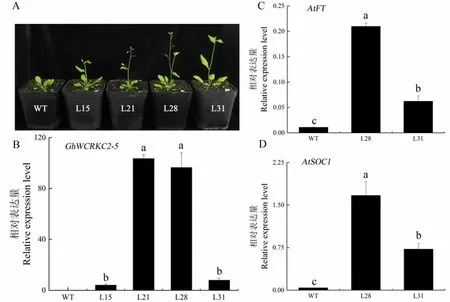
图6 过量表达GhWCRKC2-5 拟南芥的表型及相关基因的表达分析Fig.6 Phenotypic evaluation of overexpression of GhWCRKC2-5 in A.thaliana and expression analysis of the related genes
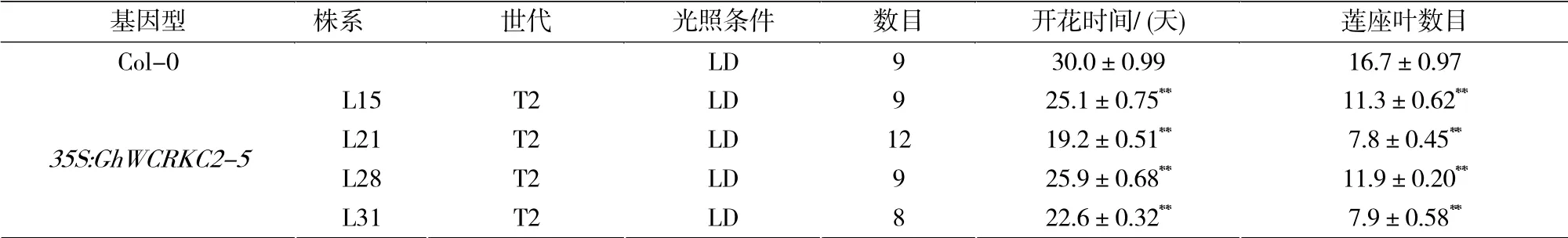
表2 T2 代不同的转基因株系及野生型拟南芥(Col-0)的开花时间和莲座叶数目Tab.2 The flowering time and rosette leaf numbers in different transgenic lines and wild type (Col-0)
2.7 棉花GhWCRKC2-5 基因VIGS 表型分析
与注射pTRV1/pTRV2(TRV2:00)载体农杆菌的对照植株相比,注射pTRV1/pTRV2-GhCLA1农杆菌的植株11 d 左右开始出现白化表型(图7A);半定量PCR 分析表明,与对照相比,注射含pTRV1/p TRV2-GhWCRKC2-5载体的农杆菌的试验植株中GhWCRKC2-5基因的表达水平有所减弱(图7B);并且,注射pTRV1/pTRV2-GhWCRKC2-5载体农杆菌的试验植株比注射TRV2:00 载体农杆菌的对照植株开花晚,植株长的也相对矮一些(图7C)。研究结果表明在棉花中降低GhWCRKC2-5基因表达,导致晚花表型。

图7 棉花GhWCRKC2-5 基因VIGS 表型分析Fig.7 Phenotypes of plants inoculated with TRV2:GhWCRKC2-5
3 讨论
本实验室前期以新陆早33 为实验材料利用酵母双杂交的方法,构建了FT 互作蛋白的cDNA 文库,筛选出陆地棉中一个硫氧还蛋白类似蛋白(未发表资料)。本研究首先经过酵母回转验证,证实二者的确互作。然后克隆了该基因,测序分析发现其具有完整开放阅读框,属于硫氧还蛋白家族成员,命名为GhWCRKC2-5。该基因编码蛋白属于非典型的Trx 家族成员;进化上与锦葵目可可中的TcWCRKC蛋白亲缘关系最近。
表达分析表明,棉花GhWCRKC2-5基因在组织表达和纤维表达中存在差异。整体来看,在纤维的不同发育时期表达高,GhWCRKC2-5基因表达呈现出降低- 升高- 降低的趋势,其中在纤维发育25天时表达最高,随后其表达下降。其次,GhWCRKC 2-5基因在根和花中表达较高;在茎、叶和SAM 中表达较低。可见,GhWCRKC2-5基因可能在棉花的纤维发育过程中发挥着一定的作用。而在拟南芥中异源表达棉花GhWCRKC2-5基因发现可以促进拟南芥提早开花。检测转GhWCRKC2-5基因拟南芥AtFT和AtSOC1的表达量,发现明显高于Col-0,说明该基因在开花过程可能对AtFT和AtSOC1的表达情况有一定的影响。因此,GhWCRKC2-5基因可能对棉花的纤维发育和开花过程都存在一定的影响。
VIGS 试验中,沉默植株比对照植株开花时间晚。同时,GhWCRKC2-5与GhFT1 蛋白互作,过表达GhWCRKC2-5基因对拟南芥FT基因的表达有一定的影响,那么GhWCRKC2-5基因作用于FT 的上游还是下游,是否参与另外一条开花通路还需要进一步探讨研究。棉花中Trx 同源基因有多少、各有什么功能、GhWCRKC2-5基因和其他Trx 基因有什么关系、在棉花中过量表达GhWCRKC2-5基因是否会促进植株早花都是需要进一步研究的问题。开展棉花硫氧还蛋白的相关研究工作,对利用现代分子育种技术提高棉花的环境适应性,并在此基础上对提高棉花产量和改善纤维品质意义重大。
