基于MWCNTs-PDA-Ag复合材料免疫传感器的构建
2018-04-12曹凯航杨玉晓高克夏珍珍乔秀文但建明李洪玲齐誉
曹凯航,杨玉晓,高克,夏珍珍,乔秀文,但建明,李洪玲,齐誉
(石河子大学化学化工学院/ 新疆兵团化工绿色过程重点实验室/省部共建国家重点实验室培育基地/材料化工新疆维吾尔自治区重点实验室,新疆 石河子832003)
癌症的早期诊断在整个治疗过程中具有重大的意义[1]。甲胎蛋白(AFP)作为一种功能性的癌胚糖蛋白[2],广泛应用于筛查和诊断原发性肝癌的肿瘤标志物,因此,对AFP 的检测在诊断中具有重要的作用[3-4]。具有操作简单、灵敏度高、测定时间较短及成本低等优点的电化学免疫传感器[5]可以作为癌症早期诊断中一种理想的检测分析方法。
多壁碳纳米管(MWCNTs)[6]具有良好的力学、电学及化学性能,使其在电化学器件、燃料电池、催化剂载体等方面应用广泛。聚多巴胺(PDA)是一种环境友好型的生物大分子,它具有很好的亲水性。在碳纳米管分散液中,多巴胺能够发生氧化自聚合反应,生成聚多巴胺沉积在多壁碳纳米管上[7]。另外,多巴胺(DA)在聚合过程中具有弱还原性,能够将银氨络合物还原成银纳米粒子。银纳米粒子具有高导电性和活跃的电活性等特点,是常用在电化学传感器中的电活性物质之一,但是由于纳米银粒子本身的不稳定性,在检测过程中易造成银流失而导致其电化学信号不稳定,会出现氧化还原峰持续降低等情况。而聚多巴胺的成膜性较好和具有粘附等作用,可将还原生成的银纳米粒子包覆在聚多巴胺薄膜中[8-9]。
本文研究在MWCNTs 分散液中聚合多巴胺,并利用聚合产生的弱还原性将银氨络合物还原成银纳米粒子,制备出MWCNTs-PDA-Ag 纳米复合材料。本实验方法绿色简便,在不引入额外还原剂的情况下一步合成该纳米复合材料,且该复合材料具备高导电性,并且因聚多巴胺的加入使得材料的分散性和稳定性都大大加强,使得制备的免疫传感器具有灵敏度高和稳定性高等优点。
1 实验部分
1.1 仪器与试剂
多壁碳纳米管(MWCNTs)购于苏州碳丰石墨烯科技有限公司,硝酸银(AgNO3)购于北京北化精细化学品有限责任公司,多巴胺(DA)购于合肥博美生物科技有限责任公司,甲胎蛋白(AFP)购于郑州人福博赛生物技术有限责任公司,牛血清蛋白(BSA)购于上海展云化工有限公司,无水乙醇(C2H5OH)购于天津水晟精细化工有限公司等。实验用水为超纯水,试剂均为分析纯。
电化学工作站为CHI760E 购于上海辰华仪器有限公司,pH 计购于上海雷磁仪器有限公司,电子天平为NewClassic(0.1mg)METTLER-TOLEDO,超声波清洗仪购于深圳市鸿展自动化设备有限公司,离心机购于常州市金坛高科仪器厂等。
1.2 纳米复合材料的制备
MWCNTs-PDA-Ag 复合材料的制备方法[10-11]如下:
取10 mg 羧基化的 MWCNTs 通过超声使其均匀分散到10 mL 蒸馏水中,并加入50 μL 氨水(28%,wt)混合均匀,然后在磁力搅拌下加入1 mL 10 mmol/L 的AgNO3溶液,并保持搅拌1 h;随后将20 mL 含 有0.5 mg/mL DA 的Tris (10 mmol/L PH=8.5) 缓冲溶液逐滴加入到上述混合溶液中,并在60 ℃下搅拌过夜;最后将得到的产物离心水洗,并在60 ℃下真空干燥。
1.3 免疫传感器的组装
分别用0.5 μm 和0.05 μm 的Al2O3粉末在麂皮上抛光金电极(GE,Φ= 4 mm)以形成光滑镜面,抛光后的电极用去离子水冲洗,随后再逐次用无水乙醇和去离子水超声多次清洗,晾干备用;通过超声震荡配制2 mg/mL 的MWCNTs-PDA-Ag 复合材料均匀分散液,并用移液枪量取10 μL 分散液滴加到金电极表面,晾干备用,即得MWCNTs-PDA-Ag 修饰的电极;随后将修饰好的电极依次anti-AFP 和BSA 中浸泡12 h 和1 h,并用蒸馏水洗去多余未连接的抗体和BSA,放置于4 ℃下储存;最后将电极在不同浓度的AFP 中孵育检测。
组装过程如图1所示。
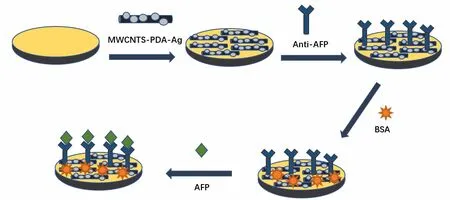
图1 免疫传感器的示意图Fig.1 The fabrication progress of the immunosensor
1.4 检测方法与检测原理
在实验中检测方法采用三电极系统,将修饰好的工作电极使用循环伏安法(CV)对电极制备过程进行表征以及探究优化测试条件,用电化学交流阻抗谱(EIS)在含有5 mmol·L-1[Fe(CN)6]3-/4- 中表征组装,在0.1 mol·L-1的缓冲液PBS 中(pH 7.0),对目标分析物AFP 进行检测,CV 电位扫描区间为-0.2-0.3 V,扫速50 mV·s-1。
实验中对抗原含量的定量检测原理是以抗体和抗原特异性结合的免疫反应为基础,抗原与抗体特异性结合后会在电极表面形成一层免疫复合物,由于蛋白质大分子会阻碍电极表面的电子转移,进而会使免疫传感器的电流响应值降低。结合抗原前后的电流响应值改变量,可进而转化为对抗原浓度的定量检测。
2 免疫传感器的电化学表征
2.1 纳米复合材料的形貌表征
在实验中将MWCNTs 和制备好的MWCNTs-PDAAg 纳米复合材料通过扫描电子显微镜(SEM)和透射电子显微镜(TEM)进行形貌的表征对比分析,了解复合材料的形态和尺寸。
图2A为MWCNTs的SEM图像,图2B、C为MWCNTs-PDA-Ag 纳米复合材料的SEM 图像。从图2A-C 可见:与多壁碳纳米管相比较,复合材料的表面呈粗糙状,这是由于聚多巴胺包覆在碳纳米管表面形成的,直径约为50nm,也可观察到银纳米颗粒附着在材料的表面。
图2D为MWCNTs的TEM图像,图2E、F为MWCNTs-PDA-Ag 纳米复合材料的TEM 图像,从图2D-F 可明显看出:图2E、F 中的碳纳米管表面包覆着一层聚多巴胺,也可清晰观察到纳米银颗粒点的存在,这进一步验证了纳米复合材料MWCNTs-PDAAg 的成功制备。
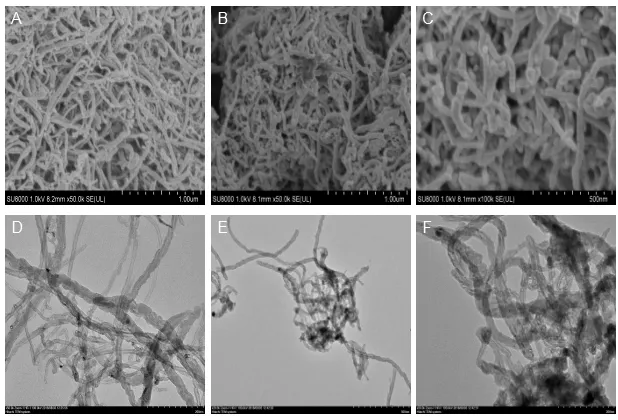
图2 材料扫描电镜SEM 和投射电镜TEM 表征图Fig.2 The SEM(A)/TEM(D) of MWCNTs and the SEM(B、C)/TEM(E、F) of MWCNTs-PDA-Ag
2.2 免疫传感器组装过程的CV 表征
电化学免疫传感器的组装过程循环伏安(CV)表征结果(图3)显示:
(1)在电极上修饰了MWCNTs-PDA-Ag 复合材料以后,由于电活性物质Ag 的成功制备,呈现出可逆的氧化还原峰(曲线a)。
(2)当成功固载上anti-AFP 在电极表面后,由于抗体阻碍了电子的转移,CV 氧化还原的峰电流出现了明显的降低(曲线b)。当蛋白分子BSA 封闭剩余活性位点后,进一步阻碍了电子转移,致使峰电流的又一步降低(曲线c)。
(3)将制备好的免疫传感器在AFP 溶液中孵育后,循环伏安峰进一步降低(曲线d),这是由于抗原抗体特异性结合后产生的免疫复合物进一步阻碍了电极表面的电子转移。
(4)上述结果表明该免疫传感器组装过程已完成。
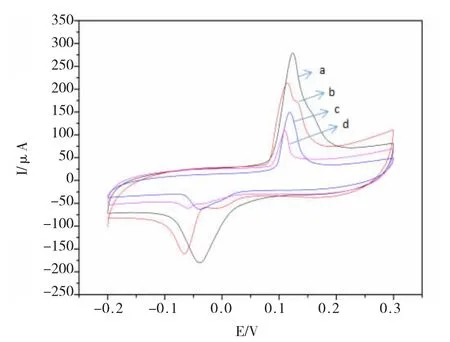
图3 免疫传感器组装过程的循环伏安图Fig.3 Cyclic voltammetry curves for the immunosensor assembly process
2.3 免疫传感器组装过程的阻抗表征
该免疫传感器组装过程所对应的交流阻抗谱(EIS)结果(图4)显示:在交流阻抗谱图中高频区内半圆的直径大小与阻抗之间存在着正比关系,直径越大则说明表面阻抗值越大,电子迁移率越差。
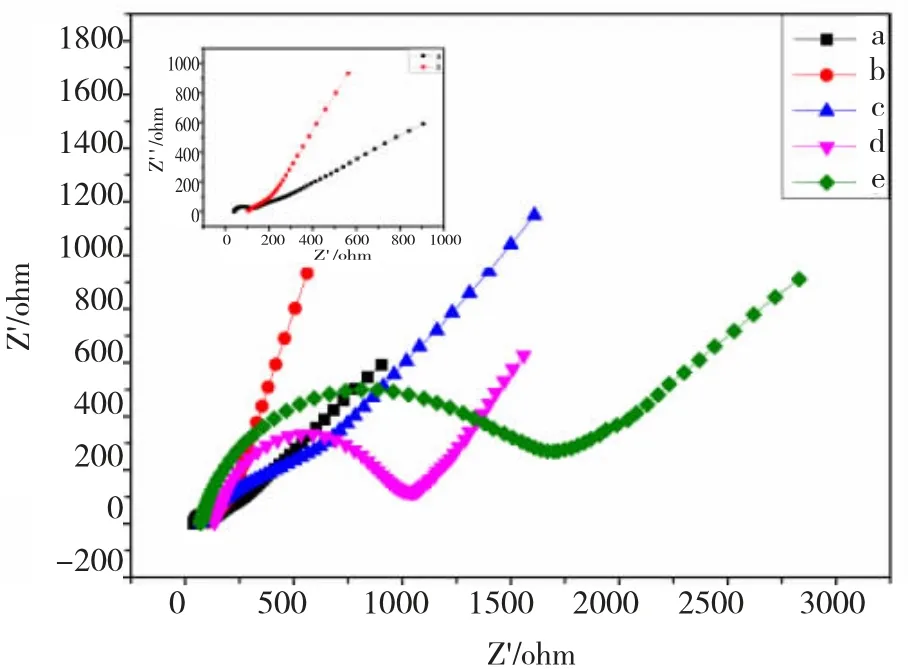
图4 免疫传感器组装过程的交流阻抗谱图Fig.4 EIS for the immunos ensor assembly process
图4中曲线a 为GE 裸电极的交流阻抗图,其直径小,所呈现出较小的阻抗,表明电子转移在电极表面受扩散影响。曲线b 为MWCNTs-PDA-Ag 修饰电极表面后的阻抗曲线,EIS 阻抗有略微减小,当抗体修饰于电极表面后(曲线c),由于抗体作为生物大分子不利于表面电子的转移,所以阻碍电子传递到电极表面,引起阻抗显著的增加。BSA 同样为不良导体,阻碍了电子转移,进一步使阻抗值增大(曲线d),抗原作为生物蛋白大分子,伴随着与抗体之间两者的特异性结合,在电极表面形成免疫复合物,阻抗值再次变大(曲线e)。交流阻抗谱的结果与循环伏安图表达一致,充分说明实验过程中各步骤的完成和免疫传感器的成功制备。
2.4 免疫传感器的扫描速度
为了探讨该免疫传感器的特性,通过对比不同的扫描速率对电化学免疫传感器的影响得到了图5,扫描速率范围为:10-200 mV/s。从图5可以看出:随着扫描速率的增加,氧化还原峰值也在不断增加,且峰电流响应值与扫描速率的平方根成正比关系,呈现出良好的线性关系。这说明该电化学免疫传感器表面的氧化还原反应受到扩散控制。
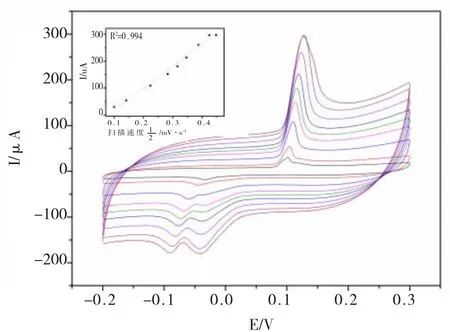
图5 电化学免疫传感器的循环伏安扫速图Fig.5 CV of the modified electrodes at different scan ra tes
3 免疫传感器的性能检测
3.1 条件的优化
PBS 缓冲溶液的pH 值是影响蛋白质大分子性质和电子流动速度的一个重要因素。本文通过实验分别检测了pH 范围为6.0-8.0 的PBS 缓冲溶液中电化学免疫传感器的循环伏安谱图,考察不同pH 值的PBS缓冲溶液对免疫传感器性能的影响,结果见图6。
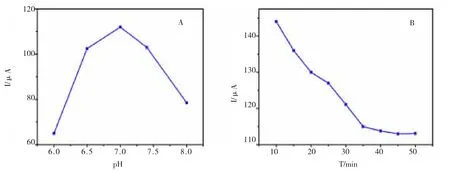
图6 免疫传感器的条件优化Fig.6 Condition optimization of Immunosensors The optimization of detection conditions
图6A 结果表明pH 为7.0 时最优。
考察不同孵育时间对免疫传感器性能的影响,结果(图6B)显示:抗原、抗体的孵育时间与抗原与抗体之间结合度有很大的关系,将已经被修饰好的电极与一定浓度的AFP 进行免疫反应,在35 min 处峰电流已经不再发生明显升高或降低已趋于稳定,表明免疫反应已达到平衡,故把最佳孵育时间定为35 min。
3.2 电化学免疫传感器的线性测试
将基于 MWCNTs-PDA-Ag 纳米复合材料的免疫传感器在上述最优条件下对梯度浓度的AFP 进行孵育并做循环伏安检测,所检测的浓度范围为0.01-50 ng/mL,结果(图7)显示:
(1)AFP 浓度越大,其循环伏安峰电流响应值越小。
(2)峰电流响应值与AFP 浓度的对数之间呈现出良好的线性关系。该免疫传感器的线性方程为I=79.315-30.481×log CAFP,R2=0.990,检出限为0.004 ng/mL (S/N=3)。
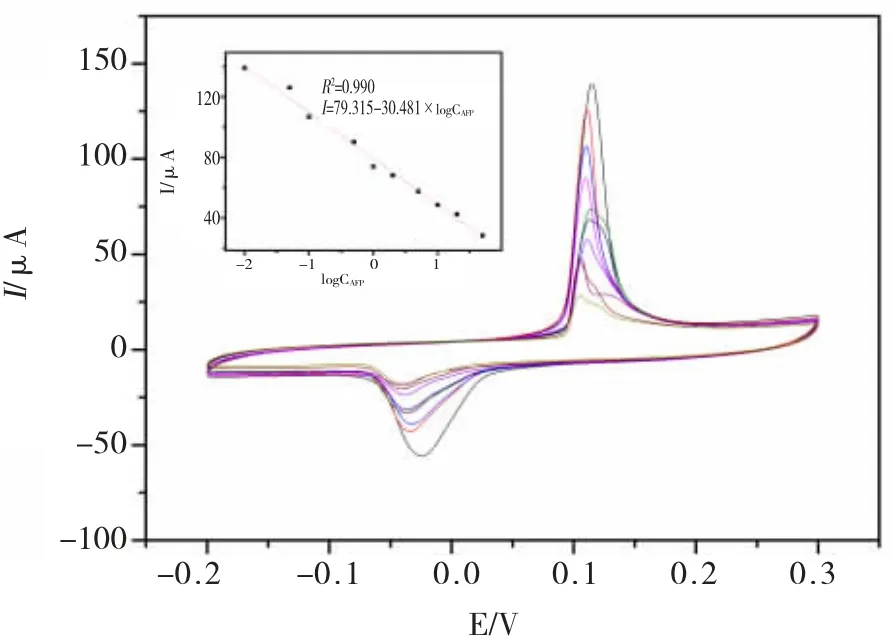
图7 电化学免疫传感器的检测性能Fig.7 Detection performance chart of electrochemical immunos ensor
3.3 电化学免疫传感器的重现性、稳定性
在相同条件下制备5 支免疫传感器,并对1 ng·mL-1标准抗原溶液进行孵育检测,其结果的响应电流的标准偏差为4.1%,这说明该免疫传感器具有较好的重现性。
将制备好的免疫传感器进行循环伏安扫描,连续扫描120 圈后的电流值仍为初始电流的95.3%,并将制备好的免疫传感器置于4 ℃下保存,且每隔3 天检测1 次,15 天后的电流响应值为初始电流的94.8%,说明该免疫传感器具有较好的稳定性。
3.4 电化学免疫传感器的选择性
考虑到在检测实际样品时,在机体内可能含有较多干扰物质可能使检测结果存在误差,所以利用甲胎蛋白(AFP)、牛血清蛋白(BSA)、癌胚抗原(CEA)、多巴胺(DA)、过氧化氢酶(HRP)考察该电化学免疫传感器的特异性和抵抗干扰的能力。将免疫传感器分别去检测干扰物质和AFP 与干扰物质混合液,其中AFP 的浓度为0.1 ng/mL,干扰物质的浓度为1 ng/mL。
检测结果(图8)显示:在不存在AFP 物质的溶液中孵育检测,其电流响应基本无变化,而在检测物中添加AFP 后,峰值有明显的降低,这表明该免疫传感器具有较强的抗干扰能力和优异的选择性。
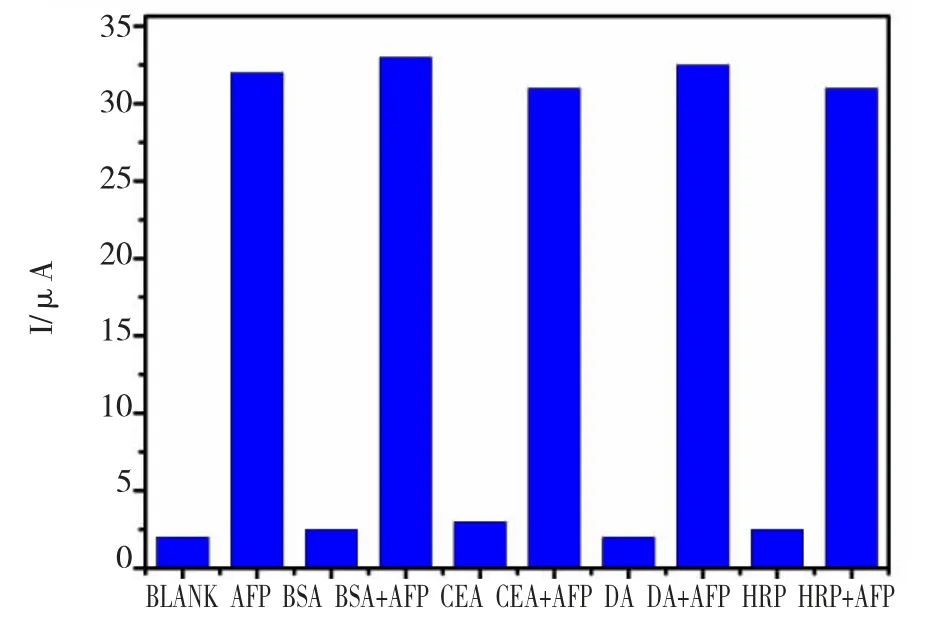
图8 免疫传感器的选择性Fig.8 The selectivity of Immunosensor
4 结论
(1) 本文实验成功制备MWCNTs/PDA/Ag 纳米复合材料,并且基于该材料构建了以甲胎蛋白为免疫模型的电化学免疫传感器。
(2) PDA 的加入在很大程度上提高材料的分散性,防止MWCNTs 团聚沉淀,利用PDA 的粘附作用和成膜性将银纳米粒子包覆在聚多巴胺膜内,在进一步提高复合材料导电性的同时也大大提高了该电化学免疫传感器的稳定性。
(3) 本实验方法具有制备成本低,制备过程绿色简便,制备出的电化学免疫传感器灵敏度、选择性和稳定性等性能良好。
