质子转移反应质谱仪在植物挥发物性有机物检测中的应用
2018-04-11沈阳辉伊力塔
俞 飞, 沈阳辉, 伊力塔,b
(浙江农林大学 a.林业与生物技术学院;b.林学类国家级实验教学示范中心,浙江 临安 311300)
0 引 言
植物挥发性有机化合物(Volatile organic compounds,VOCs)是主要来源于森林、草原、灌木和农田等陆地生态系统的生物次生代谢物质。这些化合物不仅是植物抵御逆境胁迫、信息传递的重要手段,并且可以通过氧化、沉降等作用影响区域和全球尺度的大气化学、生物化学循环和气候变化[1],因此,植物VOCs的释放和随后在空气中的转变引起了科学工作者的广泛探索。植物VOCs研究的主要测量和分析仪器包括色谱、质谱、REA 系统、FIS(Fast Isoprene System)系统、质子转移反应质谱仪(Proton Transfer Reaction Mass Spectrometer,PTR-MS)等。其中气相色谱(Gas chromatography,GC)或气质联用(gas chromatography mass spectrometer,GC-MS)是最常规的VOCs检测技术,而PTR-MS是20世纪90年代初,Lindinger研究组在选择离子流动管质谱(Selected ion flow tube mass spectrometry,SIFT-MS)的基础上,结合化学电离思想和流动漂移管模型技术开发的在线VOCs检测技术[2]。PTR-MS技术无需对样品进行预处理,可直接测定有机物的绝对浓度,并具有灵敏度高、响应速度快、裂解度低以及不受空气中常规组分干扰等优点,已发展成为痕量气体在线检测的潜在手段,在环境、医疗和食品领域的使用也越来越多。在国外PTR-MS技术也广泛应用于植物挥发物的检测中,但是国内相关研究开展较少,因此本文通过国外研究实例,从个体和生态系统两个层面对PTR-MS在植物VOCs检测中的应用展开了介绍。
1 PTR-MS的原理和特点
1.1 PTR-MS的原理
PTR-MS主要由进样系统、离子源、漂移管、质量分析器、检测系统5部分组成,其工作流程为:空气中的VOCs在漂移管与离子源产生的母体离子H3O+发生质子转移反应,将VOCs分子离子化成唯一的(VOC)H+,然后进入质量分析器通过质荷比(m/z)进行定性分析,并通过检测 H3O+和(VOC)H+强度的变化来定量VOCs的绝对浓度[2]。PTR-MS使用的这种电离技术称为软电离技术,即利用母体离子与目标物反应,把目标分子转换成离子。在VOCs检测中,H3O+是目前为止最为理想的母体离子。这是因为H3O+可以和大多数的VOCs分子发生质子转移反应(CH4和C2H4等少数有机物不能),但是不能与空气的主要成分(N2、O2、CO2和Ar等)发生质子转移反应[3]。关于PTR-MS仪器原理和结构的详细阐述在多篇文献中已有报道,在此就不再赘述。
2 PTR-MS在植物挥发性有机物检测中的应用
2.1 在个体尺度植物VOCs释放研究中的应用
植物VOCs最初受到人们关注是因为具有信号传递、抵抗高温和病原体侵染、创伤修复以及防止细胞伤害等生理生态作用,所以VOCs释放种类、排放速率与环境关系是植物生理生态研究的重要内容之一。目前利用PTR-MS开展的个体和种群水平的研究主要以控制试验为主,有模拟气候变化或环境污染对植物VOCs释放的影响,如CO2浓度升高对杨树异戊二烯释放特性的影响,模拟氮沉降对欧洲赤松单帖释放的影响,臭氧胁迫导致烟草VOCs大量释放的研究,水淹对欧洲颤杨等3种植物VOCs释放的影响等;还有生物胁迫造成的植物VOCs释放变化,如被褐卷叶蛾幼虫取食的苹果叶片72 h内植物VOCs的释放变化研究;以及植物随着自身物候变化化合物释放的变化,如络石VOCs释放随花期变化的研究[4-7]。
图1是常见的PTR-MS检测流程图[7]。主要有PTR-MS仪、采样室(chamber)、碳氢化合物捕集器、抽气泵、流量计等组成。一般流程是碳氢化合物捕集器将抽气泵抽进的空气过滤后(去除空气中的VOCs)输入采样室,然后携带植物释放的VOCs进入PTR-MS进行测定,而流量计用于控制空气流速。
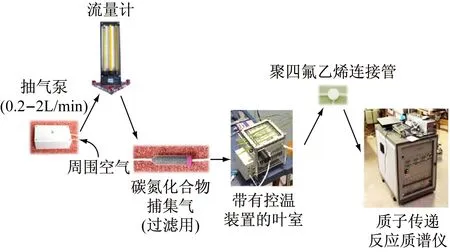
图1 植物VOCs采样和检测系统[7]
其中,采样室是非常重要的配件,用于放置待测叶片、枝条甚至整个植株。因为植物VOCs含量低,而且活性高,极不稳定,特制的采样室可以保证植物释放的VOCs能顺利进入仪器而不是挥发到空气中,并且不改变VOCs成分。常用的采样室材料有聚四氟乙烯(PTFE或Teflon)、不锈钢、黄铜、玻璃等,其中PTFE/Teflon是最常见的,不能使用橡胶或塑料,因为这两种材料会释放或吸收VOCs。图2是常见的两种采样室。Schuhfried[6]等就采用特制的玻璃采样室来盛放采摘后的络石花朵并收集VOCs(见图3),以研究络石花朵凋谢过程中VOCs的释放特征,其PTR-MS的检测结果见图4。也有的研究者直接将气体交换仪的叶室作为VOC的采样室开展研究。如Niinemets[8]等将Walz GFS-3000光合作用仪和PTR-MS进行联用,利用光合作用仪的叶室为VOC采样室,同步测定杨树叶片的气体交换数据和异戊二烯排放速率,进一步拓展了PTR-MS的应用。采样室至少要有一面是透明的以保证光线的进入维持正常的光合作用,因为一些植物的VOCs释放是受光照控制的。影响植物VOCs释放的环境生物因素有CO2浓度、湿度、臭氧变化等,这些大多数可以通过在采样室内安装风扇对叶室内空气速率进行控制,从而将环境因素的影响降到最低,有的采样室根据试验需要甚至安装了控温装置[7]。采样室与气泵和仪器等各气路也需要用PTFE或Teflon相连。

A: 玻璃采样室

B: PTFE采样室

图3采摘后置于采样室的络石花朵照片(Trachelospermumjasminoides)[6]。
注:在第1,5,9,10,11,12和13天分别用PTR-MS进行VOCs检测。

图4 络石鲜花凋谢过程中VOCs释放特征图[6]
利用PTR-MS进行VOCs研究大多会在可以控制温度和湿度的室内开展,以保持仪器的精度和灵敏度。在开展植物VOCs检测时的参数设置一般为:漂移管压强220 Pa左右,漂移电压600 V左右,漂移管内所加电场(E)和气体数密度(N)比值(E/N)为100-140 Td之间。在测定前需要用标准气体对仪器进行校准,以保证精度。
2.2 在生态系统尺度植物VOCs检测中的应用
据估算,全球生物源挥发性化合物的年均排放量高达1 273 Tg C,其中90%左右(约1 150 Tg C)来自陆地生态系统,为植物生理过程中排放到大气中的次生代谢物质,而人为源挥发性化合物仅为110 Tg C[1]。这些VOCs可以与大气中的活性自由基发生反应生成二次有机气溶胶,产生光化学烟雾及灰霾,造成空气污染,影响区域大气环境;也可以在氧化过程中与O3、NO2、OH自由基反应,降低大气的氧化性从而延长CH4等温室气体在大气中的寿命,改变大气辐射平衡,增强温室效应;还可以在大气中经过一系列反应最终生成 CO2,参与到生态系统碳循环中,最终影响全球气候变化。所以全球不同地区代表性生态系统植物VOCs释放研究成为了生态学和大气化学等学科研究的热点内容之一。
PTR-MS的发明解决了陆地生态系统植物VOCs排放在线检测困难的问题。这是因为很大一部分的植物VOCs为高活性物质,释放后几秒内即与空气发生氧化反应代谢为其它有机化合物,要求仪器具有实时、快速响应的特点。国外利用PTR-MS开展陆地生态系统植物VOCs排放的研究开始于2000年左右。目前已经对热带雨林,如南美亚马逊和马来西亚的热带雨林等;温带阔叶林,如法国地中海橡树林,日本栎树林等;北方针叶林,如芬兰的欧洲赤松林等;亚高山森林生态系统,如美国科罗拉多州北部的针叶林等世界典型森林;还有一些农业生态系统,如欧洲西北部玉米地开展了研究[9-11]。国内近几年也陆续开展了不同森林类型植物VOCs排放通量的研究,使用的检测仪器还是以GC,或者GC-MS为主,利用PTR-MS进行的VOCs排放研究几乎未见报道。
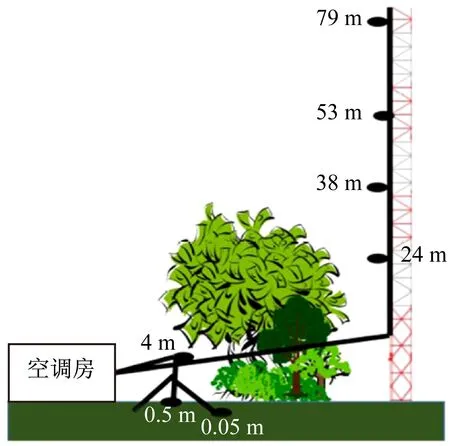
图5 实验进样装置示意图[12]
PTR-MS参数设置为标准设置:漂移管电压600 V,压强220 Pa(127 Td)。每个高度采样2 min,PTR-MS进行6-7次(每次20 s)扫描。PTR-MS 使用选择离子扫描模式,根据荷质比选择异戊二烯、甲醇等主要的植物挥发性有机化合物进行检测。研究结果如图6所示,24 m高度的异戊二烯和总单萜总体高于79 m和0.5 m处,且排放量从上午9 h开始上升,到下午3 h左右达到最大值,然后下降。
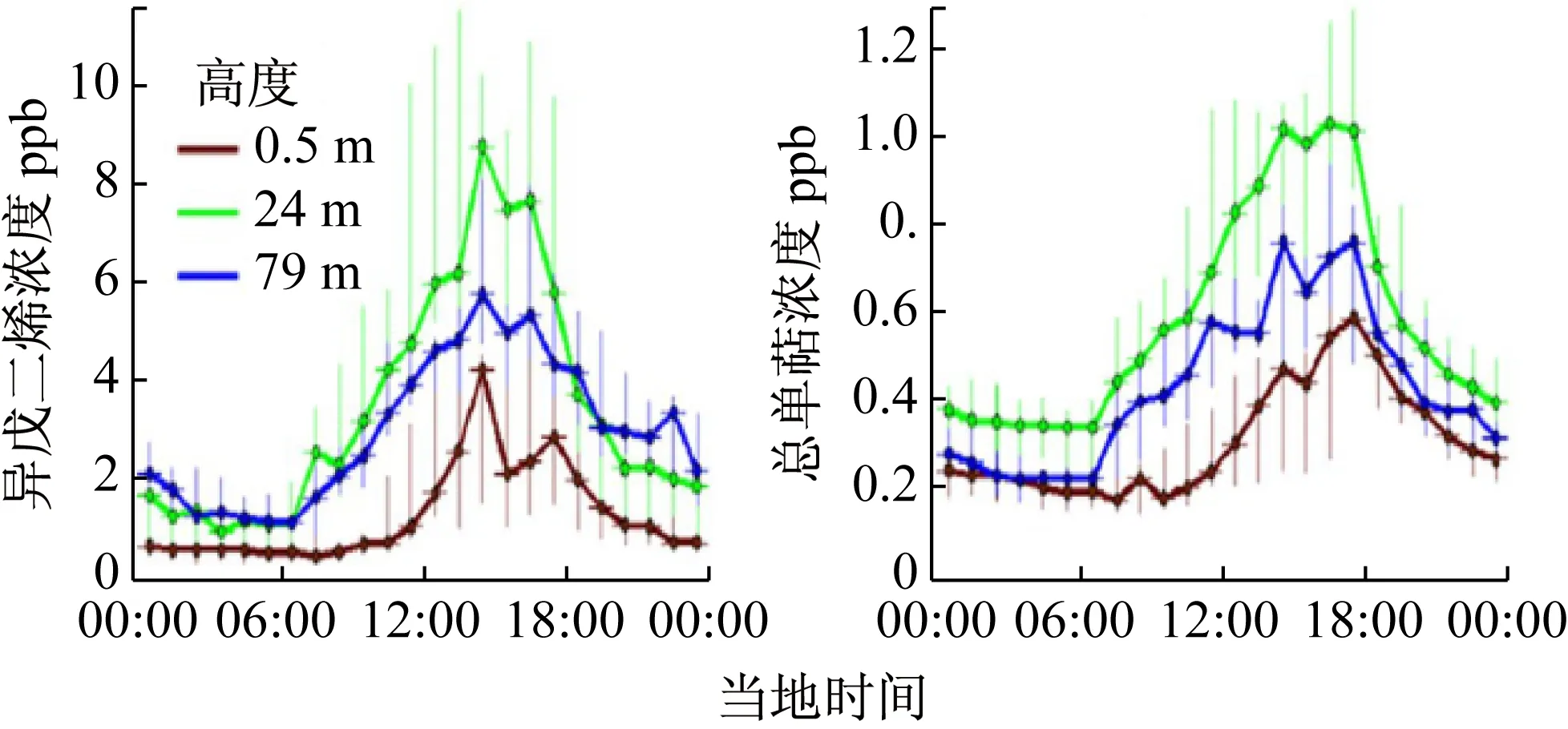
图6 异戊二烯和总单萜的日变化[12]
还有不少研究在测定植物VOCs排放速率和种类时,同步获取气象条件,然后结合梯度扩散法、涡度相关法或驰豫涡旋累积法等微气象方法,计算植物VOCs垂直通量[13]。这也是传统色谱技术无法实现的,因为目前VOCs通量观测的主要技术为涡度相关技术。该技术通过同步测定垂直风速和VOCs的浓度来计算其垂直通量,要求浓度测量工具反应时间在 1 s以内,所以传统的测量工具如GC的等达不到这些要求,而PTR-MS的响应时间仅为100 ms,检测限可达10-9,甚至10-12级,而且直接进样,完全可以满足通量观测的要求。
3 展 望
经过科学研究者多年努力,PTR-MS仪器设计实现了快速发展。在进样技术方面,目前已经实现了液体膜进样(MI-PTR-MS)、溶液直接注射进样(DAI-PTR-MS)、平衡器进样(EI -PTR-MS)、固相微萃取(SPME-PTR-MS)、激光解吸进样 (LD-PTR-MS)等多种进样方式,可以直接检测液体和固体VOCs[14-15]。在质量分析器方面,PTR-MS可分别与四极杆(Q)、离子阱(IT)、飞行时间(TOF)等结合,各有优势[7]。PTR-TOF-MS是目前最贵也是最先进的在线植物挥发物检测仪,检测限可达万亿分之一的体积比(pptv级),是今后PTR-MS的主要发展方向。而四级杆PTR-MS(PTR-Q-MS)仍将在很长一段时间内在植物VOCs监测中占重要位置,因为它更轻、更小,携带方便,价格也相对便宜,而且对数据处理器的要求也低一些,所以更适合野外使用。但是在分析同分异构体时,还需要借助GC-FID/MS开展平行试验进行鉴定。
这些研究都是针对PTR-MS仪器自身进行的检测范围、测量精度、响应时间等方面的改进。但是在利用PTR-MS进行植物挥发性有机物测定时,还要考虑植物自身因素。因为VOCs释放不仅受环境因素影响,还由植物生长状态和物候等因素决定。在个体尺度上进行的植物VOCs在线检测常与植物生长状态的仪器,如光合作用测量系统,叶绿素荧光仪等进行联用,以确定VOCs检测过程中的植物状态。所以,如何与其它仪器进行联用,也将是PTR-MS在植物VOCs检测应用中的一个重要方向。
参考文献(References):
[1]Guenther A, Hewitt C N, Erickson D,etal. A global model of natural volatile organic compound emissions[J]. Journal of Geophysical Research, 1995, 100 (D5): 8873-8892.
[2]Lindinger W, Hansel A, Jordan A. On-line monitoring of volatile organic compounds at pptv levels by means of proton-transfer-reaction mass spectrometry (PTR-MS) medical applications, food control and environmental research[J]. International Journal of Mass Spectrometry and Ion Processes, 1998, 173(3):191-241.
[3]Ellis A M, Mayhew C A. Proton transfer reaction mass spectrometry: principles and applications[M]. Experimental: Components and Principles. West Sussex, Chichester: Wiley, 2014, 49-106.
[4]Mateirc D, Blenkhorn D, Gonzalez-mendez R,etal. Monoterpene emission from young scots pine may be influenced by nutrient availability[J]. Applied Ecology and Environmental Research, 2016, 14(4): 667-681.
[5]Copolovici L, Niinemets Ü. Flooding induced emissions of volatile signalling compounds in three tree species with differing waterlogging tolerancepce[J]. Plant, Cell and Environment, 2010, 33(9): 1582-1594.
[6]Schuhfried E, Betta E, Cappellinr L,etal. Withering of plucked Trachelospermum jasminoides (star jasmine) flowers-Time-dependent volatile compound profile obtained with SPME/GC-MS and proton transfer reaction-mass spectrometry (PTR-MS)[J]. Postharvest Biology and Technology, 2017, 123:1-11.
[7]Materic D, Bruhn D, Turner C,etal. Methods in plant foliar volatile organic compounds research [J]. Application in Plant Science, 2015, 3(12):1-10.
[8]Niinemets Ü, Sun Z H, Talts E. Controls of the quantum yield and saturation light of isoprene emission in different-aged aspen leaves plant[J]. Cell and Environment, 2015, 38(12): 2707-2720.
[9]Possell M, Hewitt C N. Isoprene emissions from plants are mediated by atmospheric CO2concentrations[J]. Global Change Biology, 2015, 17(4): 1595-1610.
[10]Gray C, Monson R K, Fierer N. Biotic and abiotic controls on biogenic volatile organic compound fluxes from a subalpine forest floor[J]. Journal of Geophysical Research Biogeosciences, 2014, 119(4): 547-556.
[11]Bachy A, Aubinet M, Schoon N,etal. Are BVOC exchanges in agricultural ecosystems overestimated? Insights from fluxes measured in a maize field over a whole growing season[J]. Atmospheric chemistry and physics, 2016, 16(8):1-26.
[13]张学珍, 于志博, 郑景云, 等.植物挥发性有机物的气候与环境效应研究进展[J]. 地球科学进展, 2015, 30(11): 1198-1209.
[14]Arneth A, Makkonen R, Olin S,etal. Future vegetation-climate interactions in Eastern Siberia: an assessment of the competing effects of CO2and secondary organic aerosols[J]. Atmospheric Chemistry & Physics, 2015, 15(19): 27137-27175.
[15]Sulzer P, Hartungen E, Hanel G,etal. A proton transfer reaction-quadrupole interface Time-of-flight mass spectrometer (PTR-QiTOF): high speed due to extreme sensitivity[J]. International Journal of Mass Spectrometry, 2014, 368(14): 1-5.
