太行山南麓5个林龄侧柏人工林土壤酶活性季节变化
2018-04-11朱龙飞冯志培姜钰蒙杨喜田孔玉华
裴 丙, 朱龙飞, 冯志培, 姜钰蒙, 杨喜田, 孔玉华
(河南农业大学 林学院, 郑州 450002)
土壤酶是有机质分解、周转和矿化的主要生物催化剂,也是土壤碳、氮循环的主要限制因素之一[1-2]。土壤酶主要来源于土壤动植物残体、植物的根系以及微生物,其对全球气候变化比较敏感,与土壤养分状况、微生物活性及林分类型等密切相关,也是土壤质量和修复状况的重要生物活性指标[3-4]。20世纪80年代后期至今,对于土壤酶活性的研究多集中在土壤酶与土壤微生物的关系[5]、植物多样性对土壤酶活性的影响[6]、土壤酶与其他肥力因子的关系等方面[7],初步得出土壤酶的活性及稳定性在不同程度上受到土壤水分、pH值、温度、矿质元素和有机质的影响[8]。然而,土壤酶活性在时间和空间动态上是如何调控土壤生物化学过程并改善土壤质量的机理仍不清晰。
太行山区位于华北的中心地带,是华北平原重要的生态屏障。由于大陆性季风气候条件和人类的过度开发使该区生态系统抗干扰能力降低,土壤质量瘠薄。20世纪50年代以来,人工造林成为太行山区生态恢复的主要措施,陈家林等[9]在该区对3种30年生人工林对土壤质量影响的研究中发现,侧柏人工林的种植能有效积累土壤有机质、全氮和碱解氮含量并能显著改善土壤质地、提高土壤质量,但随着人工林的种植年限增加,植物的过度消耗可能会引起地力衰退,不利于土壤的可持续利用[10-11]。因此,本研究选取了青年(20 a)、壮年(30~40 a)、中年(50 a)和老年(60 a)侧柏人工林为研究对象,并结合前研究结果和土壤酶的特性,通过对比分析不同林龄下土壤酶活性的季节动态和在土壤剖面上的空间变化特征,及其与土壤理化性质的相关性,为揭示种植年限对土壤质量和生物活性的影响提供科学依据。
1 试验材料与方法
1.1 研究区概况
试验区位于河南省济源市,隶属于中国森林生态系统定位研究网络(CFERN)的黄河小浪底森林生态系统定位研究站(35°01′N,112°28′E)。地处黄河中游,紧连太行山,站区面积约7 200 hm2。属暖温带大陆性季风气候,年均气温12.4~14.3℃,2016年四季平均气温分别为:春季,6~18℃;夏季,19.7~32.3℃;秋季,17.3~27℃;冬季,-0.3~9.7℃。年均降雨量为641.7 mm,7—9月降雨量占全年降雨量的60%左右,全年日照时数为2 300 h以上,主要土壤种类有棕壤和石灰岩风化母质淋溶性褐土。该地区主要的生态系统类型为山地人工林生态系统和低丘农林复合生态系统,研究区代表性树种有侧柏[Platycladusorientalis(L.) Franco]、刺槐(RobiniapseudoacaciaL.)和栓皮栎(QuercusvariabilisBl.)。
1.2 研究方法
1.2.1样品采集与处理于2016年3月选取南坡向为主的5个不同林龄侧柏人工林地,按照邻近布置的原则,每块样地分别设置3个10 m×10 m固定样方,并对样方内植被情况进行详细调查,林下常见天然灌丛有酸枣(Ziziphusjujube)、荆条(Vitexnegundo)、胡枝子(Lespedezabicolor)、扁担木(GrewiabilobaG. Don)等;常见藤本植物有铁线莲(ClematisfloridaThunb.)、蛇莓[Duchesneaindica(Andr.) Focke]等;常见草本植物有中华隐子草(Cleistogeneschinensis)、白羊草(Bothriochloaischaemum)、西伯利亚远志(Polygalasibirica)、委陵菜(Potentillachinensis)、早熟禾(PoaannuaL.)等。为减少样地间的异质性,样地选取过程中保持坡向与坡度基本一致,各样地之间距离≤5 km,并排除林缘、沟渠、林间道路等的影响,且林下土壤类型均为淋溶性褐土,样地详情见表1,样地土壤基本概况见表2。
分别于2016年的3月(春)、6月(夏)、9月(秋)和12月(冬)进行土壤样品的采取,取样时天气晴朗,取样前几天也均无雨雪。在每个样方内按照S形设置5个取样点,去除地表可见的枯落物后,挖取0—40 cm土壤剖面,分4个土层(0—10,10—20,20—30,30—40 cm)采集各层土壤样品,置于自封袋密封保存,分别标记,带回实验室后低温冷藏,以供不同指标的测定。同时用环刀法采集4个土层的土壤,加盖密封后带回实验室后以测定土壤容重、土壤孔隙含水率(WFPS)和孔隙率等物理指标,每个土样设置3个重复。

表1 样地基本概况
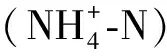
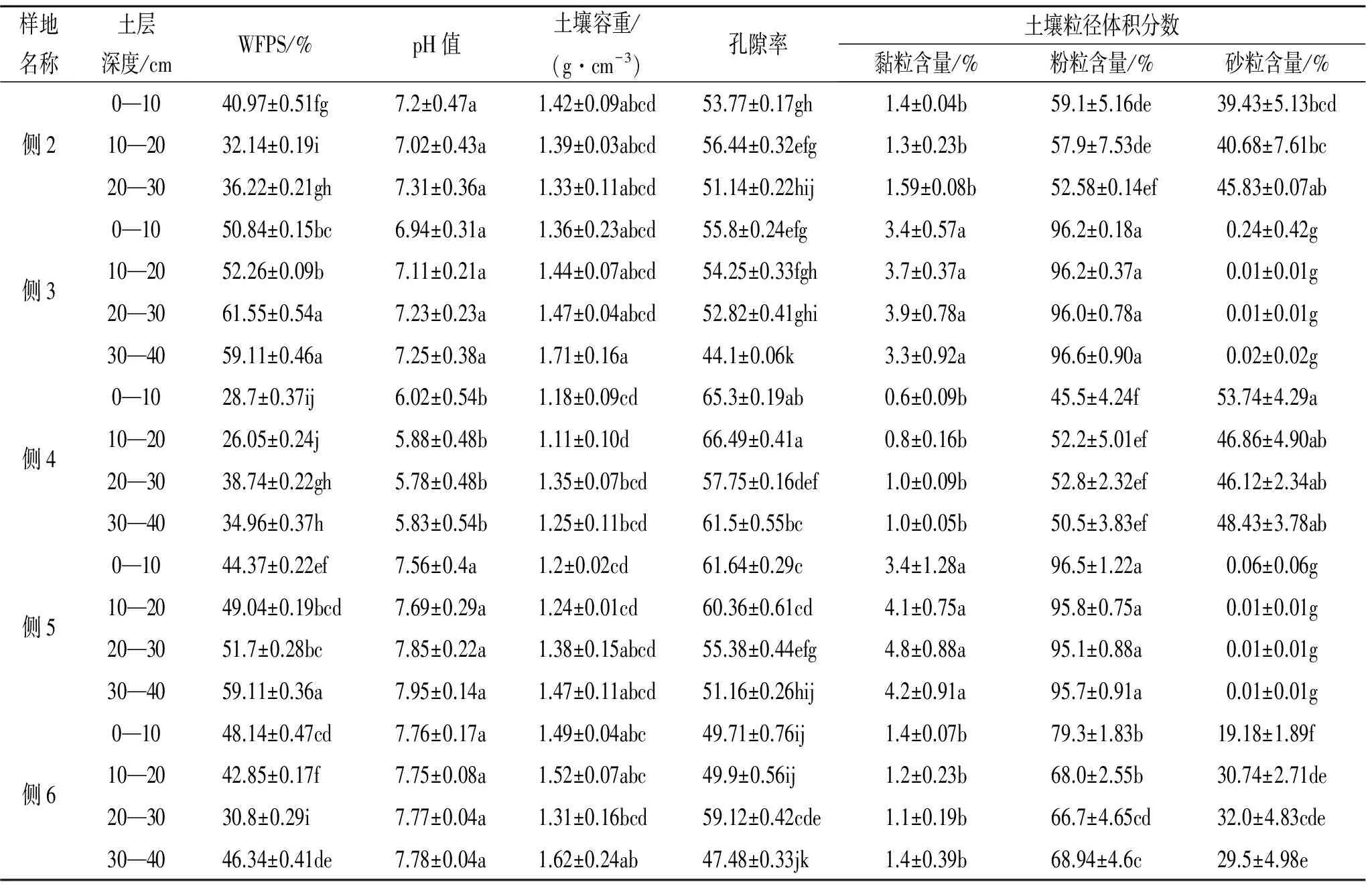
表2 样地土壤基本概况
注:表中数值为平均值±标准差,同列不同字母表示在p<0.05水平下差异显著。
土壤含水率用烘干法;土壤蔗糖酶活性的测定采用3,5-二硝基水杨酸比色法测定,以24 h后1 g土壤中葡萄糖的质量(mg)表示[8];土壤脲酶活性的测定采用靛酚比色法,以24 h后1 g土壤中NH3-N的质量(mg)表示[12];土壤DOC,DON,TN,铵态氮和硝态氮均用1 mol/L氯化钾溶液浸提新鲜土壤(土∶液=1∶5,W/W),然后用SKALAR流动分析仪(SAN++,荷兰)进行测定;土壤全氮含量采用半微量凯式法。土壤pH值采用1∶2.5浸提酸度计法测定(Hanna测定用半微量凯式法,日本);土壤颗粒组成体积分数[黏粒(Clay):<0.002 mm;粉粒(Silt):0.002~0.02 mm;砂粒(Sand):0.02~2 mm,美国制]用土壤粒径粒型测量系统测量(Mastersizer 2000,Malvern,英国);速效磷采用碳酸氢钠浸提—钼锑抗比色法测定;速效钾采用醋酸铵浸提—火焰光度计测定[13];用土壤三相仪(Daiki DIK-1150,日本)测定环刀样品的土壤容重、土壤孔隙含水率(WFPS)和孔隙率。
1.2.3数据处理采用多因素方差分析法(MNOVA)分析林龄、土层深度和季节对土壤蔗糖酶和脲酶的影响。对各土壤指标进行相关性分析(Pearson法),并采用逐步线性回归分析法分析土壤酶活性的主要影响因素。所有统计分析均采用SPSS 21.0软件进行(IBM,纽约,美国)。采用Excel进行图表绘制(Microsoft Office 2010,美国)。
2 结果与分析
2.1 不同林龄土壤蔗糖酶活性季节变化与空间分布特征
蔗糖酶能把土壤中的蔗糖分子分解为能够被土壤微生物吸收的果糖和葡萄糖,其活性反映土壤中碳周转的速率[14]。由图1可知,所有林龄土壤蔗糖酶活性均随季节变化呈明显的动态特征,夏季最高,在0—40 cm土层,平均土壤蔗糖酶活性的范围是22.95~40.74 mg/(g·h);其次是秋春,土壤蔗糖酶活性范围分别是13.42~23.97,9.59~16.05 mg/(g·h);冬季最低,其土壤酶活性范围为9.35~11.81 mg/(g·h)。
随着土层深度的增加,土壤蔗糖酶活性呈降低的趋势(图1)。相关性分析表明,随着土层深度的增加,蔗糖酶活性呈极显著减少的变化趋势(p<0.01),从0~10 cm土层到30~40 cm土层,土壤蔗糖酶活性降幅为53.8%。其4个土层的蔗糖酶活性平均值分别为26.48,17.52,13.78,11.51 mg/(g·h)。
随着侧柏林龄的增加,土壤蔗糖酶活性呈增加的趋势,但未达到显著的差别(p>0.05),其中20~40 a呈增加的趋势,0—40 cm土层的平均值变化范围是14.23~18.58 mg/(g·h),50 a侧柏0—40 cm土层的平均值是16.72 mg/(g·h),略有降低,60 a最高,达18.64 mg/(g·h)。造成这种情况的原因可能是因为30 a和40 a的侧柏处于壮年期,产生的枯落物较多,土壤中有机质归还量大,土壤酶活性较强,50 a则可能是由于树龄老化,枯落物归还量降低,植物本身消耗大,所以造成了土壤有机质降低,影响了土壤蔗糖酶活性。

图1不同林龄土壤蔗糖酶活性季节变化特征
2.2 不同林龄土壤脲酶活性季节变化与空间分布特征
土壤脲酶的产物氨是林木生长所需的氮素的直接来源,它对提高氮素的利用率和促进土壤氮素循环有重要意义[15]。由图2可知,不同林龄下土壤脲酶活性随着季节的变化呈现出明显的动态特征。其中,夏季最高,在所有0—40 cm土层剖面平均土壤脲酶活性的范围是1.81~12.59 mg/(g·24 h);其次是春秋,土壤脲酶活性分别为1.42~10.08,1.82~6.87 mg/(g·24 h);冬季最低,其0—40 cm土层剖面平均土壤脲酶活性的范围是0.4~3.68 mg/(g·24 h)。
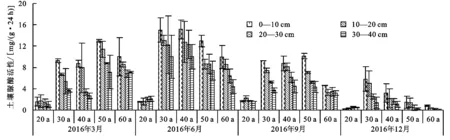
图2不同林龄土壤脲酶活性季节变化特征
随着土层深度的增加,土壤脲酶活性呈显著降低的趋势(图2)。相关性分析表明,随着土层深度的增加,脲酶活性呈极显著减少的变化趋势(p<0.01),从0—10 cm土层到30—40 cm土层,土壤脲活性降幅为46.6%。其4个土层的脲酶活性平均值分别为7.16,5.92,4.73,3.82 mg/(g·24 h)。
随着侧柏林龄的增加,土壤脲酶活性呈极显著增加后降低的趋势(p<0.01),其中20~30 a呈增加的趋势,0—40 cm土层的平均值变化范围是1.36~7.25 mg/(g·24h),30~60 a呈降低的趋势,其0—40 cm土层的平均值变化范围是4.88~7.25 mg/(g·24 h)。林龄和季节的交互作用显著影响了两种土壤酶活性的动态(表3)。

表3 林龄、土层深度和季节对土壤酶活性影响的主体间效应检验 (n=80)
2.3 蔗糖酶和脲酶与其他土壤因子的线性回归分析
为研究土壤蔗糖酶与脲酶的控制性影响因素,本文选取了土壤酶活性最高的、有代表性的6月进行了相关性分析(表4)和逐步回归分析(表5)。
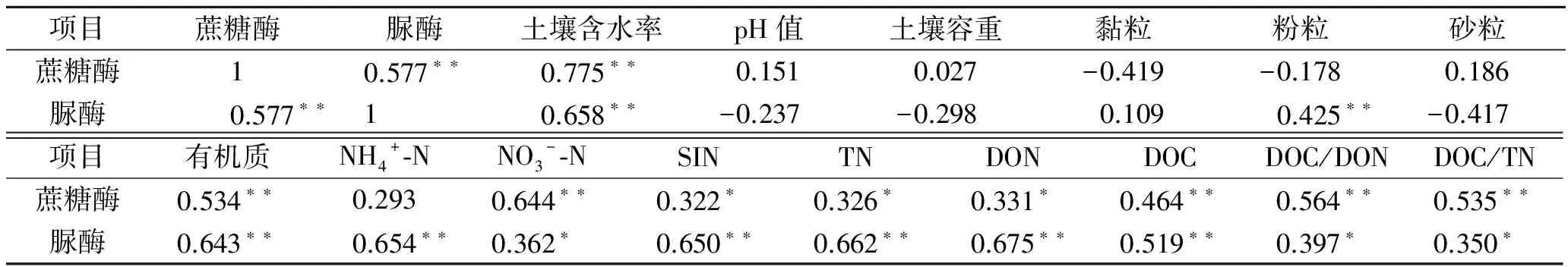
表4 土壤蔗糖酶和脲酶与其他土壤理化性质间的Pearson相关系数 (n=40)
注:**表示在0.01水平(双侧)上显著相关,*表示在0.05水平(双侧)上显著相关。

表5 土壤蔗糖酶和脲酶与其他土壤性质的相关性及多元回归分析模型
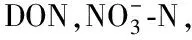
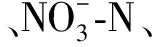
3 讨 论
土壤酶活性与生物元素循环密切相关,且对环境变化比较敏感[16]。本研究中,不同林龄侧柏人工林土壤蔗糖酶和脲酶均表现出明显的季节动态变化规律,土壤蔗糖酶活性呈夏季>秋季>春季>冬季,土壤脲酶的活性呈夏季>春季>秋季>冬季,两种土壤酶的活性均在夏季最高,冬季最低,这与诸多研究结果相一致[3,17],与孙鹏跃等[18]在对华北落叶松人工林土壤酶活性的研究结果不一致。造成这种现象的原因可能是:本研究所在地区属大陆性季风气候,具有夏季雨热同期、冬季寒冷干燥的特征,夏季植物生长旺盛,林木根系代谢加快,根系分泌物较多,土壤中的动物以及微生物活动频繁,从而促进了土壤酶活性的提高。冬季植物生长缓慢,微生物活动较少,土壤中有机质周转和矿化速率大大降低,降低了土壤蔗糖酶和脲酶活性。冯瑞芳等[19]通过模拟大气CO2浓度增加和温度升高对亚高山冷杉林土壤酶活性影响的研究中发现,在一个生长季节内,土壤转化酶和脲酶的活性高峰均出现在温度较高的夏季,且升温20℃的处理显著增加了土壤脲酶和转化酶的活性(p<0.05)。本研究中,相关性分析表明蔗糖酶和脲酶均与土壤含水率显著相关(p<0.05)(表4—5),这也进一步表明温度和水分两者之间的协同响应。但土壤蔗糖酶和脲酶活性的季节变化规律并不完全一致,主要是由两者的影响因素不同所致,土壤蔗糖酶受土壤含水率和土壤质地影响(表4—5),该研究区7—9月降雨量占全年降雨量的60%左右,较高的土壤含水率会促蔗糖酶活性的提高,并且秋季是产生枯落物的高峰季节,相应的归还到土壤中的枯落物也会增多,土壤中的微生物和动物的食物来源丰富,因此,相对夏季,虽然温度的降低一部分影响了他们的活跃性,但仍保持着较高的活性,进而土壤中的微生物和土壤动物会活动频繁,从而促进了酶活性的提高,因而土壤蔗糖酶活性秋季大于春季。土壤脲酶主要受土壤DON的控制(表5),春季土壤处于冻融期,土壤中DON和矿质N的释放量增加[20],植物生长所需氮素较少,而秋季植物根系仍从土壤中吸收较多的可利用性氮,易与土壤微生物形成氮素竞争的关系,这可能是造成土壤脲酶活性春季大于秋季的主要原因。
本研究中,随着土层深度的增加,酶活性呈递减的趋势,0—10 cm有机质土层土壤的蔗糖酶和脲酶活性均最高,这与诸多研究结果一致[3,17]。地表土壤枯落物补给来源丰富,土壤水热状况、透气性均好于深层土壤,动物和微生物活动性强,物质循环快,因此表层土壤酶活性最强。随着土层深度的增加,土壤容重增大,孔隙度减小,含水率降低(表2),且研究区土层较薄,深层土壤风化程度较低,土壤中的生物活动受到限制,故而土壤酶活性较低[21];另外,随着土层的增加,土壤中可利用性碳、氮及土壤养分均显著降低[13],侧柏根系也会吸收大量养分,而土壤蔗糖酶和脲酶活性均受土壤DOC,DON及SIN含量的影响(表4)。综合而言,在土壤剖面空间变化上,土壤酶活性更易于受土壤质地、容重、孔隙率及可利用碳、氮等的影响。
不同林龄主要通过影响林内小气候、凋落物归还与周转、细根产量及根系分泌物,从而间接影响土壤酶活性[22]。本研究中,土壤蔗糖酶活性在20~40 a呈现增加的趋势,40~60 a呈现降低的趋势。土壤脲酶活性随着林龄的增加总体呈显著增加后降低的趋势,在20~30 a迅速增加达到最大,30~40 a比较稳定,40~60 a缓慢降低。赵燕娜等[23]在研究毛乌素沙地7~32 a樟子松人工林时发现土壤蔗糖酶和脲酶活性均随林龄的增大而增大。张超等[14]在研究5~50 a人工刺槐林土壤酶活性时发现土壤蔗糖酶随林龄的增大而增大,土壤脲酶5~20 a趋于平稳的趋势,20~50 a随着林龄的增大而增大。牛小云等[11]在研究11~47 a日本落叶松人工林土壤酶活性时表明11 a或47 a林龄酶活性较高,而20 a或34 a年林龄较低,随林龄增加,土壤地力呈现衰退趋势,这可能是因为不同环境下土壤的水热状况、结构组成、植物生长状况不同等有关。本研究中30 a和40 a侧柏处于植物的壮年期,生长旺盛,林下枯落物归还多,细根生产量大,向土壤中输送的有机质较多,此时微生物在充足的养分条件下活性较高。随着林木老化,林木消耗增加归还降低,土壤地力衰退,且林分郁闭度增加,林下光照强度减弱,林内温度及土温降低,土壤微生物活性随之降低,有机质分解变慢,进而造成酶活性也相应降低。
4 结 论
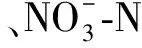
参考文献:
[1]Bengtson P, Bengtsson G. Rapid turnover of DOC in temperate forests accounts for increased CO2production at elevated temperatures[J]. Ecology Letters, 2007,10(9):783-790.
[2]Allison S D. Cheaters, diffusion and nutrients constrain decomposition by microbial enzymes in spatially structured environments[J]. Ecology Letters, 2005,8(6):626-635.
[3]陶宝先,张金池,愈元春,等.苏南丘陵地区森林土壤酶活性季节变化[J].生态环境学报, 2010, 19(10): 2349-2354.
[4]王艮梅,罗琳琳,郑聚锋.苏北不同代次和林龄杨树人工林土壤酶活性季节变化特征[J].南京林业大学学报:自然科学版,2014,38(4):45-50.
[5]张猛,张健.林地土壤微生物、酶活性研究进展[J].四川农业大学学报,2003,21(4):347-351.
[6]杨万勤,钟章成,陶建平,等.缙云山森林土壤酶活性与植物多样性的关系[J].林业科学,2001,37(4):124-128.
[7]和文祥,来航线,武永军,等.培肥对土壤酶活性影响的研究[J].浙江大学学报:农业与生命科学版,2001,27(3): 265-268.
[8]关松荫.土壤酶及其研究法[M]北京:农业出版社,1986.
[9]陈家林,裴丙,刘红恩,等.华北石质山区不同水土保持树种对土壤质量的影响[J].林业资源管理,2016(2):81-86,97.
[10]白小芳,徐福利,王渭玲.我国落叶松人工林地力衰退与施肥研究综述[J].世界林业研究,2016,29(1):75-79.
[11]牛小云,孙晓梅,陈东升,等.辽东山区不同林龄日本落叶松人工林土壤微生物、养分及酶活性[J].应用生态学报,2015,26(9):2663-2672.
[12]王家,赵阳阳,代潭,等. Cu, Cd污染对土壤脲酶活性的影响研究[J].环境科学与管理,2014,39(11):45-48.
[13]赵佳宝,杨喜田,徐星凯,等.马尾松—麻栎混交林土壤溶解性有机碳氮空间分布特征[J].水土保持学报,2016,30(3):213-219.
[14]张超,刘国彬,薛莛,等.黄土丘陵区不同林龄人工刺槐林土壤酶演变特征[J].林业科学,2010,46(12):23-29.
[15]田丽青,王风芹,付晨青,等.太行山南段刺槐林地土壤酶活性季节变化特征[J].河南农业大学学报,2015,49(5):634-640.
[16]刘捷豹,陈光水,郭剑芬,等.森林土壤酶对环境变化的响应研究进展[J].生态学报,2017,37(1):110-117.
[17]曹成有,陈家模,邵建飞,等.科尔沁沙地四种固沙植物群落土壤微生物生物量及酶活性的季节动态[J].生态学杂志,2011,30(2):227-233.
[18]孙鹏跃,徐福利,王渭玲,等.华北落叶松人工林地土壤养分与土壤酶的季节变化及关系[J].浙江农林大学学报,2016,33(6):944-952.
[19]冯瑞芳,杨万勤,张健,等.模拟大气CO2浓度和温度升高对亚高山冷杉(Abiesfaxoniana)林土壤酶活性的影响[J].生态学报,2007,27(10):4019-4026.
[20]徐星凯,段存涛,吴浩浩,等.冻结强度和冻结时间对高寒区温带森林土壤微生物量、可浸提的碳和氮含量及N2O和CO2排放量的影响[J]. 中国科学:地球科学, 2015,45(11):1698-1712.
[21]田超,孟平,张劲松,等.降雨对华北石质山地侧柏林土壤温湿度及水分运移的影响[J].林业科学研究,2015,28(3):365-373.
[22]葛晓改,肖文发,曾立雄,等.三峡库区不同林龄马尾松土壤养分与酶活性的关系[J].应用生态学报,2012,23(2):445-451.
[23]赵燕娜,廖超英,李晓明,等.毛乌素沙地不同林龄樟子松人工林土壤酶活性变化特征[J].西北林学院学报,2014,29(2):1-5.
