高寒沙区几种典型固沙植物细根生物量及周转速率比较
2018-04-11冯莉莉贾志清李清雪张友焱何凌仙子杨凯悦
冯莉莉,贾志清,刘 涛,李清雪,张友焱,石 坤,何凌仙子,杨凯悦
(1.河北工程大学 矿业与测绘工程学院,河北 邯郸 056038;2.中国林业科学研究院荒漠化研究所,北京 100091;3.青海共和荒漠生态系统定位观测研究站,青海 共和 813005;4.中国林业科学研究院 林业研究所,北京 100091;5.北京林业大学 水土保持学院,北京 100083)
植物根系是陆地生态系统重要的碳汇和养分库,细根周转过程是陆地生态系统地下部分碳氮循环的核心环节[1]。就根系不同部位而言,细根的周转对整个根系的贡献最大[2]。细根的更新数量会产生出5倍于地上部分凋落物的量[3]。从20世纪70年代开始,生态学家们开始研究细根的生物量、季节动态、生产力和周转[4],到80年代中期,通过采用钻土芯法、生长袋法、微根管法和碳氮平衡法等对根系寿命和周转开展大量研究[5-7]。这些研究揭示出不同生态系统细根生物量、寿命和周转的大致格局,并对细根从出生到死有了初步的认识[8]。有研究表明,小于2 mm的细根每年周转一次就可以消耗掉全球生态系统1/3的NPP[9]。以树木为例,整个根系的年周转速率为10%,而细根的年周转速率有56%,说明细根在根系碳周转与释放的过程中扮演着更为重要的角色[10]。就整个根系的年周转速率而言,不同的植被类型有所不同,草地比灌木要快,而灌木比乔木要快[6]。但是,不同地区植被的细根周转速率是否一致,不同物种细根的周转速率是否一致仍是一个需要探讨的问题[11]。无论在国内还是国外,细根研究的最大问题是结果的不确定性。一般细根周转研究主要有钻土芯法、生长袋法、微根管法等[12-14]。钻土芯法是研究细根生物量和周转最常用的方法,甚至在一些不同方法比较中,将钻土芯法估计结果作为其他方法的参考标准[15-16]。生长袋法可用于估计生态系统或林分细根生产量[17],其最主要缺点是生长环境的改变。如钻孔时挤压周围土壤,可影响根的生长,即使使用原土填充生长袋,但土壤团粒结构被改变或破坏,难以恢复到原状土的状态,土壤营养状况也可能被改变。细根在无根土壤与正常有根土壤中的生长也会有所差异[18-19]。微根管法可直接对细根长度和直径、细根的死亡、生命周期和分解进行快速、准确的计算,大大降低了过去图像处理的时间、人力和物力耗费。其主要缺点是不能测定单位面积的细根生物量和生产、细根化学组成及细根周转对土壤碳和养分循环的影响。微根管与土壤界面的微环境可能因安装不小心而改变,从而影响根系生长,如管与土空隙、黏土模糊管表面、管表划痕、漏光等。管与土界面可能会形成细根大量积累[17],界面的土壤紧实度、温度、湿度等的改变也会影响根系生长[20]。同时仅通过微根管拍摄的影像,难以区分不同植物种类的细根[21],尤其是在植物或树木种类多样的热带、亚热带天然林生态系统或人工混交林生态系统中。由于安放微根管对根的伤害,一般要1年后,根才能重新取得平衡[22-24],因此需要较长的观察周期。
青海共和盆地位于祁连山和昆仑山之间的青藏高原东北部。主要气候带属于由高寒地区干旱荒漠区向半干旱草原区的过渡地区,既是高寒荒漠生态系统环境变化的敏感地区,也是青海省荒漠化与沙化土地的典型代表区。与其他沙化地区相比,共和盆地地势较高,干旱寒冷,发生荒漠化和防治荒漠化的过程表现出独特性。目前,有关共和盆地的研究多集中在分析该地区发生荒漠化的原因[25-27]、沙质荒漠化过程植被群落特征的变化和对物种多样性的影响[28-29]、沙化土地治理技术[30-31]、人工植被水分利用策略[32-33]等方面,这些研究主要集中在地上部分,对于地下部分的研究还相对比较少。本研究采用钻土芯法,对青海省共和盆地高寒沙区流动沙丘上的沙蒿(Artemisiadesertorum)、柠条锦鸡儿(Caraganakorshinskii)、中间锦鸡儿(Caraganaintermedia)、沙蒿+中间锦鸡儿混交林以及丘间地上的沙柳(Salixpsammophila)、小穗柳(Salixmicrostachya)、乌柳(Salixcheilophila)、小叶杨(Populussimonii)、乌柳+小叶杨混交林的细根生物量及周转速率进行比较,从而筛选出适合该地区种植的优良固沙植物,为高寒沙区植被细根的养分循环、碳平衡等相关研究提供理论依据,对于揭示沙地人工林退化机理、维持措施和树种选择及搭配具有重要意义。
1 研究区概况
青海共和荒漠生态系统定位研究站位于青藏高原东北部的共和盆地沙珠玉地区,地域上属于高原高寒沙化土地类型区。研究数据取自于该生态站林场内,位于100°13′—100°16′E,36°13′—36°16′N。海拔2 871~3 870 m,年均气温2.4℃,年均降水量246.3 mm,年蒸发量1 716.7 mm,全年大风日数平均50.6 d,最多可达97 d,风向主要为西、西北风,年均风速2.7 m/s,最大风速可达40 m/s。青海共和盆地天然分布的植物种有冷蒿(Artemisiafrigida)、青海固沙草(Orinuskokonorica)、高寒草原以紫花针茅(Stipapurpurea)、阿尔泰针茅(Stipakrylovii)、短花针茅(Stipabreviflora)、狼毒(Stellerachamaejasme)、冰草(Agropyroncristatum)、毛刺锦鸡儿(Caraganatibetica)、披针叶黄华(Thermopsislanceolata)、猪毛菜(Salsolacollina)、沙蒿(Artemisiadesertorum)、甘草(Glycyrrhizauralensis)和赖草(Leymussecalinus)等植物种类。人工植被主要有沙蒿、柠条锦鸡儿、中间锦鸡儿、沙柳、小穗柳、乌柳、小叶杨、柽柳(TamarixchinensisLour.)、青杨(Populuscathayana)、枸杞(Lyciumchinense)、沙棘(Hippophaerhamnidea)等。
2 研究方法
2.1 采样设计
2015年6—8月期间在青海共和荒漠生态系统定位研究站林场内,选取流动沙丘上的沙蒿、柠条锦鸡儿、中间锦鸡儿、沙蒿+中间锦鸡儿混交林以及丘间地上的沙柳、小穗柳、乌柳、小叶杨、乌柳+小叶杨混交林9块样地,分别在9块样地中设置地形条件基本相同的20 m×20 m样方。对每个样方的植被进行植物形态学特性的测量,分别测定株高、冠幅并选择标准株进行取样,每株3个重复,按照不同半径、不同深度对细根进行取样,具体取样设计见图1。取到的根的样品装入自封袋,晒干后,挑出活/死细根(<2 mm),并用天平分别称重。
2.2 指标分析
对于多次重复测定的数据,异常数据常用的统计识别与剔除法有拉依达准则法、格拉布斯准则法、狄克逊准则法、肖维勒准则法、罗马诺夫斯基准则法。拉依达准则法简单,无需查表,用起来方便,测量次数较多或要求不高时用,当测量次数小于或等于10时,拉依达准则法失效。肖维勒准则是经典方法,改善了拉依达准则,过去应用较多,但它没有固定的概率意义,特别是测量数据n无穷大时,该准则失效。狄克逊准则法对数据中只存在一个异常数据时,效果良好,但当数据中异常数据的个数不止一个且出现在同侧时,该方法的检验效果不好,尤其同侧的异常数据很接近时效果更差,易遭受到屏蔽效应。罗马诺夫斯基准则法计算较为复杂。格拉布斯准则和狄克松准则给出了严格的结果,但同样存在狄克逊准则法的缺陷,朱宏[34]采用数据的中位数取代平均数,改进得到了更为稳健的处理方法,有效地消除了同侧异常数据的屏蔽效应。本研究则采用国际上常推荐采用的格拉布斯准则法。
利用极差法计算地下净初级生产力(BNPPMM):
BNPPMM=Bmax-Bmin
(1)
式中:Bmax,Bmin分别为整个生长季最大和最小生物量。BNPPMM为利用极差法获得的地下净初级生产力。
利用矩阵法计算地下净初级生产力BNPPDM:
BNPPDM=∑P
(2)
式中:P由活根生物量变化(ΔL)和死根生物量变化(ΔD)计算,计算方法见表1。BNPPDM代表利用矩阵法获得的地下净初级生产力。


图1 取样设计
注:Δ代表变化,L代表活根生物量,D代表死根生物量,P代表生物量。
根据获得的地下净初级生产力BNPP[g/(m2·a)],计算细根周转速率的公式见(3)。
(3)
式中:T为细根周转速率(a);B为生长季最大或者平均生物量(g/m2)。
3 结果与分析
3.1 沙丘上典型固沙植物生物量及其周转速率
采用格拉布斯准则法对采样数据进行筛选处理,处理后不同固沙植物在不同月份细根生物量如表2—6所示。沙丘上,不同固沙植物的生物量主要分布在0—40 cm的深度。在不同深度上,不同的固沙植物生物量之间差异明显(p<0.05)(图2)。

表2 中间锦鸡儿活/死根生物量 g/m2

表3 柠条锦鸡儿活/死根生物量 g/m2

表4 沙蒿活/死根生物量 g/m2
利用不同固沙植物在生长季不同月份的细根生物量数据得到不同固沙植物的细根周转速率见表7。利用不同的方法得到的不同固沙植物的细根周转速率变化趋势基本一致。沙丘上,不同固沙植物细根周转速率的相对顺序为:沙蒿混交林>沙蒿>柠条锦鸡儿>中间锦鸡儿混交林>中间锦鸡儿(图3)。

表5 中间锦鸡儿混交林活/死根生物量 g/m2

表6 沙蒿混交林活/死根生物量 g/m2

注:图中小写字母表示同一土壤深度不同固沙植物细根生物量之间差异显著(p<0.05),下图同。

图2 沙丘上不同固沙植物细根生物量比较

图3沙丘上不同固沙植物细根周转速率比较
3.2 丘间地上典型固沙植物生物量及其周转速率
采用格拉布斯准则法对采样数据进行筛选处理,处理后不同固沙植物在不同月份细根生物量如表8—13所示。丘间地上,不同固沙植物的生物量主要分布在0—40 cm。在不同深度上,不同的固沙植物生物量之间差异明显(p<0.05)(图4)。

表8 乌柳活/死根生物量 g/m2

表9 沙柳活/死根生物量 g/m2

表10 小穗柳活/死根生物量 g/m2

表11 小叶杨活/死根生物量 g/m2
利用不同固沙植物在生长季不同月份的细根生物量数据得到不同固沙植物的细根周转速率如表14所示。利用不同的方法得到的不同固沙植物的细根周转速率变化趋势基本一致。丘间地上,不同固沙植物细根周转速率的相对顺序为:沙柳>小穗柳>乌柳混交林>小叶杨混交林>乌柳>小叶杨(图5)。

表12 乌柳混交林活/死根生物量 g/m2
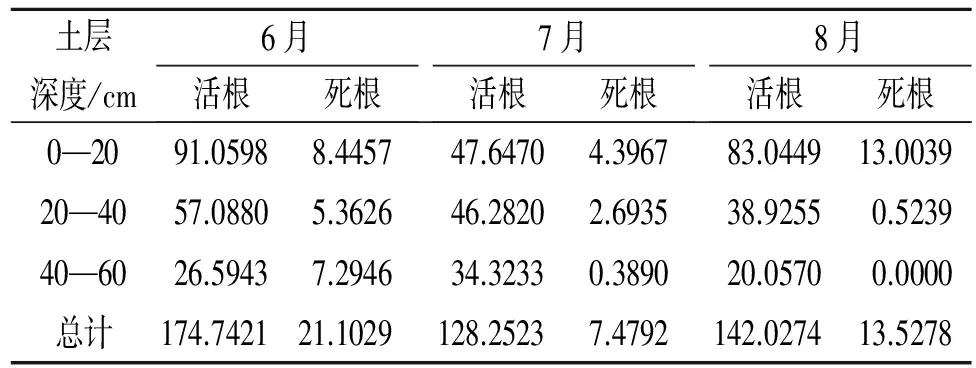
表13 小叶杨混交林活/死根生物量 g/m2


图4 丘间地上不同固沙植物细根生物量比较

图5丘间地上不同固沙植物细根周转速率比较
4 结 论
(1) 无论是流动沙丘还是丘间地上,不同固沙植物的细根生物量主要分布在0—40 cm的深度。
(2) 在沙丘上,不同固沙植物细根周转速率的相对顺序为:沙蒿混交林>沙蒿>柠条锦鸡儿>中间锦鸡儿混交林>中间锦鸡儿。
(3) 在丘间地上,不同固沙植物细根周转速率的相对顺序为:沙柳>小穗柳>乌柳混交林>小叶杨混交林>乌柳>小叶杨。
通过分析可知,共和盆地典型固沙植物的细根主要分布于表层土壤,这与当地的自然生态环境息息相关。大风吹蚀会造成根系裸露,干旱少雨会导致土壤水分主要集中在地表[35]。青海省共和盆地处于高寒沙区,当地多风、多沙,为了适应当地多风以及干旱少雨的自然生态环境,根系多分布在表层土壤,地表根系发达,以便于供给植物所需要的水分和养分。在采样的过程中我们也会发现,根系主要是侧向生长[36]。通常情况下,不同物种间细根周转速率的相对顺序为草>灌木>树[6]。本文选取的固沙植物沙蒿属于半灌木,所以周转速率比较快。无论是在沙丘还是丘间地上,混交林的细根周转速率都要大于纯林。在沙丘上,低矮的沙蒿相对于高大的柠条锦鸡儿或者中间锦鸡儿具有较高的细根周转速率。在丘间地上,沙柳的细根周转速率明显大于其他几种固沙植物,而高大的乔木小叶杨具有较低的细根周转速率。研究结果为探讨不同固沙植物细根在碳循环和养分循环中的作用功能研究奠定基础。同样,在高寒沙区植被恢复过程中,需要注意不同固沙植物之间的树种选择和搭配问题,从结果来看混交林更加有利于该地区的植被恢复。有研究表明该地区沙柳的固土能力较强,小穗柳的适应性较强[36]。结合本文的结果,在沙丘上种植沙蒿+中间锦鸡儿混交林,在丘间地上种植沙柳以及小穗柳更加有利于该地区的植被演替、更新以及植被恢复。
参考文献:
[1]吴伊波,车荣晓,马双,等.高寒草甸植被细根生产和周转的比较研究[J].生态学报,2014,34(13):3529-3537.
[2]陈曦,张乃莉,周晓梅,等.细根分解研究进展及存在问题[J].吉林师范大学学报:自然科学版,2012(2):36-40.
[3]Aber J D, Melillo J M, Nadelhoffer K J, et al. Fine root turnover in forest ecosystems in relation to quantity and from of N availability:a comparison of two methods[J]. Oecologia, 1985,66(3):317-321.
[4]Shaver G R, Billings W D. Relationships among root branch order, carbon, and nitrogen in four temperate species[J]. Oecologia, 1975,111(3):302-308.
[5]Vogt K A, Grier C C, Vogt D J. Production, turnover and nutritional dynamics of aboveground and belowground detritus of world forest[J]. Advances in Ecological Research, 1986,15(15):303-377.
[6]Gill R A, Jackson R B. Global patterns of root turnover for terrestrial ecosystems[J]. New Phytologist, 2000,147(1):13-31.
[7]Majdi H, Pregitzer K, Morén A S, et al. Measuring fine root turnover in forest ecosystems[J]. Plant and Soil, 2005,276(1/2):1-8.
[8]Hendrick R L, Pregitzer K S. Patterns of fine root mortality in two sugar maple forests[J]. Nature, 1993,361(6407):59-61.
[9]Jackson R B, Mooney H A, Schulze E D. A global budget for fine root biomass, surface area, and nutrient contents[J]. Proceedings of the National Academy of Sciences of the United States of America, 1997,94(14):7362-7366.
[10]Gaudinski J B, Trumbore S E, Davidson E A. The age of fine-root carbon in three forests of the eastern United States measured by radiocarbon[J]. Oecologia, 2001,129(3):420-429.
[11]Trumbore S E, Gaudinski J B. The secret lives of roots[J]. Science, 2003,302(5649):1344-1345.
[12]Tingey D T, Phillips D L, Johnson M G. Optimizing minirhizotron sample frequency for an evergreen and deciduous tree species[J]. New Phytologist, 2003,157(1):155-161.
[13]Ostonen I, Lõhmus K, Pajuste K. Fine root biomass, production and its proportion of NPP in a fertile middle-aged Norway spruce forest: comparison of soil core and ingrowth core methods[J]. Forest Ecology and Management, 2005,212(1):264-277.
[14]Xiao C W, Sang W G, Wang R Z. Fine root dynamics and turnover rate in an Asia white birch forest of Donglingshan Mountain, China[J]. Forest Ecology and Management, 2008,255(3):765-773.
[15]Böhm W. Maduakor H and Taylor H M. Comparison of five methods for characterizing soybean rooting density and development[J]. Agronomy Journal,1977,69(3):415-419.
[16]Samson B K, Sinclair T R. Soil core and minirhizotron comparison for the determination of root length density[J]. Plant and Soil, 1994,161(2):225-232.
[17]Vogt K A, Vogt D J, Bloomfield J. Analysis of some direct and indirect methods fox estimating root biomass and production of forests at an ecosystem level[J]. Plant and Soil, 1998,200:71-89.
[18]Friend A L, Eide M R, Hinckley T M. Nitrogen stress alters root proliferation in Douglas-fir seedlings[J]. Canadian Journal of Forest Research, 1990,20(9):1524-1529.
[19]Steele S J, Gower S T, Vogel J G, et al. Root mass, net primary production and turnover in aspen, jack pine and black spruce forests in Saskatchewan and Manitoba, Canada [J]. Tree Physiology, 1997,17(8/9):577-587.
[20]Van Rees K C J. Soil temperature effects from minirhizotron lighting systems[J]. Plant and Soil, 1998,200(1):113-118.
[21]Hendrick R L, Pregitzer K S. Applications of minirhizotrons to understand root function in forests and othernatural ecosystems[J]. Plant and Soil, 1996,185(2):293-304.
[22]Hendrick R L, Pregitzer K S. The dynamics of fine root, length, biomass, and nitrogen content in two northern hardwood ecosystems[J]. Can. J. for. Res, 1993,23(12):2507-2520.
[23]Rytter R M, Hansson A C. Seasonal amount, growth and depth distribution of fine roots in an irrigated and fertilized,SalixviminalisL. plantation[J]. Biomass and Bioenergy, 1996,11(2/3):129-137.
[24]Burke M K, Raynal D J. Fine root growth phenology, production, and turnover in a northern hardwood forest ecosystems[J]. Plant and Soil, 1994,162(1):135-146.
[25]杨世琦,高旺盛,隋鹏,等.共和盆地土地沙漠化因素定量研究[J].生态学报,2005,25(12):3181-3187.
[26]张东杰.共和盆地近50年来草地荒漠化驱动因素定量研究[J].水土保持研究,2010,17(4):166-169.
[27]封建民,李晓华.近15年来共和盆地土地沙质荒漠化动态变化及原因分析[J].水土保持研究,2010,17(5):129-133.
[28]魏占雄.高寒沙区生态恢复对植物物种多样性的影响[J].草业与畜牧,2009(7):36-51.
[29]魏婷婷.共和盆地沙质荒漠化过程植被群落特征变化[J].生态环境学报,2011,20(12):1788-1793.
[30]张永秀.青海共和盆地高寒流动沙丘快速治理技术[J].青海大学学报:自然科学版,2009,27(4):56-64.
[31]韩晓玲.共和盆地沙化土地现状及治理途径初探[J].防护林科技,2010(1):106-108.
[32]Jia Z Q, Zhu Y J, Liu L Y. Different water use strategies of juvenile and adult Caragana intermedia plantations in the Gonghe Basin, Tibet Plateau[J]. Plos One, 2012,7(9):e45902.
[33]刘丽颖,贾志清,朱雅娟,等.高寒沙地不同林龄中间锦鸡儿的水分利用策略[J].干旱区资源与环境,2012,26(5):119-125.
[34]朱宏.正态格拉布斯统计量的近似分布[J].电子科技大学学报,1990,19(3):279-283.
[35]张琳琳.长期大风对霸王根系分布的影响[D].乌鲁木齐:新疆师范大学,2014.
[36]石坤,贾志清,张洪江,等.青海共和盆地典型固沙植物根系分布特征[J].中国水土保持科学,2016(6):78-85.
