高F值寡肽对小鼠肠道菌群影响探究
2018-04-11何松泉王春利王志高张鹰炯罗红宇
何松泉,王春利,王志高,张 飞,张鹰炯,罗红宇
(1.浙江省海产品健康危害因素关键技术研究重点实验室,浙江舟山 316022;2.浙江炯炜海洋生物科技有限公司,浙江舟山 316000)
近年来,随着生命科学技术的发展,越来越多的研究证明人体的健康不仅与自身的基因有关,还与其肠道中微生物有着重要联系。人体肠道菌群的编码基因组被看作人体的第二基因组,人体自身基因的表达与肠道微生物相互协调、和谐一致,共同影响着人体的营养摄入、代谢和免疫的调控。到目前为止,众多对肠道菌群的研究证明,肠道菌群可通过影响宿主的代谢显型、营养物质的产生和吸收[1]以及改善和调整机体的免疫功能[2]进而影响机体的健康状况。肠道内菌群的动态平衡若是打破则会影响胃肠道内的功能紊乱,进而造成肠道疾病,例如炎性肠病、肠应激综合征、过敏性反应等[3]。因此,肠道菌群的结构与组成可精确的反映出机体的健康状况。
高F值寡肽是由2~9个氨基酸残基所组成且支链氨基酸与芳香族氨基酸比值大于20的一种混合肽。由于其独特的氨基酸构成、生理调节功能和易消化吸收等诸多优点,近年来逐渐被健康品与医药研究领域所关注,但多集中在高F值寡肽的制备及体外活性的研究,而其在消化吸收过程中对肠道菌群结构的影响未见报道。
本文采用实验室自制的鱿鱼碎肉高F值寡肽液对小鼠进行灌胃试验并采用Anosim、OTU Venn、OTU PCA、PCoA和LDA EffectSize(LEfSe)等分析其肠道菌群的构成变化,探讨高F值寡肽液调控小鼠肠道菌群结构的变化规律,寻找其显著干预的关键菌属,为高F值寡肽应用于肠道菌群调节提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
鱿鱼碎肉,购于浙江海力生生物科技有限公司;胃蛋白酶(3 000 U/g)、风味蛋白酶(21 000 U/g)购于南宁庞博生物科技有限公司;氢氧化钠(AR)、盐酸(AR)购于国药集团化学试剂有限公司;活性炭(325目)购于江苏森森炭业有限公司;DNA快速提取试剂盒,购于杭州荣邦生物科技有限公司;清洁级昆明种小鼠,购于浙江省实验动物中心。
1.2 主要仪器与设备
日立CR21G型高速离心机(日本日立公司);HHS型恒温水浴锅(上海迅播实业有限公司);SHA-B型恒温水浴振荡器(金坛市岸头良友实验仪器厂);PHB-4型便携式pH计(上海仪电分析仪器有限公司);LGJ-10型真空冷冻干燥机(河南兄弟仪器设备有限公司);TM-767型专业冰沙料理机(中山市海盘电器有限公司)。
1.3 试验方法
1.3.1 实验样品的制备
称取60 g鱿鱼碎肉并加入300 mL蒸馏水均质10 min,使用盐酸调节pH为2,加入6 g胃蛋白酶(21 000 U/g),45°C恒温水浴酶解5 h后,灭酶,冷却至室温后使用氢氧化钠溶液调pH为7,加入风味酶2.84 g(3 000 U/g),置于55°C恒温水浴酶解3 h,然后使用盐酸调节pH为2,加入10 g活性炭粉末吸附3 h,离心取上清液后进行旋蒸、脱盐,即得高F值寡肽酶解液(简称寡肽液)。寡肽液采用截留分子量为2 000 Da的膜进行超滤,即得到超滤液。最后,将寡肽液和超滤液进行冷冻干燥制得粉末,待用。
1.3.2 动物分组
挑选重量为18~22 g小鼠30只,按每组10只随机分为3组,即:寡肽液组、超滤组和对照组,3组每天定时于18:00进行灌胃。寡肽液组每天灌胃0.1 mL的寡肽溶液(寡肽浓度为2 g/100 mL),超滤组每天灌胃0.1 mL的超滤溶液(超滤液浓度为2 g/100 mL),对照组使用0.1 mL的生理盐水进行灌胃:试验期间各组小鼠均自由进食常规饲料,期间不限饮水。
1.3.3 DNA的提取
灌胃结束后,处死小鼠并收集肠道内容物,按照试剂盒说明进行各组肠道菌群DNA的提取,并使用Nano Drop 2000进行上机检测,各组选用5个DNA浓度高的样品送检。
1.3.4 数据分析方法
1.3.4.1 Anosim分析
Anosim分析为分参数检验,用来检测组与组之间的差异是否显著大于组内差异,从而可以判断分组是否成功,其检测标准为R值,若R大于0,则说明不同分组之间的差异大于组内差异,可以说明分组合理,若R值小于0,则说明组内差异大于组间差异,分组不合理。其中P值越小组间差异越大,P小于0.05则代表统计具有显著性。
1.3.4.2 OTU Venn图分析
通过测序获得大量的reads[4-5],其中reads为高通量测序中一个反应获得的测序序列,一般把序列相似度大于97%的reads归于同一个OTU,而序列相似度小于97%的reads划分为新的OTU,将OUT代表序列与相应的微生物数据库比对,得到每个组中物种信息,其中每个OTU通常可视为一个微生物物种。根据每一种OTU在每个样品中的丰度,计算出组间共有或特有的OTU[6]。
1.3.4.3 OTU PCA分析
PCA为约束性排序的一种,通过分析不同样品OUT组成可以反映样品的差异和距离,将多维数据的差异反映在二次坐标轴图上,坐标轴取对样品间OUT方差贡献最大的前2个特征值。括号中百分比为对样品间OUT差异的解释比例,右侧以及下方的图为样品在二维散点图第一主坐标和第二主坐标的位置。OUT PCA分析可初步反映出同组与不同组间的样品分散和聚集的分布情况,从而可评判相同条件样品组成是否存在相似性[7]。同一颜色代表同组样品,样品的距离代表OTU的相似程度,样品的距离越近则说明样品微生物群落组成越相似。
1.3.4.4 PCoA分析
PCoA分析通过UniFrac算法计算样品两两间的距离,然后利用距离矩阵展示样品距离的差异,从而展示各个样品间差异的大小[8-10]如果2个样品间距离越近,则说明2个样品的物种组成更加相似,右侧和下方的图代表这些点在第一主坐标和第二主坐标的位置,其中图4中横坐标表示第一主坐标,括号中的百分比表示第一主坐标对样品差异的贡献率;横坐标表示第二主坐标,括号中的百分比表示第二主坐标对样品差异的贡献率。
1.3.4.5 LDA EffectSize(LEfSe)分析
LEfSe分析可用来估算每个菌种丰度对差异贡献度的大小,从而找出每组中的优势菌种及每组间具有显著性差异的菌群,LEfSe分析更加强调生物相关性[11]。图5中表示对照组(蓝色)、寡肽组(红色)和超滤组(绿色)的差异,圈由外到内分别表示门、纲、目、科、属的物种分类水平。进化树中的蓝色、红色和绿色节点表示其所在组中起到重要作用的微生物,而黄色则代表3组中无明显差异的菌种。
2 实验结果
2.1 Anosim分析
本实验样品的Anosim分析如图1所示。其中Between代表组间样品的两两差异,ABC 3组的长短代表ABC 3组的组内样品两两差异的波动范围。R值为0.733>0,而p值为0.001,远小于0.05,说明此3组间具有显著性差异且组间差异远大于组内差异,分组是成功的,3组小鼠肠道菌群组成具有明显差异,且组间差异大于组内差异。王恩辉等[12]使用Anosim在对山东半岛北岸不同生境潮间带浮游细菌多样性研究时发现,烟台养马岛与黄河三角洲菌群具有明显差异,当进一步分析时发现,烟台养马岛海以变形菌门为优势菌种,而黄河三角洲中拟杆菌们为优势菌种,与Anosim分析相符。
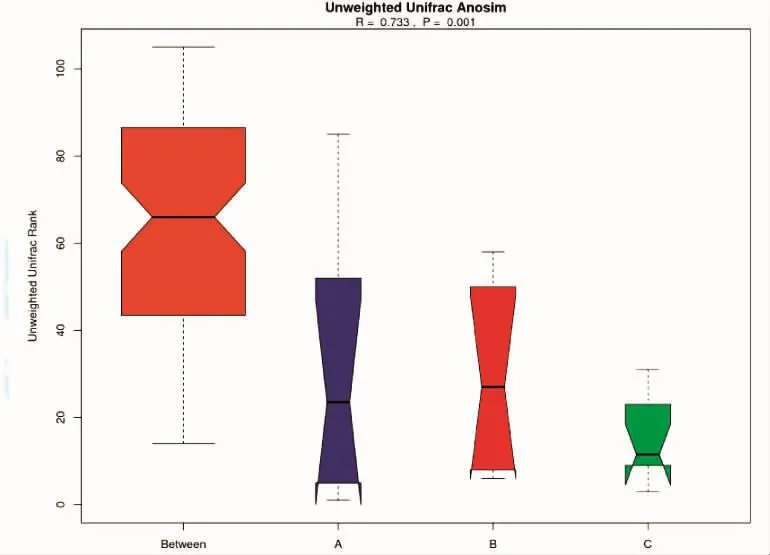
图1 Anosim分析Fig.1 Anosimanalysis
2.2 OTU Venn图分析
15个样品按照上述分类原则共得到552个OTU,OUT的代表序列混合聚类结果如图2所示,其中A组(对照组)有 498个 OTU,27个 OUT 为特有;B 组(寡肽液组)478个OUT,16个OTU为特有;C组 (超滤组)494个OTU,15个OTU为特有,3组共享OTU为423个,占总OTU中的76.6%。
2.3 OTU PCA分析
从图3可以看出,对照组(蓝色)多集中于图中左下方区域,超滤组(橘红色)多集中于左上方区域而寡肽液组(绿色)多集中于右侧中间部分。这说明各组之间OTU组成存在具有明显差异。王婷婷[13]在对皮下注射DMH所构建的大鼠结肠癌进行研究时发现,结肠癌前期与后期OTU PCA具有显著性差异,进一步对大鼠从门、纲、目、科、属水平上分析时发在各水平上菌种含量具有显著性差异,同时晚期结肠癌大鼠较早期结肠癌大鼠OTU数量显著减少,这些结论都与OTU PCA分析相符。
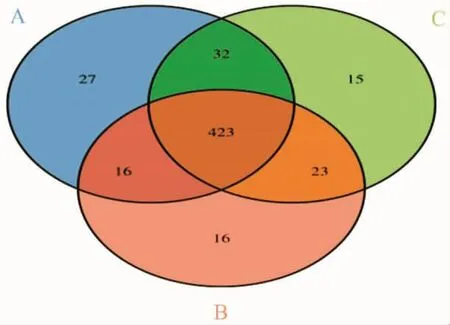
图2 OUT flower分析Fig.2 The OUT flower analysis
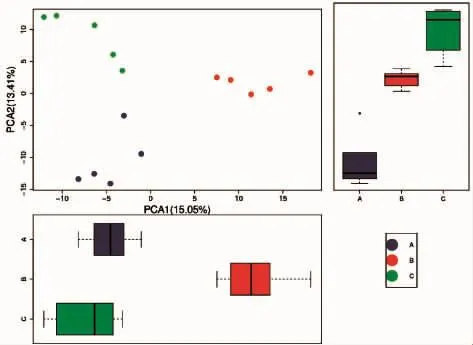
图3 OUT PCA分析Fig.3 The OUT PCA analysis
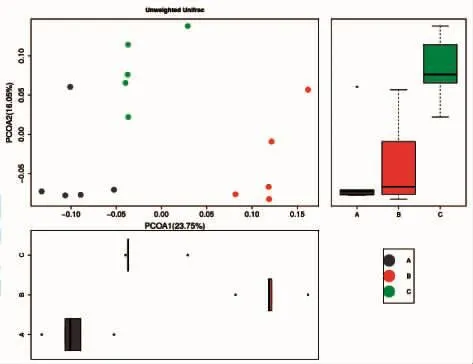
图4 PCOA分析Fig.4 PCOA analysis
2.4 PCoA分析
从图4可以看出,超滤组(绿色)主要分布在中上方,对照组(蓝色)主要分布于左下方,而寡肽液组(橘红色)主要分布于右下方。图中的对照组有1个样品靠近超滤组样品,根据分析可能因为个体差异所导致的偶然误差。根据此图分析说明3组总体上同组样品的物种组成较为相似,而不同组间样品的物种组成具有明显差异。ECKBURG,et al[11]于2005年对中国人与美国人肠道菌群分析时使用析时发现,中国人与美国人在基于weighted UniFrac算法所绘制的PCOA图中发现,2组具有显著差异,在之后对肠道菌群组成研究后发现无论在门、纲、目、科、属水平上都具有显著性差异,同时也证实了PCOA图中2组具有显著性差异这一结论。
2.5 LDA EffectSize(LEfSe)分析
菌种对肠道菌群的影响主要体现在科、属水平上,本文主要探讨各组所特有于科、属上的菌种。在寡肽液组(橘红色)中起重要作用的菌群为蛭弧菌目,其中包括毛螺菌科与蛭弧菌科;超滤组(绿色)起重要作用的菌群为肠球菌科与嗜冷杆菌属;对照组(蓝色)中起重要作用的菌群为拟杆菌门中的黄杆菌目、黄杆菌门与拟杆菌科,β-变形菌纲中的黄杆菌科和产碱杆菌科。潘明芳[14]使用LEfSe法研究植物乳杆菌对预防幽门螺杆菌小鼠肠道定值时发现,空白组小鼠受幽门螺杆菌感染后22类变形菌门如盐单胞菌科、巴斯德菌科丰度增加,而使用植物乳杆菌小鼠受幽门螺杆菌感染后只有6类菌群丰度增加,这说明植物乳杆菌具有预防幽门螺杆菌感染的功效,同时通过对小鼠体重测量、HE染色及炎症因子变化情况都印证了上述结论。
3 结论
肠道菌群与人体同时进化,为宿主提供自身所不具备的生化代谢通路与酶,为抵御外界因素所导致的机体异常构建了重要屏障。肠道菌群影响宿主的能量代谢、免疫系统和炎症反应,与人体代谢密切相关[15]。肠道微生物在与宿主相互作用时,宿主本身的基因型、年龄和饮食结构和营养的摄入等环境因素,会从不同方面影响着肠道菌群的形成及多样性组成[16-18]。高F值寡肽的生物消化吸收率会受到肠道菌群的影响,反过来其也会改变生物体内肠道菌群的构成。

图5 LEfSe分析Fig.5 LEfSe analysis
通过16S RNA技术对3组小鼠灌胃后肠道菌群的构成研究,我们发现3组小鼠肠道菌群在门水平上的组成无明显差异,以拟杆菌门和硬壁菌门为主,但在纲、目、科水平上3组小鼠肠道菌群构造具有明显差异。其中,寡肽液组起重要作用的菌群为蛭弧菌科与毛螺菌科,超滤组起重要作用的菌群为肠球菌科与嗜冷杆菌属,而对照组中起重要作用的菌群为拟杆菌门的黄杆菌目和拟杆菌科、β-变形菌纲的黄杆菌科与产碱杆菌科。
近年来,国内外学者对蛭弧菌类群的研究取得了一些突破。LEBBA,et al[19]在研究中发现,健康人肠道内的蛭弧菌数量众多,维持着人体肠道的微生态平衡;而在患有炎症性肠炎、麦胶性肠病和囊性纤维化病人的肠道菌群中明显减少或消失,进而导致肠道微生态的紊乱;LOOZEN,et al[20]在对蛭弧菌HD100研究中发现,其可以通过抑制口腔中革兰氏阴性菌从而预防牙周病,这些研究揭示了蛭弧菌在调控人类口腔、肠道菌群的微生物类群和维持正常菌群结构具有重要贡献。毛螺旋菌科是机体的有益菌,其参与碳水化合物在肠道中发酵分解为短链脂肪酸过程,而短链脂肪酸为肠道上皮细胞的重要营养来源[21]。屎肠球菌为肠球菌中代表菌属,陈曦等[22]在对断奶猪仔的肠道菌群变化中发现,屎肠球菌的加入可以改变其他细菌的丰度,进而改善肠道菌群结构,导致猪仔的腹泻率明显下降,这说明屎肠球菌对于肠道菌群的调控具有积极影响。杨红玲等[23]发现嗜冷杆菌SE6在体外抑菌性的研究试验中表明,其对人体有害的金黄色葡萄球菌和副溶血弧菌具有抑制作用。由此,可推断嗜冷杆菌的存在可以减少机体受到金黄色葡萄球菌和副溶血弧菌的侵害。拟杆菌是一类参与糖类代谢、胆汁酸和类固醇代谢等诸多功能的菌群,但通过对黄杆菌目和拟杆菌科的研究发现其代表菌群为条件致病菌,如脆弱拟杆菌为拟杆菌属的代表菌种,脆弱拟杆菌为动物肠道正常存在的菌种,当宿主的某部位受到损伤时,会导致局部感染或经血液循环进入身体其他器官从而引起化脓性感染和急慢性腹泻等[24]。黄杆菌属包括短黄杆菌、水生黄杆菌、脑膜炎脓毒性黄杆菌等[25-26],在一定治病条件下可导致脑膜炎和白血病等感染。而粪产碱杆菌为产碱杆菌科中重要的一种,其一般寄生于动物肠道中,是一种条件致病菌[27]。
通过对3组灌胃小鼠肠道菌群研究后发现,使用寡肽液以及超滤液灌胃后小鼠的肠道菌群出现了大量对机体有益的益生菌,而对照组肠道内菌群多为条件致病菌,实验说明高F值寡肽对于改善小鼠肠道菌群具有积极作用。
