猪蓝耳病抗体监测及其规律的应用
2018-04-10张成东曲玖燕彭先启郭海岩崔松涛
张成东 曲玖燕 彭先启 郭海岩 崔松涛
(河南牧翔动物药业有限公司,河南郑州 450000)
日常监测是预防和控制流行性疫病的重要基础[1],是养殖户评估免疫程序合理性、选择疫苗种类、掌握猪群健康状态的重要手段。检测数据可从侧面反映猪场的管理水平高低。蓝耳病(PRRS)实验室检测方法主要包括抗原检测和抗体检测。抗原检测包括聚合酶链式反应(PCR)和实时荧光定量PCR(Real-time PCR);抗体检测包括免疫荧光试验(IFA)、免疫过氧化物酶单层分析法(IPMA)、中和试验(SVN)和酶联免疫吸附试验(ELISA)。
由于蓝耳病病毒(PRRSV)核衣壳蛋白(N蛋白)不能诱导产生病毒中和抗体,以N蛋白作为主要包被抗原的PRRSV抗体间接ELISA方法检测结果,并不能反映机体的免疫状态,故其不适合用于对疫苗免疫效果的评价[2]。尽管N蛋白抗体ELISA检测结果不能真实反映猪的保护力,但是根据PRRS ELISA抗体S/P值的离散度结合多次抗体检测,足以准确判断猪群蓝耳病的感染状态及变化趋势[3]。与其他检测方法相比,ELISA检测方法具有操作简便、易于标准化、快速敏感等优点,非常适合大规模流行病学调查和疫病监测。
ELISA抗体检测试剂盒作为市场上最早应用的商品化检测工具,是监测PRRS的重要手段。目前,使用ELISA抗体检测法追踪并系统研究发病猪群在前驱期、明显期及转归期等不同疾病发展阶段PRRS抗体S/P值变化规律的文献较少。为更全面揭示实际生产中PRRS的抗体变化规律,本研究跟踪监测了某规模化猪场蓝耳病发病前驱期、明显期及转归期的抗体S/P值。结合以上数据,笔者针对PRRSS/P值的变化规律与猪场生产成绩的关系进行了探讨研究,期望能够为我国PRRS的监测和防控提供基础数据和科学依据。
1 材料与方法
1.1 血样采集及处理
试验地点:新乡德丰养殖场,存栏600头母猪。采血时间:分别于猪群发病的前驱期(2016年10月)、明显期(2016年11月)和转归期(2017年3月)随机选择母猪并逐头采集前腔静脉血5m L,待全血凝固析出血清后,4000 r/m in离心10 m in,取血清置于1.5 m L EP管,4℃环境存放备用。
1.2 ELISA抗体检测
RT-PCR法检测PRRS发病初期母猪血清抗原,NSP2基因引物[4]F:5’-TGGGCGACAATGTCCCTAAC-3’,R:5’-GCTGAGTATTTTGGGCGTGTG-3’,由生工生物工程(上海)股份有限公司合成。PRRS抗体检测使用进口IDEXX试剂盒。PRRS抗体的有无(阳性/阴性)根据样品的S/P值判定。如果S/P值<0.4,样品应判定为PRRS抗体阴性;如果S/P值≥0.4,样品应判定为PRRS抗体阳性。
2 结果与分析
2.1 猪场首次血清PRRS抗原检测结果
用RT-PCR的方法扩增NSP2基因,目的基因片段涵盖变异株的基因缺失片段,用于区分经典株和变异株[5]。经典株扩增基因片段508 bp,变异株扩增基因片段418 bp。RT-PCR琼脂糖凝胶电泳显示,24份血样中(共25份血样,其中1份数据丢失)共检测出7份抗原阳性,阳性率29.2%,说明母猪群存在PRRSV野毒感染,且猪群中存在经典株和变异株(见图1),存在病毒血症的猪群中,变异毒株所占比重较大(占87.5%)。该猪群免疫过经典株疫苗,未免疫过高致病株疫苗,表明本次发病由PRRSV变异株引起,可能与猪场8月份引进的150头后备母猪有关。
2.2 猪场连续3次血清PRRS抗体监测结果
首次抗体检测结果:母猪采样25头,S/P值介于0.29~3.22;第二次抗体检测结果:母猪采样16头,S/P值介于0.18~4.01;第三次抗体检测结果:母猪采样28头,S/P值介于0.45~2.39。从母猪群抗体检测结果可以明显看出,猪群发病前驱期、明显期和转归期PRRS抗体S/P值先升高再下降;其中猪场PRRS稳定以后,抗体S/P值低于2.5(见图2)。
2.3 猪场连续3次血清PRRS抗体S/P值分布
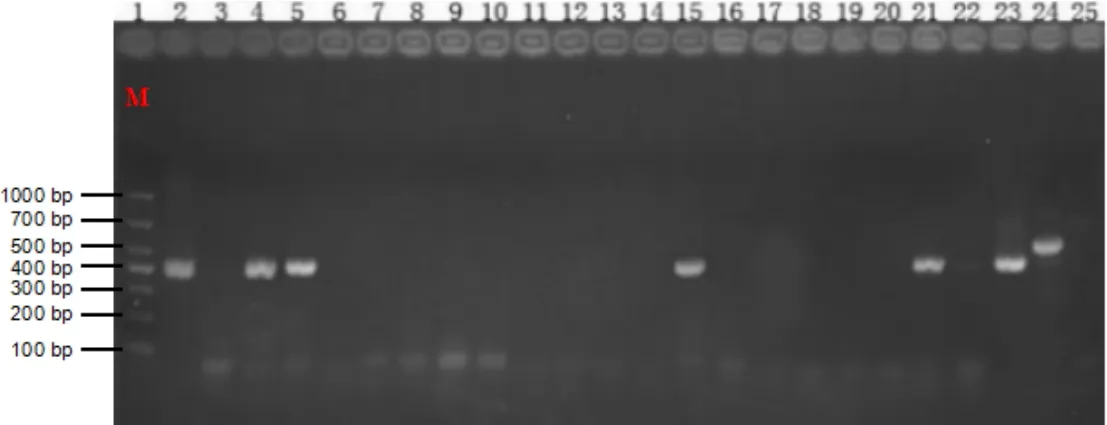
图1 RT-PCR琼脂糖凝胶电泳结果
IDEXX PRRS抗体检测S/P<0.4,PRRS为阴性;S/P≥0.4,PRRS为阳性;当猪群S/P≥2.5的比例大于5%,离散度大于40%时,猪群蓝耳病风险较高。抗体检测结果数值分布显示(见表1),发病初期S/P值平均值为1.40,离散度为63.08%,S/P值≥2.5的比例为16%;发病高峰期S/P值平均值为1.91,离散度为63%,S/P值≥2.5的比例为31.25%;康复期S/P值平均值为0.84,离散度为45.82%,S/P值≥2.5的比例为0。由3次抗体检测S/P值的分布可知,发病初期和高峰期PRRS S/P平均值会逐渐增大,且离散度较高;当96.1%的母猪群PRRS抗体S/P值介于0.4~2.0时,猪群恢复正常。
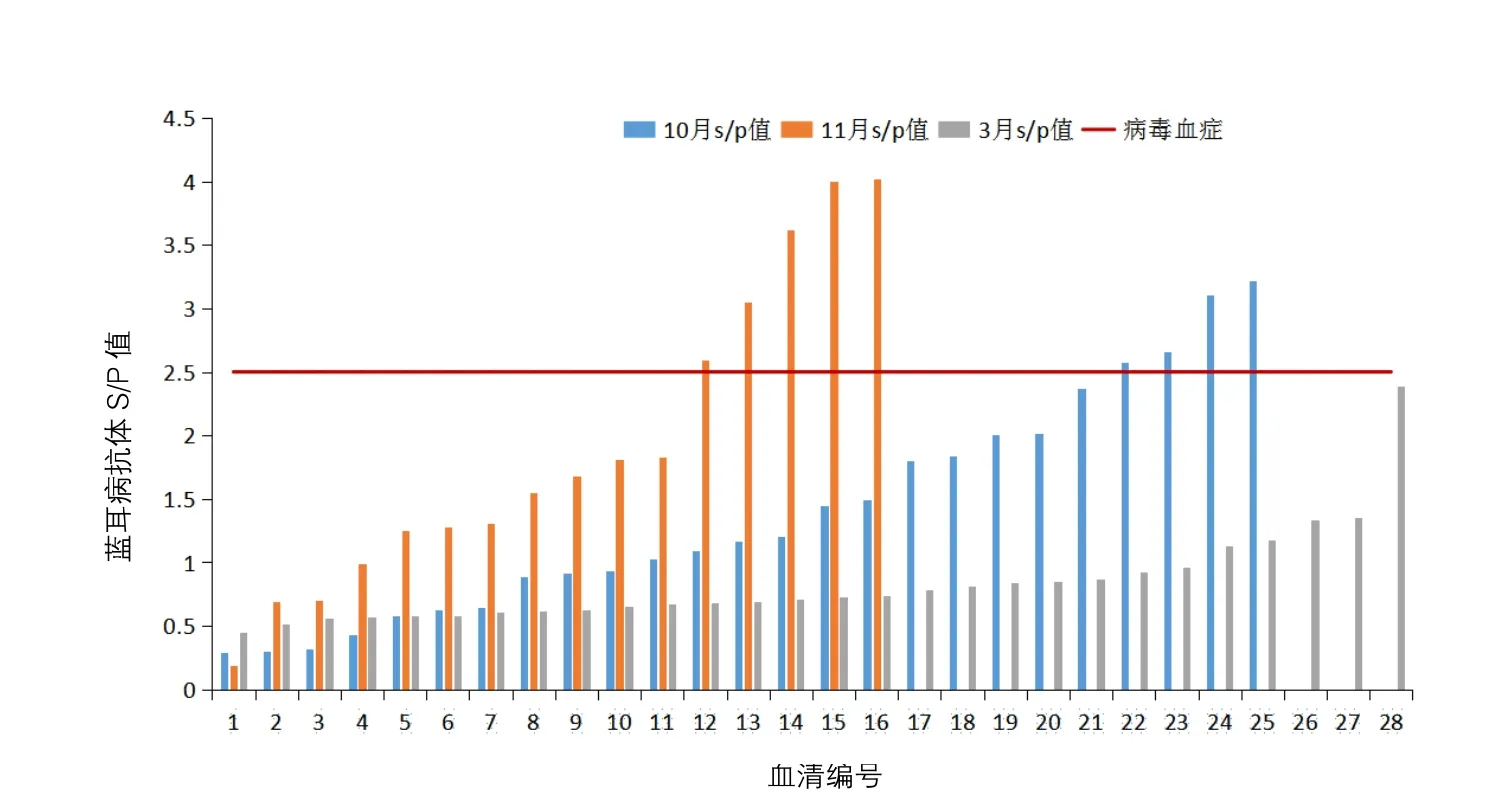
图2 母猪连续3次PRRS抗体检测结果
2.4 猪场生产情况
从2015年10月份到2016年2月份,猪场育肥猪群相对稳定(月死淘率在0.7%以内),母猪群和保育猪群一直很不稳定。如表2所示,母猪分娩率从2015年10月份到2016年1月份一直低于猪场的正常生产水平,2月份以后分娩率指标恢复正常;保育猪从2015年10月份到2016年1月份死淘率居高不下,一直遭受副猪嗜血杆菌和脑炎性链球菌的困扰,严重时仔猪在哺乳期间就出现整窝发热、喘气的现象,直至3月份以后生产恢复正常。
3 讨论
3.1 PRRSV ELISA抗体消长规律
由于猪场之间是否免疫PRRS疫苗及接种疫苗毒株情况不一,且PRRSV ELISA检测的抗体是非保护性中和抗体,故在通过抗体检测数据判断猪场PRRS感染状态时,不能仅仅依靠单次检测结果[6](并非S/P值越高越稳定),而要结合抗体检测结果、猪场的疫苗免疫情况和各阶段猪群的生产情况。判断一个猪场PRRS的变化趋势,需要定期监测抗体,并综合分析。
通过发病前驱期、明显期、转归期3次抗体S/P值的变化可知,在猪场PRRS由稳定到不稳定的过程中,抗体S/P平均值会逐渐增大,且抗体离散度较大[7];而在猪场PRRS由不稳定到稳定的过程中,抗体S/P平均值会逐渐变小,且抗体离散度较小。结合猪场的实际生产情况,当绝大多数(96.2%)猪群S/P值介于0.4~2.0时,且离散度低于45%时,母猪分娩率达到85%以上,保育猪成活率达到96%以上,猪群蓝耳病处于阳性稳定状态。
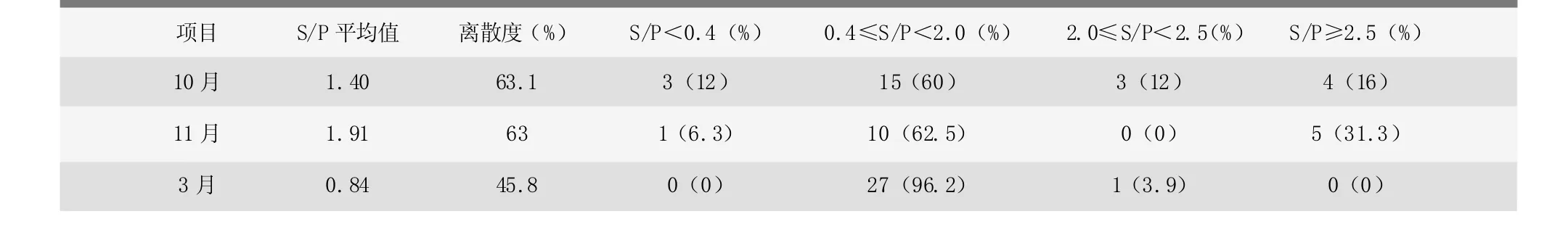
表1 母猪连续3次抗体水平检测结果分析
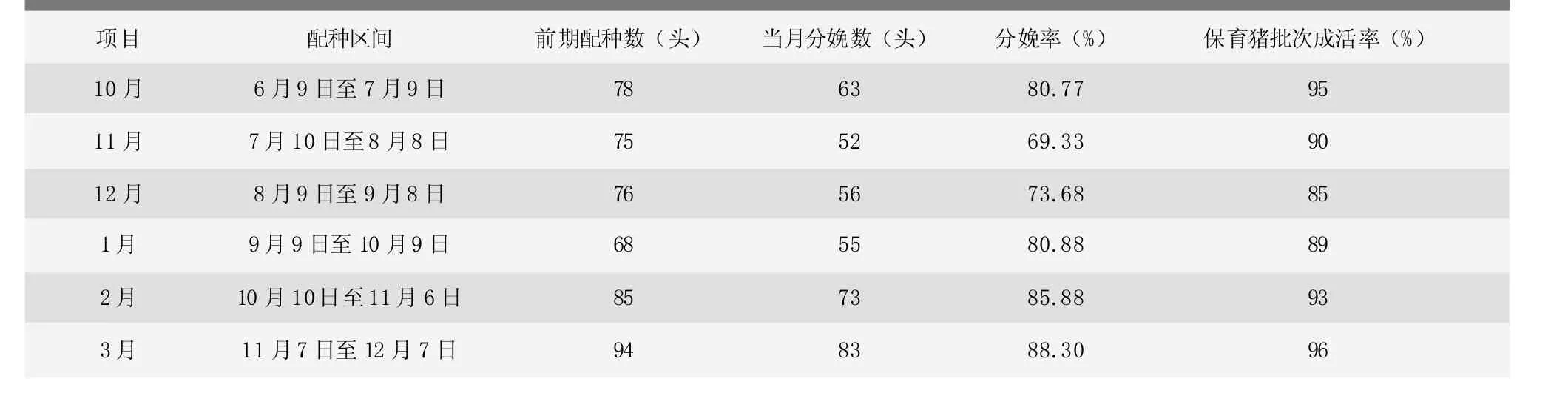
表2 猪场2015年10月至2016年3月母猪分娩率和保育猪成活率
3.2 PRRS抗体监测及其规律的应用
在中国普遍“蓝”的大环境下[8-10],中小规模养殖场应该努力做到PRRS阳性稳定状态。定期检测各阶段猪群的PRRS抗体,有助于掌握PRRS在各阶段猪群的循环情况,监控整个猪场PRRS的变化趋势,便于及时做出决策(淘汰、药物控制或者疫苗免疫)。及时淘汰S/P值高于2.5且生产成绩很差的母猪及8胎以上的母猪,保持合理的种猪胎次结构;在引进后备种猪时,了解后备猪群的PRRS感染状态,做好疫苗驯化或者淘汰母猪驯化[11],有助于种猪群维持PRRS阳性稳定状态。对于保育和育肥猪群PRRS阶段性发病问题,可以在猪群发病前1个月做经典株弱毒苗的免疫,有利于维持猪群PRRS阳性稳定,减少损失;对于PRRS阳性猪群,减少应激,定期投喂大环内酯类抗生素[12-14],有助于维持猪群良好的生产状态。
[1]杨汉春.中国养猪行业主要疫病监测预防 [J].兽医导刊,2016(21):19-20.
[2]Nelson EA,Christopher-Hennings J,Benfield DA.Serum imm une responses to the p roteins of porcine rep roductive and resp iratory synd rome(PRRS)virus[J].Journal o f Veterinary Diagnostic Investigation,1994,6(4):410-415.
[3]周庆华.规模猪场猪繁殖与呼吸障碍综合征血清学抗体监测研究[D].长沙:湖南农业大学,2010.
[4]LiB,Fang L,Guo X,et al.Ep idem iology and evolutionary charac teristicso f theporc inerep roductiveandresp iratory synd rom e virus in China between 2006 and 2010[J].Journal of ClinicalMicrobio logy,2011,49(9):3175.
[5]Fang Y,Kim D Y,Ropp S,et a l.Heterogeneity in Nsp2 of European-like porcine rep roductive and resp iratory synd rome viruses iso lated in the United States[J].Virus Research,2004,100(2):229-235.
[6]康桦华.规模化种猪场猪蓝耳病和猪瘟抗体变化规律研究及在健康流程管理中的应用[D].广州:华南农业大学,2016.
[7]吴静波,黄健强,南文金,等.粤北地区规模化猪场蓝耳病抗体水平及其与病毒血症关系的初步研究[J].广东农业科学,2016,43(8):143-150.
[8]侯丽丽,赵铁柱,遇秀玲,等.高致病性猪繁殖与呼吸综合征病毒分子流行病学调查[J].中国兽医学报,2009,29(6):677-682.
[9]郭振华,陈鑫鑫,李睿,等.中国猪繁殖与呼吸综合征病毒流行历史及现状[J].畜牧兽医学报,2018,49(1):1-9.
[10]安同庆.我国类NADC30猪蓝耳病的流行现状 [J].中国猪业,2017,12(11):24-25.
[11]Laura Batista.后备猪驯化在猪蓝耳病防控中的作用[J].曲向阳,译.猪业科学,2017,34(4):34-35.
[12]曲向阳,李喜焕,姚火春.替米考星防控蓝耳病及相关细菌性肺炎的研究进展[J].养猪,2012(2):84-87.
[13]王玉,付宝明,常靖,等.替米考星对猪蓝耳病防控的研究进展[J].中国猪业,2017,12(10):53-55.
[14]朱利俊,张锦国,田继承,等.替米考星对初产母猪蓝耳病的效果观察[J].畜牧兽医科学(电子版),2017(9):4-5.
