银杏叶提取物对体外混合培养大鼠视网膜神经细胞保护作用有效浓度的研究
2018-04-10李强王红义段俊国
李强 王红义 段俊国
近年来,大量的临床及实验研究报道了单味中药或其提取物具有视功能保护作用,在治疗效果和不良反应等方面较西药更具综合优势。其中,银杏叶提取成分(Ginkgo biloba Extract,GBE )用于视神经保护的研究引起了人们极大的兴趣。本实验通过建立体外混合培养大鼠视网膜神经细胞模型,采用MTT比色法,进行了银杏叶提物对保护作用有效浓度的筛选,为下一步在离子通道水平研究其保护作用提供实验依据。
1 材料和方法
1.1 材料
1.1.1动物
SD乳鼠(1日龄),由成都中医药大学实验动物中心提供(生产合格证:川实动管质第99~11号),2只,雌雄不拘,质量约5g~7g,母乳喂养。饲养条件保持在室温18℃~24℃,相对湿度50%~70%,空气流通。自然光线照明,12小时明-暗交替光照,昼夜循环。
SD乳大鼠的纳入标准为:①选择同窝乳鼠;②皮肤无咬痕、溃疡等损伤。
1.1.2仪器设备
Ti-U倒置相差显微镜(美国Nikon);MDF- 382E型超低温冰箱(日本SANYO);BT125D电子天平(德国Sartorius);Phenix型普通光学显微镜(江西凤凰光学集团有限公司);Milli-Q型去离子水系统(美国Millipore);Megafuge1.0R型离心机(美国KendroHeraeus); FORMA3110型二氧化碳培养箱(美国Thermo);25cm2培养瓶(美国COSTAR);XB-K-25型血球计数板(浙江玉环五金光学仪器厂);PB-10型精密PH计(德国Sartorius);35mm培养皿(美国COSTAR)体式显微镜(日本Nikon);DP-12型显微数码照相系统(日本OLYMPUS);ZHJH-C1209B型超净工作台(上海智城分析仪器制造有限公司); 96孔培养板(美国COSTAR);针芯式滤器(ф0.22um)(美国Millipore);200目筛网(上海元象器械厂)等。
1.1.3试剂
Neurobasal Medium(美国Invitrogen Corporation),Trypsin(美国Invitrogen Corporation),Poly-D-lysine hydrobromide(美国SIGMA Corporation),Fetal Bovine Serum(美国Invitrogen Corporation),DMEM(High Glucose)(美国Invitrogen Corporation), HEPES(美国SIGMA Corporation),B27(美国Invitrogen Corporation), New Born Calf Serum(美国Invitrogen Corporation),PBS(美国Invitrogen Corporation),Hank's Balanced Salt Solution(美国Invitrogen Corporation), Penicillin-Streptomycin(美国SIGMA Corporation),Laminin(美国SIGMA Corporation),L-Glutamine(美国Invitrogen Corporation),银杏叶提取物(GBE,由上海信谊百路达药业有限公司提供),脑源性神经营养因子(BDNF,美国Peprotech Corporation),二甲基亚砜(DMSO,美国SIGMA Corporation),噻唑兰(MTT,美国SIGMA Corporation)等。
1.2 方法
1.2.1体外混合培养大鼠视网膜神经细胞模型的建立
大鼠视网膜神经细胞体外培养:借鉴Kitano S等[1-4]和其他实验室的方法,并加以改进。
1.2.1.1培养器皿的铺板
以0.1mg/ml多聚赖氨酸(Poly-D-lysine hydrobromide,PBS缓冲液稀释)37℃包被96孔板、2cm×2cm盖玻片、25cm2培养瓶、直径35mm培养皿及直径100mm培养皿,要完全覆盖整个皿底。室温包被2小时后,回收多聚赖氨酸;用PBS液漂洗3次,在通风橱内干燥,待用。再以4ug/ml层粘连蛋白(laminin,PBS液稀释)包被,也要完全覆盖整个皿底。37℃过夜备用。
1.2.1.2大鼠视网膜神经细胞的培养
将出生1天SD乳鼠2只浸在75%酒精中30s,注意全身浸湿,但注意头部要适时晾干。用大剪刀迅速剪取头部,置空的皿中稍晾干残余酒精。左手夹持头部,右手用直剪剪开眼裂周围组织,暴露眼球。用弯剪弯镊夹取眼球,放入已冰浴的且加有Penicillin-Streptomycin的 Hank's Balanced Salt Solution液中,体式显微镜下钝性分离视网膜,用venus 剪剪碎组织,收集并转移到离心管中,待组织沉降3min,吸除上层液体。用终浓度为0.125% Trypsin在孵育箱中消化15分钟,其间摇两次。然后取出,加含10%FBS的DMEM培养液,以终止酶解。吹打数次。用220目网眼无菌钢网滤过,1000r/min离心3分钟。去上清液,加10%FBS的DMEM培养液,小心用吸管反复吹打,使细胞分散均匀,制成细胞悬液,尽量避免气泡产生。计数,调整细胞密度至1×106/ml加入96孔板和预先置入2cm×2cm盖玻片的培养皿中,37℃培养箱培养。24h后用维持培养(97.5% Neurobasal Medium、2% B27、0.5% 200mM/L L-Glutamine)换液1次。2天后开始用维持培养基。并观察其生长状态及形态学变化。
1.2.2银杏叶提取物对体外混合培养大鼠视网膜神经细胞保护作用有效浓度的研究
1.2.2.1体外混合培养大鼠视网膜神经细胞保护作有效浓度的筛选
采用MTT法(噻唑兰比色法)测定银杏叶提取物对体外混合培养的视网膜神经细胞的保护作用。MTT法,又称MTT比色法,是一种检测细胞存活和生长的方法。其检测原理为活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为水不溶性的蓝紫色结晶甲瓒(Formazan)并沉积在细胞中,而死细胞无此功能。二甲基亚砜(DMSO)能溶解细胞中的甲瓒,用酶联免疫检测仪在490nm波长处测定其光吸收值,可间接反映活细胞数量。在一定细胞数范围内,MTT结晶形成的量与细胞数成正比。
MTT法实验步骤:(1)取出生1天的SD乳鼠2只,制备成视网膜神经细胞悬液,调整细胞密度至1×105/ml加入预先包被Poly-D-lysine的96孔板。37℃、5%二氧化碳孵箱内培养。(2)48小时(细胞已贴壁)后,无血清培养液洗涤3次。随机分组进行实验,共分9个组:0.01μg/ml GBE组,0.1μg/ml GBE组,1μg/ml GBE组,10μg/ml GBE组,100μg/ml GBE组,500μg/ml GBE组,1000μg/ml GBE组,50ng/ml BDNF组,空白对照组(control组),每组10孔,每孔加入各100ul浓度梯度的药物、阳性对照药物(50ng/ml BDNF)、培养液(空白对照),37℃孵箱培养,并在倒置显微镜下观察。(3)48小时后,加入100ul MTT(5mg/ml,即0.5%MTT),继续37℃孵箱培养,并在倒置显微镜下观察。(4)4小时后终止培养,小心吸去孔内培养液。(5)每孔加入150ul二甲基亚砜,置摇床上低速振荡5min,使结晶物充分溶解。在酶联免疫检测仪490nm处测量各孔的OD值,并在倒置显微镜下观察(注:设置调零孔2个)。
1.2.2.2银杏叶提取物对混合培养大鼠视网膜神经细胞存活率的测定
根据OD值计算细胞存活率。细胞存活率=(试验组OD值-空白组OD值)/空白组OD值×100%
1.3 统计方法
数据结果采用SPSS 13.0统计软件进行统计学分析,多组间比较用单因素方差分析,多组间两两比较用q检验(LSD法)。
2 结果
2.1 体外混合培养大鼠视网膜神经细胞模型的建立
2.1.1大鼠视网膜神经细胞的生长状况
相差显微镜下观察,细胞于培养的3~4小时开始贴壁,贴壁后的细胞呈圆形,胞体中部较暗,光晕明显。24~48小时细胞开始伸出粗细长短不等的突起。细胞呈多边形,大多数细胞折光强,有聚集生长的现象;72小时后突起增多,并伸长。培养一周后,胞体折光降低。培养2~3周后存活细胞逐渐减少。见图1~图10。
2.1.2大鼠视网膜神经节细胞的形态学变化

图1细胞于培养的4小时开始贴壁,贴壁后的细胞呈圆形,胞体中部较暗,光晕明显(×200)图2培养24h,细胞开始伸出粗细长短不等的突起,有聚集生长的现象(×200)图3培养2d,细胞呈多边形,突起渐长,大多数细胞质折光强,有聚集生长的现象(×200)图4培养4d,细胞开始突起增多,并伸长;有聚集生长的现象(×200)图5培养6d后,突起增多,并伸长,形成网状(×200)图6培养8d后,胞体折光降低(×200)图7培养10d后,胞体折光降低开始有细胞凋亡(×200)图8培养12d后,凋亡细胞增加(×200)图9培养14d后凋亡细胞进一步增加(×200)图10培养16d后,存活细胞较少(×200)
2.2 不同浓度银杏叶提取物对体外混合培养大鼠视网膜神经细胞存活的影响
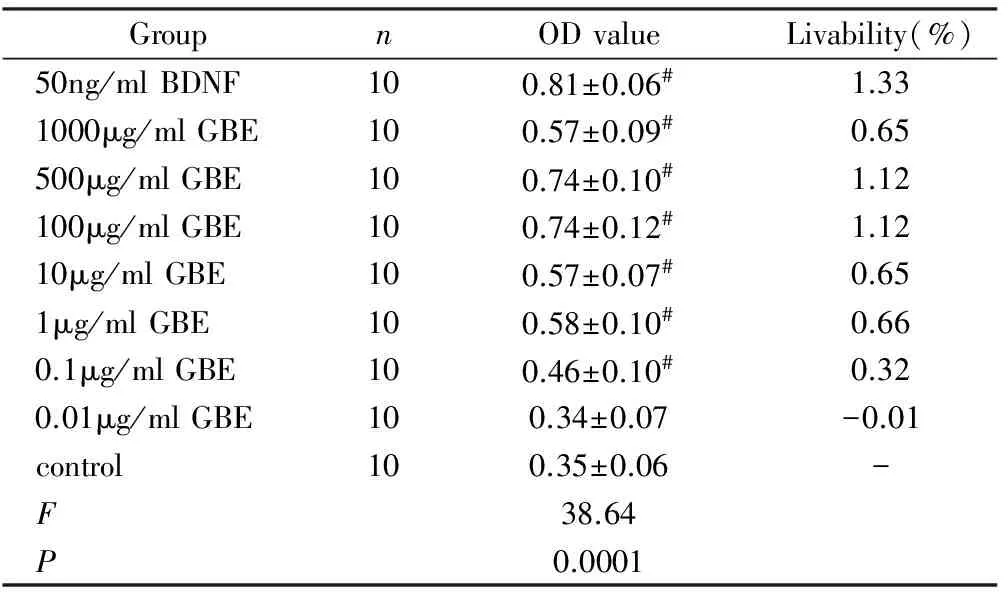
MTT比色法对RNCs保护作用有效浓度进行筛选,1000μg/mlGBE、500μg/mlGBE、100μg/mlGBE、10μg/mlGBE、1μg/mlGBE、0.1μg/mlGBE、0.01μg/mlGBE,50ng/mlBDNF各组与空白对照组的OD值分别为(0.57 ±0.09,0.74 ±0.10,0.74 ±0.12,0.57 ±0.07,0.58 ±0.10,0.46 ±0.10,0.34 ±0.07,0.81 ±0.06,0.35 ±0.06)。其中1000μg/mlGBE、500μg/mlGBE、100μg/mlGBE、10μg/mlGBE、1μg/mlGBE、0.1μg/ml GBE和50ng/ml BDNF各组与空白对照组比较,差别有统计学意义(P<0.01)。见表1,图11。
2.3 MTT结晶沉积于视网膜神经细胞的观察
银杏叶提取物对体外混合培养大鼠视网膜神经细胞保护作用有效浓度为0.1μg/ml、1μg/ml、10μg/ml、100μg/ml、500μg/ml、1000μg/ml。
3 讨论
银杏叶系银杏科银杏属植物银杏叶,是我国的特产植物。含黄酮类(约20余种)、萜类、酚类,有益微量元素和17种氨基酸等有效成分。国外较早生产的银杏叶提取物商品名为金纳多,其有效成份是24%的总黄酮和6%的萜类(银杏内酯和银杏苦内酯)。黄酮类化合物具有抗氧化作用而内酯类具有抗血小板激活因子的作用[5]。自20世纪60年代以来各国学者对银杏的成份及其药理作用做了大量的工作。最初,人们用它治疗冠心病、高血压、心绞痛、动脉硬化等循环障碍疾病及脑功能减退、老年性痴呆、老年性记忆减退、衰老等与脑内兴奋毒性损伤相关的神经系统疾病[6, 7],得了一定的效果[8, 9]。后来经过大量实验和临床证明,GBE还有显著的视功能保护作用。目前GBE成为倍受关注的药品[10]。
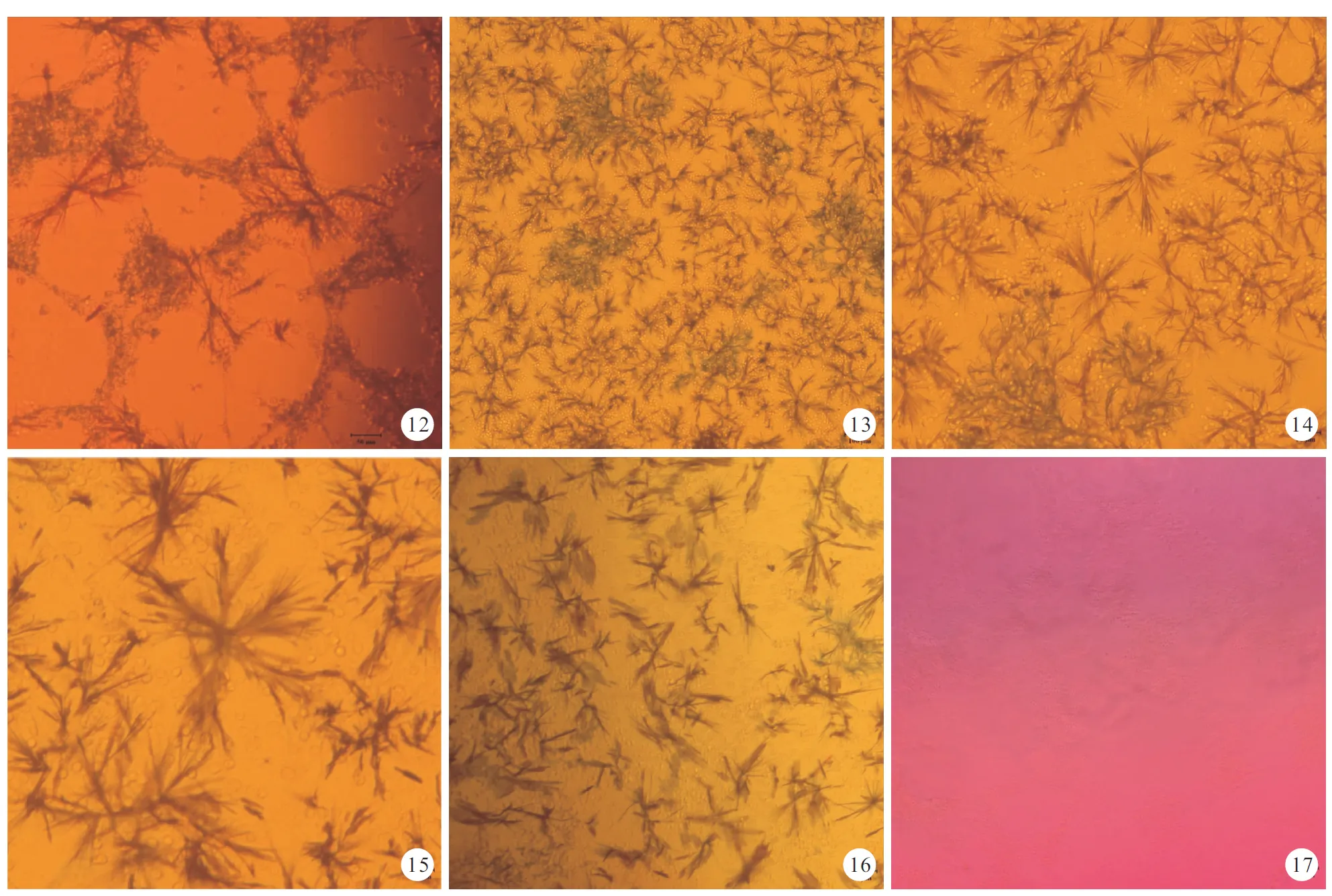
图121000μg/mlGBE组加入MTT后生成不溶于水的蓝紫色结晶甲瓒并沉积在细胞中(×200)图13100μg/mlGBE组加入MTT后生成不溶于水的蓝紫色结晶甲瓒并沉积在细胞中(×100)图1410μg/mlGBE组加入MTT后生成不溶于水的蓝紫色结晶甲瓒并沉积在细胞中(×200)图1550ng/mlBDNF组加入MTT后生成不溶于水的蓝紫色结晶甲瓒并沉积在细胞中(×400)图16空白组加入MTT后,生成不溶于水的蓝紫色结晶甲瓒并沉积在细胞中(×200)图17二甲基亚砜溶解细胞中的甲瓒(×100)
表1不同浓度银杏叶提取物对体外混合培养大鼠视网膜神经细胞存活的影响
GroupnODvalueLivability(%)50ng/mlBDNF100.81±0.06#1.331000μg/mlGBE100.57±0.09#0.65500μg/mlGBE100.74±0.10#1.12100μg/mlGBE100.74±0.12#1.1210μg/mlGBE100.57±0.07#0.651μg/mlGBE100.58±0.10#0.660.1μg/mlGBE100.46±0.10#0.320.01μg/mlGBE100.34±0.07-0.01control100.35±0.06-F38.64P0.0001
#P<0.01 vs control group(One-way ANOVA,LSD-t test)

图11不同浓度银杏叶提取物对体外混合培养大鼠视网膜神经细胞存活的影响
检验细胞存活的方法很多,如同位素释放法、乳酸脱氢酶释放改良法、三磷酸腺苷发光法等。MTT比色法由于简单经济、快速、无放射性污染,其检测结果与同位素掺入法有良好的一致性[11],故可有效地应用于视神经保护药物筛选等研究。
MTT比色分析法是由Mosmann[12]在1983年首创,MTT法测定细胞活性的机制[13]:MTT(噻唑兰)是一种淡黄色可溶性化合物,是显示线粒体中的琥珀酸脱氢酶的试剂,MTT能被活的细胞吸收,通过组织化学反应可产生不溶性的针状蓝色结晶甲瓒沉积于细胞内或细胞周围[14],而形成甲瓒的量与细胞存活数量成正比[15],由于死亡的细胞并不着色,也不生成结晶,故判断细胞活性的指标是蓝色产物的多少。细胞存活且生长活跃,蓝色产物就多。在定量细胞活性上有应用价值。
我们首先应用MTT方法,筛选了银杏叶提取物对体外混合培养大鼠视网膜神经细胞保护作用的有效浓度,结果显示:1000μg/ml GBE、500μg/ml GBE、100μg/ml GBE、10μg/ml GBE、1μg/ml GBE、0.1μg/ml GBE和50ng/mlBDNF各组与空白对照组比较,差别有统计学意义(P<0.01)。各浓度的银杏叶提取物均有不同程度的保护大鼠视网膜神经细胞的作用,且随浓度的增加保护作用加强。这样就为我们在细胞离子通道水平研究其保护作用提供了依据。
我们在实验中体会到用MTT法检测银杏叶提取物对体外混合培养大鼠视网膜神经细胞保护作用,有以下优点:①快速、灵敏、操作简单;②低成本、人为误差较小;③重复性好、实验条件易控制;④可批量实验;⑤没有放射性污染。
[1]Kitano S, Morgan J, Caprioli J. Hypoxic and excitotoxic damage to cultured rat retinal ganglion cells[J]. Exp Eye Res,1996,63(1):105-112.
[2]Caprioli J, Kitano S, Morgan JE. Hyperthermia and hypoxia increase tolerance of retinal ganglion cells to anoxia and excitotoxicity[J]. Invest Ophthalmol Vis Sci,1996,37(12):2376-2381.
[3]Nichol KA, Schulz MW, Bennett MR. Nitric oxide-mediated death of cultured neonatal retinal ganglion cells: neuroprotective properties of glutamate and chondroitin sulfate proteoglycan[J]. Brain Res,1995,697(1-2):1-16.
[4]Guenther E, Schmid S, Grantyn R, et al. In vitro identification of retinal ganglion cells in culture without the need of dye labeling[J]. J Neurosci Methods, 1994,51(2): 177-181.
[5]Drago F, Floriddia ML, Cro M, et al. Pharmacokinetics and bioavailability of a Ginkgo biloba extract[J]. J Ocul Pharmacol Ther,2002,18(2):197-202.
[6]Ahlemeyer B, Krieglstein J. Neuroprotective effects of Ginkgo biloba extract[J]. Cell Mol Life Sci,2003,60(9):1779-1792.
[7]Chandrasekaran K, Mehrabian Z, Spinnewyn B, et al. Neuroprotective effects of bilobalide, a component of Ginkgo biloba extract (EGb 761) in global brain ischemia and in excitotoxicity-induced neuronal death[J]. Pharmacopsychiatry,2003,36 Suppl 1:S89-S94.
[8]Ahlemeyer B, Krieglstein J. Pharmacological studies supporting the therapeutic use of Ginkgo biloba extract for Alzheimer's disease[J]. Pharmacopsychiatry,2003,36 Suppl 1:S8-S14.
[9]Beal MF. Bioenergetic approaches for neuroprotection in Parkinson's disease[J]. Ann Neurol,2003,53 Suppl 3:S39-S47, S47-S48.
[10] 李强,王红义,刘立夏,程琳,邓永红,马鹏飞,段俊国. 银杏叶制剂及其提取物对神经保护的研究进展[J]. 中医眼耳喉鼻杂志,2011,1(1):51-54.
[11] Mueller H, Kassack MU, Wiese M. Comparison of the usefulness of the MTT, ATP, and calcein assays to predict the potency of cytotoxic agents in various human cancer cell lines[J]. J Biomol Screen,2004,9(6):506-515.
[12] Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays[J]. J Immunol Methods, 1983,65 (1-2):55-63.
[13] 方蓉,李芳秋,武建国. MTT比色法的条件探讨[J]. 临床检验杂志,2003(1):34-35.
[14] Green LM, Reade JL, Ware CF. Rapid colorimetric assay for cell viability: application to the quantitation of cytotoxic and growth inhibitory lymphokines[J]. J Immunol Methods,1984,70(2):257-268.
[15] Pauwels R, Balzarini J, Baba M, et al. Rapid and automated tetrazolium-based colorimetric assay for the detection of anti-HIV compounds[J]. J Virol Methods, 1988, 20(4):309-321.
