血清白细胞介素-2和白细胞介素-4在糖尿病肾病早期诊断中的意义
2018-04-10刘静雷艳君丁凤娇刘婕荆成宝
刘静,雷艳君,丁凤娇,刘婕,荆成宝
(1.安康市中心医院检验科,陕西 安康 725000;2.西安交通大学医学院,陕西西安 710018)
糖尿病(DM)属于代谢性疾病,其中糖尿病肾病(DN)是DM最严重的微血管并发症[1-2]。目前DN诊断主要依靠尿白蛋白测定,但当出现尿白蛋白时说明肾脏已经发生损害。如果不能在早期及时的诊断及治疗,DN会持续恶化,导致慢性肾功能衰竭[3-4]。大量的研究证实,在DN早期的病变是可逆转的,由此可见DN的早期诊断意义重大[5-6]。目前DN早期的诊断指标分为血液指标及尿液指标,血液中的指标有白细胞介素-2(IL-2)和白细胞介素-4(IL-4)、结缔组织生长因子(CTGF)、内脏脂肪素(visfatin)等,尿液中的指标有铜蓝蛋白(CP)、游离脂肪酸(FFA)、葡萄糖醛酸转移酶(UDP)、视黄醇结合蛋白(RBP)等[7]。虽然DN的早期诊断指标很多,但是目前仍未有研究证实某个指标是可靠的。本研究测定IL-2和IL-4在DN患者中的含量,探讨分析IL-2和IL-4在DN患者早期诊断的意义。
1 资料与方法
1.1 一般资料 选取2011年6月—2013年6月在安康市中心医院被确诊为DN患者60例,单纯DM患者60例,健康的体检者60例作为研究对象。其中男性98例,女性82例,年龄40~70岁,平均年龄(49.1±11.3)岁。入选标准:(1)DN患者尿蛋白排泄率>20μg·min-1,并排除其他肾脏疾病合并症;(2)DM患者尿蛋白排泄率 <20μg·min-1;(3)健康体检者排除其他重要器官疾病,肾功能正常,无肾病及糖尿病家族史。将患者分为三组,分别为DN组、DM组、对照组各60例。本研究经安康市中心医院伦理委员会批准,所有患者或患者监护人均已签署知情同意书。
1.2 研究方法 分别对DN组、DM组和对照组患者采集晨空腹血5 mL,分离血清后,放置于-20℃下,在3 000 r·min-1下离心,取上清液测定。血清IL-2和IL-4测定均采用ELISA法,所有操作均严格按照试剂盒(上海通蔚生物科技有限公司)说明书进行。
1.3 统计学方法 所有数据结果均采用SPSS 17.0统计软件处理,计量资料以s表示,计量资料采用t检验或方差分析,计数资料以例数及率表示,采用χ2检验及Fisher精确概率法,此外分别做出3个ROC曲线并算出曲线下面积(AUC),对血IL-2和IL-4的准确性、灵敏度和特异度进行评价。p<0.05为差异有统计学意义。
2 结果
2.1 对照组、DM组和DN组患者各项临床指标各组在性别、年龄、体质量指数(BMI)、收缩压(SBP)、舒张压(DBP)上比较,均差异无统计学意义(P>0.05)。DN组患者尿肌酐(UCr)、血清肌酐(SCr)均高于其他两组,均差异有统计学意义(p<0.05)。见表1。
2.2 DN、DM和对照组患者血清IL-2和IL-4水平比较 DN患者IL-2水平明显低于DM组和对照组,而IL-4水平却高于DM组和对照组。见表2。
2.3 IL-2和IL-4的ROC曲线 IL-2和IL-4单独作为标志物诊断AKI时,ROC曲线下面积(AUC)分别为:0.833和0.952(p<0.01),两者联合诊断时,诊断率为100%。见图1。

表1 对照组、DM组和DN组患者各项临床指标
表2 DN、DM和对照组患者血清IL-2和IL-4水平比较/(ng·L-1s)
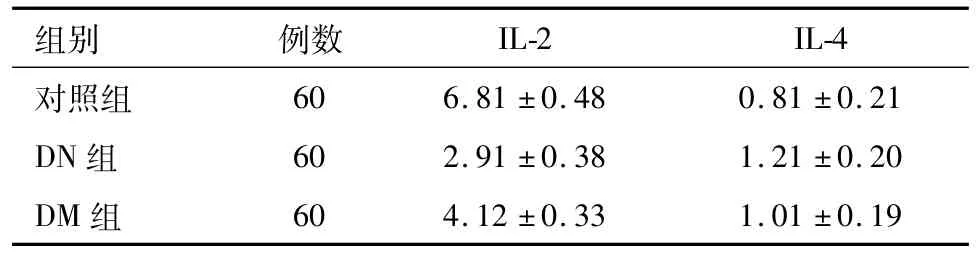
表2 DN、DM和对照组患者血清IL-2和IL-4水平比较/(ng·L-1s)
组别 例数IL-2 IL-4对照组60 6.81±0.48 0.81±0.21 DN组 60 2.91±0.38 1.21±0.20 DM组60 4.12±0.33 1.01±0.19

图1 IL-2和IL-4的ROC曲线
3 讨论
DM是一种全身性的代谢性疾病,主要特征就是血糖长时间高于正常值,引起全身微循环障碍,使得心脑血管、四肢血管、视网膜及肾脏发生器质性病变[8-9]。DN是DM多种并发症中的一种,它是由于肾脏的微血管发生病变,导致肾脏功能减退,严重威胁患者生命健康。其进展可分为五个阶段,最终可能引起肾衰竭[10]。目前临床中DN的诊断主要依靠微量白蛋白尿,但是由于微量白蛋白尿的产生是由于肾小管滤过功能明显受损所致,肾功能的退化早于尿白蛋白的出现,只有当DN发展到第Ⅲ期时才会发生改变,所以当出现微量蛋白尿的时候已发生肾功能损害。有研究证实,在DN的早期进行干预治疗,可以完全逆转肾脏的病变[11]。但是,如果肾脏已进入第Ⅲ期,只能延缓肾功能的恶化及进展。
目前虽然关于DN相关诊断指标很多,但是大多数只注重于某种独立诊断指标在DN早期诊断的灵敏度和特异度。由于DN的发病机制的复杂性和多样性,至今未能有哪个诊断指标能够成为DN早期患者诊断的金标准。临床工作者指出,把几个不同的指标联合应用来诊断DN可以提高特异度和灵敏度。
白细胞介素是非常重要的细胞因子,对维持正常肾脏的结构和功能有着举足轻重的作用。当肾脏发生病理性改变时,细胞因子会发生改变,影响肾脏功能和机构异常变化的进程。本研究证明,在DN患者中,IL-2明显低于健康人群,IL-4明显高于健康人群,表明 IL-2和 IL-4与 DN有着密切的关系。
IL-2又称为T细胞生长因子,主要由T细胞产生,其主要功能为活化T细胞,促进细胞因子产生,刺激自然杀伤细胞(NK)增殖及增强NK杀伤活性[12]。当机体受微生物感染时机体会产生IL-2做为免疫应答的一部分,通过与淋巴细胞表面的IL-2受体结合来区别“自己”和“非己”。IL-2是阻止DN发生的一种重要细胞因子,它能够抑制炎性反应的发生。本研究发现,DN患者IL-2水平明显低于DN患者和健康人群,我们认为原因可能是当肾脏发生病变时,病变侵及肾脏固有细胞,抑制了细胞产生IL-2,同时发生负反馈导致T细胞活化减少分泌更少的IL-2。此种反应的发生降低了NK细胞及巨噬细胞的能力,使得炎性反应进一步发展[13-14]。
IL-4是Th2细胞分泌的细胞因子。它的主要作用是促进B细胞增殖和分化,促进Th0细胞向Th2细胞分化,抑制Th1细胞活化及分泌细胞因子,在调节体液免疫中起关键性作用[15-16]。本研究发现,DM组IL-4水平高于DN组和对照组。我们认为这可能是因为当病变侵及肾脏时,刺激肾脏上皮细胞、内皮细胞等产生IL-4,同时IL-4的产生又抑制了Th1细胞的活化和分泌,导致IL-2的产生减少。IL-2和IL-4两者可能是相互抑制作用。故我们分析两种因子相互结合可提高DN的诊断准确性。对DN诊断的准确性进行评价后得出,IL-2和IL-4单独作为标志物诊断DN时,ROC曲线下面积(AUC)分别为 0.833和 0.952(p<0.01),二者联合诊断时,诊断率为100%。多项的联合检测能够提高DN早期诊断率,远远高于单项检测的准确性。
综上所述,临床中应用单一的生物学标志物进行诊断DN诊断价值较低。但是,联合各项生物学标志物进行检测可以相互弥补,提高DN的诊断准确率,有助于临床工作者早期发现DN,提供有效的干预措施,减少病死率。
[1] 甘华侠,熊琪辉,刘建英.2型糖尿病肾病患者血清HPA及IL-2水平变化的临床意义[J].重庆医学,2013,42(6):624-626.
[2] 罗红林,纪宏革,徐长根,等.老年2型糖尿病患者白细胞介素与尿微量白蛋白/肌酐比值的相关性[J].江苏大学学报(医学版),2013,23(5):411-413.
[3] 王爱红,毛雄伟,王孝芳,等.血清 Hcy,CRP,IL-6和 IL-8联检对糖尿病肾病的诊断价值[J].放射免疫学杂志,2013,26(4):508-509.
[4] 吴继华,徐震,朱同华,等.血清CysC检测在早期诊断2型糖尿病肾病中的意义[J].标记免疫分析与临床,2014,21(2):155-157.
[5] FAN YY,LY LH,BARHOUMI R,et al.Dietary docosahexaenoic acid suppresses T cell protein kinase C theta lipid raft recruitment and IL-2 production[J].J Immunol,2004,173(10):6151-6160.
[6] MURRAY KJ,GROM AA,THOMPSON SD,et al.Contrasting cytokine profiles in the synovium of different forms of juvenile rheumatoid arthritis and juvenile spondyloarthropathy:prominence of interleukin 4 in restricted disease[J].J Rheumatol,1998,25(7):1388-1398.
[7] MORRIS SW,KIRSTEIN MN,VALENTINE MB,et al.Fusion of a kinase gene,ALK,to a nucleolar protein gene,NPM,in non-Hodgkin′s lymphoma[J].Science,1994,263(5151):1281-1284.
[8] JOLLY CA,JIANG YH,CHAPKIN RS,et al.Dietary(n-3)polyunsaturated fatty acids suppress murine lymphoproliferation,interleukin-2 secretion,and the formation of diacylglycerol and ceramide[J].J Nutr,1997,127(1):37-43.
[9] CHEN X,BUMEL M,MNNEL DN,et al.Interaction of TNF with TNF receptor type 2 promotes expansion and function of mouse CD4+CD25+T regulatory cells[J].J Immunol,2007,179(1):154-161.
[10]AKASHI K,KONDO M,VON FREEDEN-JEFFRY U,et al.Bcl-2 rescues T lymphopoiesis in interleukin-7 receptor-deficient mice[J].Cell,1997,89(7):1033-1041.
[11]PAE HO,OH GS,CHOI BM,et al.Carbon monoxide produced by heme oxygenase-1 suppresses T cell proliferation via inhibition of IL-2 production[J].J Immunol,2004,172(8):4744-4751.
[12]SCREPANTI I,MORRONE S,MECO D,et al.Steroid sensitivity of thymocyte subpopulations during intrathymic differentiation.Effects of 17 beta-estradiol and dexamethasone on subsets expressing T cell antigen receptor or IL-2 receptor[J].J Immunol,1989,142(10):3378-3383.
[13]BURCHILL MA,YANG J,VOGTENHUBER C,et al.IL-2 receptor beta-dependent STAT5 activation is required for the development of Foxp3+ regulatory T cells[J].J Immunol,2007,178(1):280-290.
[14]OKAZAKI H,ITO M,SUDO T,et al.IL-7 promotes thymocyte proliferation and maintains immunocompetent thymocytes bearing alpha beta or gamma delta T-cell receptors in vitro:synergism with IL-2[J].J Immunol,1989,143(9):2917-2922.
[15]SUDA T,MURRAY R,GUIDOS C,et al.Growth-promoting activity of IL-1 alpha,IL-6,and tumor necrosis factor-alpha in combination with IL-2,IL-4,or IL-7 on murine thymocytes.Differential effects on CD4/CD8 subsets and on CD3+/CD3-double-negative thymocytes[J].J Immunol,1990,144(8):3039-3045.
[16] TAGAYA Y,MAEDA Y,MITSUI A,et al.ATL-derived factor(ADF),an IL-2 receptor/Tac inducer homologous to thioredoxin;possible involvement of dithiol-reduction in the IL-2 receptor induction[J].EMBO J,1989,8(3):757-764.
[17]FRENKEL D,HUANG Z,MARON R,et al.Nasal vaccination with myelin oligodendrocyte glycoprotein reduces stroke size by inducing IL-10-producing CD4+T cells[J].J Immunol,2003,171(12):6549-6555.
[18]HOBBS MV,WEIGLE WO,NOONAN DJ,et al.Patterns of cytokine gene expression by CD4+T cells from young and old mice[J].J Immunol,1993,150(8 Pt1):3602-3614.
[19]ERNST DN,HOBBS MV,TORBETT BE,et al.Differences in the expression profiles of CD45RB,Pgp-1,and 3G11 membrane antigens and in the patterns of lymphokine secretion by splenic CD4+T cells from young and aged mice[J].J Immunol,1990,145(5):1295-1302.
[20]POSNETT DN,EDINGER JW,MANAVALAN JS,et al.Differentiation of human CD8 T cells:implications for in vivo persistence of CD8+CD28-cytotoxic effector clones[J].Int Immunol,1999,11(2):229-241.
