体外循环期间Th1、Tc1/Th2Tc2细胞亚群与机体致炎/抗炎反应的关系
2018-04-09倪海峰肖颖彬
倪海峰,肖颖彬
免疫功能失调是导致体外循环(cardiopulmonary bypass,CPB)创伤及术后并发症的原因之一,对其致病机制、临床救治的研究是心外科领域的重要课题。T细胞是机体重要的免疫调节效应细胞,CPB对Th1、Tc1/Th2、Tc2细胞功能亚群分化状态的影响目前研究尚少。笔者对临床CPB病例T细胞Th1、Tc1/Th2、Tc2细胞功能亚群变化及与机体致炎/抗炎反应变化关系进行观察,报告如下。
1 资料与方法
1.1研究对象 2015年3月—2016年12月,选取二尖瓣瓣膜病患者20例作为试验组,年龄31~55岁,男10例,女10例;动脉导管未闭患者20例作为对照组,年龄20~39岁,男10例,女10例。纳入标准:(1)年龄>18 岁;(2)诊断明确,欲行 CPB 下二尖瓣置换术或非CPB下动脉导管结扎术;(3)患者知情同意接受该研究。排除标准:(1)有高血压、冠心病、糖尿病病史,或患有梅毒、乙型肝炎、丙型肝炎者;(2)有活动性感染、风湿活动期、肝肾疾病、慢性阻塞性肺部疾病者;(3)非首次心脏手术患者;(4)术前左心室射血分数<40%;24 h内发生心绞痛、心肌酶谱升高者;1个月内发生心肌梗死患者;(5)术前1周内服用过影响免疫功能的药物者。
试验组于CPB下行二尖瓣置换术,转流时间62~91 min;对照组于非CPB下行动脉导管结扎术,手术时间65~98 min。于术前、CPB或手术开始20 min、停机前或手术结束时、术后4 h、术后24 h、术后72 h抽取静脉血。该研究经医院伦理委员会批准,受试对象及亲属签署知情同意书,研究过程符合伦理学原则。
1.2 方法 浓度梯度法分离单个核细胞,尼龙柱滤除B细胞,获取T细胞。提取T细胞RNA,-70℃保存。RNA印迹法检测T细胞IFN-γ/IL-4mRNA表达。细胞内因子染色、免疫荧光标记检测T细胞IFN-γ、IL-4蛋白表达。放射免疫试剂盒检测血清中IL-6、IL-10 浓度变化。
1.3数据处理 GDS8000图像分析量化,SPSS16.0软件数据处理,计量资料以均数±标准差 (x±s)表示。符合正态分布,采用配对t检验比较组内差异;不符合正态分布,采用非参数分析;重复测量采用方差分析比较组间差异。p<0.05为差异具有统计学意义。
2 结果
2.1T细胞IFN-γmRNA蛋白表达变化 与术前相比,试验组CPB停机前IFN-γmRNA蛋白表达水平明显下调,差异有统计学意义(p<0.05);术后 4 h回升,至术后 24 h 基本恢复到术前水平(P>0.05)。对照组各时相点IFN-γmRNA蛋白表达水平差异无统计学意义(P>0.05)。 见图1~4。
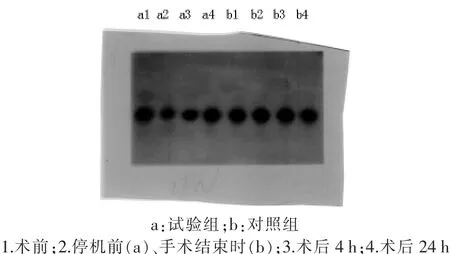
图1 RNA印迹法检测T细胞内IFN-γmRNA表达变化
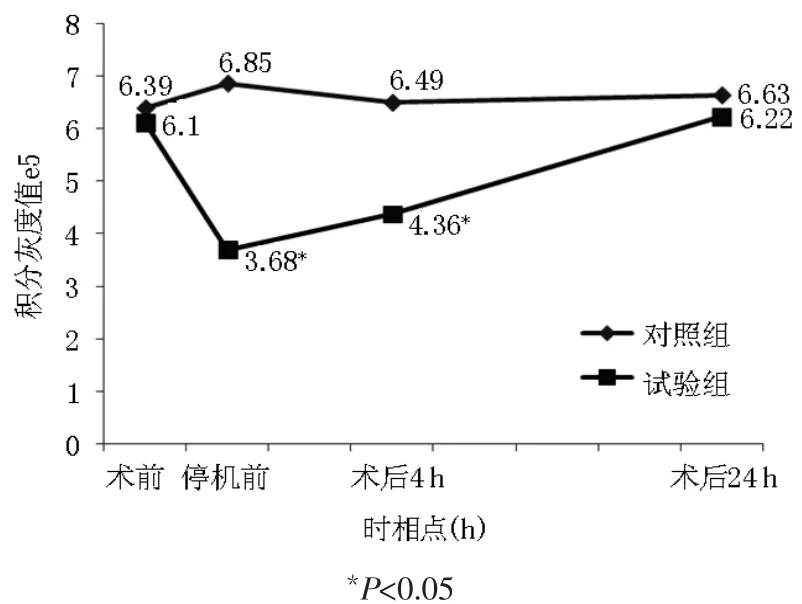
图2 T细胞内IFN-γmRNA表达变化
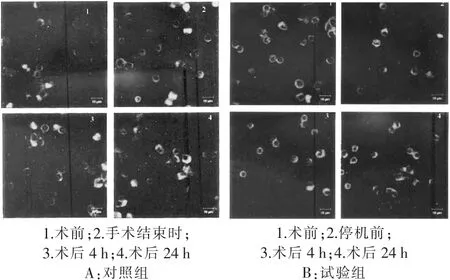
图3 表达IFN-γ蛋白的T细胞数量变化(激光共聚焦显微镜,400×)
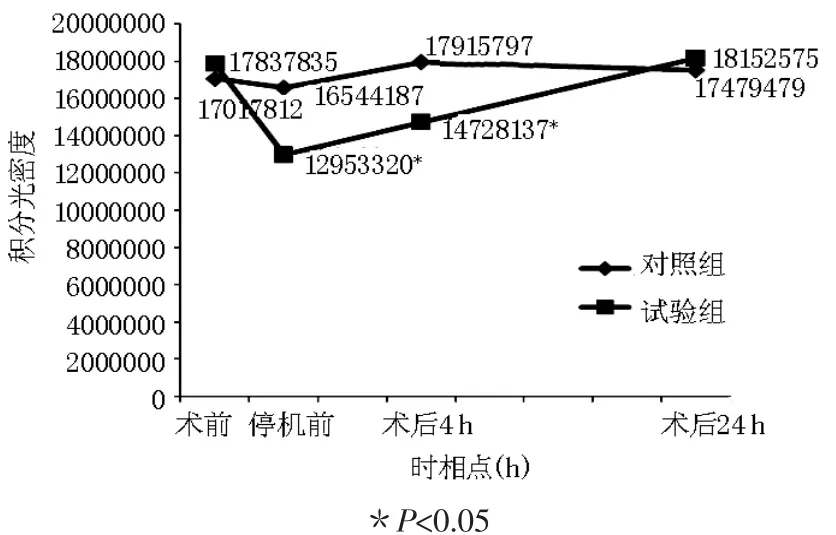
图4 T细胞内IFN-γ蛋白表达变化
2.2T细胞IL-4 mRNA蛋白表达变化 与术前相比,试验组CPB停机前IL-4 mRNA蛋白表达水平明显上调,差异有统计学意义(p<0.05);术后 4 h下降,至术后 24 h 基本恢复到术前水平(P>0.05)。对照组各时相点IL-4 mRNA蛋白表达水平差异无统计学意义(P>0.05)。 见图5~8。
2.3IL-6水平变化 与术前相比,对照组手术开始20 min后,IL-6水平明显升高,差异有统计学意义(p<0.01);手术结束后 4 h 达到高峰,差异有统计学意义(p<0.01);术后 72 h 基本恢复术前水平(P>0.05)。试验组虽同样出现 IL-6一过性上调,峰值位于术后4 h,但升高幅度明显低于对照组,差异有统计学意义(p<0.05);术后 72 h 基本恢复到术前水平(P>0.05)。 见图9。
2.4IL-10水平变化 与术前相比,试验组CPB开始20 min后,IL-10水平明显升高,差异有统计学意义(p<0.05);停机前达到高峰,差异有统计学意义 (p<0.01); 术后24 h基本恢复到术前水平 (P>0.05)。对照组各时相点IL-10水平差异无统计学意义(P>0.05)。 见图10。

图5 RNA印迹法检测T细胞内IL-4mRNA表达变化
图6 T细胞内IL-4mRNA表达变化
图7 表达IL-4蛋白的T细胞数量变化(激光共聚焦显微镜,400×)

图8 T细胞内IL-4蛋白表达变化
图9 外周血IL-6表达水平变化

图10 外周血IL-10表达水平变化
3 讨论
CPB创伤及并发症是重症心血管外科手术患者面临的危险因素之一,其致病机制、预防干预与救治研究是心外科领域的重要课题。1999年德国一项对6万例CPB手术病例的统计分析显示:CPB术后各种感染性、非感染性并发症是导致危重患者术后死亡的重要原因之一[1]。
以往研究表明,CPB可引起机体免疫功能发生改变,推测CPB创伤及并发症与机体免疫功能失调有关。T细胞作为机体重要的免疫调节、效应细胞,可能参与其发生与演变过程,但对CPB中T细胞分类及功能的变化情况,目前研究尚少。
研究认为,辅助 T细胞(Th)由 Th1、Th2两个细胞亚群组成,具有双向免疫调节作用,Th1/Th2失衡与多种疾病发生有关系[2-6]。临床研究也观察到CPB过程中,由Thl细胞分泌的致炎因子IFN-γ以及Th2细胞分泌抗炎因子IL-10水平发生了显著变化[7,8]。
进一步研究发现:细胞毒性T细胞(Tc)也可根据分泌的细胞因子谱,分为 Tc1和Tc2两种细胞亚群。Tc1/Tc2细胞亚群具有类似于Th1/Th2细胞亚群的生物学特征:诱导因素、产生的细胞因子种类、参与的免疫应答类型、分化调节机制等[9,10]。 研究表明:在CD4+与CD8+T细胞中,均存在能发挥同样双向调节与免疫效应的功能亚群。Tc1与Th1淋巴细胞、Tc2与Th2淋巴细胞,虽然细胞表面标志不同,但从功能和生物学效应上却可以分别归为同一个功能亚群。而随着对T细胞表面标志与生物学效应分子机制的逐步深入研究,以往以细胞表面标志或“效应性T细胞/调节性T细胞”“辅助性T细胞/抑制性T细胞”等传统方法进行的分类,已因为不能准确反映真实情况而受到挑战;而根据调节效应、生物学效应进行功能亚群分类,则是描述T细胞功能分类的新方法。
因此,笔者采用免疫印迹杂交、细胞内因子染色、免疫荧光、激光共聚焦显微镜等分子生物学试验方法,观察CPB对T细胞内IFN-γ/IL-4mRNA蛋白表达水平影响,了解CPB对Th1、Tc1/Th2、Tc2功能亚群影响。结果显示:CPB过程中,T细胞内由Th2、Tc2细胞亚群分泌的标志性抗炎介质IL-4 mRNA蛋白表达升高,由Th1、Tc1细胞亚群分泌的标志性致炎介质IFN-γmRNA蛋白表达下调,对照组未观察到类似变化。这种变化说明CPB中T细胞功能亚群发生变化:分泌致炎因子、诱导细胞免疫的Th1、Tc1细胞减少;分泌抗炎因子、诱导体液免疫的Th2、Tc2细胞增加;T细胞功能亚群分化向Th2、Tc2方向偏移。
笔者从免疫调节角度出发,观察Th1、Tc1/Th2、Tc2细胞亚群变化同时,对致炎因子IL-6、抗炎因子IL-10变化进行对照研究。结果表明:对照组IL-6上调,IL-10与 Th1、Tc1/Th2、Tc2细胞亚群无明显变化;试验组有不同表现:(1)IL-6虽较术前仍有升高,但明显低于对照组表达水平;(2)IL-10明显上调;(3)T细胞功能亚群分化向Th2、Tc2方向偏移。分析观察结果:对照组致炎因子IL-6表达上调,是机体非特异性免疫系统(中性粒细胞、补体等)的一种非特异性应激反应,导致炎性细胞活化、炎性介质表达上调,对抗手术创伤;特异性免疫系统Th1、Tc1/Th2、Tc2细胞亚群未产生变化,抗炎因子IL-10未随之改变。试验组中,CPB中低温、非生理性灌注等因素导致机体内环境变化,机体免疫系统、免疫细胞与CPB管道等各种变应原充分接触,诱导特异性免疫系统Th1、Tc1/Th2、Tc2细胞亚群产生变化,向Th2、Tc2方向偏移,抗炎因子IL-10上调,介导机体抗炎反应上调。虽然手术创伤也活化非特异性免疫系统,导致炎性介质IL-6上升,但由于主导致炎反应的Th1、Tc1细胞减少以及介导抗炎反应的IL-10的抑制效应,表达水平明显低于对照组。
其他研究结果显示:CPB致细胞免疫功能下降、IL-10 等抗炎因子水平升高[8,11],结合对炎症介质观察结果[12,13]可看出,CPB 对机体非特异性、特异性免疫系统均有影响。这种变化是机体对CPB的一种防御性反应,有助于机体平安渡过手术期。在一些因素作用下,如果对Th1、Tc1/Th2、Tc2细胞亚群的影响超出防御反应范围,则可能演变成为致病因素:Th2、Tc2细胞介导的免疫应答过度,会引起细胞免疫功能抑制,削弱机体防御能力,易继发病原微生物感染,甚至引发败血症、多脏器功能不全、多脏器功能衰竭等一些严重并发症;Th1、Tcl细胞介导的免疫应答过度,可能引发全身非特异性炎性反应(SIRS),导致各种非感染性并发症,亦可损害器官功能,导致严重并发症。可以推测,Th1、Tc1/Th2、Tc2淋巴细胞功能亚群的失衡可能与CPB术后并发症的发生有关。
[1] KALMAR P,IRRGANG E.Cardiac surgery in germany during 1999.A report by the German society for thoracicand cardiovascular surgery [J].Thorac Cardiovasc Surg,2004,62 (5):312-317.
[2] JUDITH F,KATHRIN O,PETER L,et al.Adoptive T-cell therapy with hexon-specific Th1 cells as a treatment of refractory adenovirus infet alion after HSCT[J].Blood,2015,125(12):1986-1994.
[3] SAADOUN D,GARRIDO M,COMARMOND C,et al.Th1 and Th17 cytokines drive inflammation in Takayasu arteritis[J].Arteritis﹠Rheumatology,2015,67(5):1353-1360.
[4] PENG D,KRYCZEK I,NAGARSHETH N,et al.Epigenetic Silencing of Th1-type chemokines shapes tumour immunity and immunotherapy[J].Nature,2015,527(7577):249-253.
[5] HAGHSHENAS MR,KHADEMI B,ASHRAF,MJ et al.Helper and cytotoxic T-cell subsets (Th1,Th2,Tc1,and Tc2)in benign and malignant salivary gland tumors[J].Oral Diseases,2016,22(6):566-572.
[6] JOHNSON D,MAYERS I.Multiple organ dysfunction syndrome:a narrative review[J].Can J Anaesth,2001,48(5):502-509.
[7] NALDINI A,BORRELLI E,CARRARO F,et al.Interleukin 10 production in patients undergoing cardiopulmonary bypass evidence of inhibition ofTh-1-type responses[J].Cytokine,1999,11(1):74-79.
[8] MARKEWITZ A,FAIST E,LANG S,et al.An imbalance T-helper cell subsets alters immune responses after cardiac surgery[J].Eur J Cardiothorac Surg,1996,10(1):61-67.
[9] GROGAN JL,LOCKSLEY RM.T helper cell differentiation:on again,off again[J].Current Opinion in Immunology,2002,14(3):366-372.
[10] MOSSMANN TR,SAD S.The expanding universe of T-cell subscets:Th1,Th2 and more[J].Immunol Today,1996,17(3):138-146.
[11] LARMANN J,THEILMEIER G,Inflammatory response to cardiac surgery:cardiopulmonary bypass versus non-cardiopulmonary bypass surgery[J].Res Clin Anaesthesiol,2004,18(3):425-438.
[12] ROTHENBURGER M,SOEPARWATA R,DENG MC,et al.Prediction of clinical outcome after cardiac surgery:the role of cytokines,endotoxin,and anti-endotoxin core antibodies[J].Shock,2001,16(S1):44-50.
[13] MURET J,MARIE C,FITTING C,et al.Ex vivo T-lymphocyte derived cytokine production in SIRS patients is influenced by experimental procedures[J].Shock,2000,13(3):169-174.
