骨唾液酸蛋白与维持性血液透析患者腹主动脉钙化的关系
2018-04-09伍宏伟张洋洋余宗超李珊珊尹良红BertholdHocher刘璠娜
伍宏伟 张洋洋 余宗超 李珊珊 尹良红 李 理 Berthold Hocher 刘璠娜
心血管疾病(CVD)是终末期肾病(ESRD)患者的主要并发症之一,其风险比普通人群高20~30倍[1],占ESRD患者死亡率的50%。血管钙化是慢性肾衰竭患者心血管事件发生的高危因素[2]。近来研究表明,血管钙化是多因素参与的受高度调控的类成骨过程[3]。骨唾液酸蛋白(BSP)是最近发现的一种参与骨-血管轴代谢的蛋白,在尿毒症患者钙化的血管中膜内表达,其影响血管钙化过程机制不明确。本研究探讨ESRD行维持性血液透析(MHD)患者血清BSP水平与腹主动脉钙化的关系。
对象和方法
研究对象选取2016年5月至2017年2月就诊于暨南大学附属第一医院血液净化中心规律维持性血液透析患者为研究对象。入选标准:年龄>18岁且透析龄>3个月。排除接受过甲状旁腺切除术,严重骨质疏松,严重感染,恶性肿瘤,接受激素治疗、严重的肝、肺疾病,妊娠、哺乳期妇女。136例患者参加筛选,符合入选条件者共75例。同时从健康体检者中选取20名志愿者作为正常对照组。所有患者均接受德国费森尤斯血液透析机进行治疗,使用碳酸氢盐透析液,透析液钙离子浓度为1.5 mmol/L。血管通路为自体动静脉内瘘或中心静脉半永久导管。所有患者透析3次/周,4h/次,血流量为200~250 ml/min。所有入选患者均签署知情同意书。本研究通过医院伦理委员会的审核批准。
实验方法
一般情况收集患者的年龄、性别、身高、体重、透析龄、既往病史等一般资料。
实验室检查所有患者均在血液透析前空腹采集血标本。采用ABX MICROS 60检测法进行血常规分析。记录红细胞、血红蛋白、血细胞比容等。采用TBA-120FR检测血钙、血磷、肌酐、尿素氮、白蛋白、总胆固醇、低度脂蛋白、高密度脂蛋白、C反应蛋白等。化学发光仪检测全段甲状旁腺素(iPTH),25羟维生素D3。用广州德为生物科技有限公司ELISA试剂检测血清BSP。
影像学检查按照KDIGO指南建议[4],用侧位腹部X线片检测患者血管钙化情况。由放射科医师对患者进行腹部侧位X平片拍摄,包括11、12节胸椎骨,第1~5腰椎和第1、2节骶椎骨。根据Kauppila等[5]报道的半定量积分方法由2位不同的放射科医师对患者第1节至第4节腰椎对应的腹主动脉钙化情况单独进行盲法评分,计算腹主动脉钙化评分,最终得分取其平均值。评分方法如下:根据腹主动脉前壁和后壁钙化斑块的长度,分别给予0~3分:无钙化者为0分;钙化范围小于1/3的动脉壁长度者为1分;钙化范围累及1/3~2/3动脉壁者为2分;钙化范围大于2/3的动脉壁长度者为3分。每个患者的腹主动脉钙化总积分为0~24分不等。参考 CORD 研究中的分段方法[6],根据 AAC 得分将患者分为无或轻度钙化组(AACs≤4),中等钙化组(5≤AACs≤15)和重度钙化组(AACs≥16)。

结 果
纳入患者的一般情况共入选患者75例,其中男43例,女32例,平均(61.63±14.9)岁(26~91岁)。原发病为慢性肾小球肾炎 16例(22.2%),糖尿病肾病23例(30.7%),高血压肾损害8例(10.7%),多囊肾4例(5.3%),肾结石5例(6.9%),其他19例(25.3%)。
MHD患者腹主动脉钙化情况75例MHD患者中,发生腹主动脉钙化者56例(74.67%),其中无钙化者19例(25.33%),轻度钙化者19例(25.33%),中度钙化者27例(36%),重度钙化者10例(13.33%)。AAC中位数为4(0,24)。参考CORD[6]研究中的分段方法分为3组,组间不同临床指标比较结果见表1。
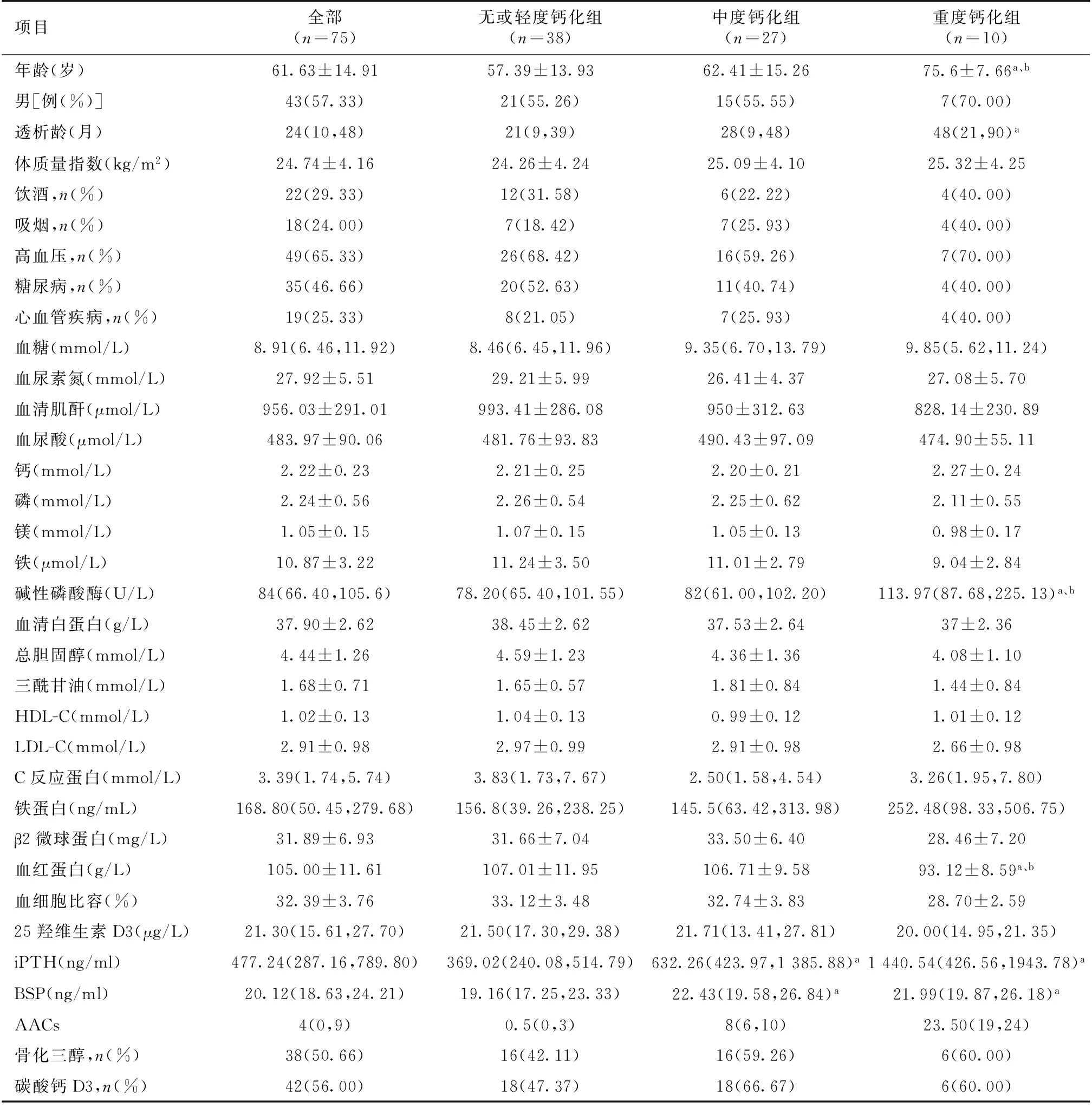
表1 不同腹主动脉钙化积分组患者的临床资料比较
HDL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇;AACs:腹主动脉钙化积分;iPTH:全段甲状旁腺激素;BSP:骨唾液酸蛋白;a:与无或轻度钙化组比较,P<0.05;b:与中度钙化组比较,P<0.05
MHD患者血清BSP水平及其对AAC的影响20例健康对照组中平均年龄(58.43±12.11)岁,血清BSP中位数为14.38 (12.34,16.39)ng/ml。75例患者BSP中位数为20.12(18.63,24.21)ng/ml。MHD患者非钙化组和钙化组血清BSP中位数显著高于健康对照组(图1)。

图1 MHD患者与健康对照组BSP值的比较MHD:维持性血液透析;BSP:血清骨唾液蛋白;+:与健康对照组比较,P<0.01;++:与MHD非钙化组比较,P<0.05
BSP与iPTH的关系分析按BSP四分位数分为BSP≤18.64 ng/ml组、BSP 18.64~20.11 ng/ml组、BSP 20.12~24.20 ng/ml组、BSP≥24.21 ng/ml组,Mann-Whitney U检验提示BSP≥24.21 ng/ml组iPTH水平高于BSP≤18.63 ng/ml组,有统计学意义(P=0.011)(图2)。
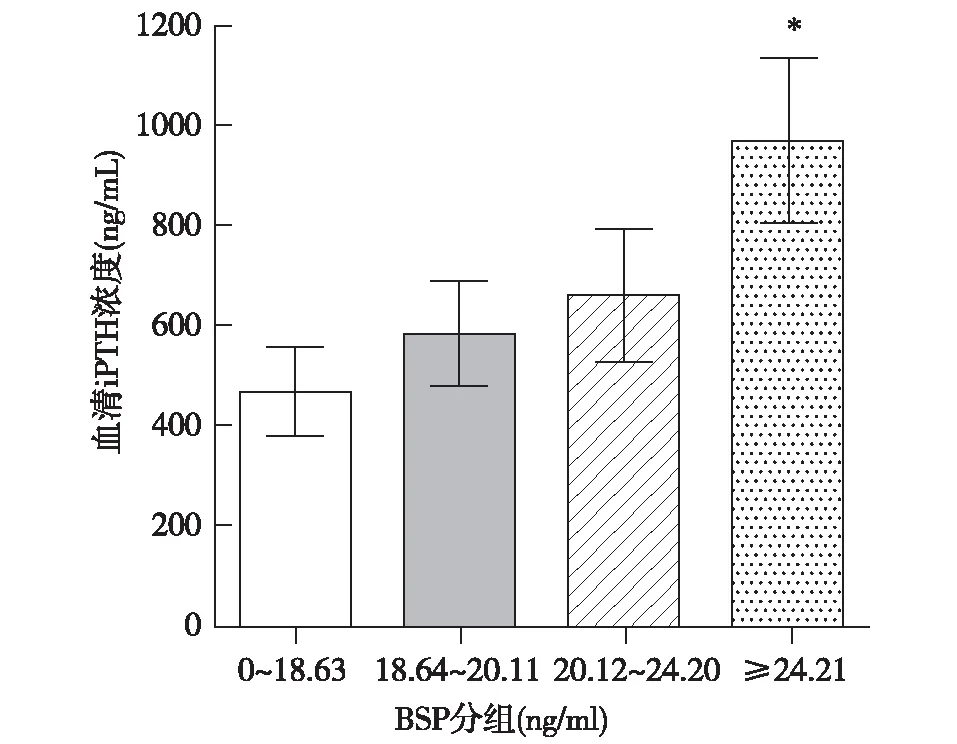
图2 不同四份位间距BSP组与iPTH差异的比较BSP:血清骨唾液蛋白;iPTH:全段甲状旁腺激素;*:与BSP≤18.63 ng/ml组比较,P<0.05
AAC危险因素分析采用单因素Logistic回归分析AAC的危险因素,其中年龄(OR=1.043,95% CI 1.008~1.080,P=0.016)、BSP(OR=1.248,95%CI 1.085~1.436,P=0.002)、iPTH(OR=1.003,95%CI 1.001~1.005,P=0.001)、尿素氮(OR=0.912,95% CI 0.834~0.997,P=0.043)有统计学意义,其他指标均无统计学意义,将单因素Logistic回归分析有意义的变量进行多因素Logistic回归。以AACs≤4分作为临界点分为两组,采用二元多因素Logistic回归分析AAC的危险因素,校正透析龄、年龄、iPTH、尿素氮后发现,BSP是AAC的独立危险因素(OR=1.175,95%CI 1.004~1.375,P<0.05),见表2。
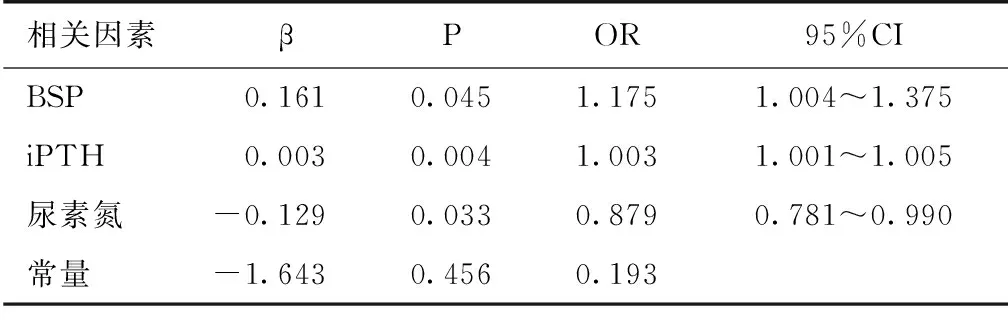
表2 腹主动脉钙化影响因素的多因素 Logistic回归分析
BSP:血清骨唾液蛋白;iPTH:全段甲状旁腺激素
ROC曲线分析使用ROC曲线分析,BSP诊断MHD患者AAC的曲线下面积为0.718,95%CI 为0.604~0.833,P=0.001,提示血清BSP对诊断AAC的准确度中等。其临界值为21.51 ng/mL,灵敏度为0.711,特异度为0.595(图3)。

图3 血清骨唾液酸蛋白诊断腹主动脉钙化的ROC曲线图
讨 论
血管钙化是慢性肾衰竭患者发生心血管事件的危险因素之一。研究显示CKD 3~5期患者,40%~60%存在动脉钙化,CKD 5期患者的钙化率高达80%~90%[7]。KDIGO指南建议使用侧位腹部X线片检测透析患者血管钙化情况,结合kauppila半定量评分可有助于腹主动脉钙化程度及进展的评估[5,8]。本研究采用上述方法发现,75例 MHD患者中发生腹主动脉钙化者56例(74.67%),与Karohl等[7]研究结果基本相符。过去认为,血管钙化是体内钙、磷增高,导致矿物质沉积引起的异位钙化[9]。最新的研究发现,血管钙化与骨钙化病理过程相似,是血管平滑肌细胞(VSMC)介导的主动过程[10]。研究己证实[11],在ESRD环境中,钙化血管中成骨相关蛋白表达上调,骨细胞基质钙化相关蛋白如碱性磷酸酶、骨钙素、骨桥蛋白表达上调,而作为VSMC特异标志物的平滑肌肌动蛋白表达却下调。BSP是一种骨代谢标志物,研究发现在粥样硬化血管中氧化低密度脂蛋白(oxLDL)增加了BSP表达,提示BSP参与血管钙化[12],
从BSP一级结构分析可知,其靠近N-端的谷氨酸富集区具有结合羟磷灰石的作用,对羟磷灰石的最初晶核形成起着重要作用,引导矿化的形成,促进钙磷堆积,加速钙化形成[13],在组织钙化中BSP是成骨细胞分化和发动矿化开始的标志物,是反映矿化组织功能细胞状态的良好标志。在本研究中,并未发现血清BSP与血钙、血磷有明显的相关性,原因可能为BSP主要在矿化起始起作用,而本研究参与者为MHD患者,长期服用影响钙磷水平的药物,因此BSP与钙、磷的关系还需要进一步的研究加以证实。
研究发现,BSP在尿毒症患者钙化血管中膜内表达,提示BSP表达可能是ESRD患者血管壁钙化的早期表现[14]。一项研究还发现,与CKD患者非钙化组相比,CKD患者钙化组BSP染色更显著,此外,与非CKD患者钙化组相比,CKD患者钙化组BSP水平更高[15]。本研究发现MHD患者与年龄和性别匹配的健康对照组相比BSP值升高,此外MHD患者非钙化组中BSP值较健康对照组BSP值高(P<0.01),因此,不管MHD患者是否存在血管钙化,BSP水平较正常人群升高,何种因素刺激MHD患者BSP表达,目前仍不清楚。此外,我们的研究还发现,在MHD患者中,中、重度钙化组BSP水平均高于无或轻度钙化组(P<0.05),而非钙化组与轻度钙化组BSP水平无差异。BSP参与血管钙化的机制尚不明确。Farrokhi等[16]研究结果表明,在VSMC中oxLDL增加Runx2和BSP的表达,但是在通过siRNA抑制Runx2表达后,oxLDL不能影响BSP表达,提示BSP表达由Runx2转录因子控制。
90%以上尿毒症患者存在继发性甲状旁腺功能亢进,iPTH是否可以直接或间接引起血管钙化尚未有研究。本研究通过Logistic 回归分析发现iPTH是AAC的独立危险因素(OR=1.003,95%CI 1.001~1.005,P<0.004),与既往的研究结果一致。同时本研究还发现BSP≥24.21 ng/mL组iPTH水平高于BSP≤18.63 ng/mL组(P=0.011)。目前尚缺少BSP与iPTH关系的研究,Ogata等[17]指出,垂体特异性转录因子-1(Pit-1)相关核心蛋白与BSP启动子同源元件的竞争性结合抑制BSP的转录,iPTH通过阻断这种竞争性结合,刺激BSP的转录,并且在不改变BSP mRNA稳定性的同时增强mRNA的表达。因此,iPTH可能有刺激BSP表达的作用。
本研究中,MHD患者中、重度钙化组的血清BSP水平均高于无或轻度钙化组,多因素回归分析提示血清BSP是AAC的独立危险因素,ROC曲线分析发现血清BSP对诊断MHD患者AAC的准确度中等。但是,重度钙化组的血清BSP水平与中度钙化组相比无统计学意义,可能与样本量较少、BSP试剂盒测量差异有关。此外,研究未发现血磷、血钙、碱性磷酸酶等传统危险因素[18]与血管钙化的相关性,其主要原因为部分患者经药物治疗后钙、磷水平基本控制在正常范围,另外还与血管钙化的评价标准存在差异,样本量较少有关,因此需要多中心大样本的研究评价血管钙化的危险因素及BSP对AAC的诊断价值。
总之,血清BSP水平升高与MHD患者AAC相关,是发生AAC的独立危险因素。血清BSP浓度可能有助于MHD患者AAC程度的预测。 BSP介导血管钙化的作用机制尚不清楚,仍需要大样本前瞻性的研究进一步探究BSP与CKD患者血管钙化的关系。
1Noordzij M,Cranenburg EM,Engelsman LF,et al.Progression of aortic calcification is associated with disorders of mineral metabolism and mortality in chronic dialysis patients.Nephrol Dial Transplant,2011,26(5):1662-1669.
2Liabeuf S,Okazaki H,Desjardins L,et al.Vascular calcification in chronic kidney disease: are biomarkers useful for probing the pathobiology and the health risks of this process in the clinical scenario?.Nephrol Dial Transplant,2014,29(7):1275-1284.
3刘小锋,何菂,蔡嫣,等.高血磷诱导慢性肾衰患者血管钙化作用机制.生理科学进展,2014,45(1):21-26.
4KDIGO clinical practice guideline for the diagnosis,evaluation,prevention,and treatment of Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD).Kidney Int Suppl,2009,(113):S1-130.
5Kauppila LI,Polak JF,Cupples LA,et al.New indices to classify location,severity and progression of calcific lesions in the abdominal aorta: a 25-year follow-up study.Atherosclerosis,1997,132(2):245-250.
6Verbeke F,Van Biesen W,Honkanen E,et al.Prognostic value of aortic stiffness and calcification for cardiovascular events and mortality in dialysis patients: outcome of the calcification outcome in renal disease (CORD) study.Clin J Am Soc Nephrol,2011,6(1):153-159.
7Karohl C,D′Marco GL,Raggi P.Noninvasive imaging for assessment of calcification in chronic kidney disease.Nat Rev Nephrol,2011,7(10):567-577.
8WOLFFE JB,SIEGAL EI.X-ray of the abdominal aorta in detection of atherosclerosis.Clin Med (Northfield),1962,69:401-406.
9Disthabanchong S.Vascular calcification in chronic kidney disease: Pathogenesis and clinical implication.World J Nephrol,2012,1(2):43-53.
10 Schweighofer N,Aigelsreiter A,Trummer O,et al.Direct comparison of regulators of calcification between bone and vessels in humans.Bone,2016,88:31-38.
11 Ciceri P,Elli F,Brenna I,et al.Lanthanum prevents high phosphate-induced vascular calcification by preserving vascular smooth muscle lineage markers.Calcif Tissue Int,2013,92(6):521-530.
12 Farrokhi E,Samani KG,Chaleshtori MH.Oxidized low-density lipoprotein and upregulated expression of osteonectin and bone sialoprotein in vascular smooth muscle cells.Lab Med,2014,45(4):297-301.
13 Vincent K,Durrant MC.A structural and functional model for human bone sialoprotein.J Mol Graph Model,2013,39:108-117.
14 张萍,陈江华,蒋华,等.尿毒症患者血管中膜钙化和骨特异性蛋白的表达.中华肾脏病杂志,2005,21(2):69-71.
15 Koleganova N,Piecha G,Ritz E,et al.Arterial calcification in patients with chronic kidney disease.Nephrol Dial Transplant,2009,24(8):2488-2496.
16 Farrokhi E,Samani KG,Chaleshtori MH.Oxidized low-density lipoprotein increases bone sialoprotein expression in vascular smooth muscle cells via runt-related transcription factor 2.Am J Med Sci,2015,349(3):240-243.
17 Ogata Y,Nakao S,Kim RH,et al.Parathyroid hormone regulation of bone sialoprotein (BSP) gene transcription is mediated through a pituitary-specific transcription factor-1 (Pit-1) motif in the rat BSP gene promoter.Matrix Biol,2000,19(5):395-407.
18 Brandenburg VM,Kramann R,Koos R,et al.Relationship between sclerostin and cardiovascular calcification in hemodialysis patients: a cross-sectional study.BMC Nephrol,2013,14:219.
