利用高通量测序法分析中国北方葡萄园土壤细菌的多样性
2018-04-09宋雪洁刘天明
宋雪洁, 刘 波, 刘天明
(齐鲁工业大学/山东省微生物工程重点实验室,山东济南 250353)
葡萄园的地理位置、土壤类型及肥力状况对葡萄、葡萄酒的质量都有一定影响,尤其是土壤中的某些元素影响着葡萄植株的生长及果实产量和质量[1]。葡萄树和土壤微生物群落之间有着密切的互生关系,土壤微生物的种群多样性和功能多样性对维持土壤生态系统动态平衡、促进根系营养吸收利用起到主要作用,同时葡萄树通过影响土壤环境来影响土壤微生物的结构和多样性[2]。葡萄作为多年生藤本植物,不可能年年轮作清茬,且施肥与灌溉方式受限,这会明显影响土壤微生物的多样性[3]。因此,研究葡萄园土壤微生物多样性,对合理制定土壤管理措施、促进根际微生物结构优化、实现葡萄的优质丰产有现实的指导意义[4]。另外,葡萄果实品质的形成与生态因子、配套农业技术密切相关,目前,有关温度、降水等生态因素及灌溉方式、整形架式、施肥措施等农业耕作制度对葡萄生长发育和品质的影响已有大量报道[5-7],而不同生态地域葡萄园土壤微生物的多样性研究相对较少,葡萄根际微生物菌群数量、结构变化与土壤肥力、地上葡萄果实品质、酿酒品质的相关性研究相对更少。探讨不同地域、不同深度的根际微生物群落差异性,对合理指导和完善施肥制度、合理改良土壤肥力、酿造优质的葡萄酒同样有现实的指导意义。
基于形态学、生理学、分子生物学等传统方法研究微生物群落的多样性已取得较多的科研成果,但由于土壤中绝大部分微生物是不可培养的,传统的分离鉴定方法只能区分环境微生物种类中的0.1%~10%,而变性梯度凝胶电泳(DGGE)也仅能够反映有限的优势微生物类群,这导致对环境微生物群落多样性的认识受到限制[8],有可能会低估土壤微生物的物种组成,并高估其丰度。李桥利用高通量技术研究细菌群落对盐生植被演替的响应发现,尽管取样地点不同,但处于相同生境中的微生物类群有相似性,不同植被类型的土壤主要微生物群落结构存在明显不同[9]。本研究采用以宏基因高通量测序技术为导向的细菌鉴定和检测方法,能快速、全面、准确地探究葡萄根际微生物的群落种类、数量,可获取更加丰富的微生物多样性信息,对传统培养法难于观察到的微生物种类及功能研究提供了可行性。
1 材料与方法
1.1 样品采集
2015年8月,从甘肃省兰州市和武威市威龙基地、宁夏回族自治区银川市永宁县、河北省怀来县、山东省德州市和东营市用孔径为4 cm的灭菌打孔器采集16年生葡萄树根际土壤,各采样点的取样深度及园区概况见表1。葡萄越冬方式均为下架埋土,施肥耕作深度为20~40 cm,采用渠灌方式补水;每个土样由同一果园8个采集点的土壤进行混合,取适量装入土袋中,迅速带回实验室[10];无菌条件下将土壤样品粉碎,过孔径为0.284 cm的筛网;四分法留取土样,4 ℃条件保存备用[11]。

表1 土样采集园葡萄栽培和管理基本概况
1.2 土壤微生物总DNA的提取
采用Omega soil DNA kit试剂盒提取13个土壤样品中的微生物基因组DNA。
1.3 细菌16S rDNA PCR扩增及测序
13个样本分别用不同的序列标签条码进行区分,引物添加长度为8 bp。采用特异性引物为F515:5′-GTGCCAGCMGCCGCGG-3′、R907:5′-CCGTCAATTCMTTTR AGTTT-3′[12]对细菌16S rRNA基因V4区进行扩增。PCR反应体系为Q5 DNA聚合酶0.25 μL,5×扩增缓冲液5 μL,5×GC缓冲液5 μL,10 mmol/L dNTP 0.5 μL,模板DNA 1 μL,10 μmol/L正向、反向引物各1 μL,水11.25 μL。PCR扩增条件为:98 ℃预变性30 s;98 ℃ 15 s,50 ℃ 30 s,72 ℃ 30 s,循环25~27次;72 ℃延伸5 min。PCR产物用2%琼脂糖凝胶电泳(120 V,20 min)检测,用美国产Axygen凝胶回收试剂盒回收目的片段,样品送上海派森诺生物科技有限公司进行Illumina MiSeq高通量测序。
1.4 序列获取与分析
1.4.1优质序列的获取高通量测序建库过程中PCR扩增会产生嵌合体序列,测序过程中会产生点突变等测序错误,故运用Qiime 1.9.0软件进行序列过滤[13],运用mothur 1.31.2软件中uchime方法去除嵌合体序列[14-15],以保证分析结果的准确性,得到可用于后续分析的优质序列。
1.4.2基于操作分类单元(OTU)的分析对河北省怀来县5个不同土层深度的土样基于操作分类单元(OTU)进行分析,使同一单元序列的相似度≥97%。
1.4.3稀释性曲线的制作对河北省怀来县5个不同土层深度、相似度≥97%的土样细菌序列,以随机抽取的短序列(reads)数目为横坐标,以该数目下聚类后得到的OTU数目为纵坐标制作稀释性曲线,如果reads数据增加过程中曲线趋于平行,则表明随reads数目的增加,OTU数目不会有较多的增加,此时已达到足够的测序数据量[16]。
1.4.4群落结构分析基于“门”分类单元,对河北省怀来县5个土层土样的微生物群落结构进行分析,基于“属”分析其分布和丰度情况;对甘肃兰州市等7个地区施肥、未施肥土壤的微生物物种数量进行统计。
2 结果与分析
2.1 优质序列的获取
由表2可知,河北省怀来县5个不同土层深度土样的优质序列占有效序列[15]的比例在86.98%以上,涵盖大部分土壤微生物的基因序列。由图1可见,土样的优质序列长度为225 bp左右。

表2 不同土层深度土样的序列数据统计

2.2 基于操作分类单元(OTU)的分析
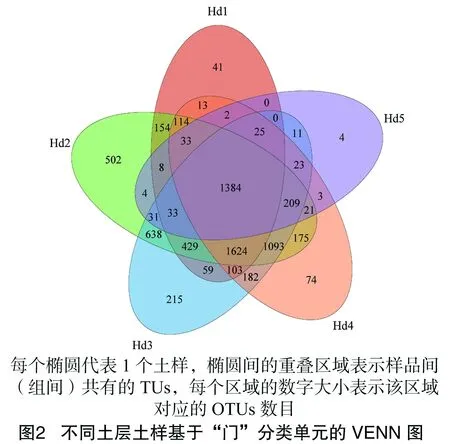
由表3可知,随土层采样深度的增加,10~70 cm土层微生物种类由多到少依次递减,0~10 cm近地表土层的微生物种类明显少于土层10~40 cm的微生物种类,与深度40~50 cm 土层的微生物种类相近,10~30 cm土层的微生物种类相对最多。由图2可见,在23 382个基于“门”分类单元中,有1 384个是5个不同深度土层共有的,占5.9%,土样Hd1、Hd2、Hd3、Hd4、Hd5中各自特有的分类单元分别有41、502、215、74、4个,这表明不同深度土壤分布的微生物,绝大多数种类在各层间有差异,不论从哪个分类水平看,特有种类分类单元主要分布在10~40 cm土层,60 cm下土层的微生物种类数量急剧减少。

表3 不同土层深度土样相似度≥97%的分类单元统计
2.3 稀释性曲线
高通量测序所得序列数量的多少直接决定着不同相似性水平上所能分辨出的系统发育分类物种数量的多少[17]。由图3可见,随测得序列数量的增加,曲线虽趋于平缓,但有微小的上升趋势,说明Illumina Miseq测序获得了样品中绝大部分细菌序列,但仍处于不饱和状态。分析表明,在97%相似性水平上,5个不同深度土样的细菌序列覆盖度在86.98%~93.81%之间,更直观说明本研究已获取绝大多数的样本信息,基本能够比较真实地反映研究区的细菌群落组成情况。
2.4 群落结构分析
由图4、图5可见,5个土样中,占优势的物种有9个门,从多到少依次为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、芽单胞菌门(Gemmatimonadetes)、浮霉菌门(Planctomycetes)、放线菌门(Actinobacteria)、绿屈挠菌门(Chloroflexi)、疣微菌门(Verrucomicrobia)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes),占比分别为34.9%、20.1%、13.6%、8.6%、6.5%、3.7%、2.8%、2.7%、2.5%;芽单胞菌门、绿屈挠菌门在0~10 cm的土层中丰度较高,芽单胞菌门从表层土到深层土丰度逐渐减少;放线菌门、拟杆菌门、绿屈挠菌门在10~30 cm土层中丰度较高,放线菌门中的类诺卡氏菌科(Nocardioidaceae)占菌种的2.1%,拟杆菌门中的噬纤维细菌科占菌种的2.4%;放线菌门、浮霉菌门、疣微菌门在30~40 cm的土层中丰度较高,而硝化螺旋菌门(Nitrospirae)、浮霉菌门的丰度向上、下2层逐渐递减;厚壁菌门在40~50 cm土层中丰度较高;60~70 cm土层的微生物群落中,放线菌门、绿屈挠菌门、厚壁菌门、芽单胞菌门、疣微菌门比其他土层中的丰度有明显降低,酸杆菌门、变形菌门则明显升高,酸杆菌门中的iii1-15菌科成为优势菌种,占 24.6%,变形菌门中的华杆菌科占12.6%、红螺菌科占5.2%。

由表4可见,在施农家肥条件下,河北省酿酒葡萄赤霞珠2个土样Hs1、Hs2在“属”分类水平上物种数量具有相似性,而与同样来自河北省种植鲜食葡萄马奶子的土样Hn在“属”分类水平上差异相对较小,表明施用同样农家肥条件下,品种对微生物物种的数量影响相对较小;甘肃土样Gh、宁夏土样Nb、山东土样Sy这3个土样的物种数量差异相对较大,表明地域对物种的数量影响相对稍大;未施农家肥的甘肃土样Gl、山东土样Sd、河北土样Hd1与施农家肥的土样在“属”分类水平上物种数量有明显差异;比较甘肃土样Gh、Gl与河北土样Hn、Hd1的物种数量发现,农家肥的影响比地域影响更为明显;无论鲜食葡萄还是酿酒葡萄,在施农家肥条件下土壤中的微生物在属分类水平上具有相似的群落组成,可聚类到一起(图5)。


3 结论与讨论
从土层10 cm开始,随着土层的加深,葡萄园土壤中细菌种类呈下降趋势,与李艳丽等在梨上的研究结论[18]一致;0~10 cm土层的细菌种类明显较少,与40~50 cm土层的细菌种类相当;10~30 cm的耕作层即葡萄根系分布区寄居的细菌种类数相对最多,这与栾丽英等的研究结论[19]相似;地表和50 cm以下非耕作层细菌数相对减少,这与根际分布规律和地上、地下深层生态微环境相对应,可能是地表冬夏温湿度变化剧烈,紫外线强烈,外界环境对细菌的影响较大,导致表层土的细菌种类相对较少,加之通气良好,生存着好氧菌和抗逆境的细菌类型或光合菌类,而50 cm以下土层土壤养分贫瘠、缺氧,可能主要分布着厌氧菌和化能自养菌。10~30 cm土层冬夏温湿度相对稳定,根际有机物分泌丰富、肥水丰沛,水、肥、气、热等因子有利于多种细菌的繁衍,聚集着大量好氧、厌氧及兼性厌氧菌。
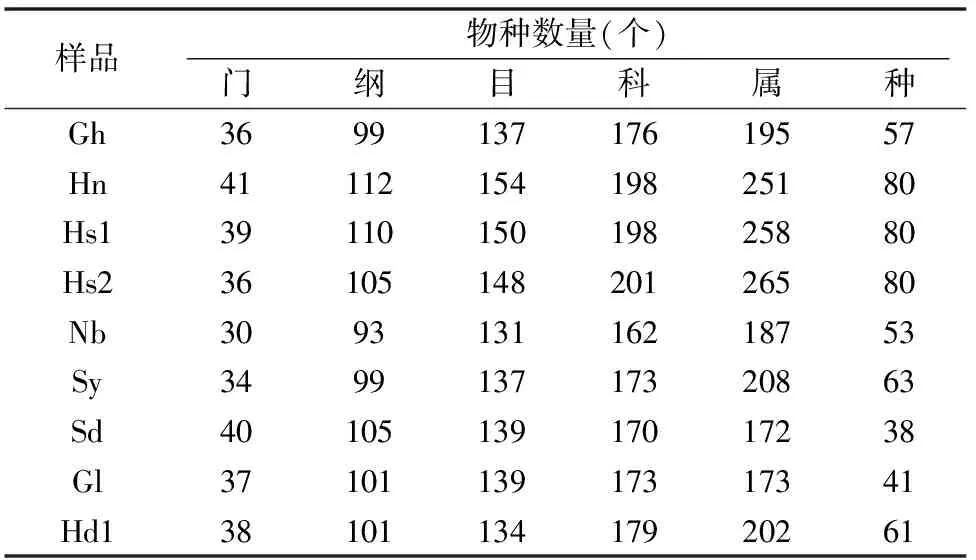
表4 不同地区土样物种数量统计
袁莹莹等研究认为,生物有机肥施用可提高土壤中细菌和放线菌的数量,且有益菌群对土壤微生物有一定的活化作用[20]。胡可等利用Biolog法研究不同施肥处理下土壤微生物功能多样性表明,生物有机肥处理更能提高土壤中微生物的活性[21]。蔡燕飞等研究表明,施用生态有机肥可以提高土壤微生物多样性和土壤质量,能调控土壤微生物群落结构,促进土壤有益微生物生长,在保持微生物多样性与生态稳定性方面起着重要的作用[22]。罗希茜等研究表明,有机肥有利于提高微生物群落物种数量、优势种的优势度及各物种的丰度[23],这可能是由于有机肥的C/N有利于土壤微生物的生长。本研究中,施用农家肥改变了葡萄园土壤微生物的群落组成,提高了细菌的生物多样性。
高通量测序能够较为全面和准确地反映土壤微生物群落结构,而变性梯度凝胶电泳(DGGE)仅能反映有限的优势微生物类群,在很大程度上极可能低估土壤微生物的物种组成并高估其丰度[24]。在不同的微生物分类水平上,通过高通量测序可检测到葡萄园土壤36门102纲141目181科212属,而这是DGGE技术远远不能达到的[25]。
参考文献:
[1]张云峰,李艳,严斌,等. 葡萄园土壤中4种金属元素的测定及其对葡萄和葡萄酒的影响[J]. 食品科学,2010,31(24):374-379.
[2]杨海君,肖启明,刘安元. 土壤微生物多样性及其作用研究进展[J]. 南华大学学报(自然科学版),2005,19(4):21-26,31.
[3]刘灵芝,吕德国,秦嗣军. 果园土壤生态系统功能微生物多样性研究进展[J]. 北方果树,2014(6):1-4.
[4]王保莉,岑剑,武传东,等. 过量施肥下氮素形态对旱地土壤细菌多样性的影响[J]. 农业环境科学学报,2011,30(7):1351-1356.
[5]王锐,孙权,郭洁,等. 不同灌溉及施肥方式对酿酒葡萄生长发育及产量品质的影响[J]. 干旱地区农业研究,2012,35(5):123-127.
[6]周军,兰彦萍,齐建勋,等. 灌溉方式对葡萄果实品质及矿质营养元素的影响[J]. 宁夏农林科技,2001(3):8.
[7]毛娟,陈佰鸿,曹建东,等. 不同滴灌方式对荒漠区‘赤霞珠’葡萄根系分布的影响[J]. 应用生态学报,2013,24(11):3084-3090.
[8]Pace N R. A molecular view of microbial diversity and the biosphere[J]. Science,1997,276(5313):734-740.
[9]李桥. 基于高通量测序技术下土壤微生物群落结构的研究[D]. 济南:山东师范大学,2014:53-54.
[10]刘玮琦. 保护地土壤细菌和古菌群落多样性分析[D]. 北京:中国农业科学院,2008:22-22.
[11]马艳. 基于PCR-RFLP技术的当归根际土壤细菌研究[D]. 兰州:西北师范大学,2014:14-15.
[12]Xia W,Zhang C,Zeng X,et al. Autotrophic growth of nitrifying community in an agricultural soil[J]. The ISME Journal,2011,5(7):1226-1236.
[13]Caporaso J G,Kuczynski J,Stombaugh J,et al. QIIME allows analysis of high-throughput community sequencing data[J]. Nature Methods,2010,7(5):335-336.
[14]Schloss P D,Westcott S L,Ryabin T,et al. Introducing mothur:open-source,platform-independent,community-supported software for describing and comparing microbial communities[J]. Applied and Environmental Microbiology,2009,75(23):7537-7541.
[15]Edgar R C,Haas B J,Clemente J C,et al. UCHIME improves sensitivity and speed of chimera detection[J]. Bioinformatics,2011,27(16):2194-2200.
[16]张俊. 根结线虫土壤微生物多样性研究[D]. 昆明:云南大学,2015:13-87.
[17]敏玉霞. 青藏高原冻土区甜水海湖盆沉积物微生物多样性及其与环境关系的研究[D]. 兰州:兰州大学,2013:16-18.
[18]李艳丽,赵化兵,谢凯,等. 不同土壤管理方式对梨园土壤微生物及养分含量的影响[J]. 土壤,2012,44(5):788-793.
[19]栾丽英,房玉林,宋士任,等. 不同树龄酿酒葡萄不同土壤深度根际和根区微生物数量的研究[J]. 西北林学院学报,2009,24(2):37-41.
[20]袁英英,李敏清,胡伟,等. 生物有机肥对番茄青枯病的防效及对土壤微生物的影响[J]. 农业环境科学学报,2011,30(7):1346-1350.
[21]胡可,王利宾. BIOLOG微平板技术在土壤微生态研究中的应用[J]. 土壤通报,2007,38(4):819-821.
[22]蔡燕飞,廖宗文,章家恩,等. 生态有机肥对番茄青枯病及土壤微生物多样性的影响[J]. 应用生态学报,2003,14(3):349-353.
[23]罗希茜,郝晓晖,陈涛,等. 长期不同施肥对稻田土壤微生物群落功能多样性的影响[J]. 生态学报,2009,29(2):740-748.
[24]夏围围,贾仲君. 高通量测序和DGGE分析土壤微生物群落的技术评价[J]. 微生物学报,2014,54(12):1489-1499.
[25]Stahl D A,Lane D J,Olsen G J,et al. Analysis of hydrothermal vent-associated symbionts by ribosomal RNA sequences[J]. Science,1984,224(4647):409-411.
