干旱胁迫下郑麦7698的抗旱性能及光合特性分析
2018-04-08许为钢齐学礼赵明忠河南省农业科学院粮食作物研究所河南郑州45000河南省农业科学院小麦研究所河南郑州45000河南省农业科学院科研管理处河南郑州45000
秦 娜,许为钢,齐学礼,赵明忠,张 磊(.河南省农业科学院 粮食作物研究所,河南 郑州 45000; .河南省农业科学院 小麦研究所,河南 郑州 45000; 3.河南省农业科学院 科研管理处,河南 郑州 45000)
小麦耐旱性是受其遗传物质、生理生化和生长发育等多方面调控的复杂数量性状,光合过程的变化、渗透调节等代谢产物含量的变化、抗氧化物质的合成、根系形态的建成等均会影响小麦的抗旱特性[1]。植物的光合作用是感受干旱胁迫最为敏感的生理过程之一,干旱胁迫下气孔导度的降低是植物光合效率下降的主要原因[2],干旱胁迫也可通过改变光合作用中某些关键酶活性间接影响植物光合性能[3]。大量研究证明,光合作用的暗反应过程受1,5-二磷酸核酮糖羧化酶/加氧酶(Rubisco)活性与数量的调控[4],植物在干旱胁迫下Rubisco活性显著降低[5],1,5-二磷酸核酮糖(RuBP)的合成速率降低,这对光合作用碳同化效率和利用能量造成较大影响[6]。渗透调节物主要包括氨基酸(如脯氨酸、天冬氨酸和谷氨酸)、甲基化的胺类物质(如甜菜碱)、可溶性糖(果糖和蔗糖等)以及环醇类物质(如甘露醇)等[7]。植物响应干旱胁迫的另一个重要生理生化过程是抗氧化物质的合成,植物细胞内形成的清除活性氧类有害物质的保护体系被称为保护酶系统。其中,超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)可清除超氧阴离子和过氧化氢等有害物质,从而减轻活性氧自由基对植物的伤害。干旱胁迫显著影响小麦根系的发育,在水分含量很低的生长条件下,根长、根体积、根干质量、根鲜质量、根活力等都与小麦抗旱性密切相关[8]。
小麦是我国的主要粮食作物,在黄淮麦区北片、北部冬麦区、西北春麦区等小麦生产地区,其生长往往遭受高温、干旱、高光强等非生物逆境胁迫,导致小麦产量降低,因此,小麦的抗旱抗逆机制研究成为科研工作者的关注点之一。本试验以周麦18为对照材料,研究郑麦7698的抗旱及光合生理特性,旨在揭示其耐干旱胁迫的机制,为选育耐干旱胁迫小麦品种提供理论依据。
1 材料和方法
1.1 材料与处理
试验材料为河南省农业科学院小麦研究所选育的郑麦7698与黄淮南部区域试验对照品种周麦18。试验在河南省原阳县河南现代农业研究开发基地小麦研究所防雨干旱棚内进行,于2013年10月10日播种。试验共设2个处理:正常灌水组,土壤含水量全生育期控制在田间持水量的80%~85%;干旱胁迫组,孕穗期(开花前15 d)前土壤含水量同正常灌水组,孕穗期后开始降低,5月1日(开花前7 d)含水量降至40%~45%,并保持该含水量至成熟。2个处理中,每个材料均种植9盆(盆钵内径30 cm、高40 cm),每3盆为一次试验重复,每盆5穴,每穴1苗。采用全自动土壤水分测定仪测定土壤相对含水量,并于开花期和成熟期取样,测定相关指标。
1.2 抗旱特性测定
1.2.1叶片相对含水量测定叶片相对含水量(RWC)测定参照Barrs等[9]的方法进行。剪取小麦旗叶叶片,称鲜质量(FW),然后将其漂浮于盛有蒸馏水的三角瓶中,于4 ℃冰箱放置24 h后取出,用滤纸吸去叶片表面的水,立即称取叶片的吸胀质量(TW),将叶片放入铺滤纸的培养皿中,置于70 ℃的烘箱24 h,称取干质量(DW)。RWC=(FW- DW)/(TW- DW)×100%。
1.2.2渗透调节物含量测定取开花期旗叶叶片1 g,测定可溶性糖、可溶性蛋白与脯氨酸含量。可溶性糖含量采用蒽酮法测定[10],可溶性蛋白含量利用考马斯亮蓝G-250溶液测定,脯氨酸含量的测定采用磺基水杨酸提取法[11]。
1.2.3抗氧化酶活性测定酶液提取时,将0.5 g旗叶叶片置于预冷研钵中,加入2 mL 0.05 mol/L预冷的PBS缓冲液(5 mmol/L EDTA、2 mmol/L抗坏血酸、2%聚乙烯吡咯烷酮,pH值7.8),冰浴研磨成匀浆,4 ℃条件下,12 000 g离心20 min,上清液用于SOD、POD、CAT活性测定。蛋白质定量采用Bradford方法,BSA用作标准蛋白[12]。
SOD活性釆用氮蓝四唑光化还原法测定[13],POD活性采用愈创木酚法测定[14],CAT活性测定参照Jiang等[15]的方法进行。
1.2.4根系特性测定采取盆栽冲洗法取根,根系活力和根系体积测定分别采用改良TTC法和排水法,将根在80 ℃条件下烘干至恒质量(24 h),而后用千分之一天平称质量,即为根系干质量。
1.3 光合特性测定
1.3.1光合酶相关基因实时荧光定量PCR分析取开花期郑麦7698和周麦18植株的旗叶各0.1 g,利用植物总RNA提取试剂盒(Bioteke,Beijing)提取RNA,根据PrimeScriptTMRT Reagent Kit with gDNA Eraser试剂盒(Takara,Japan)的操作流程进行第一链cDNA的合成。参照已有的编码Rubisco大、小亚基的2个基因(rbcl和rbcs)序列,用Primer 3.0软件设计引物(表1),采用Toyobo公司SYBR Green RT-PCR试剂盒在Bio-Rad CFX96实时荧光定量PCR仪上进行表达量分析。基因相对表达量参照Livak等[16]的2-ΔΔCt法进行计算。

表1 光合酶相关基因实时荧光定量PCR分析所用引物
1.3.2光合酶活性测定取开花期郑麦7698和周麦18植株旗叶叶片0.5 g,参照Ku等[17]的方法提取酶液,并利用BCA精确定量试剂盒(CWBIO,Beijing)对蛋白质进行定量。Rubisco活性测定参照翁晓燕等[18]的方法进行。
1.3.3光合作用参数测定在小麦开花期,选择晴朗无云天气,于9:00—11:00采用CIRAS-3便携式光合仪(UK),测定旗叶的光合速率(Pn)、蒸腾速率(Tr)与气孔导度(Gs)。测定条件为:大气CO2浓度(360±5)μmol/mol,相对湿度(60±5)%,温度25 ℃,使用仪器自带的 LED 光源控制光强,光量子通量密度(PPFD)为1 500 μmol/(m2·s)。
1.4 产量性状测定
成熟期,盆栽单株收获后在挂藏室阴干,各处理分别随机选取15株,测定农艺性状,包括单株生物量、单株穗数、穗粒数、千粒质量等。采用DPS软件进行统计分析。
2 结果与分析
2.1 郑麦7698抗旱特性分析
2.1.1叶片相对含水量正常灌水条件下,郑麦7698与周麦18叶片相对含水量分别为90.0%和87.7%,二者无显著性差异。干旱胁迫条件下,郑麦7698叶片相对含水量为69.5%,较周麦18高12.3%,差异显著(表2)。上述结果表明,干旱胁迫下郑麦7698叶片持水能力较强,耐旱性较强。
2.1.2渗透调节物含量正常灌水条件下,郑麦7698、周麦18的脯氨酸含量分别为0.65、0.56 mg/g,可溶性糖含量分别为0.22、0.21 mg/g,可溶性蛋白含量分别为10.55、10.22 mg/g,郑麦7698、周麦18无显著性差异。干旱胁迫条件下,郑麦7698脯氨酸、可溶性糖、可溶性蛋白含量分别为3.17、0.33、25.00 mg/g,分别较周麦18提高了32.1%、10.0%、16.3%,差异显著(表2)。结果表明,干旱胁迫下郑麦7698渗透调节物的合成与积累速度较快,耐干旱胁迫能力较强。
2.1.3抗氧化酶活性正常灌水条件下,郑麦7698、周麦18的SOD活性分别为288、269 U/g, POD活性分别为7 283、6 907 U/g,CAT活性分别为3 713、3 544 U/g,郑麦7698与周麦18无显著性差异。干旱胁迫条件下,郑麦7698的SOD、POD、CAT活性分别为486、13 120、9 115 U/g,分别较周麦18高11.5%、13.8%、6.8%,其中SOD和POD差异达到了显著水平(表2)。这表明,干旱胁迫条件下郑麦7698中SOD和POD的合成与积累速率较快,对植株内活性氧与过氧化物的清除能力较强,干旱胁迫对细胞的氧化伤害明显减轻。
2.1.4根系生理指标正常灌水条件下,郑麦7698、周麦18根系活力分别为0.10、0.09 mg/(g·h),根系体积分别为4.75、4.27 cm3/株,根系干质量分别为1.04、0.96 g/株,郑麦7698与周麦18无显著性差异。干旱胁迫条件下,郑麦7698根系活力、根系体积、根系干质量分别为0.08 mg/(g·h)、4.33 cm3/株、0.85 g/株,分别较周麦18高14.3%、20.3%、9.0%,差异显著(表2)。这一结果表明,干旱胁迫条件下郑麦7698根系发育受抑制程度较弱,耐旱适应能力较强。
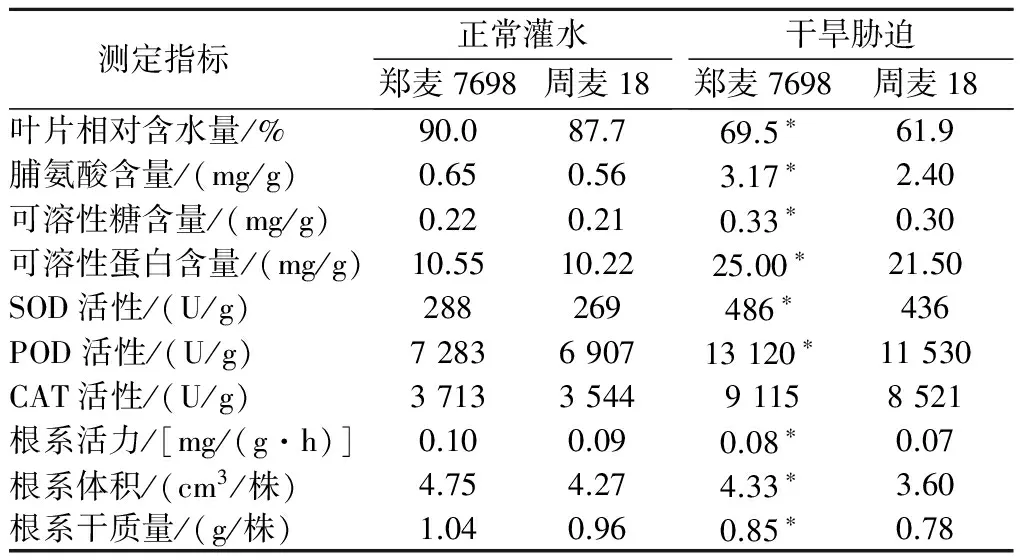
表2 正常灌水与干旱胁迫条件下郑麦7698与周麦18的抗旱特性指标
注:*表示郑麦7698与周麦18之间差异显著(P<0.05),下同。
2.2 郑麦7698光合特性分析
2.2.1光合酶相关基因的表达量正常灌水条件下,郑麦7698、周麦18rbcl的相对表达量分别为1.10、1.00,rbcs的相对表达量分别为1.20、1.10,郑麦7698与周麦18无显著性差异。干旱胁迫条件下,郑麦7698rbcl、rbcs的相对表达量分别为0.84、0.89,分别较周麦18高出29.2%、27.1%,差异显著(表3)。可以看出,干旱胁迫下郑麦7698维持了相对较高的rbcl和rbcs表达量,这对减轻干旱胁迫造成的 C3循环抑制作用有重要意义。
2.2.2光合酶活性正常灌水条件下,郑麦7698、周麦18的Rubisco活性分别为79.2、74.1 μmol/(mg·h),二者无显著性差异。干旱胁迫条件下,郑麦7698的Rubisco活性为60.7 μmol/(mg·h),较周麦18高出33.4%,差异极显著(表3)。这表明,干旱胁迫下郑麦7698仍保持了较高的光合酶活性,对抑制光合效率的降低发挥了重要作用。
2.2.3光合作用参数正常灌水条件下,郑麦7698、周麦18的光合速率分别为21.3、20.2 μmol/(m2·s),蒸腾速率分别为7.9、6.8 g/(m2·h),气孔导度分别为190、176 mmol/(m2·s),郑麦7698与周麦18无显著性差异。干旱胁迫条件下,郑麦7698光合速率、蒸腾速率、气孔导度分别为7.8 μmol/(m2·s)、4.6 g/(m2·h)、88 mmol/(m2·s),较周麦18分别高出20.0%、53.3%、25.7%,差异显著或极显著(表3)。可见,在干旱胁迫下,郑麦7698能保持较高的光合速率、蒸腾速率及气孔导度,从而表现出较强的耐旱能力。
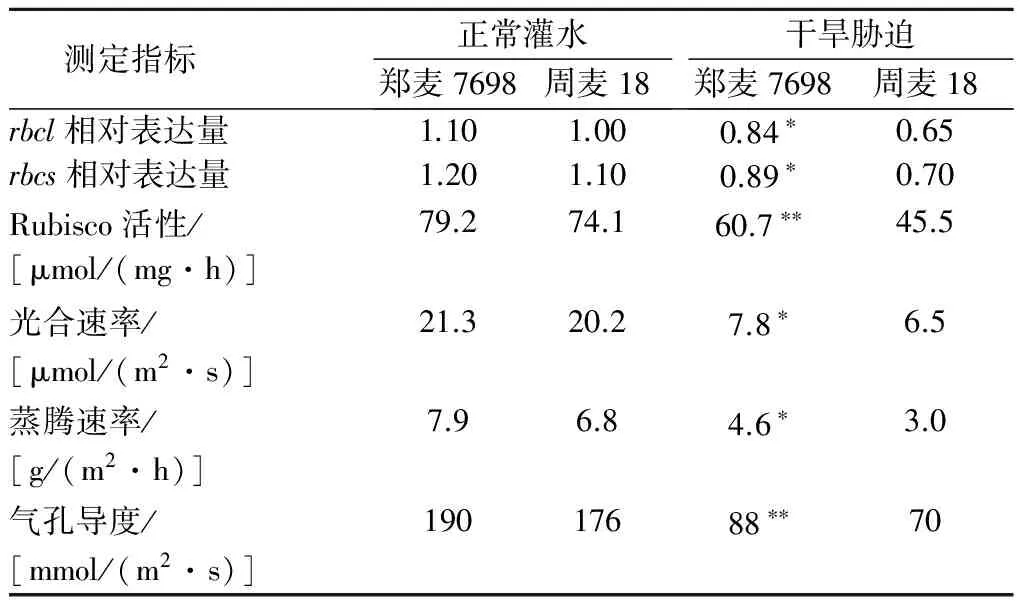
表3 正常灌水与干旱胁迫条件下郑麦7698与周麦18光合酶相关基因的表达量及旗叶光合效率
注:**表示郑麦7698与周麦18之间差异极显著(P<0.01)。
2.3 郑麦7698产量性状分析
正常灌水条件下,郑麦7698单株生物量、单株穗数、穗粒数和千粒质量分别为50.8 g、11.5穗、41.8粒和52.4 g,周麦18分别为49.7 g、11.2穗、41.4粒和51.7 g,郑麦7698和周麦18无显著性差异。干旱胁迫条件下,郑麦7698单株生物量、单株穗数、穗粒数和千粒质量分别为27.3 g、7.1穗、39.1粒和44.1 g,较周麦18分别高了8.3%、2.9%、5.4%和7.0%,其中单株穗数差异未达到显著水平,单株生物量、穗粒数和千粒质量差异均达到了显著水平(表4)。结果表明,郑麦7698在干旱胁迫下具有较高的产量,主要表现为单株生物量、穗粒数及千粒质量较高。
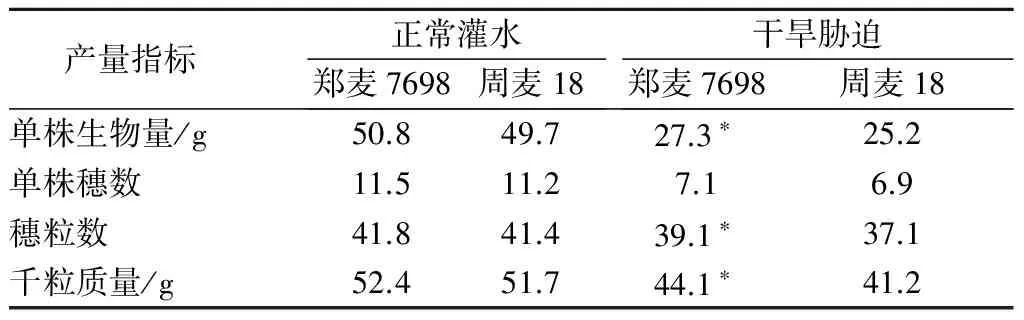
表4 正常灌水与干旱胁迫条件下郑麦7698与周麦18的产量性状
3 结论与讨论
3.1 干旱胁迫条件下小麦的抗旱性能
植物水分代谢是指吸收水分、利用水分以及叶片蒸腾作用等生物学过程的总和,可用叶片含水量、水分利用效率、细胞水势等反映水分盈缺和利用状况[19]。叶片相对含水量反映了植物体内水分亏缺程度与维持水分含量的能力[20]。本研究发现,正常灌水条件下,郑麦7698叶片相对含水量与周麦18无显著差异,而干旱胁迫下郑麦7698叶片相对含水量显著高于周麦18,表明干旱胁迫下郑麦7698仍可以保持相对较好的水分利用状况,水分代谢过程受影响较小,为其在干旱胁迫下保持相对较高的光合效率奠定了基础。此外,作物为应对干旱胁迫,进化出了一整套完善的机制,如积累较多的渗透调节物质,以此调节胞内渗透势,从而缓解其细胞受逆境伤害程度[1,21]。本研究中,干旱胁迫下郑麦7698维持了较高的叶片含水量,部分上是脯氨酸、可溶性糖及可溶性蛋白浓度升高的结果。SOD、POD、CAT是抗氧化酶系统中的关键酶,当植物遭遇干旱等逆境胁迫时,植物的适应能力和抗性与抗氧化酶的活性密切相关,抗氧化酶具有保护植物细胞的作用,能清除逆境下植物体内积累的自由基和活性氧,减轻逆境对植物细胞造成的伤害[22]。本研究发现,干旱胁迫下郑麦7698抗氧化酶活性明显高于周麦18,即郑麦7698在逆境胁迫中分解有害产物的能力高于周麦18。
根系是作物直接感受土壤水分信号并吸收土壤中水分的器官,当作物遭受干旱胁迫时,其根系能首先感受到并迅速向整个植株发出信号,使整个植株对干旱做出反应,因此,根系是研究作物抗旱性的一个重要组成部分[23]。梅雪英等[24]研究表明,作物的根长、根粗、根系活力、根干质量等根系相关性状与抗旱性显著相关。本研究结果显示,干旱胁迫抑制了郑麦7698与周麦18根系的生长,但干旱胁迫条件下郑麦7698根系活力、根系体积与根系干质量显著高于周麦18,表明郑麦7698根系发育抑制作用较周麦18有所减缓,这可能与郑麦7698叶片抗氧化酶合成较多有关,因此抑制了郑麦7698旗叶与根系衰老的速度,保持了较好的根系发育特征。
3.2 干旱胁迫条件下小麦的光合性能
光合作用是小麦生长的基础,干旱胁迫后,小麦各个生理过程都受到不同程度的影响,其中光合作用是受影响最明显的过程之一[25]。本研究表明,干旱胁迫处理后,开花期小麦C3光合途径的Rubisco及其调控基因的表达均受到显著抑制,但郑麦7698受抑制程度显著低于周麦18。净光合速率、蒸腾速率、气孔导度均大幅度降低,但郑麦7698的降低幅度小于周麦18。郑麦7698由于在干旱胁迫条件下具有较好的光合特性,所以表现出了较好的同化物生产特性和产量特性,降低了干旱胁迫的不利影响。
综上所述,干旱胁迫下郑麦7698的抗旱性能、光合特性及产量性状显著优于周麦18,表明郑麦7698具有较强的抗旱能力与光合性能,这对选育耐干旱小麦新品种、保证干旱胁迫下小麦的正常生产具有重要的意义。
参考文献:
[1]Xiong L,Schumaker K S,Zhu J K.Cell signaling during cold,drought,and salt stress[J].The Plant Cell,2002,14(S1):S165-S183.
[2]Flexas J,Bota F,Loreto G,etal.Diffusive and metabolic limitations to photosynthesis under drought and salinity in C3plants[J].Plant Biology,2004,6(3):269-279.
[3]David W L.Limitation to photosynthesis in water-stressed leaves:Stomata vs.metabolism and the role of ATP[J].Annals of Botany,2002,89(7):871-885.
[4]Chaitanya K V,Jutur P P,Sundar D,etal.Water stress effects on photosynthesis in different mulberry cultivars[J].Plant Growth Regulation,2003,40(1):75-80.
[5]Martina J P,John A P,Shahnaz K,etal.Rubisco activity:Effects of drought stress[J].Annals of Botany,2002,89(7):833-839.
[6]Garcia M,Monreal J,Alvarez R,etal.Characterization of salt stress enhanced phosphoenolpyruvate carboxylase kinase activity in leaves ofSorghumvulgare:Independence from osmotic stress,involvement of ion toxicity and significance of dark phosphorylation[J].Planta,2003,216(4):648-655.
[7]Maheshwari R,Dubey R S.Nickel toxicity inhibits ribo-nuclease and protease activities in rice seedlings:Protective effects in praline[J].Plant Growth Regul,2007,51:221-224.
[8]赵君霞,马耕,岳鹏莉,等.氮素和干旱胁迫对冬小麦幼苗生长发育及生理指标的影响[J].河南农业科学,2015,44(5):26-30.
[9]Barrs H D,Weatherley P E.A re-examination of the relative turgidity technique forestimating water deficits in leaves[J].Australian Journal of Biological Sciences,1962,15(3):413-428.
[10]Dubois M,Gilles K A.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry,1956,28(3):350-356.
[11]Troll W,Lindsley J.A photometric method for the determination of praline[J].J Biolchem,1955,215(2):655-660.
[12]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1):248-254.
[13]Dhindsar S,Plumb-Dhindsa P,Thorpe T.Leaf senescence:Correlated with increased levels of membrane permeability and lipid peroxidation,and decreased levels of superoxide dismutase and catalase[J].Journal of Experimental Botany,1981,32(1):93-101.
[14]Gao S,Ou-yang C,Tang L,etal.Growth and antioxidant responses inJatrophacurcasseedling exposed to mercury toxicity[J].Journal of Hazardous Materials,2010,182(1):591-597.
[15]Jiang M,Zhang J.Effect of abscisic acid on active oxygen species,antioxidative defence system and oxidative damage in leaves of maize seedlings[J].Plant and Cell Physiology,2001,42(11):1265-1273.
[16]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCtmethod[J].Methods,2001,25:402-408.
[17]Ku M S,Agarie S,Nomura M,etal.High-level expression of maize phosphoenolpyruvate carboxylase in transgenic rice plants[J].Nat Biotechno,1999,17(1):76-80.
[18]翁晓燕,陆庆,蒋德安,等.水稻Rubisco活化酶在调节Rubisco活性和光合日变化中的作用[J].中国水稻科学,2001,15(1):35-40.
[19]Vysotskaya L B,Arkhipova T N,Timergalina L N,etal.Effect of partial root excision on transpiration,root hydraulic conductance and leaf growth in wheat seedlings[J].Plant Physiology and Biochemistry,2004,42(3):251-255.
[20]白志英,李存东,赵金锋,等.干旱胁迫对小麦代换系叶绿素荧光参数的影响及染色体效应初步分析[J].中国农业科学,2011,23(1):62-65.
[21]Farooq M,Wahid A,Kobayashi N,etal.Plant drought stress:Effects,mechanisms and management[J].Sustainable Agriculture,2009,29(1):185-212.
[22]Singh R,Jwa N.Understanding the responses of rice to environmental stress using proteomics[J].Journal of Proteome Research,2013,12(11):4652-4669.
[23]景蕊莲,胡荣海.作物抗旱性的根系研究[J].麦类作物学报,1995(3):37-39.
[24]梅雪英,严平,王凤文,等.水分胁迫对冬小麦根系生长发育及产量的影[J].安徽农业科学,2003,31(6):962-964.
[25]王曙光,史雨刚,史华伟,等.春小麦光合特性与抗旱关系的研究[J].作物杂志,2017(6):23-29.
