黄瓜CsWRKY32基因的cDNA克隆及生物信息学分析
2018-04-04张金梅佟德利
张 颖, 刘 佳, 廉 想, 张金梅, 佟德利
(沈阳师范大学 生命科学学院, 沈阳 110034)
黄瓜起源于印度,是世界栽培广泛的园艺作物之一,在我国设施内栽培面积大,因其风味和口感广受人民喜爱,在蔬菜生产和消费中占重要地位,但我国设施环境中的亚适宜问题对黄瓜的产量和品质产生重要影响。自2009年黄瓜全基因组测序以来[1],释放了大量的基因组数据,随后进行了转录组的测序,为黄瓜的品质改良提供了丰富的组学数据,为进一步从基因水平提高黄瓜的品质提供契机。
WRKY是近年来广泛研究的热点转录因子,自从1994年从甘薯中被发现以来,研究人员利用遗传学、分子生物学和生物信息学等方法,逐步揭示了WRKY转录因子的功能,发现它们不仅参与植物生长发育、生物及非生物胁迫的过程,还参与一些特殊的代谢途径。但WRKY转录因子调控植物响应逆境,以及详细的生理生化反应分子机制,目前尚未完全解析清楚[2]。借助黄瓜基因组、转录组测序完成的契机,以黄瓜为研究对象,利用生物信息学工具在转录调控水平研究WRKY转录因子这个调控基因表达的开关,以期揭示黄瓜在设施内亚适宜环境下的调控机制,为设施黄瓜调控抗逆提供新思路。
1 材料与方法
1.1 材料与试剂
供试品种为设施温室内抗病抗逆品种“中农26”,种子购买于中国农业科学院蔬菜花卉研究所。
植物总RNA的提取采用TRIzol方法进行, 提取后测定其浓度,取5 μg RNA进行cDNA反转录。使用Fermentas公司的Revert AidTM First Strand cDNA Synthesis Kit反转录试剂盒进行cDNA合成。RT-PCR所用的酶及T载体均购自Vazyme公司。
1.2 方 法
1.2.1 黄瓜总RNA的提取及cDNA克隆
本实验于沈阳师范大学生化与分子生物学实验室进行,2017年2月将黄瓜种子经消毒后催芽,种子露白播种于50孔穴盘,育苗基质为按体积比为2∶1混配的草炭和蛭石。出苗后待第一片真叶完全展开,分苗到营养钵里(直径10 cm)。之后培养于沈阳师范大学日光温室内。当黄瓜生长至两叶一心时,提取叶片组织RNA,反转录后进行RT-PCR,电泳回收后转入GV pXT19-T Vector的载体中,进行TA克隆,筛选获得阳性克隆后,送上海生工公司测序并做序列比对。
1.2.2CsWRKY32基因的生物信息学分析
应用生物信息学软件分析CsWRKY32基因及其推导的氨基酸序列的性质,应用GSDS[3]软件绘制CsWRKY32基因的结构;应用SMART软件预测WRKY结构域,利用NetPhos 2.0 Server进行磷酸化位点预测,PORTII软件预测基因的亚细胞定位。使用MEGA软件构建系统发育树,系统进化树选用邻位相接法(neighbor-joining),设置bootstrap检验的重复次数为1 000次。
2 结果与分析
2.1 CsWRKY32的cDNA克隆
CsWRKY32基因克隆以两叶一心的黄瓜叶片做实验材料,液氮速冻后提取RNA,如图1a所示,得到较为清晰的28S,18S和5.8S三条RNA条带,证明RNA提取完整,经ScanDrop200测试RNA浓度,得A260/280在2.0~2.2之间,证明RNA纯度较高。进一步应用表1引物进行RT-PCR克隆CsWRKY32,如图1b所示,除目的条带1 000 bp左右,还出现一条非特异性扩增条带,因此,我们割胶回收目的条带进行TA克隆,经蓝白斑筛选后,选择白斑,提取质粒进行酶切检测,如图1c所示,为BglⅡ及SpeⅠ酶切质粒的电泳图。出现目的条带送菌液测序。
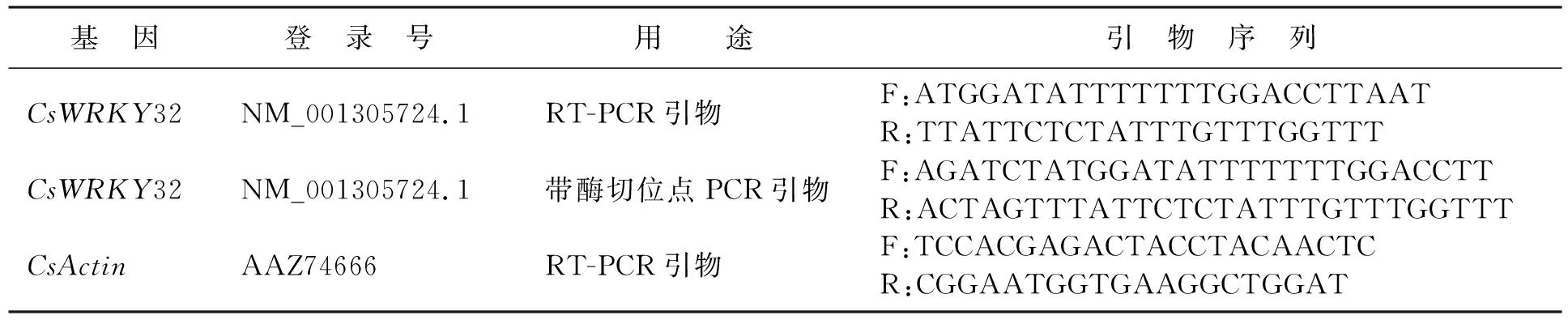
表1 PCR引物表Tab.1 Primers used for PCR assays

(a)—黄瓜RNA提取电泳图; (b)—CsWRKY32逆转录PCR电泳图; (c)—TA克隆后双酶切电泳图图1 CsWRKY32的基因cDNA克隆电泳图Fig.1 cDNA clone of CsWRKY32 gene
2.2 CsWRKY32基因的生物信息学分析
2.2.1CsWRKY32的基因结构及序列分析
CsWRKY32的cDNA开放阅读框全长975 bp,如图2a显示,由5个外显子和4个内含子组成,外显子1、2、3、4、5大小分别为1~84、196~264、730~1068、1948~2064、2544~2909 bp;该基因编码的蛋白预测由324个氨基酸组成, WRKY结构域进行预测结果表明:CsWRKY32蛋白含有一个WRKY结构域,位于蛋白的166个氨基酸到226个氨基酸之间(图2b)。依据Eulgem[4]等 的分类方法,属于Ⅱ类WRKY转录因子。PORTII软件进行亚细胞定位预测后,结果表明该蛋白60.9%定位于细胞核中,17.4%定位于细胞质,13.0%定位于细胞支架,4.3%定位于高尔基体,4.3%定位于线粒体。这一结果符合CsWRKY32是转录因子的特性。

图2 预测CsWRKY32的基因结构及蛋白质结构域Fig.2 Analysis of CsWRKY23 gene structure and prediction of WRKY domain
2.2.2CsWRKY32预测蛋白基本性质分析
应用 http:∥web.expasy.org/protparam/网站对CsWRKY32蛋白进行理化性质分析:CsWRKY32蛋白的等电点为6.35、分子量为36.3 kDa;其中带有负电荷的氨基酸(Asp+Glu)46个,带正电荷的氨基酸(Arg+Lys)44个,平均亲水系数(grand average of hydropathicity,GRAVY)为-0.766,脂肪系数(aliphatic index)为71.02,通常认为平均亲水系数越低,蛋白亲水性越强[5],因此,预测CsWRKY32是一个亲水蛋白。应用ProtScale网站对CsWRKY23蛋白做亲疏水性分析,氨基酸标度选Hphob.Kyte & Doolittle为默认值,如图3所示,该蛋白的324个氨基酸的亲疏水性分析结果表明,氨基酸标度的最大值是第308位氨基酸的2.289,氨基酸标度最小值是119位氨基酸的-2.911。应用Expasy网站的Swiss-Model工具进行蛋白质的三维结构的预测,并用Swiss PDB viewer软件显示,预测的三维结构有5个β折叠片(图4)。

图3 CsWRKY32的亲水性、疏水性分析Fig.3 Hydrophobic or hydrophilic property of CsWRKY32

图4 CsWRKY32的三维结构预测Fig.4 Prediction of 3-D structure of CsWRKY32
利用NetPhos 2.0 Server 软件[6-7]对CsWRKY32的蛋白序列进行潜在的磷酸化位点预测,结果表明, 该蛋白含有潜在的丝氨酸Ser、苏氨酸Thr和酪氨酸Tyr磷酸化位点,其中磷酸化位点数目最多是Ser,为20个,其次为Tyr,有6个,最少的为Thr,有4个。
2.2.3 CsWRKY32系统发育分析
利用NCBI的BLAST功能在UniProKB数据库中与CsWRKY32序列比对,获得得分较高的WRKY蛋白10个,如图5所示,分别是AtWRKY18(Q9C5T4.2)、AtWRKY60(Q9SK33.1)、AtWRKY40(Q9SAH7.1)、OsWRKY76(Q6IEK5.1)、OsWKRY62(Q6EPZ0.1)、AtWRKY47(Q9ZSI7.2)、AtWRKY42(Q9XEC3.1)、AtWRKY9(Q9C9F0.1)、AtWRKY72(Q9LXG8.1)和AtWRKY36(Q9CAR4.1),系统发育树如图5所示,结果表明AtWRKY40与CsWRKY32是同源基因,这与我们之前的研究结果[8]吻合。

图5 CsWRKY32的系统发育树Fig.5 Phylogenetic analysis of CsWRKY32
3 讨 论
WRKY转录因子是高等植物中最大的转录因子家族之一,具有特殊的WRKYGQK保守的结构域[9]。在植物的一生中生物胁迫与非生物胁迫时有发生,诸多的研究表明WRKY转录因子参与了干旱[10-11]、高盐[12]、低温[13-14]等非生物胁迫,并在植物的抗逆过程中起到了重要的调控作用,这为改良设施环境内园艺作物的产量和品质提供了新思路。
随着黄瓜基因组、转录组测序的完成, 以及生物信息学的发展[15], 以黄瓜为研究对象揭示WRKY转录因子的功能的报道逐渐增多, 李胜男等[16]揭示了黄瓜WRKY30在霜霉威胁迫下的表达变化及功能, 张颖等[17]揭示了黄瓜CsWRKY23这个含有2个WRKY结构域的基因响应低温胁迫, 并且对其蛋白的功能进行了生物信息学预测。 但目前对单一WRKY转录因子的功能研究较多, 对于其调控的网络通路、上下游作用因子尚不明确[18-19]。 因此, 要进一步借助组学及生物信息学的工具对WRKY转录因子的调控网络进一步预测, 进而利用分子生物学、遗传学以及生物化学等手段验证其网络节点的作用。
4 结 语
本研究表明,黄瓜CsWRKY32基因开放读码框全长975 bp,含有一个WRKY结构域,属于类ⅡWRKY转录因子,与拟南芥AtWRKY40同源。车永梅等[10]研究表明,AtWRKY40响应干旱信号,参与干旱胁迫反应;这与我们前期在黄瓜上的研究结果不尽相同,Ling等[8]在黄瓜幼苗期利用半定量RT-PCR研究CsWRKY32发现,其并未响应干旱等非生物胁迫,但该基因在黄瓜结果期是否响应干旱胁迫的研究尚未见报道。此外,AtWRKY40参与植物对抗胁迫的过程,并在调控胁迫响应的编码叶绿体及线粒体蛋白的核基因中起了重要作用[20]。这些为继续研究黄瓜CsWRKY32基因的功能提供了思路。
