多交叉置换扩增技术在单增李斯特菌检测中的应用及评价
2018-04-04,,,,,
, , , ,,
单增李斯特菌(L.monocytogenes)是一种革兰阳性、兼性厌氧的食源性致病菌,广泛分布于自然界,常见于生冷食品中[1]。它主要通过污染食品使老年人、孕妇、新生儿和免疫力低下等易感人群感染,并诱发败血症、脑膜炎、早产甚至死亡等严重病发症[2]。因此,简单、快速、敏感和特异的检测方法对李斯特菌的监测尤为重要。传统的分离培养方法是检测单增李斯特菌的金标准,但其过程繁琐、耗时长[3]。随后,聚合酶链式反应(PCR)、多重PCR和荧光定量PCR等虽优于分离培养方法,但仍然耗时、繁琐且受昂贵实验室设备的限制[4-5]。相比于PCR方法,恒温扩增检测方法克服了以上劣势并且能够在野外、临床和实验室中高效地检测目的病原菌[6]。多交叉置换扩增(MCDA)是本实验室近期建立的一种新型恒温扩增技术[7],它能够在恒温(60~67 ℃)条件下、1 h内快速、敏感和特异地扩增核酸,明显提高了检测效率。
在本实验中,以单增李斯特菌种特异性基因lmo0733为靶标,应用MCDA方法建立了一个快速、敏感和有效的诊断方法,并验证了该方法的特异性和敏感性。同时与LAMP和CPA方法进行了检测阈值的比较,评价了本方法对实际样本的检测能力。
1 材料与方法
1.1材料
1.1.1菌株55株单增李斯特菌和28株非单增李斯特菌被用于本研究,见表1。所有菌株使用前在脑心浸液(BHI)琼脂平板37 ℃过夜生长。
1.1.2试剂与仪器FRASER BROTH BASE、BRILLIANCETMLISTERIA AGAR BASE培养基购自英国OXOID公司;API Listeria生化试剂条购自法国bioMérieux公司;脑心浸液购自北京陆桥技术有限公司;细菌基因组提取试剂盒(Bacteria Gene DNA kit)购自北京康为世纪生物科技有限公司;DL100DNA Marker购自大连宝生物公司;Loopamp○RDNA反应试剂盒与Loopamp○R荧光检测试剂购自北京葵沫生物科技有限公司。凝胶成像系统(GEL Doc2000)购自美国Bio-rad公司;Loopamp○R实时浊度仪LA-320C购自于荣研生物科技(中国)公司;引物合成由北京擎科生物科技公司完成。
表1本研究所使用的菌株
Tab.1Bacterial strains used in this study


aU,未知血清型;bATCC,美国标准生物品收藏中心;NCTC,国际生物品收藏中心;ICDC,中国疾病预防控制中心传染病预防控制所。
aU,unidentified serotype.bATCC, American Type Culture Collection; NCTC, National Collection of Type Cultures; ICDC, National Institude for Communicatable Disease Control and Prevention, Chinese Center for Disease Control and Prevention.
1.1.3DNA模板制备细菌基因组按试剂盒说明书进行提取,制备好的菌株DNA模板保存于-20 ℃备用。
1.2方法
1.2.1引物设计本研究单增李斯特菌EGD-e菌株的lmo0733基因(Genbank number: NC_003210.1)作为检测靶标,使用PRIMERPRIMER 5.0 软件设计引物,序列见表2。
1.2.2单增李斯特菌-MCDA检测MCDA反应体系为25 μL:F1和F2引物各0.4 mmol/L,C1和C2引物各0.8 μmol/L,R1、R2、D1和 D2引物各1.2 μmol/L,CP1和CP2引物各2.4 μmol/L,2×reaction mix 12.5 μL,Loopamp荧光检测试剂12.5 μL,BstDNA聚合酶(10U)1.25 μL,DNA模板1 μL。MCDA产物采用三种方法判断结果:荧光染料的颜色变化观察、琼脂糖凝胶电泳和Loopamp 实时荧光浊度仪LA-320C(Eiken Chemical Co., Ltd, Japan)浊度检测。
表2本研究使用的单增李斯特菌-MCDA引物
Tab.2L. monocytogenes-MCDA primers used in this study

引物Primers序列Sequence(5′⁃3′)长度LengthCP1ACAGTCCTTGCTCCCATTTAGA⁃AGAAAT⁃TGCCATCAAACTGAA43merCP2GCTTGAAACACCAGTAAGCACT⁃TTCG⁃GAAATTGCTTTTACATCA44merF1AAATCAAAAGGACTTTCGCA20ntF2CAAACTGTAAGTTTATAATCTCCAG25ntC1ACAGTCCTTGCTCCCATTTAGA22ntD1GATTGTTTGTCGCACCACA19ntR1ATATCGGAATCAGGAACTG19ntC2GCTTGAAACACCAGTAAGCACT22ntD2CTTGGAGAAACTGTTATGGT20ntR2GTTAATCTCCATATCGGAAGT21ntP1AGAAATTGCCATCAAACTGAA21ntP2TTCGGAAATTGCTTTTACATCA22nt
单增李斯特菌-MCDA最佳反应条件确定:分别在60 ℃~67 ℃ 8个温度下恒温扩增1 h,然后95 ℃加热5 min后终止反应。实验使用单增李斯特菌EGD-e作为阳性对照,猪链球菌(革兰阳性菌)和肠侵袭性大肠杆菌(革兰阴性菌)作为阴性对照,蒸馏水作为空白对照,各取1 μL DNA模板用于实验。
1.2.3单增李斯特菌-MCDA方法的特异性和敏感性验证55株单增李斯特菌和28株非单增李斯特菌株(表1)用于确认MCDA方法的特异性。
将EGD-e 菌株DNA进行倍比稀释(10ng、10pg、10fg、1fg和0.1fg)来评估MCDA方法的检测下限。每个反应需1 μL稀释好的模板,实验至少重复两次。同时比较MCDA、LAMP和CPA三种方法的敏感性。其中单增李斯特菌-LAMP和单增李斯特菌-CPA检测下限值来自参考文献[6, 8]。
1.2.4MCDA、LAMP、CPA和PCR方法对鼠粪便增菌培养物的检测能力比较本实验室另一项研究中使用ISO11290-1方法[6]对153份鼠肠道粪便进行了单增李斯特菌检测,结果为24份单增李斯特菌阳性,129份为单增李斯特菌阴性(结果未发表)。将该研究中153份粪便标本在Fraser培养基中的增菌培养物1 mL提取DNA(100 ℃金属浴10 min),同时使用针对单增李斯特菌的MCDA、LAMP、CPA 和PCR方法进行检测。其中LAMP、CPA和PCR的操作方法见参考文献[6, 8-9]。
2 结 果
2.1单增李斯特菌-MCDA检测引物该方法共5对引物,其引物特异性通过 NCBI BLAST (Basic Local Alignment Search Tool) 验证,具体信息见表2。
2.2单增李斯特菌-MCDA产物的检测与验证阳性扩增结果如图1A和1B。在扩增反应60 min后,产物颜色由亮灰色变为绿色;在2%的琼脂糖凝胶电泳上显示为典型的阶梯状分布图像。仅单增李斯特菌分离阳性的反应管出现阳性扩增结果,而空白对照和阴性对照无上述现象。最佳反应温度,本研究的其它评估检测均在此温度下进行。
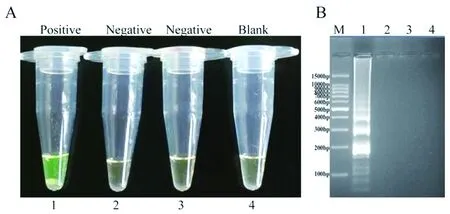
(A)单增李斯特菌MCDA反应管的颜色变化:1,阳性扩增;2、3和4分别为阴性对照(猪链球菌和侵袭性大肠杆菌)和空白对照。(B)单增李斯特菌MCDA产物的琼脂糖凝胶电泳图结果:1,单增李斯特菌扩增产物;2,猪链球菌(阴性对照)扩增产物;3,侵袭性大肠杆菌(阴性对照)扩增产物;4,空白对照;M,100 bp DNA marker。(A) Color change of the L. monocytogenes-MCDA tubes; tube 1, positive amplification; tube 2, 3, 4, negative control (Streptococcus suis), negative control (Enteroinvasive E. coli) and blank control, respectively. (B) 2% agarose gel electrophoresis of the lmo0733-MCDA products; lane 1, MCDA products of L. monocytogenes; lane 2, MCDA products of Streptococcus suis (negative control); lane 3, MCDA products of Enteroinvasive E. coli (negative control); lane 4, blank control; lane M, DNA marker DL 100 bp.图1 MCDA产物的验证和鉴定Fig.1 Verification and identification of MCDA products
2.3单增李斯特菌-MCDA方法的最佳扩增温度如图2所示,61 ℃为单增李斯特菌MCDA方法的
2.4单增李斯特菌-MCDA方法特异性和敏感性特异性评估如图3所示,单增李斯特菌株均为阳性扩增结果(在琼脂糖凝胶电泳中呈现典型阶梯状分布图像),非单增李斯特菌为阴性结果。单增李斯特菌-MCDA方法的敏感度评估结果如图4所示,MCDA的检测下限为10 fg/反应,其中10 ng、10 pg和10 fg浓度的核酸模板分别于12、15和24 min反应时间即可检测到。
通过已有文献报道和本研究方法的敏感度检测,LAMP、CPA和MCDA方法对lmo0733 的检测下限分别为250 fg/反应、2.5 pg/反应和 10 fg/反应[11, 14]。
2.5MCDA、LAMP、CPA和PCR方法对鼠粪便标本增菌培养物的检测比较检测结果见表4。MCDA的检测能力优于LAMP、CPA和PCR方法,其分离结果与传统分离培养技术得出的24份阳性分离株一致。
表4MCDA、LAMP、CPA和PCR方法对鼠粪便标本增菌培养物的检测
Tab.4Identification of L. monocytogenes for the rat feces samples by MCDA, LAMP, CPA and PCR methods

No.ofL.monocytogenespositivesamples(阳性样本数)PCRCPALAMPMCDASecondenrichmentbrothsample∗(二次增菌液样本)1281724
*153份老鼠肠道粪便增菌液样本,传统分离培养方法检测为24份单增李斯特菌阳性。
*24L.monocytogenespositive second enrichment broth samples were come from the 153 rat intestinal feces samples based on culture-biotechnical method.
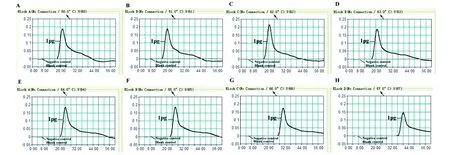
MCDA反应通过实时浊度检测进行分析,并显示相应的DNA浓度曲线。阈值> 0.1视为阳性扩增。在不同温度(60-67 ℃)下获得8个动力学图(A-H),每个反应中模板为1 pg,A到F图显示出良好的扩增。The MCDA reactions were analyzed by means of real-time turbidity detection and the corresponding curves of DNA concentrations were shown in the figure. The threshold value of >0.1 was regarded to be positive. Eight kinetic graphs (A-H) were obtained at different temperature (60-67 ℃)with L. monocytogenes DNA at the level 1 pg per reaction and from A to F graphs displayed robust amplification.图2 MCDA方法的最佳反应温度Fig.2 The optimal temperature for MCDA assay
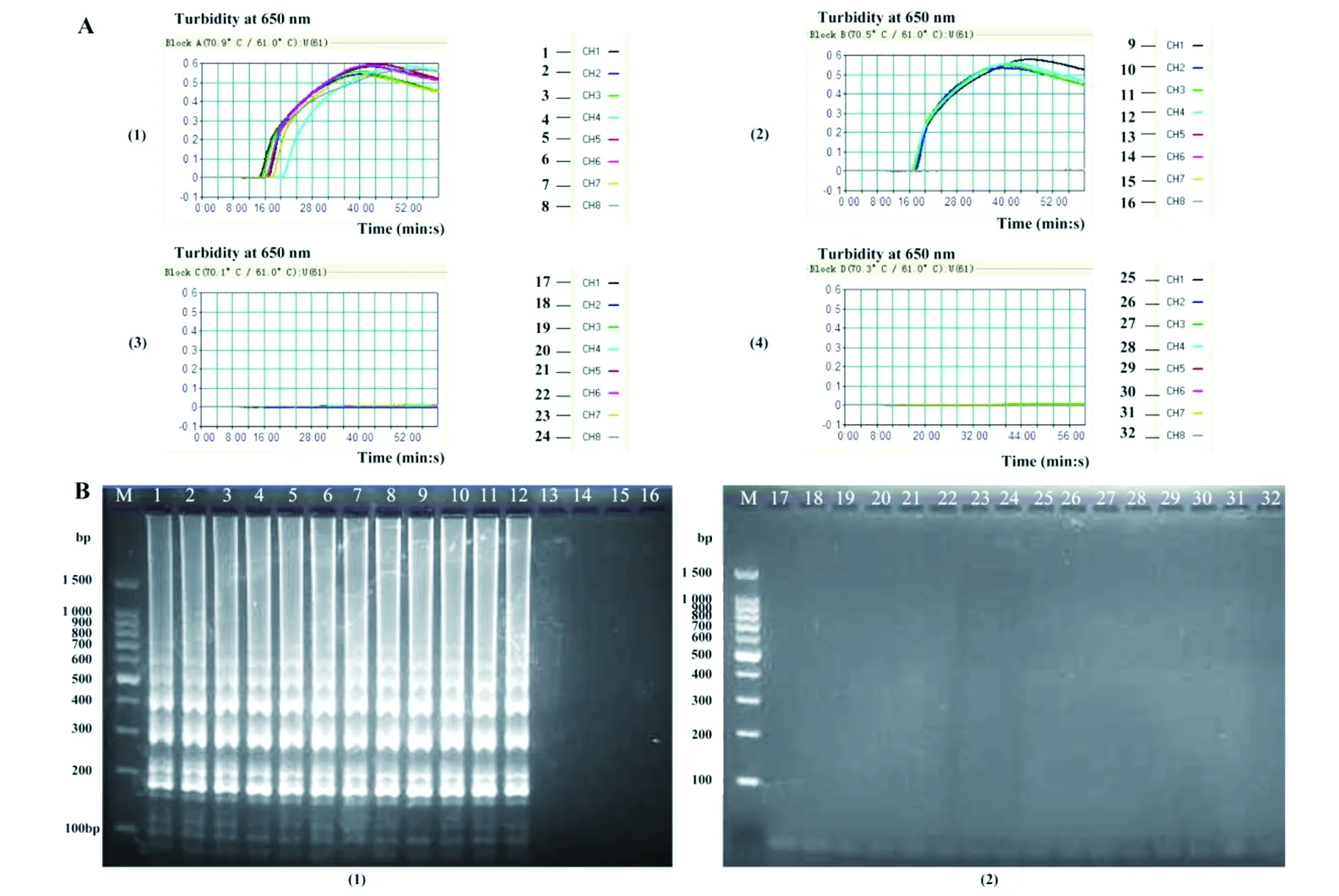
(A1-4)实时浊度检测图及相应DNA浓度曲线 阈值>0.1视为阳性扩增。(B1-4)2%琼脂糖凝胶电泳成像图,阳性扩增为典型阶梯图像 1-12,单增李斯特菌血清型1/2a(EGD-e)、1/2a(ATCC51772)、1/2b(ATCC-BAA-2658)、1/2c(ATCC51779)、3a(ATCC51782)、3b(ICDC)、4a(ATCC19114)、4b(ATCC19115)、4c(ATCC19116)、4d(ATCC19117)、4e(ATCC19118)、7(NCTC10890);13-17,其它李斯特菌参考菌株-绵羊李斯特菌(ATCCBAA-678)、威尔李斯特菌(ATCC35897)、英诺克李斯特菌(ATCC-BAA-680)、格氏李斯特菌(ATCC25402)、西尔李斯特菌(ATCC35967);18-32,猪链球菌、粪链球菌、肠球菌、肺炎链球菌、副伤寒沙门菌,类志贺邻单胞菌、肠杆菌、普通变形杆菌、志贺菌、肠致病性大肠杆菌、肠产毒性大肠杆菌、肠聚集性大肠杆菌、肠侵袭性大肠杆菌、肠出血性大肠杆菌。M,DL100-bp DNA marker。(A1-4) Specificity of L. monocytogenes-MCDA was detected by real-time measurement of turbidity and the corresponding curves of DNA concentrations were shown in figure. The threshold value of >0.1 was considered to be positive. (B1-2) The positive products of MCDA were able to produce a ladder-like pattern by 2% agarose gel eletrophoresis. Line (lane) 1-12, L. monocytogenes of serovar 1/2a (EGD-e),1/2a(ATCC51772),1/2b (ATCC-BAA-2658), 1/2c(ATCC51779),3a(ATCC51782),3b(ICDC),4a(ATCC19114), 4b(ATCC19115), 4c(ATCC19116), 4d(ATCC19117), 4e(ATCC19118), 7(NCTC10890); line(lane) 13-17, other Listeria reference strains of L. ivanovii(ATCCBAA-678), L. welshimeri(ATCC35897), L. innocua(ATCC-BAA-680), L. grayi(ATCC25402), L. seeligeri(ATCC35967); line(lane), 18-32, non-Listeria strains of Streptococcus suis, Streptococcus faecalis, Streptococcus oralis, Enterobacter cloacae, Streptococcus pneumoniae, Salmonella paratyphi, Plesiomonasshigelloides, Enteric bacilli, Proteusbacillus vulgaris, Shigelladysenteriae, Enteropathogenic E. coli, Enterotoxigenic E. coli, Enteroaggregative E. coli, Enteroinvasive E. coli, Enterohemorrhagic E. coli. Lane M, DL100-bp DNA maker.图3 不同菌株验证单增李斯特菌-MCDA方法特异性Fig.3 Specificity of L. monocytogenes-MCDA detection for different strains
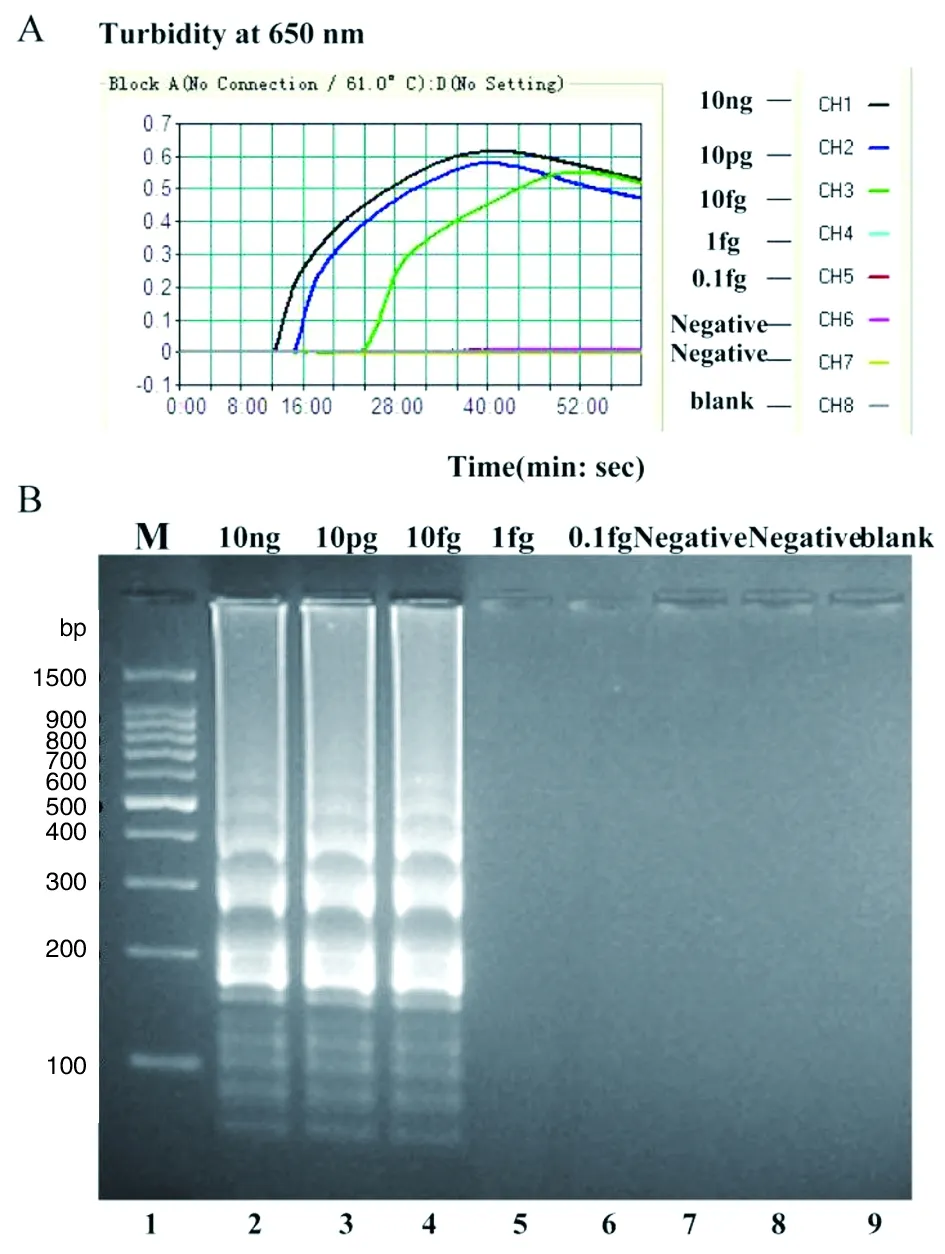
(A)敏感性实时浊度检测图。MCDA方法的检测下限为10 fg/反应。(B) lmo0733-MCDA敏感性验证的琼脂糖凝胶电泳图,阳性扩增为典型阶梯图像。1,DL 100 bp DNA marker;2-6, EDG-e DNA浓度分别为10 ng、10 pg、10 fg、1 fg、0.1 fg;7,阴性对照(猪链球菌);8,阴性对照(肠侵袭性大肠杆菌);9,空白对照。(A) Sensitivity of lmo0733-MCDA was detected by real-time measurement of turbidity. The LoD for MCDA assay was 10 fg genomic DNA per reaction. (B)Sensitivity of lmo0733-MCDA was detected by 2% agrose gel electrophoresis and positive products produced a ladder-like pattern. Lane 1, DL 100-bp DNA marker. 2-6, 10 ng, 10 pg, 10 fg, 1 fg, 0.1 fg of EDG-e DNA; Lane 7, negative control (Streptococcus suis); Lane 8, negative control (Enteroinvasive E.coli), Lane 9, blank control.图4 使用连续倍比稀释的单增李斯特菌EGD-e DNA模板验证lmo0733-MCDA方法的敏感性Fig.4 Sensitivity of lmo0733-MCDA assays using serially diluted genomic DNA with L. monocytogenes strain EGD-e as template
3 讨 论
本研究以单增李斯特菌种特异性基因lmo0733为靶标,建立了一种快速、敏感和特异的多交叉置换扩增(MCDA)检测方法。该方法操作简便,仅需在61 ℃维持恒温1 h。单增李斯特菌-MCDA方法的敏感度为10 fg,分别是LAMP和CPA方法的25倍和250倍[6, 8]。同时,该方法的高敏感度也在实际标本应用评价中得到了验证。153份鼠粪便标本增菌培养物样本中,MCDA方法的检测能力优于LAMP、CPA和PCR方法,其检测结果与传统分离培养方法一致(24份单增李斯特菌阳性),且仅需2次增菌液的水煮模板即可检测。
此外,该方法具有良好的特异性。单增李斯特菌检测的靶基因通常是hlyA和iap[12, 16-17],但它们并非单增李斯特菌所特有,也存在于绵羊李斯特菌和希尔李斯特菌[2-3]。本研究靶标lmo0733是单增李斯特种特异性基因,并且在83株菌特异性评估中也成功地被验证。因此,单增李斯特菌-MCDA方法能够方便、快速、有效的检测单增李斯特菌。
本研究可用于食品行业、临床标本中单增李斯特菌的检测,为监测和预防控制提供技术支持。
参考文献:
[1] Ma AJ, Wang Y, Wang Y, et al. Molecular epidemiological characteristics ofListeriamonocytogenesisolated from raw meat samples in some regions of Beijing, China[J]. Chin J Zoonoses, 2015, 31(5): 403-407. DOI:10.3969/cjz.j.issn.1002-2694.2015.05.003 (in Chinese)
马爱静, 王艳, 王毅, 等. 北京市一些地区生肉标本中单增李斯特菌的分离及其分子流行病学特征分析[J]. 中国人兽共患病学报, 2015, 31(5): 403-407.
[2] Goulet V, Hebert M, Hedberg C, et al. Incidence of listeriosis and related mortality among groups at risk of acquiring listeriosis[J]. Clin Infect Dis, 2012, 54(5): 652-660. DOI:10.1093/cid/cir902
[3] Zhang W, Hughes A, Wilt G, et al. The BAX PCR assay for screeningListeriamonocytogenestargets a partial putative gene lmo2234[J]. J Food Prot, 2004, 67(7): 1507-1511.
[4] Somer L, Kashi Y. A PCR method based on 16S rRNA sequence for simultaneous detection of the genusListeriaand the speciesListeriamonocytogenesin food products[J]. J Food Prot, 2003, 66(9): 1658-1665. DOI:10.4315/0362-028X-66.9.1658
[5] O’grady J, Ruttledge M, Sedano-Balbás S, et al. Rapid detection ofListeriamonocytogenesin food using culture enrichment combined with real-time PCR[J]. Food Microbiol, 2009, 26(1): 4-7. DOI: 10.1016/j.fm.2008.08.009
[6] Wang Y, Wang Y, Ma A, et al. Rapid and sensitive detection ofListeriamonocytogenesby cross priming amplification oflmo0733 gene[J]. FEMS Microbiol Lett, 2014, 361(1): 43-51. DOI: 10.1111/1574-6968.12610
[7] Wang Y, Wang Y, Ma AJ, et al. Rapid and sensitive isothermal detection of nucleic-acid sequence by multiple cross displacement amplification[J]. Sci Rep, 2015, 5: 11902. DOI: 10.1038/srep11902
[8] Wang Y, Wang Y, Lan R, et al. Multiple endonuclease restriction real-time loop-mediated isothermal amplification: A novel analytically rapid, sensitive, multiplex loop-mediated isothermal amplification detection technique[J]. J Mol Diagn, 2015, 17(4): 392-401. DOI: 10.1016/j.jmoldx.2015.03.002.
[9] Ryu J, Si HP, Yeom YS, et al. Simultaneous detection ofListeriaspecies isolated from meat processed foods using multiplex PCR[J]. Food Control, 2013, 32(2): 659-664. DOI: 10.1016/j.foodcont.2013.01.048
[10] Wang D, Zhang G, Lu C, et al. Rapid detection ofListeriamonocytogenesin raw milk with loop-mediated isothermal amplification and chemosensor[J]. J Food Sci, 2011, 76(9): M611-M615. DOI: 10.1111/j.1750-3841.2011.02383.x
[11] Liu D, Ainsworth AJ, Austin FW, et al. Use of PCR primers derived from a putative transcriptional regulator gene for species-specific determination ofListeriamonocytogenes[J]. Int J Food Microbiol, 2004, 91(3): 297-304. DOI: 10.1016/j.ijfoodmicro.2003.07.004
[12] Gouin E, Mengaud J, Cossart P. The virulence gene cluster ofListeriamonocytogenesis also present inListeriaivanovii, an animal pathogen, andListeriaseeligeri, a nonpathogenic species[J]. Infect Immun, 1994, 62(8): 3550-3553.
[13] Bubert A, Köhler S, Goebel W. The homologous and heterologous regions within theiapgene allow genus-and species-specific identification ofListeriaspp. by polymerase chain reaction[J]. Appl Environ Microbiol, 1992, 58(8): 2625-2632.
