黄海高眼鲽卵巢发育特征及卵径分布*
2018-04-03滕广亮单秀娟金显仕戴芳群陈云龙
滕广亮 单秀娟 金显仕 戴芳群 陈云龙 杨 涛
黄海高眼鲽卵巢发育特征及卵径分布*
滕广亮1,3单秀娟2,3①金显仕2,3戴芳群3陈云龙3杨 涛3
(1. 南京农业大学无锡渔业学院 无锡 214081;2. 青岛海洋科学与技术国家实验室 海洋渔业科学与食物产出过程功能实验室 青岛 266071;3. 农业部海洋渔业可持续发展重点实验室 山东省渔业资源与生态环境重点实验室 中国水产科学研究院黄海水产研究所 青岛 266071)
本研究通过组织学观察,描述了黄海高眼鲽()卵母细胞发育特征及其退化过程。高眼鲽卵母细胞发育分为5个时相:第1时相为卵原细胞,细胞体积小,细胞质少,细胞核明显;第2时相卵母细胞细胞核附近出现卵黄核;第3时相由胞质外缘向内层逐渐产生液泡并生成卵黄颗粒,出现双层滤泡膜;第4时相卵母细胞内充满卵黄,细胞核向动物极移动,放射膜增厚;第5时相细胞核溶解,卵母细胞从滤泡膜中释放出来并发生水合作用;产卵期过后,卵巢发生退化,卵黄颗粒逐渐被吞噬,放射膜溶解断裂。通过比较卵巢中各时相卵母细胞组成比例,表明卵母细胞发育具有非同步性。Ⅳ、Ⅴ、Ⅵ-Ⅳ¢期卵巢内卵径(长径)呈单峰分布,优势粒径组分别为0.45~0.55 mm、0.60~0.65 mm和0.40~0.50 mm;Ⅴ¢期卵巢,卵径分布呈双峰型,峰值分别为0.50~ 0.55 mm和0.90~0.95 mm,水合卵母细胞与卵径较小的小生长期卵母细胞比例增大,呈现出明显的双峰分批产卵型特征。
高眼鲽;卵巢发育;组织学;卵径分布
鱼类繁殖是种群延续的基础,直接决定了其资源量变动。性腺发育是鱼类繁殖的关键过程,是鱼类把所获得的物质和能量用于繁殖再分配的过程。了解鱼类性腺发育特征以及性腺发育的调控因子,准确确定鱼类的产卵特性,对于鱼类繁殖生态、种群结构和资源增殖研究,以及掌握鱼汛和中心渔场的变动均具有重要意义。
近年来,受环境变化和人为因素的影响,很多鱼类生物学特征发生了显著变化,渔获个体小型化、低龄化日趋严重(宓崇道, 1997; 林龙山等, 2004; 李显森等, 2006; 张国政等, 2010),同时,伴随着繁殖生物学的相应变化(凌建忠等, 2005; 李建生等, 2015),性成熟提早、相对繁殖力提高已经是普遍现象(李城华, 1983; 曾玲等, 2005; 林龙山等, 2009)。
黄海高眼鲽()隶属于鲽形目Pleuronectiformes、鲽科Pleuronectidae、高眼鲽属,为冷温性底层鱼类,主要分布于33°N以北的海区(Wan, 1998),是黄、渤海鲆鲽类中数量最多的种类,也是黄海渔业生态系统中的主要种类。研究证明,黄海高眼鲽种群结构已经改变,其资源量明显下降,体长分布集中,优势体长减小,“小型化”明显(Shan,2012)。因此,本研究基于近年来高眼鲽黄海调查资料,对高眼鲽卵巢发育特征及卵径分布进行了分析,以期为黄海高眼鲽补充动态研究和资源的合理开发利用提供理论基础。
1 材料与方法
1.1 样品来源
高眼鲽样品来源于“北斗”号调查船2016年8月、10月、11月及2017年1月在黄海的渔业资源调查,取样站位见图1。样品采集159尾,体长为80~ 353 mm,体重为7~531 g。现场进行解剖留取卵巢,自卵巢血管面的前、中、后三部分各切取组织小块保留。采用Davidesons AFA固定液固定,24 h后换浓度为70%乙醇保存,组织学测定40尾。
图1 黄海高眼鲽样品采集点
1.2 组织切片
固定的卵巢组织经过自动脱水机(LEICA TP1020)脱水,二甲苯透明和浸蜡后,用包埋机(LEICA 1160)包埋,用半自动切片机(LEICA RM2145)切片,切片厚度为6 μm,自动染色机(SHANDON Varistain 24-4) 进行HE染色,每份样品非连续切片2张,用中性树胶进行封片。
1.3 卵巢发育观测
用ZEISS Scope.A1显微镜与配套的图像处理软件Axiovision LE64观察卵巢内卵母细胞的发育特征并进行时相组成分析。卵巢发育分期及卵母细胞时相的划分采用Мейeh BA(1939)的原则,同时参考楼允东(1980)和刘筠(1993)。每张切片统计视野为5~10个(约100~500个卵母细胞),以平均数的百分数表示。
1.4 卵径分布分析
取保存完好的卵巢左右2叶的前、中、后共六部分,随机取500~1000粒,在ZEISS Scope.A1显微镜下进行观察,用Axiovision LE64专业图像处理软件测量卵径(长径)。以0.05 mm分组间距统计卵径分布,各卵径组统计包括卵径组下限的卵母细胞,不包括卵径组上限的卵母细胞。
2 结果与分析
2.1 卵母细胞的发育特征
2.1.1 第1时相 卵原细胞或卵原细胞向初级卵母细胞过渡期。细胞圆形或椭圆形、体积小,卵径为17.40~ 48.42 μm,细胞质少,细胞核明显。核内染色质细丝状,形成稀疏的网。
2.1.2 第2时相 小生长期的初级卵母细胞。细胞体积变大,卵径为22.46~193.04 μm,呈多角形。细胞质嗜碱性,呈疏松微粒状,细胞核仁数增加,靠核膜内侧分布,核径为20.01~86.41 μm,细胞核周围出现生长环,强嗜碱性(图2A);后期卵膜稍微增厚,出现1层较薄的滤泡细胞,核仁外移到核膜边缘,胞质外围出现卵黄核(图2B)。
2.1.3 第3时相 大生长期的初级卵母细胞。细胞体积进一步增大,基本呈圆形,卵径为98.04~286.33 μm,核径为39.07~77.96 μm。细胞外出现2层滤泡膜,外层厚内层薄,界限不明显,放射膜开始形成。早期的卵母细胞细胞核呈不规则叶状,核仁多位于核膜内缘,细胞质弱嗜碱性。并且胞质边缘出现液泡,形成环状结构(图2C),随着卵母细胞体积的增大,液泡从细胞质边缘向内逐渐增多、变大;后期的卵母细胞放射膜逐渐增厚,核膜变得凹凸不平,大部分核仁在核膜边缘分布,少数分散在核中央,卵黄核消失,卵膜内缘液泡之间卵黄开始形成,随着生长逐渐增多(图2D)。
2.1.4 第4时相 发育晚期的初级卵母细胞。体积大幅增大,卵径为271.21~623.19 μm。在本时相早期,细胞核位于卵母细胞中央,核径为58.32~127.56 μm,核仁分散于核中央,并逐渐溶解,放射膜增厚为10.56~ 18.47 μm,除核周及靠近卵膜边缘含有较多嗜碱性细胞质外,其余充满卵黄颗粒(图2E);后期的卵母细胞核膜开始溶解,细胞核逐渐向卵膜孔方向移动,核仁逐渐消失,动物极形成,卵母细胞进入成熟期(图2F)。
2.1.5 第5时相 初级卵母细胞向次级卵母细胞过渡期。卵母细胞体积达到最大,卵径为420.12~806.24 μm。本时相早期,卵母细胞仍可见细胞核,核仁变成细小颗粒状,多聚集于中间,放射膜变薄,细胞质中充满粗大的卵黄颗粒(图2G);后期,卵黄颗粒变大并逐渐形成较大的卵黄板块,核膜、核仁溶解(图2H),成熟的卵从滤泡膜中释放出来,形成空滤泡(图2I)。即将排出的卵母细胞发生水合作用,游离于卵巢腔中,水合卵母细胞在石蜡切片上透明并收缩成阿米巴 形(图2J)。
2.1.6 退化卵母细胞 退化吸收前期,充满卵黄的卵母细胞卵膜界限不清,放射膜开始溶解,滤泡膜内2层滤泡细胞排列混乱,滤泡膜增厚,层数增加,有单个细胞游离出来,并且侵入细胞内,卵黄颗粒胶 液化,逐渐被分解,卵母细胞内开始出现不规则空 腔(图2K);退化后期,滤泡膜基本不存在,由于滤泡细胞的吞噬作用,靠近卵膜的卵黄粒基本消失,中间只剩下吸收的残余组织和少量未吸收卵黄颗粒,放射膜断裂,卵膜发生皱褶,最后断裂而消失(图2L)。
2.2 卵巢形态与组织学特征
2.2.1 Ⅰ期 卵巢整体大致呈细条状、透明,前部延伸短小,表面无血管或甚微弱。外观不能与雄性精巢区分。卵巢壁薄,为30.02~38.24 μm,细胞排列紧密、体积较小、形成明显的蓄卵片,其上主要为第1时相的卵原细胞以及发育早期的第2时相卵母细胞(图3A)。
2.2.2 Ⅱ期 卵巢体积增大,呈浅粉色或浅白色,前部稍大逐渐往后延伸,后端细长,呈圆锥形,表面可见微细的血管。卵巢内结缔组织和血管发达,卵巢壁较薄,为34.65~39.25 μm。卵母细胞发育整齐,为第1、2时相的卵母细胞(图3B)。
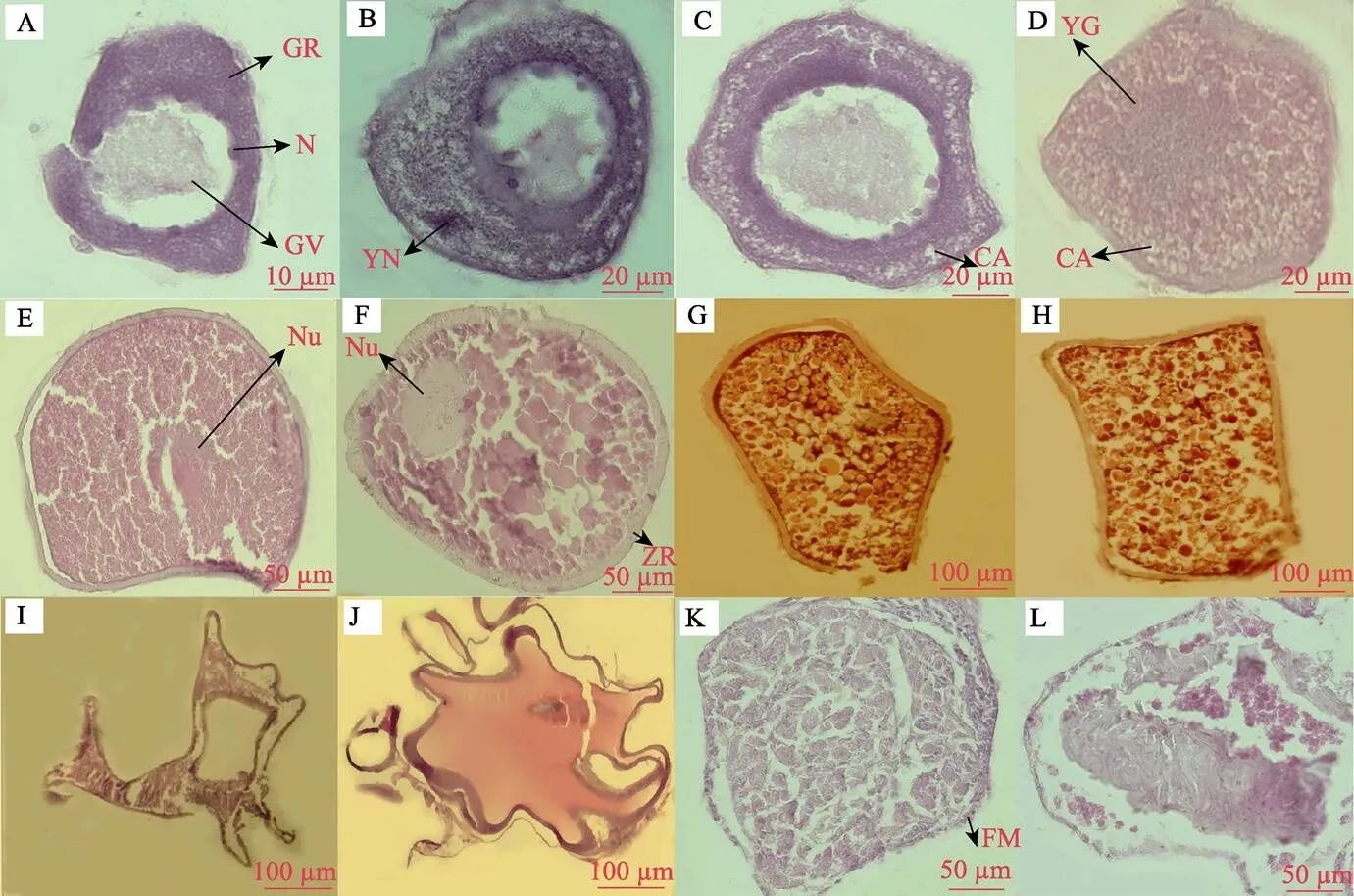
图2 各时相卵母细胞形态特征
A. 第2时相早期;B. 第2时相后期;C. 第3时相早期;D. 第3时相后期;E. 第4时相早期;F. 第4时相后期;G. 第5时相早期;H. 第5时相后期;I. 空滤泡;J. 水合卵母细胞;K. 早期退化卵母细胞;L. 后期退化卵母细胞;GR:生长环;GV:胚泡;CA:液泡;N:核仁;Nu:细胞核;YG:卵黄颗粒;YN:卵黄核;ZR:放射膜;FM:滤泡膜
A. Oocyte at early phase 2; B. Oocyte at late phase 2; C. Oocyte at early phase 3; D. Oocyte at late phase 3; E. Oocyte at early phase 4; F. Oocyte at late phase 4; G. Oocyte at early phase 5; H. Oocyte at late phase 5; I. Evacuated follicle;
J. Hydrated oocyte; K. Degenerated oocyte at early phase; L. Degenerated oocyte at late phaseGR: Growth Ring; GV: Geminal Vesicle; CA: Cortical Alveoli; N: Nucleolus; Nu: Nucleus; YG: Yolk Globules; YN: Yolk Nucleus; ZR: Zone Radiate; FM: Follicle Membrane
2.2.3 Ⅲ期 卵巢呈黄白色,体积明显增大,占据整个腹腔的1/2,总体呈扁平状,前段膨胀延长,呈三角形。肉眼可见黄色卵粒,卵子紧密连接于蓄卵片,较难剥离,表面血管丰富。卵巢内卵母细胞为圆形,体积增大,卵巢壁增厚,为46.37~116.43 μm,主要由第2时相晚期卵母细胞以及第3时相卵母细胞组成,也有出现第4时相早期卵母细胞(图3C)。
2.2.4 Ⅳ期 卵巢体积进一步增大、呈橘黄色或橘红色,体表可见明显隆起,占据腹腔的2/3。卵巢表面血管发达,前部三角形变得更加丰满,在腹腔内向后延伸明显。肉眼可见饱满卵粒,其中还出现少量半透明卵粒。卵巢中同时存在1、2、3、4、5五个时相的卵母细胞,其中第4时相卵母细胞占主要优势,卵巢壁为40.34~135.56 μm(图3D)。
2.2.5 Ⅴ期 卵巢进入临产期,充满整个体腔,松软而膨大,呈橘黄色,对鱼体腹部稍加压力,卵粒即能流出体外。卵粒清晰易辨、大而透明。此时卵巢内第5时相卵母细胞占主要成分,除此之外,还存在不同发育程度的第4时相卵母细胞和初积卵黄的第3时相卵母细胞以及处于小生长期的第1、2时相卵母细胞分布在大型卵母细胞之间。卵巢壁为35.17~74.24 μm (图3E)。Ⅴ期停留阶段较短,产完1次卵后卵巢处于Ⅵ-Ⅳ¢期。
2.2.6 Ⅵ-Ⅳ¢期 产卵后的卵巢外层包膜变成紫黄色,体积变小,卵巢腔间隙变大,仍然能看到有大量卵粒存在。卵巢内存在较多结缔组织,血管布满卵巢膜,卵巢壁较厚,为80.78~116.46 μm。卵母细胞排列较为稀松,具有大量第2时相卵母细胞、第3时相早期卵母细胞,以及充满卵黄的第4时相的卵母细胞和部分未排出的成熟的第5时相卵母细胞。此外,有空滤泡和呈泡沫状的退化卵(图3F)。Ⅵ-Ⅳ¢期停留时间不长便转入Ⅴ¢期,再次进行产卵。
2.2.7 Ⅴ¢期 外观和未产卵Ⅴ期没有明显差别,体积稍有减小,外观橘黄色,卵巢壁稍有松弛、柔软,卵巢壁为50.40~86.51 μm,卵粒彼此分离,透明卵的比例略有增加。主要由第4、5时相卵母细胞以及水合卵母细胞组成,同时,第2、3时相的卵母细胞变多(图3G),卵母细胞之间存在空滤泡以及排卵痕迹。
2.2.8 Ⅵ期 产完卵后的卵巢进入Ⅵ期,卵巢退化,体积和重量明显减小,血管丰富,呈紫红色,卵巢腔萎缩,卵巢膜松弛变厚,呈缩皱的囊状。排卵后卵巢成为中空状态,未排出的卵在卵巢周围,卵巢腔内有一些紫色粘浆液。卵巢有很多空滤泡、结缔组织和血管,后部空虚,前、中部尚有未成熟卵母细胞和少量的未排出的成熟卵母细胞。隔壁崩溃,未排出的成熟卵母细胞被吸收(图3H)。
2.2.9 Ⅵ-Ⅱ期 卵巢为深红色,基部颜色深,卵母细胞发育转入Ⅱ期,早期卵母细胞明显增加,卵巢腔内空滤泡和残留卵被吸收,还能见未吸收完的退化卵母细胞。卵母细胞发育较未产卵Ⅱ期不整齐,除了第1、2时相卵母细胞,还有少数已经开始积聚卵黄的发育到第3时相前期的卵母细胞。卵巢壁厚,为232.46~274.59 μm(图3I)。
2.2.10 退化卵巢 外观特征与Ⅵ-Ⅱ期卵巢相似,呈现暗红色,个体较大且饱满,卵巢松弛有明显褶皱。卵巢内有结缔组织,细胞排列较为紧密。卵母细胞退化,细胞内变为泡沫状,同时存在发育早期卵母细胞(图3J)。
2.3 卵巢中卵母细胞组成
Ⅰ期主要由第1、2时相卵母细胞组成,其中第1时相卵母细胞占绝对优势,85.05%。
Ⅱ期主要由第1、2时相卵母细胞组成,相比于I期卵巢,第2时相卵母细胞比例增加,为59.24%。
Ⅲ期主要由第2、3时相卵母细胞组成,第1时相卵母细胞比例下降为12.86%,并且出现第4时相早期卵母细胞,为12.89%。
Ⅳ期主要由第2、4时相卵母细胞组成,相比较Ⅲ期卵巢,第3时相卵母细胞比例下降为13.27%,第4时相卵母细胞增加为30.93%。
Ⅴ期主要第2、4时相卵母细胞组成,第4时相卵母细胞占绝对优势49.09%,同时,出现第5时相卵母细胞且部分已经发生水合作用。
Ⅵ-Ⅳ¢期中第2时相卵母细胞比例较高,为59.44%,其余各时相卵母细胞同时存在且比例接近。
Ⅴ’期卵巢中第4时相卵母细胞比例最高,第4、5时相卵母细胞比例有较大提高,分别为40.51%、24.85%,并且第5时相卵母细胞大部分处于水合 状态。
Ⅵ-Ⅱ期卵巢存在第1、2、3时相卵母细胞,其中第2时相卵母细胞占优势60.73%,并且第3时相卵母细胞占较高比例19.62%(表1)。
2.4 卵径分布
Ⅳ期卵巢中卵母细胞卵径呈单峰分布,卵径主要分布在0.45~0.55 mm。
Ⅴ期卵巢中卵母细胞呈单峰分布,卵径分布范围扩大,在0.70~1.15 mm间呈浅锯齿状分布,主要分布在0.50~0.70 mm,其中0.60~0.65 mm所占比例最高,为24.27%。
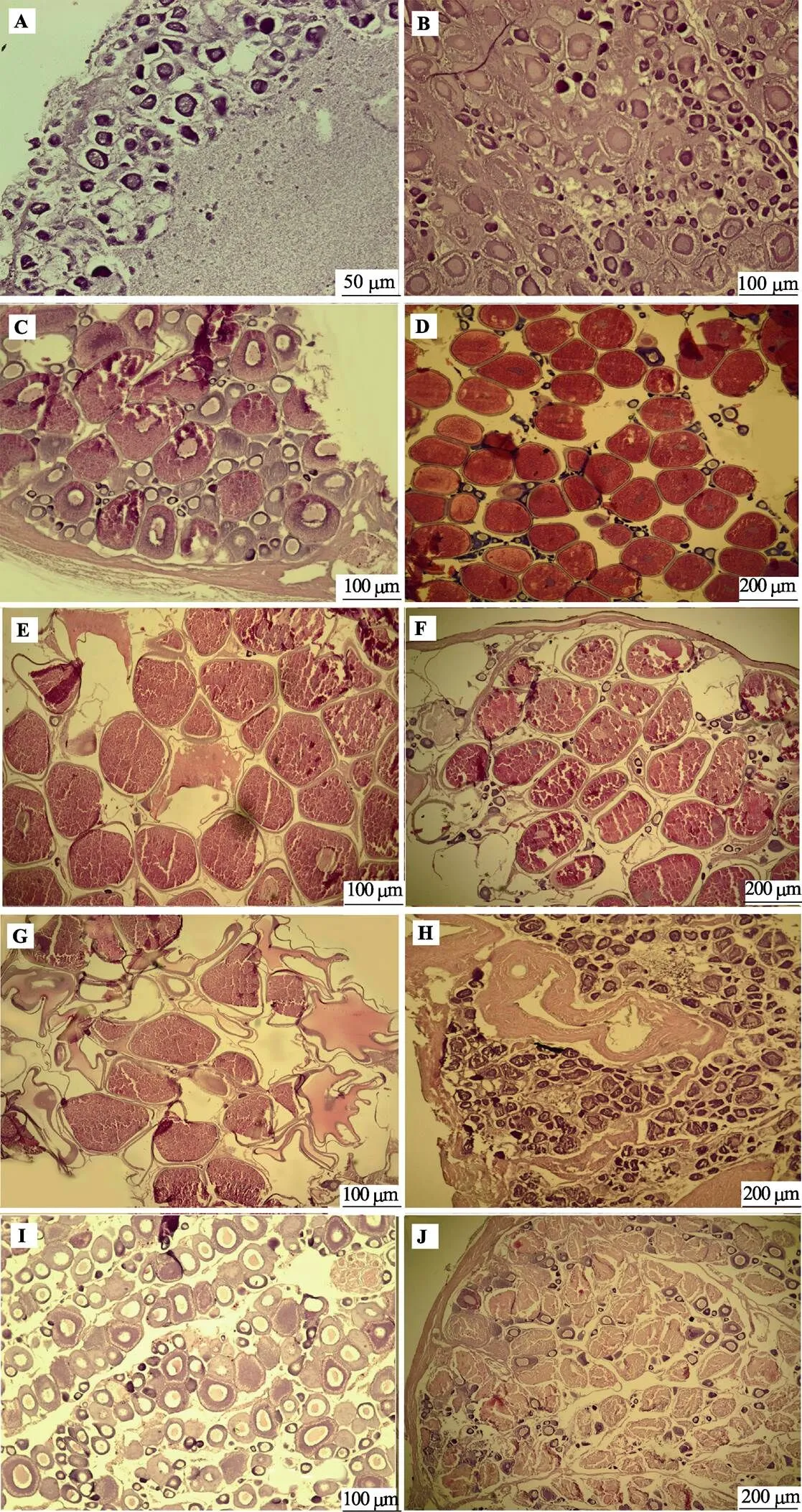
图3 各发育期卵巢
A:Ⅰ期;B:Ⅱ期;C:Ⅲ期;D:Ⅳ期;E:Ⅴ期;F:Ⅵ-Ⅳ’期;G:Ⅴ’期;H:Ⅵ期;I:Ⅵ-Ⅱ期;J:退化卵巢
A: Stage Ⅰ; B: Stage Ⅱ; C: Stage Ⅲ; D: Stage Ⅳ; E: Stage Ⅴ; F: Stage Ⅵ-Ⅳ’; G: Stage Ⅴ’; H: Stage Ⅵ; I: Stage Ⅵ-Ⅱ; J: Degenerated ovary
表1 各期卵巢中不同时相卵母细胞组成比例
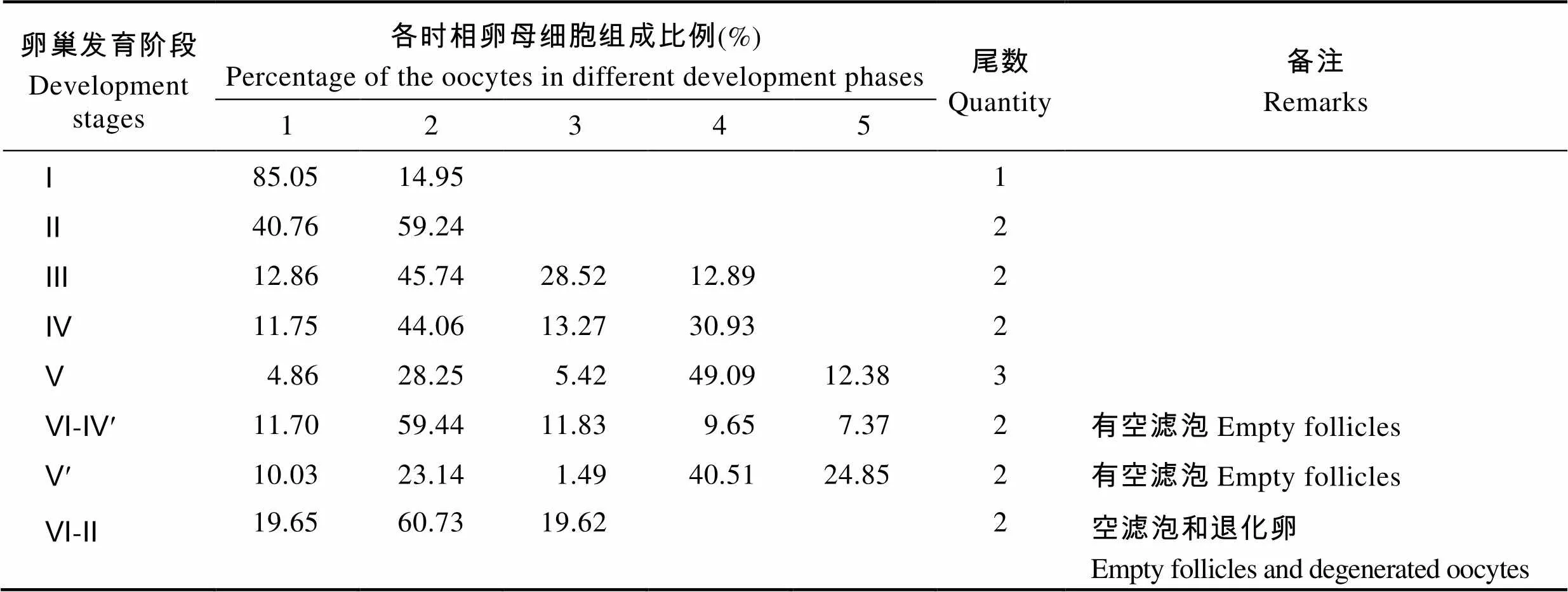
Tab.1 Percentage of the oocytes in different development phases at different stages
Ⅵ-Ⅳ¢期卵巢中卵母细胞呈单峰分布,卵径分布在0.40~0.50 mm,其中0.45~0.50 mm占比例最高,为37.77%。
Ⅴ’期卵巢中卵母细胞呈双峰分布,在0.50~0.55 mm和0.90~0.95 mm处形成峰值(图4)。水合卵母细胞以及处于小生长期的卵径较小的卵母细胞比例均有所提高。
3 讨论
3.1 卵母细胞的发育与退化
在硬骨鱼类中,由于遗传因素和长期环境影响,卵母细胞的发育和生长方式存在一定区别,其中卵黄和液泡的发生顺序在不同种类存在显著差异,这与不同的营养吸收方式有关(施瑔芳, 1988)。高眼鲽卵母细胞发育是先出现卵黄,随后液泡出现,与牙鲆()、半滑舌鳎()、宽体舌鳎()、圆斑星鲽()等相同(孙朝徽等, 2008; 柳学周等, 2009; 倪海儿等, 1999; 徐永江等, 2011);而大西洋牙鲆()、欧洲黄盖鲽()等(Merson, 2000; Htun-Han, 1978)卵母细胞发育过程中液泡、油滴和卵黄颗粒同时出现;鲻鱼()、小黄鱼()等卵母细胞发育时液泡首先出现,紧靠在核的外周,随着液泡中脂肪物质的积累,逐渐均匀的分散在细胞质的各个部位,卵黄首先在靠近卵膜边缘的细胞质中形成,逐步向中央填充(吴佩秋, 1981; 何大仁, 1998; 方永强等, 2004)。这种卵黄和液泡发生方式的差异,反映了卵母细胞发育过程中营养积累及代谢的差异,也直接决定了卵母细胞的发育速度和时间,种群不同是造成这种差异的原因,另外,与不同生态类群也有关(倪娜等, 2011)。高眼鲽卵母细胞第2时相随着卵黄核的出现,细胞外围出现1层滤泡膜,滤泡膜是鞘膜细胞层和颗粒细胞层组成的细胞结构,是鱼类合成卵巢类固醇激素的基础结构,而雌激素对于卵黄合成具有诱导作用(Young, 1983),随着卵母细胞发育,出现双层滤泡结构,滤泡上皮细胞突出许多微绒毛深入卵母细胞中,卵母细胞由此获得营养(Riehl, 1980)。当卵母细胞完全成熟时,由于微绒毛移出,滤泡膜脱离,卵母细胞营养积累结束。
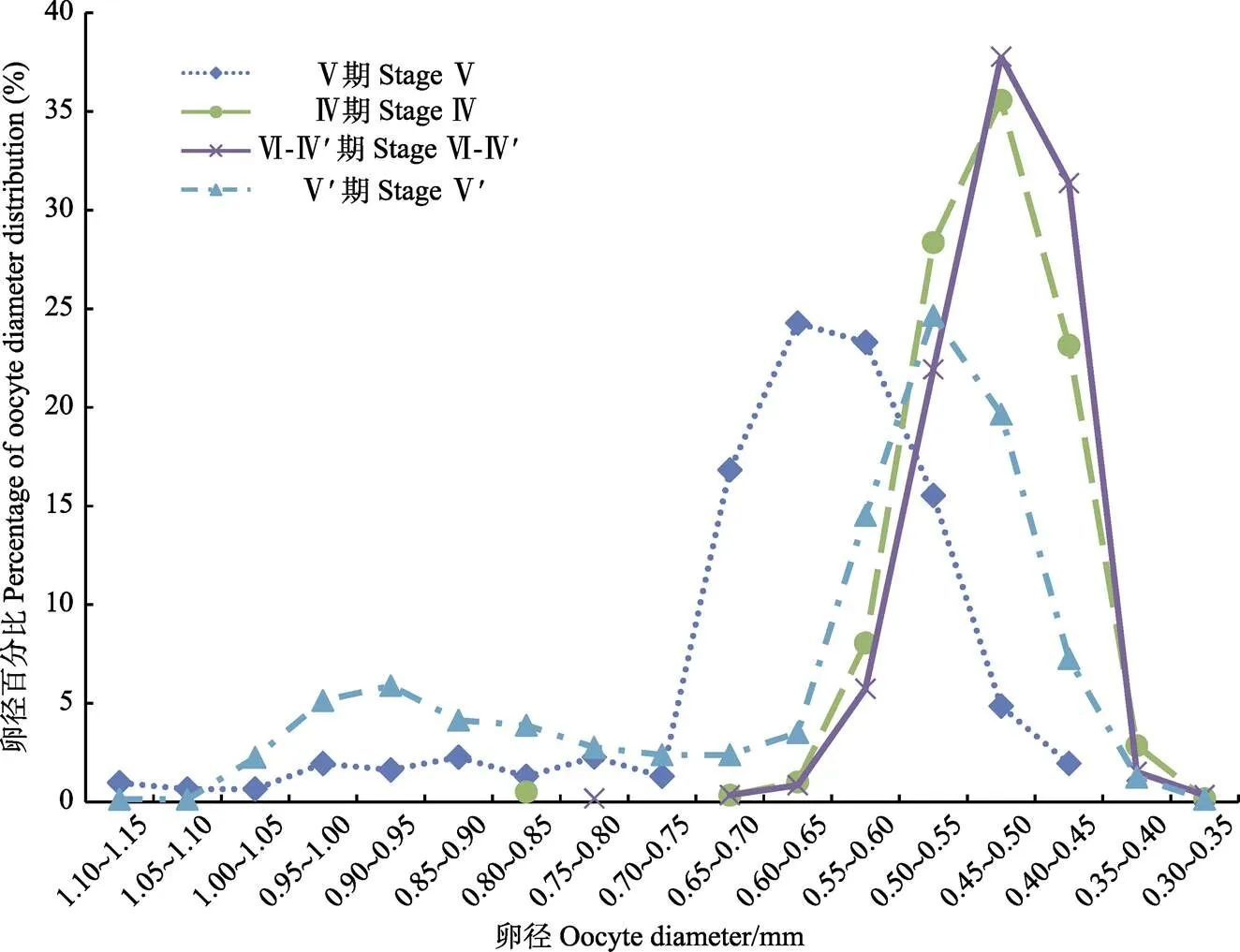
图4 各期卵巢的卵径分布
高眼鲽卵母细胞退化时滤泡细胞排列紊乱、体积变大,卵黄颗粒从边缘往中心逐渐变小、分解。该时期卵母细胞对不利的外界条件非常敏感,极易受到损伤(何大仁, 1981)。高眼鲽卵巢退化期样品主要采集于11月,此时水温下降,产卵季节结束,卵母细胞被吸收,卵巢退化。另外,卵巢退化可能与鱼类营养状态及其他外部环境有关。通过观察发现,产卵时间早的高眼鲽个体有充足的时间进行排卵,卵巢基本能够达到排空状态,而产卵时间晚的个体在产卵季节结束时残存数量较多的卵母细胞。
3.2 卵巢的发育与卵径分布
高眼鲽卵母细胞发育存在不同步性,其卵巢中同时存在不同时相卵母细胞,并且各期卵巢中均存在一定数量的早期卵母细胞。研究证明,此部分卵母细胞的多少与亲鱼食物供给及生理状态相关(Bower, 1961)。另外,各时相卵母细胞的比例、被产出和被吸收数量,与资源状态有一定的关系,如北太平洋无须鳕()因资源减少,进而引起被排出的卵母细胞数量增加,被吸收的卵母细胞数量减少(Foucher, 1980),这是鱼类维持其种群延续的内在繁殖机制的调节。
高眼鲽卵巢中各卵母细胞分离生长,卵径在Ⅳ、Ⅴ期卵巢中均呈单峰型分布,产卵后的Ⅵ-Ⅳ’期卵巢,卵径也呈单峰型分布,随着卵母细胞的进一步发育,卵巢到达Ⅴ’期,此时卵巢主要由水合卵母细胞和第4时相的卵母细胞组成,卵径呈双峰型分布。高眼鲽的这种双峰分批产卵,卵母细胞的补充以第4、5时相卵母细胞为主,这种方式不需要同时形成大量卵黄物质,减少了对能量的需求。鱼类卵巢中不同时相卵母细胞分布及排卵规律受神经内分泌和外部环境的双重调控(宋海霞等, 2005),因此,关于高眼鲽的繁殖机制需结合内分泌及环境因素进一步研究。
Bower AB, Holliday FGT. Histological changes in the gonad associated with the reproductive 1961, 5: 1–16
Fang YQ, Lin JZ, Weng YZ,. The process of the ovary development and oogenesis in the cultured-pond. Journal of Fisheries of China, 2004, 28(4): 353– 359 [方永强, 林君卓, 翁幼竹, 等. 池养鲻的卵巢发育和卵子发生过程. 水产学报, 2004, 28(4): 353–359]
Foucher RP, Beamish RJ. Production of nonviable oocytes by Pacific hake (). Canadian Journal of Fisheries and Aquatic Sciences, 1980, 37(1): 41–48
He DR, Xiao JH, Shi YF. A histological study on the gonad of grey mullets in Xinglin Wan, Xiamen. Journal of Fisheries of China, 1981, 5(4): 329–342 [何大仁, 肖金华, 石燕飞. 厦门杏林湾普通鲻鱼性腺组织学研究. 水产学报, 1981, 5(4): 329–342]
Htun-Han M. The reproductive biology of the dab(L.) in the North Sea: Seasonal changes in the ovary. Journal of Fish Biology, 1978, 13: 351–359
Li CH. A study on the individual fecundity and its dynamics of(Forskal) of the East China Sea. Oceanologia et Limnlogia Sinica, 1983, 14(3): 220–239 [李城华. 东海带鱼个体生殖力及其变动的研究. 海洋与湖沼, 1983, 14(3): 220–239]
Li JS, Yan LP, Hu F. Inter-decadal changes in biological characteristics of reproductive stocks of chub mackerel,, in the East China Sea. Journal of Fishery Sciences of China, 2015, 22(6): 1253–1259 [李建生, 严利平, 胡芬. 东海日本鲭繁殖群体生物学特征的年代际变化. 中国水产科学, 2015, 22(6): 1253–1259]
Li XS, Zhao XY, Li F,. Structure and its variation of the anchovy () spawning stock in the southern waters to Shandong Peninsula. Marine Fisheries Research, 2006, 27(1): 46–53 [李显森, 赵宪勇, 李凡, 等. 山东半岛南部产卵场鳀鱼生殖群体结构及其变化. 海洋水产研究, 2006, 27(1): 46–53]
Lin LS, Jiang YZ, YAN LP,. Study on the distribution characteristics and fecundity of Spawning stock ofin the Southern Yellow Sea and the East China Sea. Journal of Shanghai Ocean University, 2009, 18(4): 453–459 [林龙山, 姜亚洲, 严利平, 等. 黄海南部和东海小黄鱼产卵亲体分布特征与繁殖力的研究. 上海海洋大学学报, 2009, 18(4): 453–459]
Lin LS, Cheng JY, Ren YP,. Analysis of population biology of small yellow croakerin the East China Sea region. Journal of Fishery Sciences of China, 2004, 11(4): 333–338 [林龙山, 程家骅, 任一平, 等. 东海区小黄鱼种群生物学特性的分析. 中国水产科学, 2004, 11(4): 333–338]
Ling JZ, Yan LP, Lin LS,. Reasonable utilization of hairtailresource in the East China Sea based on its fecundity. Journal of Fishery Sciences of China, 2005, 12(6): 726–730 [凌建忠, 严利平, 林龙山, 等. 东海带鱼繁殖力及其资源的合理利用. 中国水产科学, 2005, 12(6): 726–730]
Liu J. Reproductive physiology of cultural fishes in China. Beijing: Agriculture Press, 1995(5): 29 [刘筠. 中国养殖鱼类繁殖生理学. 北京: 农业出版社, 1995(5): 29]
Liu XZ, Xu YJ, Liu NZ,. Study on histological and morphometric characters of gonad development ofGünther. Progress in Fishery Sciences, 2009, 30(6): 25–35 [柳学周, 徐永江, 刘乃真, 等. 半滑舌鳎卵巢发育的组织学和形态数量特征研究. 渔业科学进展, 2009, 30(6): 25–35]
Lou YD. Histology and embryology. Beijing: China Agriculture Press, 1980: 131–137 [楼允东. 组织胚胎学(第二版). 北京: 中国农业出版社, 1980: 131–137
Merson RR, Casey CS, Martincz C. Oocyte development in summer flounder: Seasonal changes and steroid correlates. Journal of Fish Biology, 2000, 57(1): 182–196
Мейeh BA, Bоnросу K, roдoBоM O. UHKле КОСТNCTЫХ РЫХ. ИЗЬ AHCCCP. Бuoл, 1939, 3: 389–420
Mi CD. A study on resources, stock structure and variation of reproductive habit of hairtail,in East China Sea. Journal of Fishery Sciences of China, 1997, 4(1): 7–14 [宓崇道. 东海带鱼资源状况, 群体结构及繁殖特性变化的研究. 中国水产科学, 1997, 4(1): 7–14]
Ni HE, Yu H, Zheng ZM. On the change of the overy in annual cycle offrom the East China Sea. Journal of Zhejiang Ocean University(Natural Science), 1999, 18(1): 34–39 [倪海儿, 於宏, 郑忠明. 东海宽体舌鳎卵巢周年变化的组织学观察. 浙江海洋学院学报(自然科学版), 1999, 18(1): 34–39]
Ni N, Liu XZ, Xu YJ,. The study of gonadal development and steroid hormone annual change in barfin flounder. Progress in Fishery Sciences, 2011, 32(3): 16–25 [倪娜, 柳学周, 徐永江, 等. 条斑星鲽卵巢发育规律和性类固醇激素周年变化研究. 渔业科学进展, 2011, 32(3): 16–25]
Riehl R. Ultracytochemical localization of Na+, K+-activated ATPase in the oocytes of, 1853 (Pisces, Poecilidae). Reproduction Nutrition Development, 1980, 20(1A): 191–196
Shan XJ, Jin XJ, Zhou, ZP,. Stock dynamics ofin the central and southern Yellow Sea. Acta Ecologica Sinica, 2012, 32(5): 244–252
Shi QF. Recent advances in the studies on gonad development in fishes. Acta Hydrohiologica Sinica, 1988, 12(3): 248–258 [施瑔芳. 鱼类性腺发育研究新进展. 水生生物学报, 1988, 12(3): 248–258]
Song HX, Wen HS. Histological studies on the ovarian development and its mechanism of regulation-controlling in cultured Japanese flounder. Transactions of Oceanology and Limnology, 2005, 4: 75–83 [宋海霞, 温海深. 养殖牙鲆卵巢发育及其调控的组织学研究. 海洋湖沼通报, 2005, 4: 75–83]
Sun ZH, Liu HJ, Si F,. Histological observation of gonadal differentiation in cultured Japanese flounder. Journal of Dalian Fisheries University, 2008, 23(6): 451–454 [孙朝徽, 刘海金, 司飞, 等. 养殖牙鲆性腺分化的组织学观察. 大连学产学院报, 2008, 23(6): 451–454]
Wan RJ, Jiang YW. Studies on the ecology of eggs and larvae of osteichthyes in the Yellow Sea. Marine Fisheries Research, 1998, 19(1): 60–73 [万瑞景, 姜言伟. 黄海硬骨鱼类鱼卵、仔稚鱼及其生态调查研究. 海洋水产研究, 1998, 19(1): 60–73]
Wu PQ. The morphological characters and seasonal changes in development of the oocytes of small yellow croakerBleeker. Acta Zoologica Sinica, 1980, 26(4): 337-345, 401 [吴佩秋. 小黄鱼卵母细胞发育的形态特征和季节变化. 动物学报, 1980, 26(4): 337- 345, 401]
Xu YJ, Liu XZ, Liu JG,. Histological and morphometric studies on the annual gonadal maturation cycle of spotted halibut. Progress in Fishery Sciences, 2011, 32(3): 7–15 [徐永江, 柳学周, 刘君刚, 等. 圆斑星鲽卵巢发育的组织学和数量形态特征研究. 渔业科学进展, 2011, 32(3): 7–15]
Young G, Crim LW, Kagawa H,. Plasma 17α, 20β-dihydroxy- 4-pregnen-3-one levels during sexual maturation of amago salmon (): Correlation with plasma gonadotropin and in vitro production by ovarian follicles. General & Comparative Endocrinology, 1983, 51(1): 96–105
Zeng L, Li XS, Zhao XY,. Fecundity and its variations of anchovyin the central and southern Yellow Sea. Journal of Fishery Sciences of China, 2005, 12(5): 569–574 [曾玲, 李显森, 赵宪勇, 等. 黄海中南部鳀鱼的生殖力及其变化. 中国水产科学, 2005, 12(5): 569–574]
Zhang GZ, Li XS, Jin XS,. Changes of biological characteristics of small yellow croaker () in the central and southern Yellow Sea. Acta Ecologica Sinica, 2010, 30(24): 6854–6861 [张国政, 李显森, 金显仕, 等. 黄海中南部小黄鱼生物学特征的变化. 生态学报, 2010, 30(24): 6854–6861]
(编辑 江润林)
A Study on the Ovary-Development Characters and Oocyte Size-Distribution ofin the Yellow Sea
TENG Guangliang1,3, SHAN Xiujuan2,3①, JIN Xianshi2,3, DAI Fangqun3, CHEN Yunlong3, YANG Tao3
(1. Wuxi Fisheries College, Nanjing Agricultural University, Wuxi 214081;2. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071; 3. Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture; Shandong Provincial Key Laboratory of Fishery Resources and Eco-Environment, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071)
This study investigated the development and resorption of the oocyte ofin the Yellow Sea, using light microscopy and morphometric methods. Oocyte development was divided into five phases, based on morphological criteria and nutrition accumulation. Oocytes in phase I were small, with little cytoplasm. In phase Ⅱ, oocytes were distinguished by the appearance of yolk nucleus near the cell nucleus. In phase Ⅲ, cortical vacuoles first appeared on the edge of the cytoplasm and then extended to the center, with the occurrences of crystalline yolk and double follicular membrane. Oocytes in phase Ⅳwere full of non-crystalline yolk, with the cell nucleus moving towards the animal pole and the zona radiate becoming thicker. In phase Ⅴ, the cell nucleus of the oocyte dissolved, and the hydrated oocyte was released from the follicular membrane. Ripe ovary that had not ovulated completely was in turn resolved, with the yolk absorbed and the zona radiate ruptured after the spawning season. In addition, this study showed thatwas characterized by asynchronous oocyte development and batch spawning, based on histologic observations of the different stages of the ovary and the oocyte size-distribution method. The sizes (major axes) of the oocytes in the stage Ⅳ, Ⅴ, and Ⅵ-Ⅳ¢ovaries had unimodal distributions, with the three modes at 0.45~0.55 mm, 0.60~0.65 mm, and 0.40~0.50 mm, respectively. Oocyte size distribution was bimodal for stage Ⅴ¢ovary, the oocytes mainly distributed at both 0.50~0.55 mm and 0.90~0.95 mm, with the percentage of hydrated oocytes and small oocytes increased. The two dominant size groups of oocytes in the stage Ⅴ¢ovary were well separated with a clear hiatus, and the oocytes in the larger-size group were all hydrated, which was in accordance with the characteristics of batch spawners. In the course of protectingresources, we should take into account their reproductive characteristics.
; Ovary development; Histological characters; Oocyte size- distribution
SHAN Xiujuan, E-mail: shanxj@ysfri.ac.cn
2017-04-15,
2017-06-06
S931
A
2095-9869(2018)01-0012-09
10.11758/yykxjz.20170415001
http://www.yykxjz.cn/
* 青岛海洋科学与技术国家实验室鳌山科技创新计划(2015ASKJ02-05)、农业部财政项目“黄渤海渔业资源调查”、青岛海洋科学与技术国家实验室‘鳌山人才’培养计划项目(2017ASTCP-ES07)和山东省泰山学者专项基金共同资助。[This work was supported by Aoshan the Scientific and Technological Innovation Project Financially Supported by Qingdao National Laboratory for Marine Science and Technology (2015ASKJ02-05), Ministry of Agriculture Special Fund “Fisheries Assessment in Yellow & Bohai Sea”, Aoshan Talents Cultivation Program Supported by Qingdao National Laboratory for Marine Science and Technology (2017ASTCP-ES07), and the Special Funds for Taishan Scholars Project of Shangdong Province]. 滕广亮,E-mail: tenggliang@126.com
单秀娟,副研究员,E-mail: shanxj@ysfri.ac.cn
滕广亮, 单秀娟, 金显仕,戴芳群, 陈云龙, 杨涛. 黄海高眼鲽卵巢发育特征及卵径分布. 渔业科学进展, 2018, 39(1): 12–20
Teng GL, Shan XJ, Jin XS, DAI Fangqun, Chen YL, Yang T. A study on the ovary-development characters and oocyte size-distribution ofin the Yellow Sea. Progress in Fishery Sciences, 2018, 39(1): 12–20
猜你喜欢
杂志排行
渔业科学进展的其它文章
- Using SSR Marker to Trace Chinese Shrimp Fenneropenaeus chinensis Released in Natural Sea — A Feasible Strategy for Assessment of Release Effect in Natural Resources Recovery Program
- 尼罗罗非鱼Xbp1-S基因克隆及表达分析
- 凡纳滨对虾家系幼虾淡化和养殖阶段存活性状遗传参数估计*
- 渤海湾近岸海域浮游纤毛虫丰度和生物量的季节变化*
- 基于约束线性回归的柔鱼栖息地指数渔场预报模型构建*
- 加工方式对海水虾及其制品中SO2含量的影响*
