滑菇胞内多糖去蛋白工艺研究
2018-04-02陈晓宁钟咏汕褚秀丹江玉姬
陈晓宁 钟咏汕 褚秀丹 江玉姬
滑菇胞内多糖去蛋白工艺研究
陈晓宁 钟咏汕 褚秀丹 江玉姬*
(福建农林大学食品科学学院,福建 福州 350002)
采用Sevage法,以氯仿与正丁醇的体积比、Sevage试剂用量及脱蛋白次数为因素,设计正交试验,优化滑菇胞内多糖脱蛋白工艺,提高滑菇胞内多糖的纯度。试验结果为:当氯仿与正丁醇的体积比为6︰1,试剂与样液比为2.5︰1,脱蛋白次数5次时,其纯化效果最佳,去除蛋白质率可达62.59%、多糖损失为22.22%。
滑菇;多糖;Sevage试剂;脱蛋白;正交试验
滑菇()是我国人工栽培的主要食用菌品种之一,原产于日本,春、冬季发生,菌盖粘滑的木腐菌,又名滑子菇、珍珠菇,日本称为“纳美菇”[1,2]。滑菇菌盖呈半球形、黄褐色,表面有一层粘液,菌柄短粗,直径约为8~15 mm,富含多糖、蛋白质,是一种药食两用的食用菌[3]。
食用菌多糖提取完成后,粗多糖中往往混杂许多蛋白质[4,5]。本研究通过采用热水浸提法,以提取完滑菇胞外多糖的滑菇子实体为原料,提取滑菇胞内多糖[6]。采用Sevage法脱除蛋白质,设计正交试验,优化滑菇胞内多糖脱蛋白工艺,以期为后续研究提供基础资料。
1 试验方法
1.1 滑菇胞内多糖的提取工艺流程
去除胞外多糖的滑菇子实体→75 ℃干燥→称重→加入蒸馏水浸泡→水浴→用纱布过滤→3 500 r/min离心15 min→取上清液→于旋转蒸发仪上蒸发浓缩至原体积一半→得胞内粗多糖提取液→95%乙醇醇沉12 h→离心后将沉淀物置于冷冻干燥机中干燥。
1.2 滑菇胞内多糖的分离纯化
粗多糖干样加水溶解→加入Sevage试剂→3 500 r/min离心15 min→取上清液→重复用Sevage试剂脱蛋白→加入95%乙醇醇沉→离心后将沉淀物置于冷冻干燥机中干燥。
1.3 蛋白质脱除率测定[7,8]
采用考马斯亮蓝法测定蛋白质,利用牛血清蛋白标准曲线的回归方程=346.59-202.27(2=0.999 6)计算蛋白质含量。
1.4 胞内多糖脱蛋白条件研究
①氯仿与正丁醇的体积比选择试验:确定Sevage试剂用量(试剂用量∶样液)比为2∶1,脱蛋白次数5次,比较不同氯仿与正丁醇体积比的影响,以选择最佳氯仿与正丁醇的体积比例。②Sevage试剂用量选择试验:在脱蛋白次数5次,及由上述试验确定的氯仿与正丁醇的体积比的条件下,比较不同Sevage试剂用量对脱蛋白效果的影响,根据其去除蛋白质率确定最佳Sevage试剂用量。③脱蛋白次数选择试验:在上述试验确定的最佳氯仿与正丁醇的体积比、最佳Sevage试剂用量不变的条件下,选择不同的脱蛋白次数脱蛋白,根据脱蛋白率确定最佳脱蛋白次数。
1.5 正交试验
根据单因素试验确定的条件范围,通过L9(33)正交试验,得出最佳脱蛋白工艺。
2 结果与分析
2.1 氯仿与正丁醇体积比对蛋白质脱除率的影响
不同体积比的氯仿︰正丁醇对蛋白质脱除率的影响见图1。从图1可知,随着氯仿与正丁醇的体积比不断加大,蛋白质脱除率逐渐升高,当氯仿与正丁醇的体积比达到5︰1时,蛋白质脱除率达到最大值,为38.62%,多糖损失28.94%。而后随着体积比增大,呈现不断下降趋势;且其他比例与5︰1均存在极显著差异(P<0.01)。
2.2 Sevage试剂用量对蛋白质脱除率的影响
采用氯仿︰正丁醇的体积比为5︰1,脱蛋白次数为5次,不同量的Sevage试剂对蛋白质脱除率的影响见图2。从图2可知,随着试剂与样液体积比不断加大,蛋白质的脱除率先增加,当试剂与样液比为2︰1时,达到最高点,蛋白质脱除率达到60.42%,多糖损失26.57%,而后随体积比的增大,蛋白质脱除效果降低。比例2︰1与其余体积比例均存在极显著差异(<0.01)。加入的Sevage试剂与多糖提取液的比例为2︰1时,对脱除蛋白质起到最佳效果。
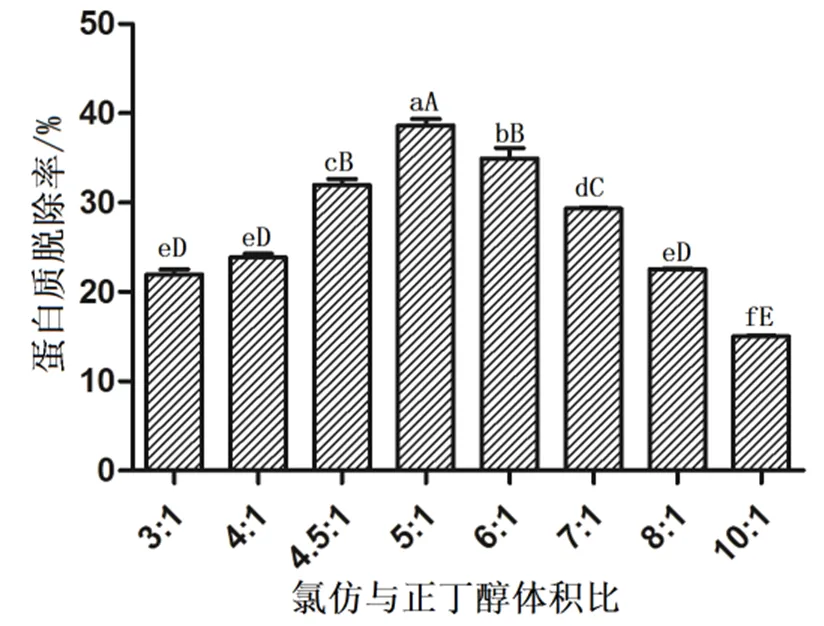
注:用LSD法进行多重比较分析,同一曲线上标有不同字母,小写字母表示组间差异显著(<0.05),大写字母表示组间差异极显著(<0.01),标注相同字母表示组间差异不显著(>0.05)。下同。
图1不同氯仿与正丁醇体积比的蛋白质脱除率
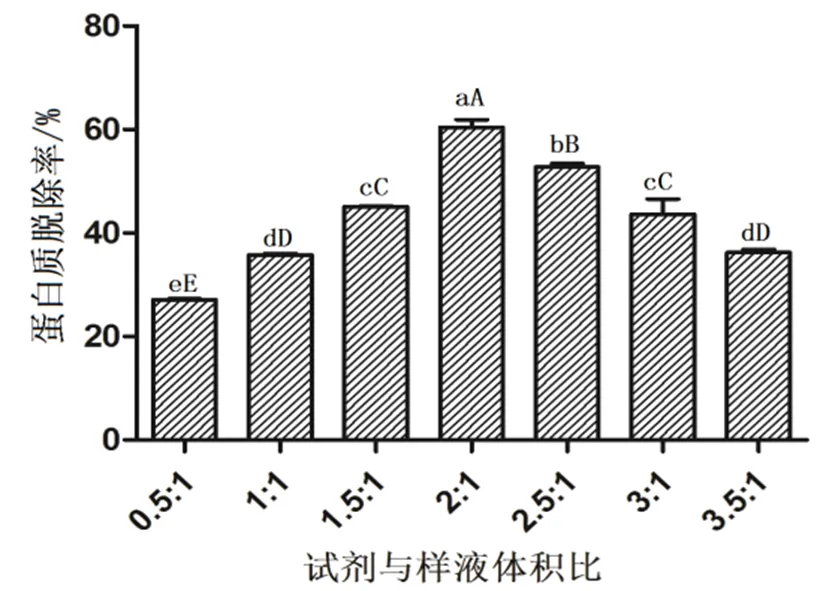
图2 不同试剂与样液体积比的蛋白质脱除率
2.3 脱蛋白次数对蛋白质脱除率的影响
采用氯仿与正丁醇的体积比为5︰1,Sevage试剂与样液比为2︰1,脱蛋白次数对蛋白质脱除率的影响见图3。从图3可知,随着脱蛋白次数不断增加,蛋白质脱除率迅速提高,当脱蛋白次数为5次时达到最大值,为44.64%,多糖损失25.89%。5次后随脱蛋白次数的增加,呈缓慢下降趋势。脱蛋白5次与其他的脱蛋白次数均存在极显著差异(<0.01)。
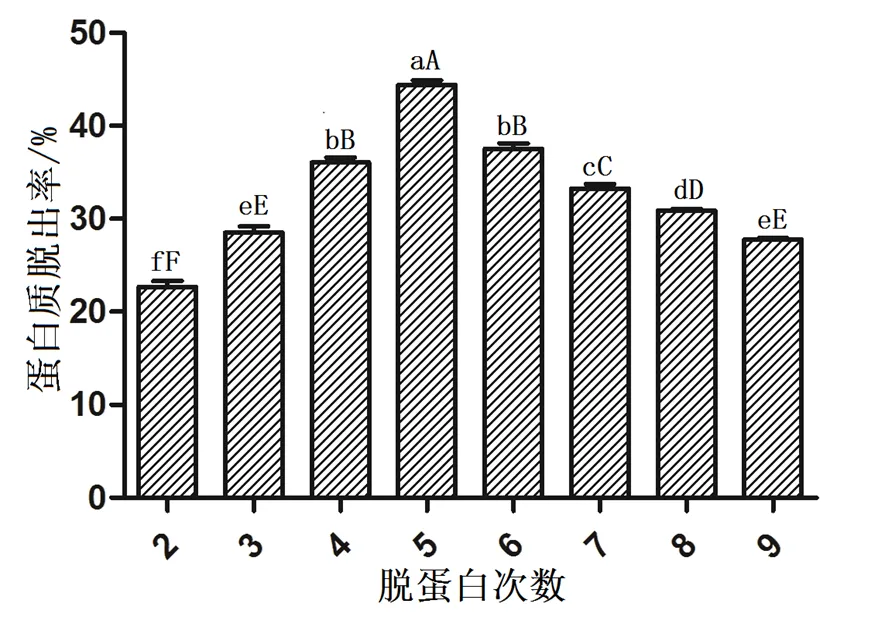
图3 不同脱蛋白次数的蛋白质脱出率
2.4 正交试验结果
在氯仿与正丁醇的体积比(A)、Sevage试剂用量(B)、脱蛋白次数(C)这3个单因素实验的基础上,进行L9(33)正交优化试验,结果见表1和表2。
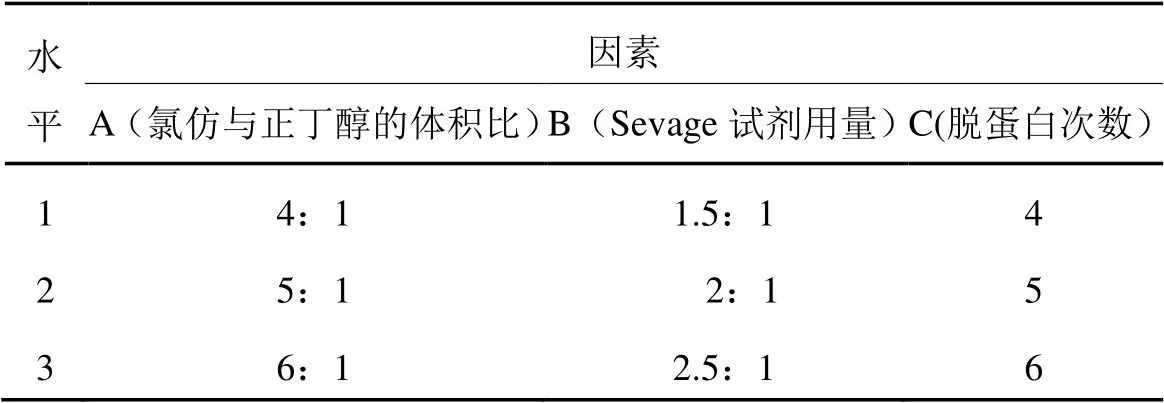
表1 正交试验因素与水平
从表1可知,在这3个因素中,Sevage试剂用量极差最大,为主要因素。Sevage试剂用量对多糖提取液的蛋白质脱除率效果最强;脱蛋白次数对多糖提取液的蛋白质脱除率效果最弱。影响蛋白质脱除率的大小顺序依次为B、A、C。试验结果表明,脱蛋白的最佳工艺方法为A3B3C2,即氯仿与正丁醇的体积比为6︰1,试剂与样液的体积比为2.5︰1;脱蛋白次数为5次。按照最优方案测得蛋白质脱除率为62.59%,多糖损失率为22.22%。
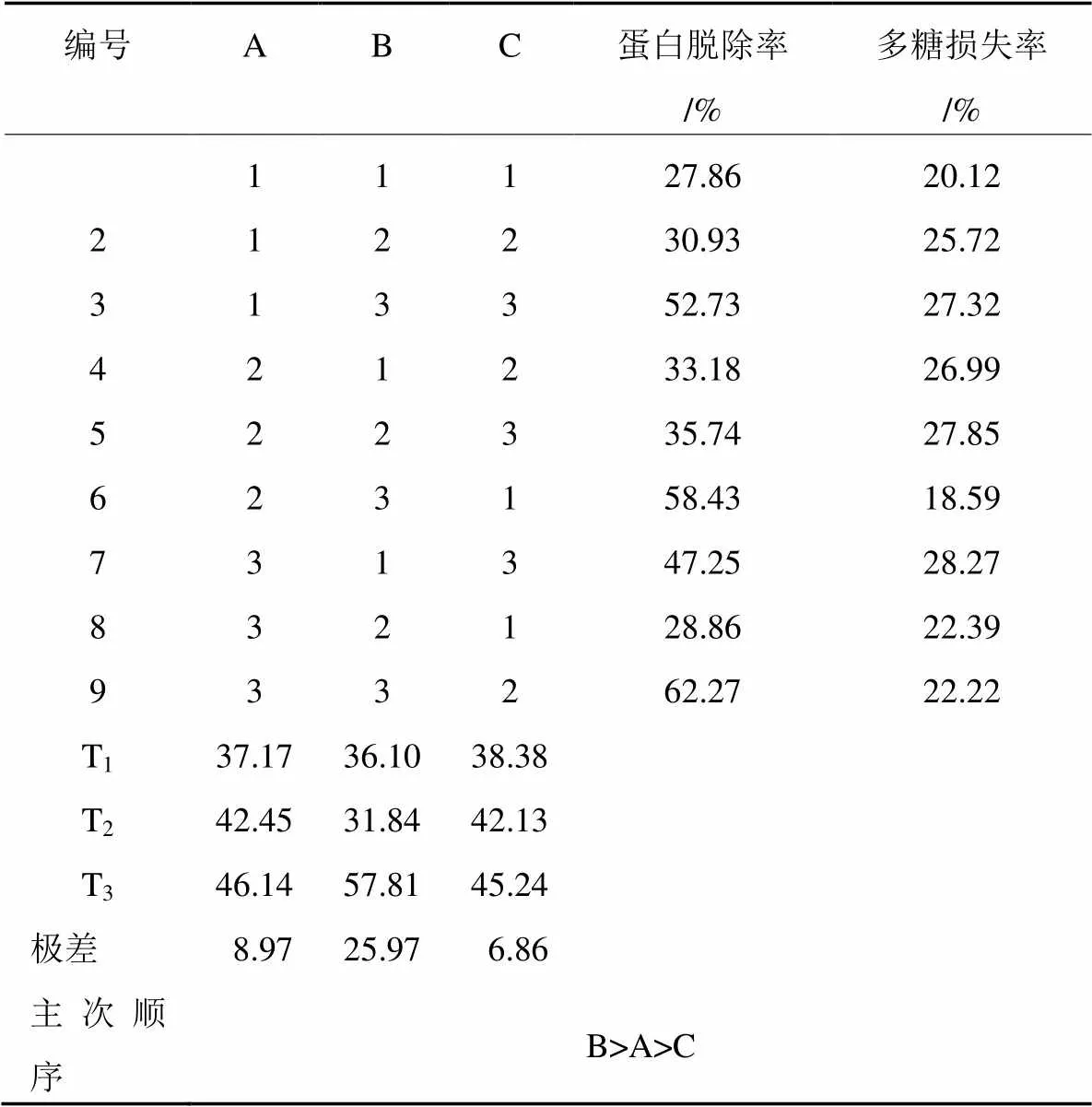
表2 正交试验结果
3 结论与讨论
根据单因素试验确定的条件,经正交试验优化后,按照氯仿与正丁醇的体积比为6︰1,试剂与样液的体积比为2.5︰1,脱蛋白次数为5次对滑菇胞内多糖进行脱蛋白处理,最优方案测得蛋白质脱出率为62.59%,无法达到100%,多糖损失仍有22.22%。
较多研究发现,采用Sevage脱除蛋白效果较好,但还不能达到100%的脱除率。这主要是由于多糖内有部分与蛋白质结合的糖蛋白复合物,若脱蛋白强度太大、时间过长、次数过多,将导致多糖—蛋白质复合键的断裂,失去其原有的生物活性和营养价值[9~11]。
[1] 刘青月. 冷凉山区滑子菇袋料栽培技术[J]. 食药用菌, 2012, 20(4): 239-246.
[2] 于晓红, 吴宪玲, 付薇, 等. 西洋参多糖脱色脱蛋白方法研究[J]. 中国食品学报, 2017, 17(11): 145-149.
[3] 郑守晶, 彭云飞, 陈强, 等. 脱蛋白和未脱蛋白的银耳多糖生物活性研究[J]. 武夷科学, 2017, 33: 94-100.
[4] 周聪, 孙月, 李德海, 等. 柳蘑多糖对肿瘤细胞增殖抑制作用的研究[J]. 现代食品科技, 2017, 33(9): 56-62.
[5] 孙宁. 姬松茸多糖的提取、结构表征及其在饮料中的应用研究[D]. 哈尔滨商业大学, 2017.
[6] 彭云飞. 银耳多糖酶法提取及生物活性研究[D]. 福建农林大学, 2017.
[7] 于文华. 山药多糖的生物活性功能及其作用机理[D]. 内蒙古农业大学, 2017.
[8] 许女, 张天震, 陈旭峰, 等. 鸡腿菇子实体多糖的分离纯化、理化性质及抗氧化活性[J]. 生物工程学报, 2017, 33(5): 808-816.
[9] 王新嘉, 雷国风, 翟志军, 等. 平菇多糖中蛋白质脱除方法的比较[J]. 食品研究与开发, 2017, 38(5): 111-118.
[10] 孙玉军, 江昌俊, 任四海. 秀珍菇多糖对D-半乳糖致衰老小鼠的保护作用[J]. 食品科学, 2017, 38(5): 251-256.
[11] Jouquet P, Bottinelli N, Lata JC, et al. Role of the fungus-growing termite Pseudac-anthotermes spiniger (Isoptera,Macrotermitinae) in the dynamic of clay and soil organic matter content.An experimental analysis[J]. Geoderma, 2007, 139: 127-133.
[12] 王国艺. 滑菇W-01胞外与胞内多糖的提取及其抗氧化活性[J]. 山东农业大学, 2012(6): 55-56.
Study on the process of intracellular polysaccharide deproteinized of
Chen Xiaoning Zhong Yongshan Chu Xiudan Jiang Yuji*
(College of Food Science, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China)
In order to improve the purity of the intracellular polysaccharides (IPS), the Sevage reagent was used to deproteinize the IPS. Through the three factors of the ratio of chloroform to n-butanol, Sevage reagent dosage and treatment times, the orthogonal test was used to optimize the deproteinization process. The results showed when the ratio of chloroform to n-butanol was 6: 1, Sevage reagent dosage was 2.5: 1, treatment times was 5 times, the purification efficiency was the best. Intracellular polysaccharides protein removal rate was 62.59%, polysaccharide loss rate was 22.22%.
; intracellular polysaccharides(IPS); Sevag re agent; deproteinization; orthogonal test
S646
A
2095-0934(2018)02-088-04
福建省现代农业食用菌产业技术体系项目(No. K83139295)
,E-mail:jyj1209@163.com。
