多发性硬化患者血清与脑脊液中IL-23、IL-17、TNF-α水平变化
2018-04-02段姝洁
段姝洁
多发性硬化(MS)是一种中枢神经系统脱髓鞘疾病,以髓鞘脱失、神经胶质细胞增生、轴索病变、进行性功能障碍为主要特征,且患者在病程中常有缓解与复发反复出现[1]。目前医学界对MS的确切病因尚无统一解释,多数观点认为,先天免疫调节功能紊乱与后天环境因素所致异常自身免疫应答可能是诱发MS发生发展的主要原因[2]。最新研究发现,白细胞介素-23(IL-23)、白细胞介素-17(IL-17)在产生和维持MS髓鞘损伤中扮演了重要角色,而肿瘤坏死因子-α(TNF-α)的局部促炎作用被认为能够反映MS的活动性[3]。在总结过往研究结论的基础上,此次研究就MS患者血清与脑脊液中IL-23、IL-17、TNF-α水平变化进行观察。
1 资料与方法
1.1 一般资料
37例参照第四版《神经病学》中Poser诊断标准[4]确诊MS患者,入组时间2014年7月—2017年2月,入组患者无免疫调节药物使用史,排除合并全身脏器严重病变、其他自身免疫性疾病、恶性肿瘤及严重感染者;并选取同期31名健康体检者纳入对照组。MS组男14例,女23例,年龄20~56岁,平均(37.16±5.24)岁;对照组男12例,女19例,年龄21~52岁,平均(35.92±5.38)岁。两组受试者性别比例、年龄比较,差异无统计学意义(P>0.05),具有可比性。本临床研究已征得我院医学伦理委员会批准,受试者均知情同意并签署知情同意书。
1.2 分组及治疗方案
MS分组急性发作期为神经功能恶化且有影像学支持,症状于2周内反复发作;缓解期为急性发作期过后1个月以上[5]。22例急性发作组患者均接受注射用甲泼尼龙琥珀酸钠(商品名甲强龙,美国辉瑞制药有限公司,批准文号H20130301,规格40 mg)治疗,前3 d每日1次,每次40 mg;后4 d每日1次,每次20 mg,而后口服醋酸泼尼松片(商品名强的松,浙江仙琚制药股份有限公司,国药准字H33021207,规格5 mg×100 s),初始剂量每日60 mg,逐渐递减,1个月后停服[7]。急性发作组患者治疗期间均同时给予胃粘膜保护剂、补钾补钙治疗[8]。
1.3 观察指标
各组受试者入组时及急性发作组患者治疗7 d、治疗28 d后抽取肘静脉血5 mL、脑脊液3 mL,均以4000 r/min离心5 min,取上清液,分装于分离管内,-80℃保存,统一检测[9]。血清与脑脊液中IL-23、IL-17、TNF-α检测均采用酶联免疫吸附法(ELISA法),试剂盒均购自美国R&D公司,操作方法严格按照试剂盒使用说明书。
1.4 统计学分析
使用SPSS18.0软件,性别资料以(n/%)表示,并采用χ2检验,年龄、血清与脑脊液细胞因子水平等计量资料以(±s)表示,并采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 MS组与对照组IL-23、IL-17、TNF-α水平比较
MS组血清与脑脊液中IL-23、IL-17、TNF-α均高于对照组,差异有统计学意义(P<0.05);急性发作组血清与脑脊液中IL-23、IL-17、TNF-α均高于缓解期组,差异有统计学意义(P<0.05)。见表1。
表1 MS组与对照组血清、脑脊液内IL-23、IL-17、TNF-α水平比较(±s)
注:与急性发作组比较,*P<0.05;与缓解期组比较,#P<0.05
缓解期组(n=13)血清 IL-23(pg/mL) 561.39±94.85 308.13±81.97*150.36±34.81*#IL-17(pg/mL) 77.93±11.26 56.31±12.24* 35.31±4.82*#TNF-α(pg/mL) 1.52±0.23 1.00±0.19* 0.79±0.13*#脑脊液 IL-23(pg/mL) 594.36±105.28 365.52±84.63*108.59±31.36*#IL-17(pg/mL) 118.24±16.59 79.71±15.38* 30.26±4.37*#TNF-α(pg/mL) 3.17±0.58 1.89±0.50* 0.64±0.11*#部位 指标 急性发作组(n=22)MS组(n=37) 对照组(n=31)
2.2 急性发作组治疗前后IL-23、IL-17、TNF-α水平变化
急性发作组治疗后血清与脑脊液中IL-23、IL-17、TNF-α均逐渐降低,差异有统计学意义(P<0.05)。见表2。
表2 急性发作组治疗前后血清、脑脊液内IL-23、IL-17、TNF-α水平比较(±s)
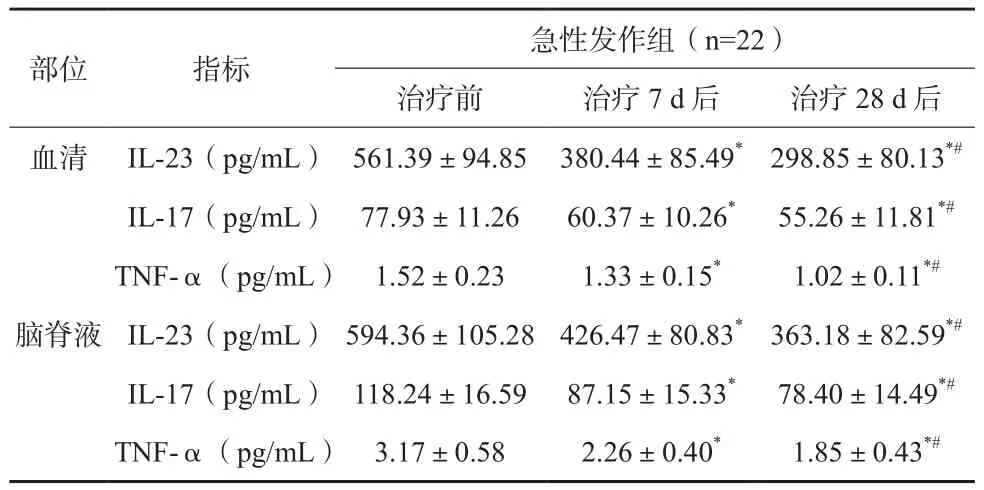
表2 急性发作组治疗前后血清、脑脊液内IL-23、IL-17、TNF-α水平比较(±s)
注:与治疗前比较,*P<0.05;与治疗7 d后比较,#P<0.05
部位 指标 急性发作组(n=22)治疗前 治疗7 d后 治疗28 d后血清 IL-23(pg/mL) 561.39±94.85 380.44±85.49*298.85±80.13*#IL-17(pg/mL) 77.93±11.26 60.37±10.26* 55.26±11.81*#TNF-α(pg/mL) 1.52±0.23 1.33±0.15* 1.02±0.11*#脑脊液 IL-23(pg/mL) 594.36±105.28 426.47±80.83*363.18±82.59*#IL-17(pg/mL) 118.24±16.59 87.15±15.33* 78.40±14.49*#TNF-α(pg/mL) 3.17±0.58 2.26±0.40* 1.85±0.43*#
3 讨论
作为一种免疫性疾病,在MS病理过程中,T细胞免疫发挥的重要作用已得到大量研究证实[10]:在病毒感染的基础上,由T淋巴细胞介导并引发的包括巨噬细胞活化、多种细胞因子分泌在内的一连串相关免疫反应,是引发MS及其相关视力下降、共济失调、四肢麻木等临床症状的主要原因。此次研究选取IL-23、IL-17、TNF-α三种细胞因子,就其在MS发生发展中发挥的作用进行了探讨。
本研究结果表明,MS患者血清及脑脊液IL-23、IL-17、TNF-α水平均高于正常人群,且急性发作时血清与脑脊液中IL-23、IL-17、TNF-α水平显著升高,说明Th1型CD4+T细胞产生的IL-23、IL-17、TNF-α等细胞因子在激活巨噬细胞、介导迟发性变态反应、引发器官特异性自身免疫组织损伤中均发挥作用。IL-23生物学作用主要依靠其P40、P19两种亚单位与对应受体复合物相互作用发挥[11],IL-23与靶细胞膜上IL-23受体结合后,可激活JAK2、STAT3等信号通路,诱导记忆性T淋巴细胞分化为IL-17分泌细胞,进而释放大量前炎症介质,加之IL-23的趋化炎症细胞聚集与迁移作用,血清及脑脊液中IL-23水平升高意味着强烈的自身免疫性炎症反应[12-13]。既往研究发现,在中枢神经系统内,IL-23主要由小胶质细胞和激活的吞噬细胞产生,但其受体仅表达于激活的吞噬细胞表面,故IL-23的组织特异性使得其在MS发病过程中扮演的角色尤为关键[14],而采用抗IL-23P19抗体治疗,有望在抑制MS病情恶化方面发挥积极作用[15]。
IL-17是一种强大的前炎症细胞因子,也是炎症反应的微调因子,多数情况下,IL-17产生于适应型免疫反应,但其经典功能主要在固有免疫调节中发挥作用,包括诱导上皮细胞、角质细胞、内皮细胞和成纤维细胞大量分泌单核细胞趋化蛋白-1、IL-6、IL-8等,且可上调细胞间粘附分子-1表达,具有较强的致炎作用[16]。动物实验发现,IL-17可上调小胶质细胞的IL-6、粘附因子表达能力,在参与免疫过程的同时,还可与TNF-α发挥协同作用,共同诱发MS症状的加剧[17]。因此,血清与脑脊液IL-17的监测亦有助于MS的病情评估,而针对IL-17的免疫治疗有望为MS患者预后质量的改善提供新的思路。
TNF-α是特异性免疫应答和急性炎症之间的中介,主要由单核细胞和吞噬细胞分泌,通过结合相应受体发挥调节适应性免疫、杀伤靶细胞、诱导细胞凋亡作用,但TNF-α的过量表达可引发全身性毒性反应,包括激活多形核细胞、促进纤维蛋白溶酶激活剂分泌、上调巨噬细胞表达等,且有学者发现,高浓度TNF-α与MS病理机制中脱髓鞘环节具有密切关联[18],故血清及脑脊液中TNF-α水平的升高均意味着MS的病情恶化。在本次研究中,急性发作组患者治疗后血清与脑脊液IL-23、IL-17、TNF-α水平均显著下降,说明上述指标与MS患者病情活动度具有一定相关性,有望成为MS病情预测、复发风险评估、预后质量判断的辅助指标。
综上所述,MS患者血清与脑脊液中IL-23、IL-17、TNF-α水平均显著升高,且其升高水平与患者病情严重度密切相关,根据上述细胞因子监测结果判断MS活动性,并探索调节IL-23、IL-17、TNF-α的靶向治疗药物,有望为MS患者病情的控制及预后质量的改善提供新的思路。
[1] ROSSI S, MOTTA C, STUDER V, et al. Tumor necrosis factor is elevated in progressive multiple sclerosis and causes excitotoxic neurodegeneration[J]. Mult Scler J, 2014, 20(3): 304-312.
[2] 赵盼, 苗宇, 杨春晓. 与多发性硬化相关的细胞因子的研究进展[J]. 国际免疫学杂志, 2015, 38(3): 297-299.
[3] KALLAUR A P, OLIVEIRA S R, SIMÃO A N C, et al. Tumor necrosis factor beta NcoI polymorphism is associated with inflammatory and metabolic markers in multiple sclerosis patients[J]. J Neurol Sci, 2014, 346(1): 156-163.
[4] XU G, LIU G, XIONG S, et al. The histone methyltransferase Smyd2 is a negative regulator of macrophage activation by suppressing interleukin 6 (IL-6) and tumor necrosis factor α(TNF-α) production[J]. J Biol Chem, 2015, 290(9): 5414-5423.
[5] 周冬亮, 关颖, 王岳, 等. 调节性T细胞在多发性硬化中的免疫分子机制研究[J]. 医学分子生物学杂志, 2015, 12(6): 333-337.
[6] COSSU D, MAMELI G, GALLERI G, et al. Human interferon regulatory factor 5 homologous epitopes of Epstein-Barr virus and Mycobacterium avium subsp. paratuberculosis induce a specific humoral and cellular immune response in multiple sclerosis patients[J]. Mult Scler J, 2015, 21(8): 984-995.
[7] 梁军利, 赵丽君, 钱琪, 等. 甲泼尼龙冲击治疗对缓解复发型多发性硬化早期血清中 IL-23 和 IL-17A 水平的影响[J]. 中国神经免疫学和神经病学杂志, 2015, 22(2): 93-95.
[8] BRENNER D, BLASER H, MAK T W. Regulation of tumour necrosis factor signalling: live or let die[J]. Nat Rev Immunol,2015, 15(6): 362-374.
[9] KARATAYLI S C, ULGER Z E, ERGUL A A, et al. Tumour necrosis factor-alpha, interleukin-10, interferon-gamma and vitamin D receptor gene polymorphisms in patients with chronic hepatitis delta[J]. J Viral Hepat, 2014, 21(4): 297-304.
[10] 王利娟, 李晓玲, 谢沁芳, 等. 多发性硬化患者IL-17、IL-27水平的动态表达及意义[J]. 免疫学杂志, 2016, 32(7): 616-619.
[11] LANGRISH C L, CHEN Y, BLUMENSCHEIN W M, et al. IL-23 drives a pathogenic T cell population that induces autoimmune inflammation.[J]. J Exp Med, 2005, 201(2):233-240.
[12] SATO H, KOBAYASHI D, ABE A, et al. Tocilizumab treatment safety in rheumatoid arthritis in a patient with multiple sclerosis:a case report[J]. BMC Res Notes, 2014, 7(1): 641.
[13] ROSSI S, MOTTA C, STUDER V, et al. Interleukin-1β causes excitotoxic neurodegeneration and multiple sclerosis disease progression by activating the apoptotic protein p53[J]. Mol Neurodegener, 2014, 9(1): 56.
[14] 付红梅, 王寅旭, 王晓明, 等. IL-17F及IL-17A基因多态性与中国四川汉族人群多发性硬化的相关性[J]. 中国神经免疫学和神经病学杂志, 2015, 22(1): 12-15.
[15] LI H, WANG W, WANG G, et al. Interferon-γ and tumor necrosis factor-α promote the ability of human placenta–derived mesenchymal stromal cells to express programmed death ligand-2 and induce the differentiation of CD4+interleukin-10+ and CD8+ interleukin-10+ Treg subsets[J].Cytotherapy, 2015, 17(11): 1560-1571.
[16] KICHEV A, ROUSSET C I, BABURAMANI A A, et al. Tumor necrosis factor-related apoptosis-inducing ligand (TRAIL)signaling and cell death in the immature central nervous system after hypoxia-ischemia and inflammation[J]. J Biol Chem, 2014,289(13): 9430-9439.
[17] BONORA M, DE MARCHI E, PATERGNANI S, et al. Tumor necrosis factor-α impairs oligodendroglial differentiation through a mitochondria-dependent process[J]. Cell Death Differ,2014, 21(8): 1198-1208.
[18] LEVY-CLARKE G, JABS D A, READ R W, et al. Expert panel recommendations for the use of anti–tumor necrosis factor biologic agents in patients with ocular inflammatory disorders[J]. Ophthalmology, 2014, 121(3): 785-796.
