儿童急性呼吸窘迫综合征预后危险因素分析
2018-04-02娄志峰孙立会
娄志峰 孙立会
急性呼吸窘迫综合征(Acute respiratory distress syndrome,ARDS)患者以进行性呼吸窘迫、顽固性低氧血症为主要临床表现,死亡率较高[1]。儿童ARDS的整体死亡率低于成年人[2],但儿童更易发生毛细血管内皮细胞损伤和弥散性肺泡上皮细胞损伤,进而出现肺水肿,启动全身性炎症反应[3]。因此,本文针对性分析ARDS患儿的死亡影响因素。
1 资料与方法
1.1 一般资料
整理2012年2月—2016年7月参照中华医学会呼吸病学分会制定的诊断标准[4]确诊且临床资料保存完整的ARDS患儿资料,排除合并左心衰竭、肺源性疾病者,151例患儿入选。151例患儿中,男92例,女59例,年龄12 d~13岁,平均(2.36±0.77)个月;原发病:肺源性疾病81例,肺外疾病70例;其中29例(19.21%)合并新生儿肺透明膜疾病。
1.2 分析方法
按照患儿确诊后30 d预后情况,将存活患儿纳入存活组,将死亡患儿纳入死亡组,计算患儿死亡率并对比两组患儿年龄、原发病及基线小儿危重病例评分(PCIS)、实验室检查结果、病情等基线资料间差异,数据采用SPSS18.0进行分析,性别、年龄分布等计数资料以(n/%)表示,并采用χ2检验,计量资料以(±s)表示,并采用Mann-Whitney非参数检验,将单因素分析中存在统计学差异的因素纳入Logistic多因素回归分析,总结影响ARDS患儿预后的相关危险因素。其中,原发病包括肺源性疾病(肺炎、肺挫伤等)及肺外疾病(中毒、败血症、窒息、休克等);PCIS评分标准参照相关文献[5],包括心率、血压(收缩压)、呼吸、动脉血氧分压(PaO2)、pH、Na+、K+、肌酐/尿素氮、血红蛋白(Hb)、胃肠系统等,各项指标根据测定值及表现分值4分、6分或10分,总分44~110分,结果判定:<70分:极危重;71~80分:危重;>80分:非危重;实验室检查结果包括白细胞(WBC)、白蛋白(ALB)、氧合指数(PaO2/FiO2)等;病情指标包括机械通气时间、受累器官数量等。
2 结果
共有92例患儿死亡,死亡率为60.93%,其中57例于确诊后3 d内死亡;死亡患儿平均生存时间为(14.26±3.08)d。
存活组基线PCIS评分、氧合指数、WBC高于死亡组,其机械通气时间、受累器官数量低于死亡组,差异有统计学意义(P<0.05),见表1;死亡组年龄<28 d、肺源性疾病及新生儿透明膜肺病构成比高于存活组,差异有统计学意义(P<0.05),见表2。
表1 存活组与死亡组患儿计量资料比较(±s)
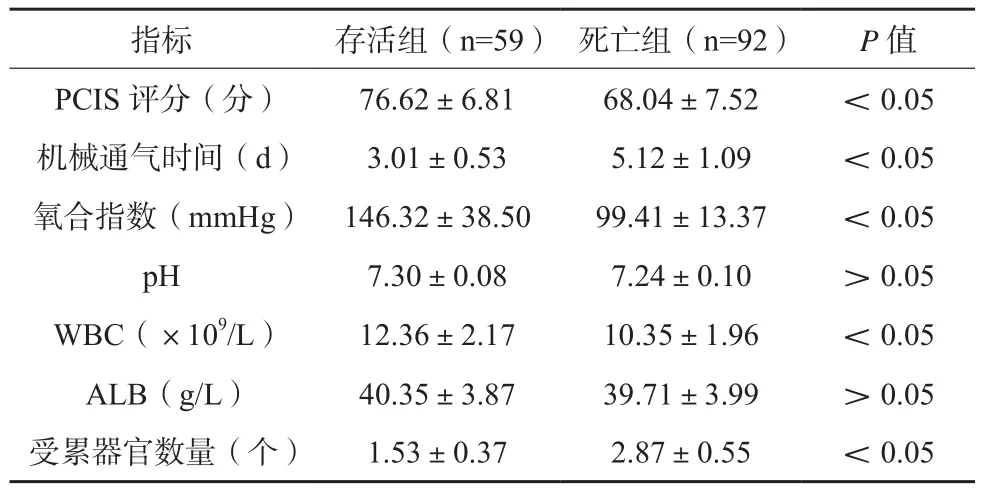
表1 存活组与死亡组患儿计量资料比较(±s)
指标 存活组(n=59) 死亡组(n=92) P值PCIS评分(分) 76.62±6.81 68.04±7.52 <0.05机械通气时间(d) 3.01±0.53 5.12±1.09 <0.05氧合指数(mmHg) 146.32±38.50 99.41±13.37 <0.05 pH 7.30±0.08 7.24±0.10 >0.05 WBC(×109/L) 12.36±2.17 10.35±1.96 <0.05 ALB(g/L) 40.35±3.87 39.71±3.99 >0.05受累器官数量(个) 1.53±0.37 2.87±0.55 <0.05

表2 存活组与死亡组患儿计数资料比较(n/%)
进一步进行回归分析,PCIS评分≥70分、年龄≥28 d为儿童ARDS预后的保护因素,受累器官数量≥2个、肺源性疾病、新生儿透明膜肺病为影响儿童ARDS预后的独立危险因素(P<0.05),见表3。
3 讨论
ARDS是院内重症监护病房(ICU)的常见危重症。据报道,我国新生儿ICU中ARDS发病率高达8.7%,ARDS患儿死亡率更是超过58.80%[6],显现出儿童ARDS防治的重要性。既往研究发现,脓毒血症、心脏手术及白血病是导致儿童ARDS的主要原因[7-8],本组患儿死亡率高达60.93%,与过往报道一致[9-10],且患儿死亡时间集中在确诊后3 d内。患儿肺泡损害和间质性肺水肿严重、肺泡腔大量炎性浸润有关,多种损伤因素导致的瀑布式炎症级联反应可引发多种并发症甚至多脏器功能衰竭,直接造成患儿的死亡[11]。
通过多因素回归分析,可以发现,PCIS评分≥70分、年龄≥28 d为儿童ARDS预后的保护因素,其中,PCIS评分在儿童各类疾病的病情严重度判断中均得到了广泛应用,其准确预测患儿死亡风险的价值也已得到认可[12]。作为新生儿ICU病情评估及疾病预后预测的标准化工具,PCIS评分的降低意味着患儿病情的加重与肺外脏器功能障碍状况的恶化[13-14]。本研究结果显示,新生儿ARDS的预后较差,随着患儿年龄的增长,其存活率呈上升趋势,与过往报道存在差异[15],其原因可能与此次研究选取的受试对象转院患儿占比高有关,若患儿自出生至确诊均于我院完成,其确诊和救护时间能够得到明显缩减,死亡率有望得到一定程度的控制。
与此同时,本研究结果还显示,受累器官数量的增加可导致ARDS患儿死亡率的上升,且受累器官≥2个为ARDS患儿死亡的独立预测因素,与多数文献报道的ARDS患者死亡率与器官衰竭数目呈正相关的结果具有一致性[16],故应注重全身多器官受损的及时纠正。此外,肺源性疾病、新生儿肺透明膜病在患儿死亡率的上升中亦扮演了重要角色,其原因可能为:1)与肺外性疾病所致ARDS相比,肺源性疾病所致ARDS往往以早期肺泡大量损伤为主要表现,并伴有肺组织弹性的急剧增加,即便接受肺保护性通气治疗,患儿呼吸力学、肺泡复张和气体交换等指标的改善往往不及肺外性ARDS[17];2)合并新生儿肺透明膜病者,其肺部不仅存在单纯缺氧换气功能障碍,还存在严重通气功能障碍,并表现为肺泡群萎缩、肺泡腔内纤维素沉着、渗出物纤维化及继发细支气管炎[18],进一步加重肺损伤、影响患儿预后质量。
综上,儿童ARDS的死亡率较高且多集中于确诊3 d后,应早期根据患儿PCIS评分、年龄、原发病、基础疾病综合判断其死亡风险,并选择最为合适的治疗策略。
[1] THABET F C, BOUGMIZA I M, CHEHAB M S, et al.Incidence, risk factors, and prognosis of intra-abdominal hypertension in critically ill children: a prospective epidemiological study[J]. J Intensive Care Med, 2016, 31(6):403-408.
[2] KOO H J, DO K H, CHAE E J, et al. Humidifier disinfectantassociated lung injury in adults: prognostic factors in predicting short-term outcome[J]. Eur Radiol, 2017, 27(1): 203-211.
[3] KNEYBER M C, MARKHORST D G. Management of acute lung injury and acute respiratory distress syndrome in children:a different perspective.[J]. Crit Care Med, 2009, 37(8):2448-2454.
[4] SCHOUTEN L R A, VELTKAMP F, BOS A P, et al. Incidence and mortality of acute respiratory distress syndrome in children:a systematic review and meta-analysis[J]. Crit Care Med, 2016,44(4): 819-829.
[5] AL-BILTAGI M A, ABO-ELEZZ A A A E B, ABU-ELA K T, et al. The prognostic value of soluble intercellular adhesion molecule 1 plasma level in children with acute lung injury[J]. J Intensive Care Med, 2017, 32(5): 320-325.
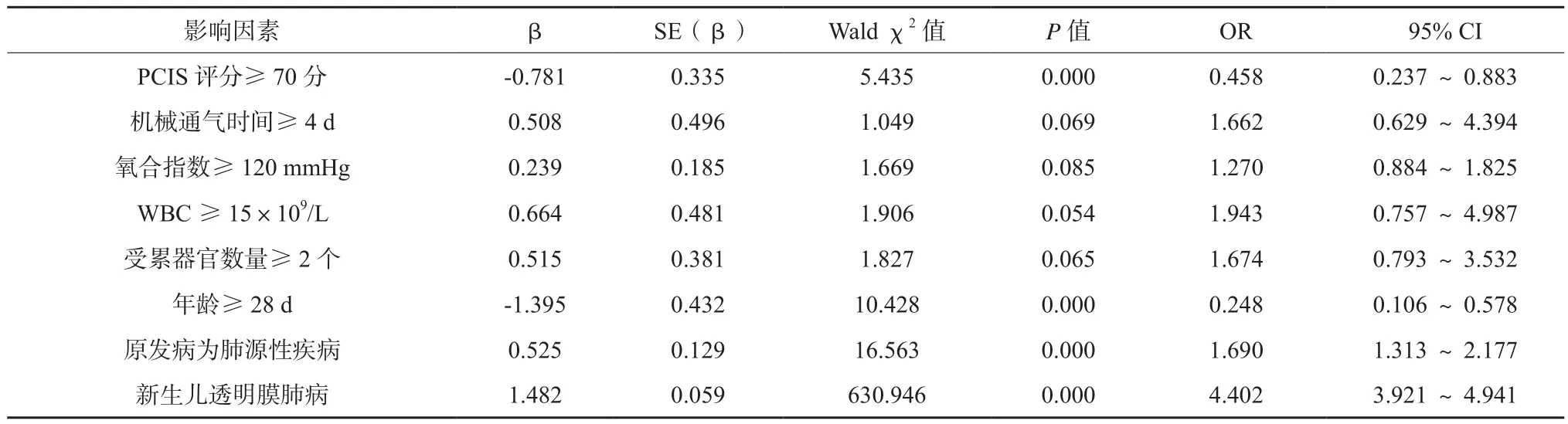
表3 影响儿童ARDS预后的多因素回归分析结果
[6] 陆铸今, 王莹, 汤定华,等. 上海市四家儿童医院重症监护室中急性呼吸窘迫综合征发生率调查[J]. 中华儿科杂志, 2003,41(8):619-620.
[7] BUTT W. Mechanical Ventilation for Children With Hypoxemic Respiratory Failure After Stem Cell Transplantation: Quo Vadis?[J]. Pediatr Crit Care Med, 2017, 18(4): 379-381.
[8] 刘丹琴, 曾潍贤, 周王锋, 等. 血管外肺水指数及肺血管通透性指数对ARDS患者预后的评估价值[J]. 中华医学杂志, 2015,95(44): 3602-3606.
[9] FUCHS H, SCHOSS J, MENDLER M R, et al. The cause of acute respiratory failure predicts the outcome of noninvasive ventilation in immunocompromised children[J]. Klin Padiatr,2015, 227(06/07): 322-328.
[10] ORWOLL B E, SPICER A C, ZINTER M S, et al. Elevated soluble thrombomodulin is associated with organ failure and mortality in children with acute respiratory distress syndrome(ARDS): a prospective observational cohort study[J]. Crit Care,2015, 19(1): 435.
[11] CHEN W, WARE L B. Prognostic factors in the acute respiratory distress syndrome[J]. Clinical and translational medicine, 2015, 4(1): 23.
[12] Yoon H M, Lee E, Lee J S, et al. Humidifier disinfectantassociated children’s interstitial lung disease: computed tomographic features, histopathologic correlation and comparison between survivors and non-survivors[J]. Eur Radiol, 2016, 26(1): 235-243.
[13] KIM Y H, KIM K W, LEE K E, et al. Transforming growth factor-beta 1 in humidifier disinfectant-associated children’s interstitial lung disease[J]. Pediatr Pulmonol, 2016, 51(2): 173-182.
[14] ESPINOZA J C, HALEY K, PATEL N, et al. Outcome of young children with high-grade glioma treated with irradiationavoiding intensive chemotherapy regimens: Final report of the Head Start II and III trials[J]. Pediatr Blood Cancer, 2016,63(10): 1806-1813.
[15] BODE U, ZIMMERMANN M, MOSER O, et al. Treatment of recurrent primitive neuroectodermal tumors (PNET) in children and adolescents with high-dose chemotherapy (HDC) and stem cell support: results of the HITREZ 97 multicentre trial[J]. J Neurooncol, 2014, 120(3): 635-642.
[16] 张剑. 血乳酸清除率对社区获得性肺炎所致ARDS患者预后的预测价值[J]. 河北医科大学学报, 2015, 36(6): 690-692.
[17] MEISENHEIMER E S, BEVIS Z J, TAGAWA C W, et al.Drowning injuries: an update on terminology, environmental factors, and management[J]. Curr Sports Med Rep, 2016, 15(2):91-93.
[18] GUO F, HAO L, ZHEN Q, et al. Multicenter study on the prognosis associated with respiratory support for children with acute hypoxic respiratory failure[J]. Exp Ther Med, 2016, 12(5):3227-3232.
