东湖表层沉积物中氨氧化古菌和氨氧化细菌丰度及多样性研究
2018-03-30潘彦羽代嫣然王飞华
潘彦羽 代嫣然 王飞华 梁 威
(1. 中国科学院水生生物研究所淡水生态与生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
随着人口的增长以及经济的快速发展, 大量氮磷等营养元素及有机污染物未经处理即汇入淡水生态系统[1], 致使其生态系统的生态服务功能日渐退化甚至消失。2015年《中国环境统计年报》显示全国废水中氨氮排放量2.3×109kg, 其中城镇生活污水中氨氮排放量占氨氮排放总量的58.3%, 农业源氨氮排放量占排放总量的31.6%, 工业废水氨氮排放量占氨氮排放总量的9.4%[2]。水体中氮素含量过高不仅会极大促进藻类的生长繁殖, 导致水体富营养化, 还会毒害其中的水生动物[3,4]。
氮循环具有复杂的变化过程, 并且与微生物多样性和群落结构密切相关。这个过程包括: 固氮作用、氨化作用、硝化作用和反硝化作用[5]。其中氨氧化是硝化作用的第一步, 也是限速步骤[6]。长期以来, 氨氧化细菌(Ammonia-oxidizing bacterial,AOB) 被认为是氨氧化作用的主要承担者[7], 然而,近年来随着分子生物学技术的发展和研究的深入,新一类具有氨氧化能力的微生物——氨氧化古菌(Ammonia-oxidizing archaea, AOA) 从环境中被分离和鉴定出来。2005年Konneke等[8]从海洋沉积物中分离了一株氨氧化古菌。2006年Leininger等[9]在欧洲中性土壤中发现了AOA的广泛存在, 并且amoA基因丰度大于AOB。氨氧化过程中两个关键酶分别是氨单加氧酶和羟胺氧化还原酶。氨单加氧酶是由amoA、amoB、amoC三个基因编码的α、β、γ三个亚基组成。目前, 编码α亚基的amoA基因被广泛用于生态系统中AOA和AOB的研究[10]。大量研究表明, AOA和AOB存在于很多生态系统中,如土壤[11]、海洋沉积物[12]、湖泊沉积物[13]和活性污泥[14]等, 但是AOA和AOB在淡水生态系统尤其是沉积物中的生态特征、功能差异及多样化环境要素的影响机制仍需要进一步研究[15]。
本研究以典型城市湖泊——东湖为例, 通过监测东湖表层沉积物的理化参数, 采用荧光定量PCR和高通量测序等分子生物学技术, 以功能基因amoA为分子标记, 对AOA和AOB进行定量和定性分析。探讨在不同环境条件下表层沉积物中AOA和AOB的amoA基因的数量及多样性, 分析底质和水质中各种理化因子对它的影响, 力求为湖泊氮循环研究提供理论基础。
1 材料与方法
1.1 采样地点
本研究选取东湖子湖——郭郑湖作为研究对象, 设置3个采样点(图 1), 1号点(30°33′4.71″N 114°21′36.68″E); 2号点(30°33′49.02″N 114°23′3.52″E);3号点(30°33′6.20″N 114°23′31.73″E)。
1.2 样品采集
分别于2016年1月、4月、7月和10月采集东湖表层沉积物样品(12个样品, 0—20 cm)。将沉积物样品充分混匀后分两份置于无菌塑料袋中密封,4℃保存运回实验室, 一份自然风干过200目筛用于理化性质的测定, 另一份放于-20℃冰冻保存用于后续分子实验。
1.3 理化指标测定
采用标准方法对样品进行分析, 其中pH采用pH计(Mettler Toledo, Switzerland)测定; 氨氮(-N)、亚硝酸氮(-N)、硝酸盐氮(-N)采用氯化钾溶液提取-分光光度法测定; 底泥总氮(TN)、总磷(TP)测定按照《土壤农化分析》(第三版)所述方法进行[16]; 总有机碳(TOC)采用总有机碳分析仪(Elementar, Germany)测定。每个样品设置3个平行。
1.4 沉积物中AOA和AOB丰度的测定
沉积物样品DNA提取称取0.3 g沉积物样品, 采用PowerSoil DNA试剂盒(MO BIO Laboratories Inc., USA)进行样品DNA提取, 提取产物用1%的琼脂凝胶电泳检测。

图 1 东湖采样点Fig. 1 Sampling sites in Donghu Lake
绝对定量标准曲线制作参照He等[17]报道的方法, 将提取的土壤样品的微生物全基因组DNA混合并作为PCR扩增的模板, 扩增引物和程序如表 1所示。扩增体系为: 10×PCR buffer (Mg2+)5 μL, dNTP (2.5 mmol/L) 4 μL, 正反向引物(10 mmol/L)各1 μL, Taq酶(2.5U)0.25 μL, DNA模板2 μL, 加ddH2O补足至50 μL。使用Easy Pure QuickGel Extraction Kit (Trans)纯化试剂盒对PCR扩增产物进行切胶纯化, T载体与PCR回收产物连接后转入JM109感受态细胞, 进行蓝白斑筛选。选取白色克隆, 采用菌落PCR鉴定阳性克隆, 所用引物为载体通用引物M13F和M13R。将挑取出的重组质粒进行测序。测序结果经NCBI比对, AOA与泉古菌(JQ345886.1) amoA基因的同源性高达99%, AOB与亚硝化单胞菌(KC769053.1) amoA基因的同源性高达99%。因此, 可作为绝对荧光定量PCR分析的标准DNA。使用EasyPure Plasmid Miniprep Kit(Trans)提取重组质粒DNA, 经核酸定量仪(Nanodrop 2000, USA) 测定浓度, AOA的amoA基因重组质粒浓度为44.6 ng/μL, AOB的amoA基因重组质粒浓度为37.5 ng/μL。根据阿伏伽德罗常数计算出amoA基因的拷贝数, AOA为2.11×1010copies/μL,AOB为1.77×1010copies/μL。将AOA重组质粒按10倍梯度稀释, 用于标准曲线绘制。
荧光定量PCR采用SYBR Green法进行荧光定量PCR, 所用引物参见表 1, 扩增体系为20 μL,其中, 2×Trans Start Tip Green qPCRSuperMix 10 μL,浓度为10 μmol/L的AOA、AOB正反向引物各0.4 μL,DNA模板1 μL, 用ddH2O补足至20 μL。采用Roche LightCycler® 480扩增仪进行定量, 其反应程序如表 1所示。实验设置阴性对照, 并与稀释好的6个标准样品进行定量扩增, 得到标准曲线, 每个样品设置3次重复。以基线(背景)荧光信号标准差的10倍作为阈值, 扩增效率>80%, 溶解曲线为单一峰。
1.5 沉积物中AOA和AOB群落结构分析
HiSeq平台高通量测序针对氨氧化微生物的功能基因amoA, 采用表 1中的引物进行扩增。PCR产物用2%琼脂糖凝胶电泳检测, 引物扩增出来的AOA amoA基因片段长度在600—700 bp, AOB amoA基因片段长度在400—500 bp, 使用AxyPrep-DNA凝胶回收试剂盒切胶回收PCR产物, TrisHCl洗脱; 2%琼脂糖电泳检测。参照电泳初步定量结果, 将PCR产物用QuantiFluoruantTM蓝色荧光定量系统进行检测定量, 之后按照每个样本的测序量要求, 进行相应比例的混合。通过Hiseq 2500平台(IlluminaSanDiego, USA)进行测序, 测序长度250 bp(凌恩生物, 上海)。

表 1 氨氧化微生物amoA基因PCR扩增引物及反应条件Tab. 1 Primers and PCR reaction conditions for amoA gene
AOA和AOB amoA基因多样性分析利用Cluster及Mothur软件对序列进行降噪, 并进行聚类,获得不同序列之间的距离矩阵, 转化为相似度, 将相似度超过80%的序列归为一个操作分类单元(Operational taxonomic unit, OTU)。通过稀释曲线比较不同样品细菌群落多样性差异。用Mothur计算微生物群落的多样性和丰度指数, 包括Shannon指数、Simpson指数、ACE指数、Chao指数和文库覆盖率C[18]。
1.6 系统发育分析
挑选丰度最高的前40个OTUs的代表核酸序列与数据库中已知序列进行比对。采用Neighbor-Joining建树方法利用MEGA6.0软件构建AOA和AOB的amoA基因系统发育树, 建树结果进行1000次Bootstrap检验。
1.7 数据分析
用SPSS 16.0统计分析软件进行方差分析及多因素相关分析。amoA基因丰度进行了以10为底的对数转换。氨氧化微生物群落结构与环境因子之间的关系采用Canoco软件进行典范对应分析, 确定显著影响AOA或AOB群落结构的环境因子, 显著水平设置为P<0.05和极其显著P<0.01。
2 结果
2.1 沉积物理化指标
东湖沉积物基本理化特征如表 2所示。温度随季节变化明显, 其中夏季最高(28.6—29.3℃), 冬季温度最低(6.91—7.14℃)。沉积物呈弱碱性(7.0—7.5), 1号位至3号位点, 沉积物pH呈现逐渐降低的趋势。沉积物TN含量介于1.18—2.31 g/kg (干重), 其中冬季、夏季总氮含量较低, 春季、秋季TN含量较高。沉积物总磷含量介于0.58—1.15 g/kg(干重); 沉积物-N浓度介于26.8—60.9 mg/kg(干重);-N (-N+-N)浓度介于11.1—50.4 mg/kg (干重)。TOC浓度介于27.1—49.2 g/kg(干重), 其中2号点TP、-N及TOC含量均较高,表明2号位点污染最为严重, 可能是由于2013年对1号点区域进行了清淤使得1号点受污染程度有所好转。
2.2 沉积物氨氧化微生物的丰度
AOA和AOB的定量分析结果显示(图 2), 所有样品中均检测到AOA和AOB的存在, 且AOA的丰度高于AOB, AOA与AOB的比值介于1.10—-73.6。AOA的丰度介于1.50×108—8.48×109拷贝/g沉积物(干重), 其中冬季AOA较多, 介于2.83×109—8.48×109拷贝/g沉积物(干重); 夏季最低为1.74×108—1.95×109拷贝/g沉积物(干重)。AOB的丰度介于4.87×107—2.40×109拷贝/g沉积物(干重),4个季节AOB丰度差异不显著。

表 2 沉积物理化性质Tab. 2 Physical and chemical properties in sediments
将东湖AOA和AOB的amoA基因丰度与沉积物的理化因子做Pearson相关性分析(表 3), 结果表明AOA的丰度与温度呈显著负相关(P<0.05), 沉积物温度越高, AOA的丰度越少; AOB丰度与理化因子相关性不显著(P>0.05)。
2.3 沉积物氨氧化微生物多样性
对Shannon指数、Simpson指数、OTU数目的Chao指数和ACE指数进行了分析, 具体结果见表4—6。利用Mothur进行数据的过滤分析, 12个沉积物样品中共得到高质量的AOA amoA基因序列906010条, 平均每个样品的序列条数为37750条。在所有的12个沉积物样品中, 按照80%的序列相似度进行OTU划分。东湖沉积物样品的OTU数量介于5—16, Shannon指数介于0.03—0.05。比较东湖不同季节不同采样的多样性指数发现, 冬季样品多样性高于其他季节, 2号位点多样性最低。

图 2 沉积物中AOA和AOB的丰度Fig. 2 The abundance of AOA and AOB in sediments
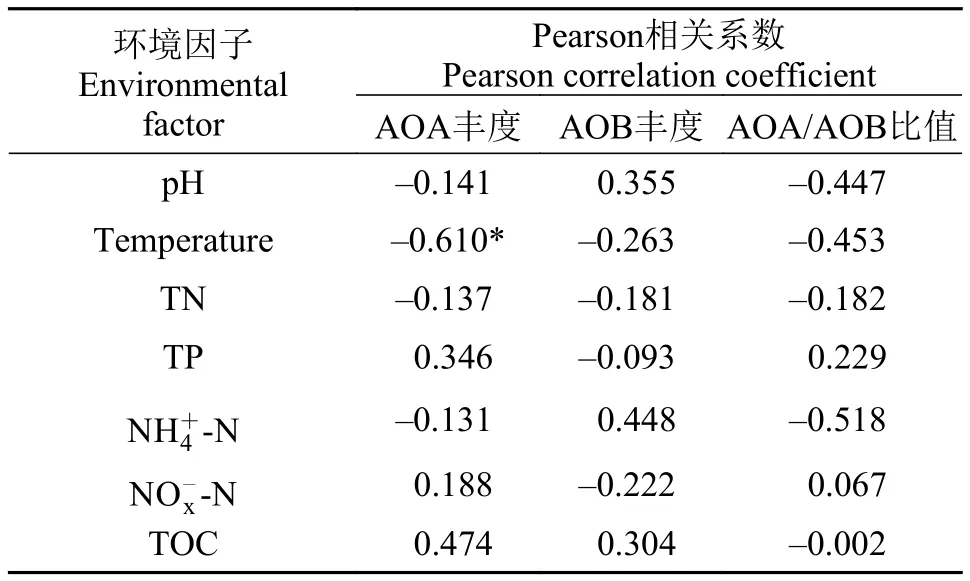
表 3 AOA和AOB丰度与沉积物理化指标相关性分析Tab. 3 Correlation analysis between the abundance of AOA and AOB and physical and chemical indicators in sediments
同时, 我们对沉积物AOB amoA基因进行测序(表 5), AOB的文库覆盖率均达到了较高的水平(>99.9%), 这表明了所建立的amoA基因的文库涵盖了沉积物中几乎所有的amoA基因类型。不同采样点的样品OTU数量差异显著, 沉积物样品AOB的OTU数量介于42—102。Shannon指数最高的是DSP1(1.99), 最低的是DAU2(1.34)。利用不同的指数来估算样本中微生物多样性时, 各指数反应的结果略有偏差, 本研究中DSP3 Chao指数最高, 但其Shannon指数为1.87, 最大为1.99。可能是各指数的计算方法不同, 并且群落多样性受群落组成和群落分布情况的共同影响。
对氨氧化微生物的多样性指标与沉积物的理化性质进行相关性分析(表 6), 结果发现东湖沉积物中AOA OTU数量与TOC呈极显著负相关(P<0.01), 而AOB OTU数量与pH呈显著负相关(P<0.05)。此外, AOA Shannon指数和AOB Shannon指数也与TOC呈极显著负相关(P<0.01), 说明沉积物TOC越高, 群落多样性越低。2号位点相对于其他位点TOC含量最高, 所以AOA和AOB的多样性均较低。
2.4 沉积物氨氧化微生物的群落结构分析
高通量测序解析氨氧化微生物群落的组成和多样性结果如图 3—5所示。总体来看东湖沉积物中AOA亲缘关系较近的既有来自水体的, 也有来自土壤和沉积物的, AOA序列可以分为Nitrosopumilus、Nitrososphaera以及其他。各个季节各个采样点之间AOA群落组成有一定的差异, 但是Nitrosopumilus均占绝对优势(99.8%), 仅在1号位点的冬季、春季及夏季检测到了Nitrosospharea存在, 含量很低。AOB amoA基因序列分为来自土壤和淡水环境的Nitrosomonas, Nitrosospira以及相当一部分处于发育树外枝的序列。在东湖不同季节不同采样点采集的12个样品中, Nitrosomonas占55.27%, 其他占44.70%, Nitrosospira含量仅占0.03%。
2.5 环境因子对AOA和AOB群落结构的典范对应分析
利用Canoco将AOA和AOB的优势种与环境因子进行典范对应(CCA)分析(图 6)。东湖AOA群落结构与环境因子排序轴AX1和AX2的解释度分别为80.6%和9.14%。TOC (-0.9999)、TP (-0.9872)与AX1的相关性较高;-N (0.6545)与AX2的相关性较高。AOB优势种与环境因子的结果表明, 排序轴AX1的解释度为88.5%, 排序轴AX2的解释度为2.70%。与AX1相关性高的环境因子有TP(-0.9984)、TN (-0.9798)、TOC (-0.9933), 与AX2轴相关性较高的环境因子为温度(-0.9631)和pH (0.7244), 总体而言, TN是影响东湖沉积物AOA群落结构的主要因素, TOC和TP是影响AOB群落结构的主要因素。

表 4 沉积物中AOA的多样性指数Tab. 4 Diversity index of AOA in sediments

表 5 沉积物中AOB的多样性指数Tab. 5 Diversity index of AOB in Sediments
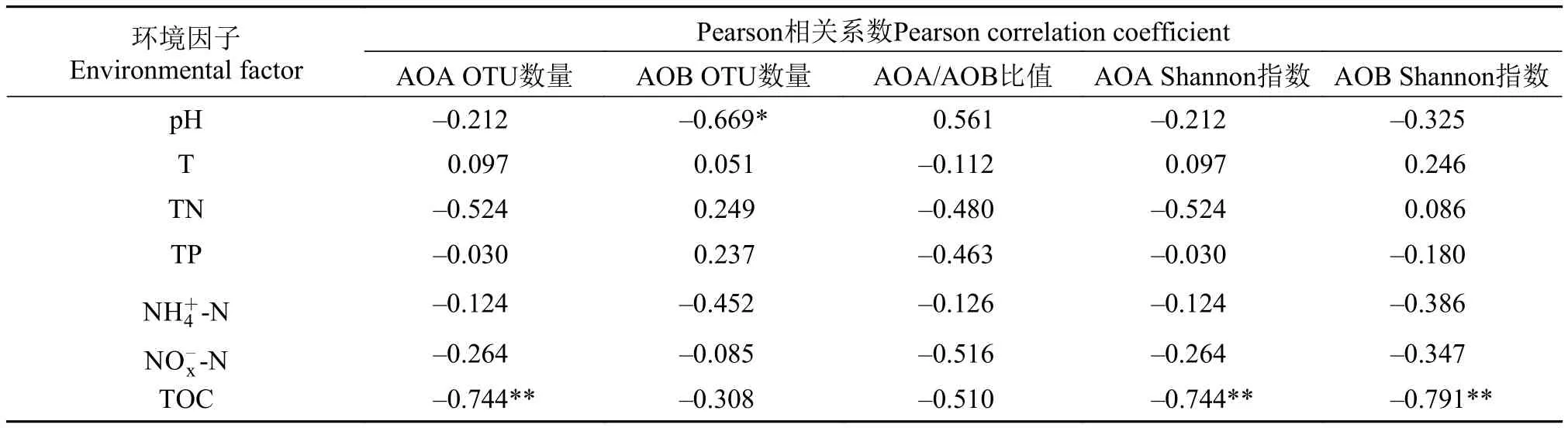
表 6 AOA和AOB的多样性指数与沉积物理化指标相关性分析Tab. 6 Correlation analysis between the diversity index of AOA and AOB and physical and chemical indicators in sediments
3 讨论
已有研究表明, AOA比AOB更适合厌氧或低氨氮浓度条件[19], 在海洋生态系统[20]和土壤环境中[21]AOA amoA基因比AOB的丰度高3个数量级。在淡水生态系统中, Hou等[22]分析了太湖和巢湖不同富营养程度点位中沉积物AOA与AOB丰度, 发现在中营养采样点中AOA多于AOB; Yang等[23]发现在洱海的沉积物中, AOA数量多于AOB。这与本研究在东湖沉积物中AOA和AOB丰度的研究结果类似, 携带amoA基因的微生物并不足以说明其参与氨氧化过程, 因此无法仅仅以基因丰度含量高低确定AOA和AOB在氮循环中的具体贡献, 但目前还没有发现不能进行氨氧化过程的此类微生物[24],AOA可能在东湖生态系统氨氧化中占主要作用。
湖泊沉积物中的AOA和AOB受多种环境因子的影响, 现有研究发现AOA丰度受pH[25]、-N[26]、-N[27]、TN[26]、TP[27]及TOC[28]的影响,AOB的丰度受-N[29]、-N[26]、pH[26]的影响。在本研究中, 东湖沉积物AOA丰度在不同季节存在显著差异, 其数量与温度呈显著负相关。Lu等[30]研究农业池塘沉积物AOA群落分布时, 也得到相似的结论。Hou等[31]研究了东湖不同富营养化程度子湖郭郑湖和团湖AOA群落分布, 发现AOA丰度与沉积物中有机物的含量呈负相关, AOA丰度对环境因子变化敏感。本研究中考察了季节尺度, 方差分析表明不同季节之间TN、TP、-N均有显著差异(P<0.05), 使得温度对AOA数量的影响更为明显。pH[32]被认为是影响AOA和AOB amoA基因数量的一个重要环境因子, 但是在本研究中, pH对沉积物中AOA和AOB的amoA基因数量无显著影响。这些不一致的研究结果表明AOA和AOB对于氨氧化过程中的贡献与环境条件密切相关。
利用高通量测序分析了东湖沉积物AOA和AOB的群落结构, 在AOA和AOB中均检测到部分序列(其他)与目前GenBank中已经探明的amoA序列相似性较低, 可能是未分离或培养的区别于已知菌种的新型氨氧化微生物。东湖沉积物AOA Shannon指数介于0.03—0.05, 东湖AOB Shannon指数介于1.34—1.99, 高于AOA, 在淡水湿地[33]、金山湖[27]及太湖[26]沉积物中AOB多样性均较AOA高,AOA多样性较AOB低, 使得优势属的相对丰度和优势度更加明显。李虎等[34]研究了浙江瓯江沉积物中AOA及AOB组成, 发现AOA的shannon指数在2.64—2.89, AOB的shannon指数在2.83—3.56。多样性显著高于东湖, 推测是由于东湖是湖泊生态系统, 环境条件相对封闭单一, 因此生物多样性也较低。河流生态系统具有流动性, 易受周边环境影响,造成了较高的AOA、AOB多样性。Bollmann等[28]研究了不同营养程度湖泊沉积物的AOA组成, 结果表明湖泊的营养程度是影响氨氧化微生物群落组成的重要因素, 富营养湖泊Erie沉积物AOA以Nitrososphaera为主, 寡营养湖泊Superior以Nitrosopumilus为主。东湖沉积物AOA主要为Nitrosopumilus (99.8%), 说明东湖郭郑湖的污染程度相对较轻, 沉积物TN是影响东湖沉积物AOA群落结构的主要因素。对于AOB, Nitrosomonas青睐于低氨氮环境而Nitrosospira更适应高氨氮的污染环境[35], 东湖沉积物AOB主要为Nitrosomonas(55.3%),AOB群落结构主要受TOC和TP的影响, 与Yang等[23]在滇池的研究结论类似。有研究表明AOA和AOB的群落结构多样性受总磷的影响[36], 但Liu等[33]在淡水湿地的研究发现AOA和AOB的群落结构多样性和总磷没有显著相关性, AOA的多样性和有效磷含量显著正相关。到目前为止, AOA及AOB在含磷酸盐生态位中的优势尚未确定。应进一步研究磷酸盐水平与AOA和AOB的存在与活性之间的关系[37]。
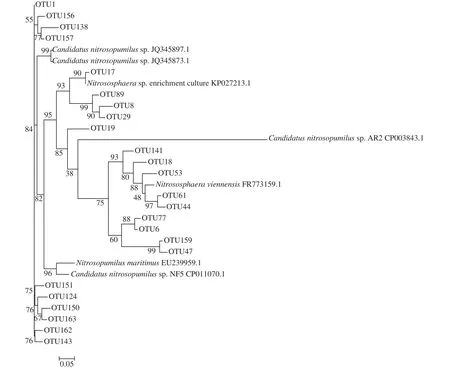
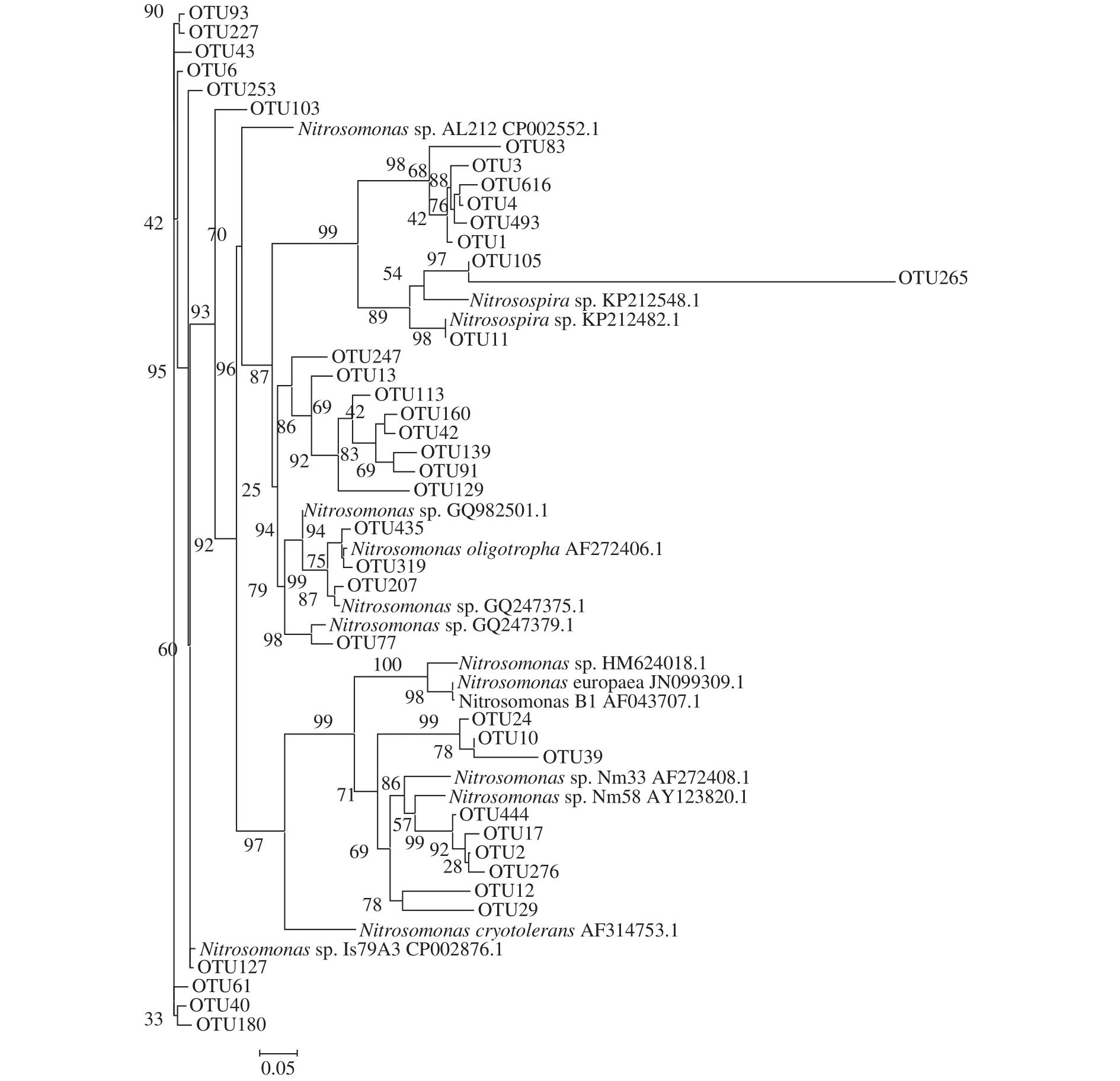
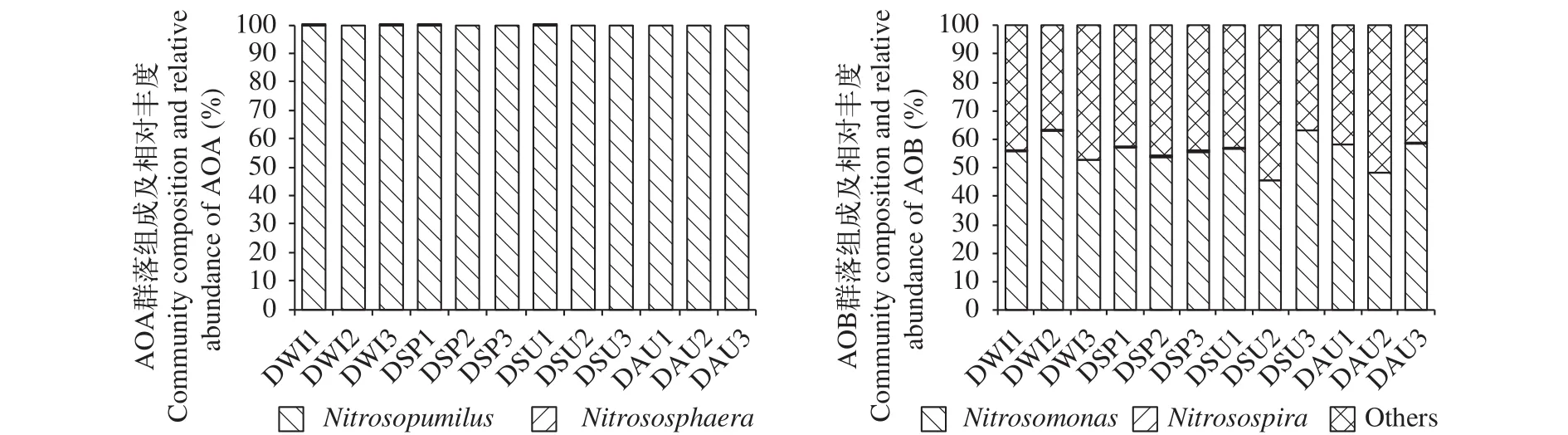
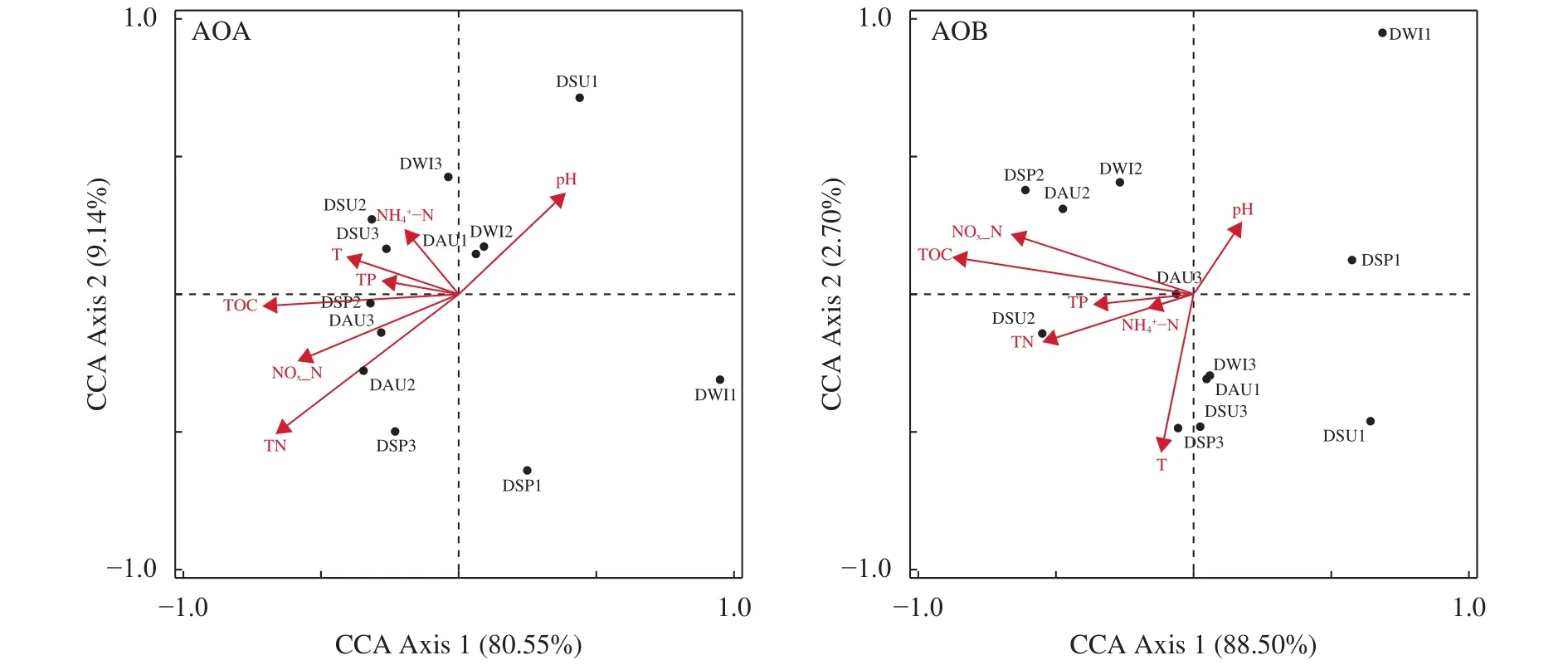
图 6 环境因子对AOA和AOB群落结构影响CCA分析Fig. 6 CCA analysis of the effects of environmental factors on AOA and AOB community structure
4 结论
在东湖沉积物中, AOA丰度比AOB高, 沉积物中氨氧化反应可能由AOA驱动。东湖沉积物样品中AOA丰度与T呈显著负相关, 但AOB丰度变化不明显。沉积物中Nitrosopumilus为优势AOA菌, 沉积物TN是影响东湖沉积物AOA群落结构的主要因素; Nitrosomonas为优势AOB菌, 东湖沉积物AOB群落结构主要受TOC和TP的影响。
参考文献:
[1]Fowler D, Coyle M, Skiba U, et al. The global nitrogen cycle in the twenty-first century [J]. Philosophical Transactions of the Royal Society B, 2013, 368(1621): 1—13
[2]Ministry of Environmental Protection. Annual Report on Environmental Statistics. 2015 [环保部. 2015年环境统计年报]
[3]Arauzo M. Harmful effects of un-ionised ammonia on the zooplankton community in a deep waste treatment pond[J]. Water Research, 2003, 37(5): 1048—1054
[4]Pauer J J, Auer M T. Nitrification in the water column and sediment of a hypereutrophic lake and adjoining river system [J]. Water Research, 2000, 34(4): 1247—1254
[5]Liu G H, Wu H B. Diversity of ammonia-oxidizing archaea in the surface sediments of the northern continental slope of the South China Sea [J]. Tropical Geography,2016, 36(1): 108—113 [刘国辉, 吴后波. 南海北部陆坡表层沉积物氨氧化古菌多样性初探. 热带地理, 2016,36(1): 108—113]
[6]Ke X B, Angel R, Lu Y H, et al. Niche differentiation of ammonia oxidizers and nitrite oxidizers in rice paddy soil[J]. Environmental Microbiology, 2013, 15(8): 2275—2292
[7]Chen Z B, Xia T Y, Wang D K, et al. Spatial and temporal differences of anammox bacterial distribution in Dianchi Lake sediments [J]. Acta Hydrobiologica Sinica,2016, 40(2): 425—430 [陈泽斌, 夏体渊, 王定康, 等. 滇池沉积物中厌氧氨氧化细菌分布的时空差异. 水生生物学报, 2016, 40(2): 425—430]
[8]Konneke M, Bernhard A, de la Torre J R, et al. Isolation of an autotrophic ammonia-oxidizing marine archaeon [J].Nature, 2005, 437(22): 543—546
[9]Leininger S, Urich T, Schloter M, et al. Archaea predominate among ammonia-oxidizing prokaryotes in soils [J].Nature, 2006, 442(7104): 806—809
[10]Petersen D G, Blazewicz S J, Firestone M, et al. Abundance of microbial genes associated with nitrogen cycling as indices of biogeochemical process rates across a vegetation gradient in Alaska [J]. Environmental Microbiology, 2012, 14(4): 993—1008
[11]Han P, Li M, Gu J D. Biases in community structures of ammonia/ammonium-oxidizing microorganisms caused by insufficient DNA extractions from Baijiang soil revealed by comparative analysis of coastal wetland sediment and rice paddy soil [J]. Applied Microbiology and Biotechnology, 2013, 97(19): 8741—8756
[12]Park S J, Ghai R, Martain-Cuadrado A B, et al. Genomes of two new ammonia-oxidizing archaea enriched from deep marine sediments [J]. PLoS One, 2014, 9(5): e96449
[13]Zhang J Z, Yang Y Y, et al. Distribution of sediment bacterial and archaealcommunities in plateau freshwater [J].Environmental Biotechnology, 2015, 99(8): 3291—3302
[14]Limpiyakorn T, Furhacker M, Haberl R, et al. amoA-encoding archaea in wastewater treatment plants: a review[J]. Applied Microbiology and Biotechnology, 2013,97(4): 1425—1439
[15]Shen J P, Xu Z H, He J Z. Frontiers in the microbial processes of ammonia oxidation in soils and sediments [J].Journal of Soils and Sediments, 2014, 14(6): 1023—1029
[16]Bao S D. Analysis of Soil Aggregation [M]. Beijing:China Agricultural Press. 2010, 123—142 [鲍士旦. 土壤农化分析. 北京: 中国农业出版社. 2010, 123—142]
[17]He J Z, Shen J P, Zhang L M, et al. Quantitative analyses of the abundance and composition of ammonia-oxidizing bacteria and ammonia-oxidizing archaea of a Chinese upland red soil under long-term fertilization practices [J].Environmental Microbiology, 2007, 9(9): 2364—2374
[18]Zhuang L J, Xia C, Tian Q, et al. Community structure of anaerobic ammonia oxidation bacteria in subsurface soil from riparian zone to land in Baiyangdian Lake using high-throughput sequencing technology [J]. Acta Scientiae Circumstantiae, 2017, 37(1): 261—271 [庄林杰, 夏超,田晴, 等. 高通量测序技术研究典型湖泊岸边陆向深层土壤中厌氧氨氧化细菌的群落结构. 环境科学学报,2017, 37(1): 261—271]
[19]Liu Z H, Huang S B, Sun G P, et al. Diversity and abundance of ammonia-oxidizing archaea in the Dongjiang River [J]. Microbiological Research, 2011, 166(5):337—345
[20]Zhong J J, Weng J H, Lin X G, et al. Microbial ecology of archaeal ammonia oxidation-a review [J]. Acta Microbiologica Sinca, 2010, 50(4): 431—437 [贾仲君, 翁佳华,林先贵, 等. 氨氧化古菌的生态学研究进展. 微生物学报, 2010, 50(4): 431—437]
[21]Leininger S, Urich T, Schloter M, et al. Archaea predominate among ammonia-oxidizing prokaryotes in soils [J].Nature, 2006, 442(17): 806—809
[22]Hou J, Song C L, Cao X Y, et al. Shifts between ammonia oxidizing bacteria and archaea in relation to nitrification potential across trophic gradients in two large Chinese lakes (Lake Taihuand Lake Chaohu) [J]. Water Research, 2013, 47(12): 2285—2296
[23]Yang Y Y, Zhang J X, Zhao Q, et al. Sediment Ammonia-Oxidizing Microorganisms in two plateau freshwater lakes at different trophic states [J]. Microbiology of Aquatic Systems, 2016, 71(5): 257—265
[24]Zhou L L, Zhu G B, Wang S Y, et al. Abundance, biodiversity and contribution to ammonia -oxidizing archaea in littoral sediments of Dongting Lake [J]. Acta Microbiologica Sinca, 2013, 33(6): 1741—1747 [周磊榴, 祝贵兵,王衫允, 等. 洞庭湖岸边带沉积物氨氧化古菌的丰度、多样性及对氨氧化的贡献. 环境科学学报, 2013, 33(6):1741—1747]
[25]Wang X Y, Wang C, Bao L L, et al. Abundance and community structure of ammonia-oxidizing microorganisms in reservoir sediment and adjacent soils [J]. Applied Microbiology and Biotechnology, 2014, 98(3): 1883—1892
[26]Zhao D Y, Luo J, Zeng J, et al. Effects of submerged macrophytes on the abundance and community composition of ammonia-oxidizing prokaryotes in a eutrophic lake[J]. Environmental Science and Pollution Research, 2014,21(8): 389—398
[27]Liu B, Li Y M, Zhang J P, et al. Abundance and diversity of ammonia-oxidizing microorganisms in the sediments of Jinshan Lake [J]. Current Microbiology, 2014, 69(7):751—757
[28]Wu Y C, Xiang Y, Wang J J, et al. Heterogeneity of archaeal and bacterial ammonia oxidizing communities in Lake Taihu, China [J]. Environmental Microbiology Reports, 2010, 2(33): 569—576
[29]Bollmann A, Bullerjahn G S, Mckay R M. Abundance and diversity of ammonia-oxidizing archaea and bacteria in sediments of trophic end members of the Laurentian Great Lakes, Erie and Superior [J]. PLoS One, 2014, 9(5):e97068
[30]Lu S M, Liao M J, Xie C X, et al. Seasonal dynamic of ammonia-oxidizing microorganisms in freshwater aquaculture ponds [J]. Annals of Microbiology, 2015,65(5): 651—657
[31]Hou J, Cao X Y, Song C L, et al. Predominance of ammonia-oxidizing archaea and nirk-gene-bearing denitrifiers among ammonia-oxidizing and denitrifying populations in sediments of a large urban eutrophic lake(Lake Donghu [J]. Canadian Journal of Microbiology, 2013,59(6): 456—464
[32]Ying J Y, Li X X, Wang N, et al. Contrasting effects of nitrogen forms and soil pH on ammonia oxidizing microorganisms and their responses to long-term nitrogen fertilization in a typical steppe ecosystem [J]. Soil Biology & Biochemistry, 2017, 107(12): 10—18
[33]Liu Y, Zhang J X, Zhang X L, et al. Depth-related changes of sediment ammonia-oxidizing microorganisms in a high-altitude freshwater wetland [J]. Environmental Biotechnology, 2014, 98(3): 5697—5707
[34]Li H, Huang F Y, Su J Q, et al. Distribution and diversity of ammonium-oxidizing archaea and ammonium-oxidizing bacteria in surface sediments of Oujiang River [J].Environmental Science, 2015, 36(12): 4459—4666 [李虎,黄福义, 苏建强, 等. 浙江省瓯江氨氧化古菌和氨氧化细菌分布及多样性特征. 环境科学, 2015, 36(12): 4459—4666]
[35]Wang Y F, Feng Y Y, Gu J D, et al. Seasonal dynamics of ammonia/ammonium-oxidizing prokaryotes in oxic and anoxic wetland sediments of subtropical coastal mangrove [J]. Applied Microbiology and Biotechnology,2013, 97(3): 7919—7934
[36]Wu Y C, Xiang Y, He J Z, et al. Heterogeneity of archaeal and bacterial ammonia oxidizing communities in Lake Taihu, China [J]. Environmental Microbiology Reports,2010, 2(4): 569—576
[37]Erguder T H, Boon N, Wittebolle L, et al. Environmental factors shaping the ecological niches of ammonia-oxidizing archaea [J]. FEMS Microbiology Reviews, 2009,33(5): 855—869
