示指与接触物菌群ERIC-PCR指纹图谱比对
2018-03-30刘耘汀孙大明施少培
刘耘汀 ,孙大明 ,施少培 ,杨 旭
(1.华东政法大学,上海 200043;2.司法鉴定科学研究院 上海市法医学重点实验室 上海市司法鉴定专业技术服务平台,上海 200063)
对嫌疑人现场留下的蛛丝马迹进行识别和追踪是刑事案件侦破的最常用手段之一。随着嫌疑人反侦察意识的增强,传统的鉴定方法如手印、足迹等痕迹鉴定已无法完全满足现代刑事侦查的要求。毛发、血液、软组织碎片等生物物证的DNA分析技术是近年来使用广泛、成熟可靠的物证鉴定技术,被广泛运用于犯罪现场、犯罪嫌疑人、血缘关系确认等诸多侦查领域[1-2],但该技术对生物检材的质和量均有一定要求,部分限制了该技术的应用。
细菌作为最原始、种类数量最庞大的客体,是人体与生俱来的附属生物。研究[3-4]发现,细菌几乎存在于人体所有部位并和人体建立了密切的共生或寄生关系,一个正常人所携带的细菌约为1.0~1.5kg,这些细菌大多存在于肠道系统,帮助人体消化食物、保护病原微生物入侵。仅就人手部而言,每个人双手大约有150种细菌,总数多达80万个。2010年,FIERER等[5-6]发现,细菌寄生人体具有一定的“特异性”,即每个人可能具有独有的寄生细菌,人和人之间的菌群种类差别高达80%~90%,且在人体手部接触物体后,留在物体表面的细菌可存活2周,这些细菌具有顽强的生命力,即使在犯罪嫌疑人用洗涤液清洗后,残留的少量细菌仍能在4h左右恢复原有细菌菌群。因此,人体自身特有的细菌群落,可能成为犯罪现场无法消除的重要生物学线索。当提取到犯罪嫌疑人残留在其接触物体上的细菌后,即可扩大培养,进而复原细菌原有种群,通过DNA指纹技术建立独特的“细菌指纹图谱”,从而用于司法鉴定工作。
DNA指纹技术是指利用不同生物体中DNA序列的差异性,建立起的一种用于个体识别、遗传追溯的DNA条带图谱。该技术自从20世纪70年代被提出后,迅速运用于物种起源进化、肿瘤发生、疾病诊断、亲子鉴定、法医鉴定等诸多领域[7-8]。肠道细菌基因间重复序列(enterobacterial repetitive intergenic consensus,ERIC)是最早在肠道细菌中发现的长度约为124~127bp的高度保守的DNA重复序列。近年大量研究[9-13]表明,几乎所有细菌基因组均包括ERIC,该序列在不同细菌基因组的重复频次、间隔等具有特异性。在使用该序列的PCR引物进行扩增后,肠道中不同的细菌会出现特异性DNA条带图谱,即ERICPCR指纹图谱。这种图谱具有分辨率高、敏感性高、重复性高、操作简便快速等特点,因此被越来越多地运用于细菌鉴定、种群分布、群落生态等研究领域。
本研究采集人体示指细菌和其常用手机触摸屏、个人办公桌桌面细菌,对菌群进行扩大培养后,提取混合细菌的宏基因组DNA,利用ERIC-PCR技术对上述样本分别进行分型,通过对三者之间的图谱比对分析,探讨ERIC-PCR指纹图谱用于同一认定的可能性。
1 材料与方法
1.1 试剂和仪器
酵母浸粉、胰蛋白胨(北京陆桥技术股份有限公司),溶菌酶、饱和酚溶液、蛋白酶K(国药集团化学试剂上海有限公司),ERIC-PCR引物[生工生物工程(上海)股份有限公司],LA Taq 酶、dNTP、DNA maker(日本TaKaRa公司),9700型PCR仪(美国AB公司),G-Box型凝胶成像分析仪(美国SYNGENE公司),PowerPacTM基础电泳仪(美国Bio-Rad公司),5810R型低温冷冻离心机(德国eppendorf公司),NanoDrop 2000C分光光度计(美国Thermo Scientific公司),SIMF140AY65型雪花状制冰机(日本SANYO公司)。
1.2 实验材料
1.2.1 细菌样本采集及培养
邀请男性和女性志愿者各5名,用灭菌PBS溶液湿润灭菌棉球,根据志愿者使用手机和鼠标的习惯,分别擦拭志愿者右手示指、手机触摸屏、个人办公桌桌面,将擦拭后的棉球放入标识好的普通培养基(LB培养基)中,37℃摇床过夜培养。男性细菌样本用M代表,示指分别编号为Mf1~5,对应的手机触摸屏分别编号为Mp1~5,对应的桌面编号为Me1~5;女性样本用F代表,示指、手机触摸屏、个人办公桌桌面分别编号为Ff1~5、Fp1~5、Fe1~5。LB培养基配方如下:胰蛋白胨10g/L、酵母提取物5g/L、氯化钠10 g/L、琼脂粉15g/L,高灭菌后倒置固体平板培养基。
1.2.2 细菌宏基因组提取
取过夜培养16h的菌液3mL,以离心半径10cm,5000r/min,离心10min,弃上清液,PBS缓冲液洗菌体沉淀3次,1mL PBS重悬后加入50mg/mL溶菌酶37℃孵育1h,依次加入100μL 10%SDS溶液,20 mg/mL蛋白酶K 55℃孵育1h,再加入1500μL 5mol/L NaCl溶液;最后经过 V酚∶V氯仿∶V异戊=25∶24∶1 抽提,2 倍体积无水乙醇沉淀DNA后双蒸水溶解。
1.2.3 ERIC-PCR
ERIC-PCR 引物序列为 ERIC(F) 5′-ATGTAAG CTCCTGGGGATTCAC-3′,ERIC(R) 3′-AAGTAAGTG ACTGGGGTGAGCG-5′[8,11]。反应条件:95 ℃ 2 min;94℃ 3s,92℃ 30s,50℃ 1min,65℃ 8min;30 次循环;65℃ 8 min。PCR产物进行1%琼脂糖凝胶电泳后,由G-Box型凝胶成像分析仪采集图像。
1.3 结果分析
电泳图谱通过G-Box型凝胶成像分析仪采集条带后进行分析比对。
2 结 果
2.1 示指宏基因组DNA质量
如图1所示,所有采集到的志愿者宏基因组均有较完整的全基因组条带。另外,经NanoDrop 2000C分光光度计分析,所有DNA的D260/280值均在1.8~2.0。

图1 10名志愿者的宏基因组DNA提取结果
2.2 示指和手机触摸屏细菌宏基因组ERIC-PCR关联性比较
示指和手机触摸屏细菌宏基因组ERIC-PCR结果如图2所示,在10名志愿者中一共有4名男性、3名女性的示指与手机触摸屏上的菌群ERIC-PCR指纹图谱对应吻合。有1名男性、2名女性示指和手机触摸屏上的细菌ERIC-PCR指纹图谱不一致,其中1名男性(7~8泳道)示指和手机触摸屏上的DNA图谱只有一条近似大小的DNA条带,1名女性(11~12泳道)示指和手机触摸屏上的菌群ERIC-PCR指纹图谱完全不同,无同样大小的条带。以上两名志愿者示指和手机触摸屏上的菌群采集和ERIC-PCR重复三次,结果完全相同。对于不同人的ERIC-PCR指纹图谱进行比对发现,不论是示指还是手机触摸屏上的细菌ERIC-PCR指纹图谱均有较大区别。
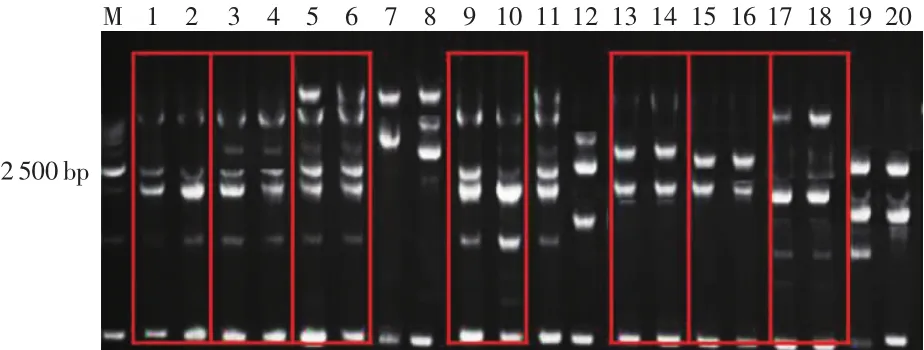
图2 示指和手机触摸屏菌群宏基因组ERIC-PCR结果
2.3 示指和个人办公桌桌面细菌宏基因组ERICPCR关联性比较
如图3,在10名志愿者中,只有2名男性(1~2和9~10泳道)和1名女性(17~18泳道)的示指与个人办公桌桌面菌群ERIC-PCR指纹图谱对应吻合,而其他7名志愿者示指和办公桌桌面菌群ERIC-PCR指纹图谱不完全相符。但图谱条带比对分析发现,3~4、5~6、11~12、13~14、15~16、19~20 泳道中至少有一个条带大小近似,且大多数条带大小完全一致,可以根据条带的符合程度来推测两者之间细菌种群的近似性,条带位置、数目越接近,表示两者的菌群构成越相似。
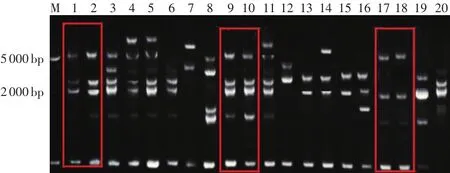
图3 示指和办公桌桌面细菌宏基因组ERIC-PCR结果
3 讨 论
2010年,FIERER等[5]发现细菌寄生人体具有一定的“特异性”。2012年,GOGA 研究[14]发现,可以通过袜子上的细菌来确定袜子的所有者。以上研究证明,细菌作为一种可扩增繁殖、不易被消除的生物材料,在法医学鉴定方面具有较大潜力,但实际运用并不多。
本研究通过对志愿者示指和接触物(手机触摸屏、个人办公桌桌面)细菌进行ERIC-PCR,建立DNA指纹图谱,比较示指和其接触物(手机触摸屏、个人办公桌桌面)之间细菌宏基因组的关联性。结果发现,人体示指与接触物(手机触摸屏、个人办公桌桌面)菌群之间存在关联性,且这种关联性可以借助ERIC-PCR建立DNA指纹图谱来快捷、直观地呈现。其中,与手机触摸屏相比,个人办公桌桌面采集的细菌和个体示指表面菌群的关联性明显降低。考虑到示指及接触物(手机触摸屏、个人办公桌桌面)菌群复杂,部分细菌可能带有荚膜、细胞壁等,对细菌的裂解造成影响,另外糖类、蛋白质、RNA可能也会对扩增结果产生不良影响,而相较于一般PCR,ERIC-PCR对模板DNA要求更高。因此,为了保证DNA质量,本实验采用琼脂糖凝胶电泳、NanoDrop 2000C分光光度计测定D260/280值两种方法来检测DNA质量。另外,反复实验发现细菌样品的采集极为关键,物品使用者的个人习惯、环境中其他微生物等都会对ERIC-PCR结果产生较大影响。
因为本研究招募的志愿者人数有限,所得的结果只能作为初步推测。鉴于细菌群落构成受地域、性别、年龄、职业、遗传等多个因素影响而表现出相对的稳定和变化,手机触摸屏、个人办公桌桌面的菌群也受到湿度、酸碱度、时间等因素影响,为了尽可能地避免干扰,实验邀请的10名志愿者均为年龄、职业、工作环境相对一致的研究生,但最终想要将菌群作为个体识别的材料之一,仍需进一步深入研究。此外,本研究虽然通过ERIC-PCR指纹图谱比对方法初步证明了宏基因组在同一认定中的应用价值,但是由于体外培养的方法可能带来微生物种类的变化或偏移,加之检验方法的灵敏度所限,在今后的研究中将对实验方法进一步优化,包括采用新一代高通量测序等更加灵敏的检测手段以及增加样本检测量和代表性,使研究结果更接近鉴定应用的需要。
[1]伍湘萍.在案件侦破中DNA指纹技术的应用[J].黑龙江科技信息,2015(22):119.
[2]高赛飞,彭建军,王莹,等.分子标记技术构建DNA指纹图谱在个体识别中的应用[J].野生动物,2009,30(5):269-273.
[3]TIMS S,VAN WAMEL W,ENDTZ H P,et al.Microbial DNA fingerprinting of human fingerprints:dynamic colonization of fingertip microflora challenges human host inferences for forensic purposes[J].Int J Legal Med,2010,124(5):477-481.
[4]陈超.肠内有益菌减少易患抑郁症[N].科技日报,2016-06-17(2).
[5]FIERER N,LAUBER C L, ZHOU N, et al.Forensic identification using skin bacterial communities[J].Proc Natl Acad Sci USA,2010,107(14):6477-6481.
[6]曹淑芬.根据手上细菌锁定罪犯[J].自然与科技,2010(3):2.
[7]李伯龄,倪锦堂,叶健,等.DNA指纹技术研究[C].中国分析测试协会科学技术奖发展回顾,2015.
[8]李钟淑,金粉玉,王士勇,等.DNA指纹技术在动物亲子鉴定中的应用[J].延边大学农学学报,2003,25(2):131-133,148.
[9]刘毅,姚粟,李辉,等.三种DNA指纹图谱技术在菌株分型中的应用[J].生物技术通报,2015(6):81-86.
[10]杨柳,张邑帆,郑华,等.ERIC-PCR及其指纹图谱技术的研究[J].中国微生态学杂志,2010,22(9):845-847.
[11]DORNELES E M,SANTANA J A,RIBEIRO D,et al.Evaluation of ERIC-PCR as genotyping method for Corynebacterium pseudotuberculosis isolates[J].PLoS One,2014,9(6):e98758.
[12]李云飞,秦翠丽,王忠泽,等.兔粪中微生物区系ERICPCR DNA指纹图谱的建立及分析[J].畜牧兽医学报,2016,47(4):716-722.
[13]崔明全,何廷美,钟志军,等.大熊猫粪便菌群ERICPCR指纹图谱的分析及优势菌群的鉴定[J].畜牧与兽医,2013,45(9):6-11.
[14]GOGA H.Comparison of bacterial DNA profiles of footwear insoles and soles of feet for the forensic discrimination of footwear owners[J].Int J Legal Med,2012,126(5):815-823.
