Nrf2蛋白在骨骼肌损伤修复中的时序性表达及作用
2018-03-30张小红杜秋香王英元孙俊红
张小红 ,刘 季 ,李 娜 ,杜秋香 ,王英元 ,孙俊红
(1.山西医科大学法医学院,山西 太原 030001;2.邹平县公安局,山东 邹平 256200;3.广州市公安局交通警察支队,广东 广州 510000)
损伤时间推断是法医病理学研究的重点及难点之一,损伤时间的研究虽然取得了很多成果[1-3],但在实践中应用较有限,探索理想指标仍是目前研究的主要任务。骨骼肌损伤在法医学实践中很常见,而氧化应激信号通路是机体损伤后的重要保护机制之一,因此,本研究选择骨骼肌和氧化应激信号通路进行观察。核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)是氧化应激信号通路中的一种关键蛋白。正常状态下,其在胞质中与Kelch样环氧氯丙烷相关蛋白-1(Kelch-like ECH-associated protein 1,Keap1)结合,活性被抑制。当炎症、辐射等有害刺激引起细胞内活性氧(reactive oxygen species,ROS)积累时,引起Nrf2与Keap1解离,游离的Nrf2进入细胞核内蓄积,与抗氧化元件(antioxidant responsive element,ARE)结合,诱导解毒酶及抗氧化蛋白高表达,对机体起保护作用。
研究[4-5]表明,氧化应激信号通路在多种细胞的损伤与修复过程中起重要作用,作为该通路的关键信号分子ROS和Nrf2在肌肉损伤后的变化规律、机制及是否能够用于损伤时间推断有待于进一步研究。心脏毒素(cardiotoxin,CTX)制作骨骼肌损伤模型具有损伤程度和范围易于控制的优点[6-7],目前被广泛用于骨骼肌损伤修复研究。因此,本研究采用大鼠腓肠肌内注射CTX造模,观察骨骼肌修复过程中组织形态学变化,探索氧化应激信号通路中关键蛋白Nrf2及重要因子ROS的表达变化规律,以期找到理想的损伤时间推断指标。
1 材料与方法
1.1 主要试剂和仪器
心脏毒素(cardiotoxin,CTX,ZX0005)购自广州威佳科技有限公司,2’,7’-二氯二氢荧光素二乙酸酯(2’,7’-dichloro-dihydro-fluorescein diacetate,DCFHDA,35845)购自美国Sigma公司,兔抗大鼠Nrf2抗体(sc-722)、异硫氰酸荧光素(fluorescein isothiocyanate,FITC)-驴抗兔抗体(sc-2090)购自美国 Santa Cruz公司,哺乳动物组织总蛋白提取试剂(AR0101)、二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒(AR0146)、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)蛋白上样缓冲液 5×(AR1112)、彩色预染蛋白 marker(10000~170000)、5%牛血清白蛋白封闭液(bovine serum albumin,BSA,AR0004)、增强型化学发光(enhanced chemiluminescent,ECL)底物(AR1170)、硝酸纤维素膜(nitrocellulose membrane,NC)、4’,6’-二脒基-2-苯基吲哚(4’,6’-diamidino-2-phenylindole,DAPI)染色液(AR1176)、兔抗大鼠甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH) 抗 体 (BA2913)、 辣 根 过 氧化物酶(horseradish peroxidase,HRP)-羊抗兔 IgG(BA1054)均购自武汉博士德生物工程有限公司。
Infinite M200 Pro多功能酶标仪(瑞士Tecan公司),2-16PK型低温高速离心机(美国Sigma公司),电泳转印两用仪(美国C.B.S集团有限公司),BioSpectrum凝胶成像系统(美国UVP公司),RM2135型石蜡切片机(德国Leica公司),BX61型荧光显微镜、BH-2型光学显微镜(日本Olympus公司)。
1.2 实验动物分组及损伤模型制备
健康成年雄性SD大鼠84只,10~12周龄,体质量220~250g,由山西医科大学实验动物中心提供,在山西医科大学法医学院动物室分笼饲养,自由进食和饮水,光照12 h/d,随机分为正常对照组和损伤后1 h、4 h、8 h、12 h、16 h、1 d、3 d、5 d、7 d、9 d、13 d、17 d、21 d组,共14组,每组6只。
损伤后大鼠用10%水合氯醛(0.35 mL/100 g)腹腔注射麻醉,剪去毛发,用75%乙醇溶液消毒后,于大鼠左下肢腓肠肌内注射45μL CTX,建模成功后与正常对照组一起常规饲养。
在各损伤时间脱颈处死大鼠,迅速切取左下肢腓肠肌组织:部分用4%多聚甲醛溶液固定,用于HE染色及免疫荧光染色;部分用液氮速冻后于-80℃低温保存,用于ROS含量检测及Western印迹法检测。
正常对照组大鼠不做处理,处死方法、取材部位及实验方法同损伤组。
1.3 HE染色
取损伤区肌肉用4%多聚甲醛溶液固定24h后,脱水、透明、浸蜡后石蜡包埋,制作4μm切片。切片经脱蜡、水化后,进行苏木素-伊红染色,在BH-2型光学显微镜下观察。
1.4 ROS相对含量检测
取各组肌肉组织,称重后用液氮低温研磨,按肌肉质量(g)∶PBS 体积(mL)=1∶4 的比例加入 PBS,充分振荡后,4℃下,1000×g离心10min,提取上清液。 用BCA法测定所提取各组上清液蛋白浓度并将各组上清液稀释至相同浓度。取190μL上清液及10μL DCFH-DA(0.1μmol)在荧光酶标板中混匀,37℃反应30min。DCFH-DA进入细胞内后,被细胞内的酯酶水解生成DCFH,细胞内的活性氧可以氧化无荧光的DCFH生成有荧光的二氯荧光素(dichlorofluorescein,DCF),用酶标仪测量DCF的荧光值,即为组织中ROS相对含量。
1.5 蛋白样品制备及Western印迹法检测
取低温保存的各组肌组织,称重后用液氮低温研磨,按肌肉质量(g)∶哺乳动物组织总蛋白提取试剂体积(mL)=1∶4的比例充分振荡混匀,4℃下反应90min,1000×g离心 10min,提取上清液。 用 BCA 法测定各组上清液蛋白浓度并稀释至同一蛋白浓度,按4∶1的体积比例加入SDS-PAGE蛋白上样缓冲液5×,100℃煮沸5min。制作电泳凝胶,上样、电泳,170mA转印50 min,5%BSA封闭2 h,将NC膜上目的蛋白区和内参蛋白区剪开,分别滴加一抗(1∶200兔抗大鼠Nrf2抗体、1∶5 000兔抗大鼠GAPDH抗体)4℃孵育过夜,再分别滴加二抗(1∶2000 HRP-羊抗兔 IgG)室温孵育2h,与ECL底物反应,用BioSpectrum凝胶成像系统拍照、测量。
1.6 免疫荧光染色
取1.3节所述切片经脱蜡、水化后,进行免疫荧光染色:0.3%TritonX-100透膜,枸橼酸微波修复,5%BSA封闭液封闭,滴加1∶200兔抗大鼠Nrf2抗体4℃孵育过夜,水洗后滴加1∶200 FITC-驴抗兔抗体室温避光孵育1h,滴加DAPI染色液室温孵育10min染核、抗荧光衰减剂封片。阴性对照采用PBS代替一抗。使用荧光显微镜拍照后,利用Image-Pro Plus 6.0软件计算各组Nrf2阳性核率(Nrf2阳性细胞核数/总细胞核数),以表示Nrf2蛋白在细胞核内表达水平。
1.7 统计学分析
用 SPSS 16.0、Image-Pro Plus 6.0、BioSpectrum凝胶成像系统软件对实验数据进行统计分析。Nrf2阳性核率用百分率表示,进行卡方检验;ROS相对含量及Western印迹法检测数据用±s表示,采用单因素方差分析。检验水准α=0.05。
2 结 果
2.1 大鼠骨骼肌损伤修复过程的形态学变化
行HE染色观察,在损伤后4 h即可看到骨骼肌细胞明显水肿、坏死,有少量中性粒细胞浸润,在损伤后16h中性粒细胞明显增多,1d达高峰。损伤后3d炎症细胞浸润以单核细胞为主,并伴有新生毛细血管及较多的成纤维细胞。损伤后5d可见大量核位于胞质中央的新生肌细胞出现,13d时大量新生肌细胞融合为肌管,至21d时肌细胞分化成熟,细胞横径基本接近正常肌细胞,核位于细胞膜下(图1)。
2.2 大鼠骨骼肌损伤后ROS相对含量变化
与正常对照组相比,骨骼肌损伤后ROS相对含量在损伤后12h减少(P<0.05),其余各组变化差异无统计学意义(表1)。
2.3 大鼠骨骼肌损伤后Nrf2蛋白表达变化
用Western印迹法检测Nrf2蛋白表达情况,结果见图2。与正常对照组相比,骨骼肌组织仅损伤后16h表达升高具有统计学意义(P<0.05),其余各组Nrf2蛋白变化差异均无统计学意义。
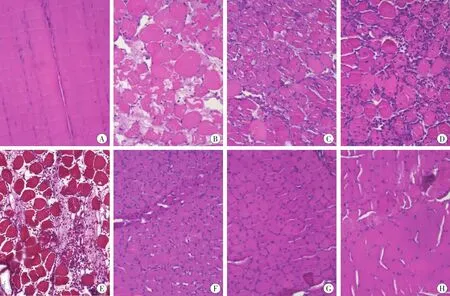
图1 大鼠骨骼肌损伤修复过程中的病理学改变 HE×200
表1 大鼠骨骼肌损伤后ROS相对含量及Nrf2 阳性核率 (n=6,±s)
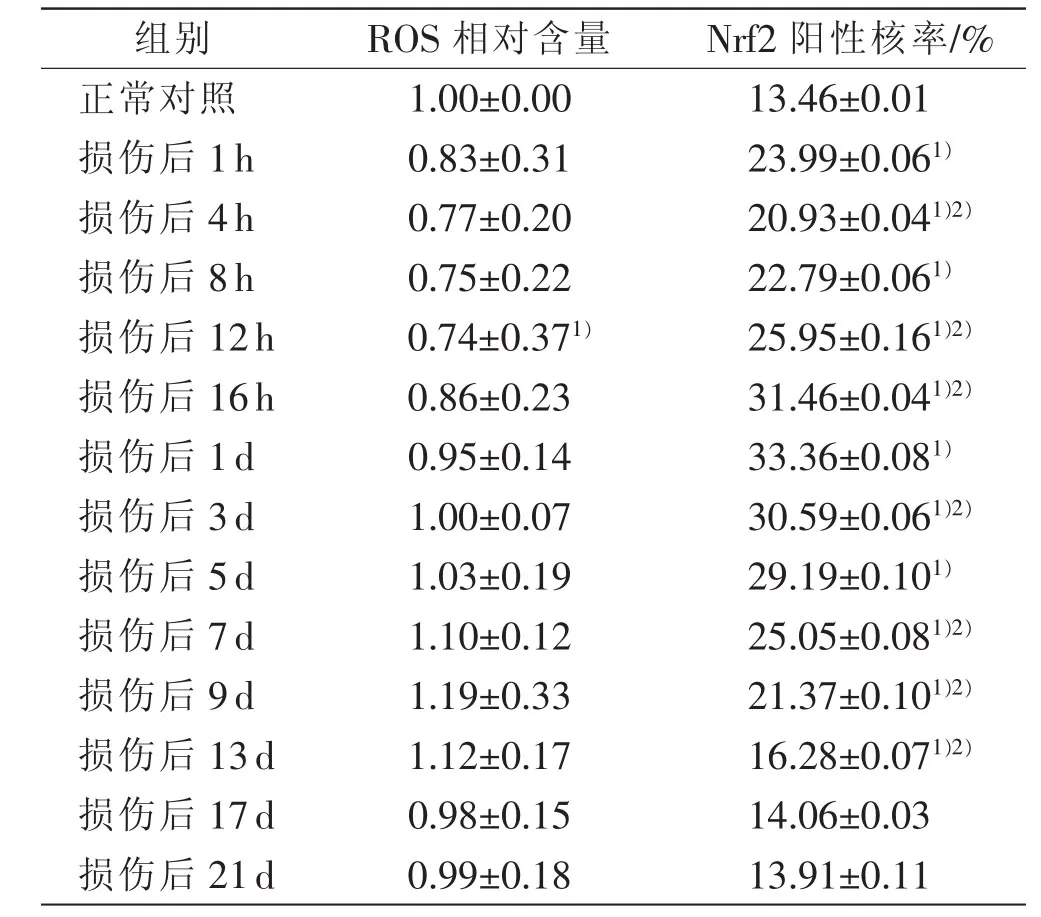
表1 大鼠骨骼肌损伤后ROS相对含量及Nrf2 阳性核率 (n=6,±s)
注:1)与正常对照组比较,P<0.05;2)与相邻上组比较,P<0.05
组别 ROS相对含量 Nrf2阳性核率/%正常对照 1.00±0.00 13.46±0.01损伤后 1h 0.83±0.31 23.99±0.061)损伤后 4h 0.77±0.20 20.93±0.041)2)损伤后 8h 0.75±0.22 22.79±0.061)损伤后 12h 0.74±0.371) 25.95±0.161)2)损伤后 16h 0.86±0.23 31.46±0.041)2)损伤后 1d 0.95±0.14 33.36±0.081)损伤后 3d 1.00±0.07 30.59±0.061)2)损伤后 5d 1.03±0.19 29.19±0.101)损伤后 7d 1.10±0.12 25.05±0.081)2)损伤后 9d 1.19±0.33 21.37±0.101)2)损伤后 13d 1.12±0.17 16.28±0.071)2)损伤后 17d 0.98±0.15 14.06±0.03损伤后 21d 0.99±0.18 13.91±0.11
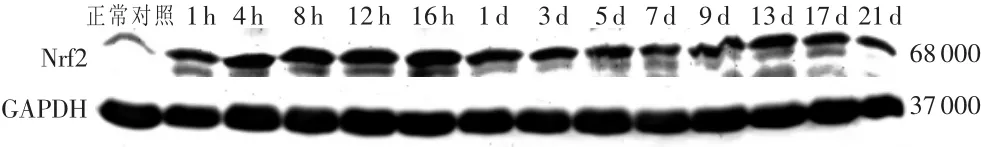
图2 骨骼肌损伤后不同时间点Nrf2蛋白表达量
2.4 Nrf2蛋白在骨骼肌损伤后阳性核率比较
对各组骨骼肌组织进行免疫荧光染色,Nrf2蛋白呈绿色荧光,细胞核呈蓝色荧光,当绿色荧光与蓝色荧光重叠表示Nrf2蛋白位于细胞核内。由图3可见,在骨骼肌损伤后Nrf2蛋白染色阳性的细胞核比正常对照组增多,并随损伤时间呈先增高后减少的变化。
对各组骨骼肌Nrf2阳性核率进行统计分析(表1),与正常对照组相比,在骨骼肌损伤后除17d、21d外,其余时间点Nrf2阳性核率均升高(P<0.05);各损伤组与相邻上组比较,除4h与8h、16h与1d、3d与5d、13 d与17 d、17 d与21 d 5组外,其余各相临两组间差异均有统计学意义(P<0.05),并且Nrf2阳性核率呈先增高后降低的变化规律,在16h~1d达到峰值。
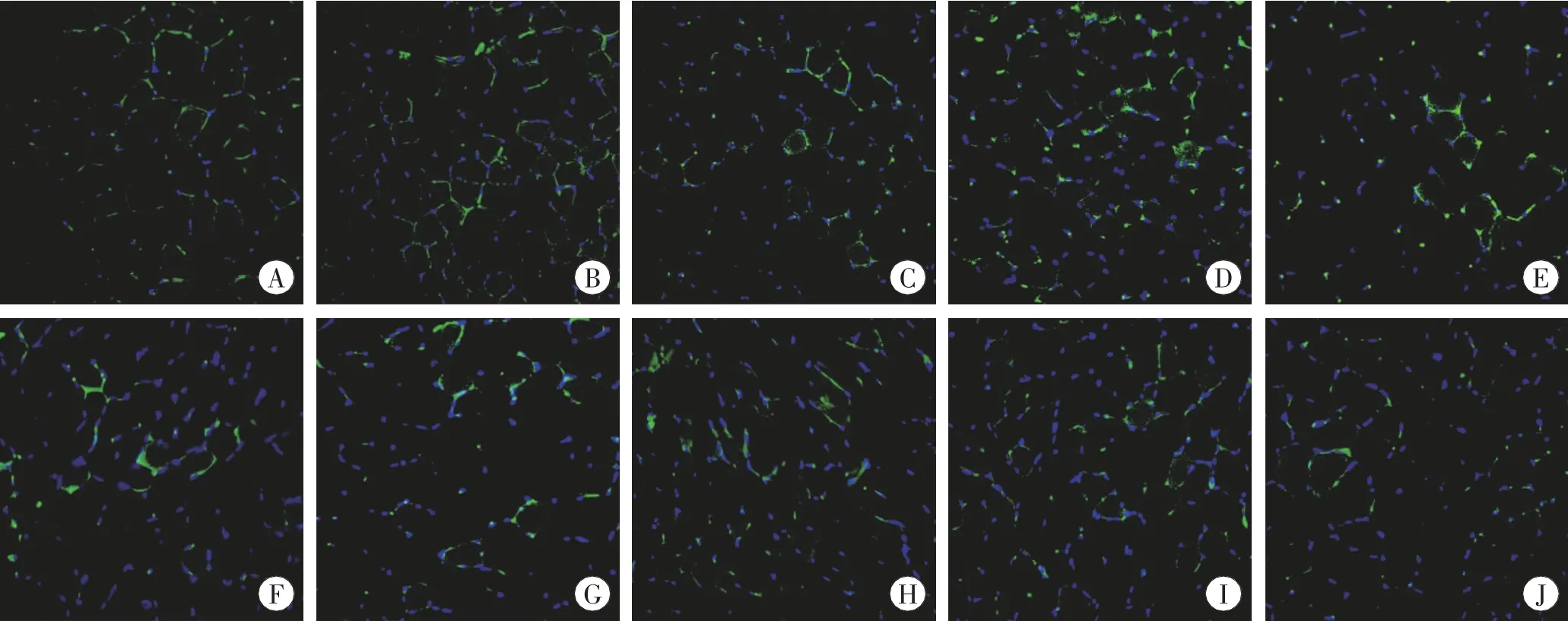
图3 骨骼肌免疫荧光染色 ×400
3 讨 论
氧化应激信号通路对细胞的代谢活动起重要调节作用,参与组织细胞抗氧化、炎症、衰老及凋亡等病理生理过程,此通路包含一个重要的转录因子Nrf2和一个重要的细胞内信号分子ROS[4-5,8-13]。HORIE等[8]用电刺激小鼠C2C12细胞,刺激停止后,增加的ROS在1h内迅速降至对照水平;有研究者[9]用·NO(活性氧)刺激HCT116细胞,发现细胞核内Nrf2从停止刺激后4h开始升高,24h升高到131%,说明ROS代谢迅速,但短时间内增多可诱导Nrf2蛋白发生核转位。但信号分子ROS在损伤后是否持续处于高水平以维持细胞核内Nrf2蛋白水平以及损伤后Nrf2蛋白的核转位机制尚不清楚。本研究结果显示,信号分子ROS和组织中Nrf2蛋白在损伤1h后与正常对照组差异无统计学意义。而Nrf2阳性核率显著增高,说明氧化应激信号通路在修复过程中被激活,而ROS仅在损伤早期(1h内)起“开关样”激活作用,Nrf2并不是通过蛋白表达增多,而是通过Nrf2蛋白的核转位实现对其下游代谢的调节。本实验结果从另一方面也表明,在肌肉损伤1h后检测信号分子ROS的含量变化对损伤时间推断应用价值不大。
文献[5,11,14-17]报道,Nrf2 蛋白具有抗感染、促进肌卫星细胞分化和增殖、抑制衰老等作用。结合HE染色发现,细胞核内Nrf2蛋白高表达正处于炎症反应、细胞增殖、分化阶段,随肌细胞成熟而恢复到对照水平,说明Nrf2参与了骨骼肌损伤后的炎症反应、肌卫星细胞的增殖分化及成熟的过程,具有促进损伤修复的作用。
Nrf2阳性核率在损伤后1 h~13 d均高于正常对照组,在16h~1d达峰值,在17d降至对照水平,具有随损伤时间先升后降的时序性变化规律。HE染色显示,在损伤1 d内主要表现为坏死及炎症反应,3 d后主要是组织修复,因此,可将Nrf2阳性核率变化与HE染色相结合,用于损伤时间推断。当然使用此指标仍具有推断时间跨度大的局限性,后续研究可以寻找其他mRNA及蛋白指标结合应用来缩短损伤时间推断的时间窗并提高准确性。
本研究发现,在骨骼肌损伤后,氧化应激信号通路关键蛋白Nrf2阳性核率随骨骼肌的损伤修复过程呈时序性变化,说明其参与此过程,并且其变化规律可用于骨骼肌损伤时间推断。
[1]孙俊红,朱细燕,王小伟,等.大鼠肌肉组织挫伤后ASL mRNA表达与损伤时间的关系[J].中国法医学杂志,2015,30(4):376-379.
[2]王慧君,阮海根,黄光照.PDGF-β,PDGFR-β,TGF-β1,bFGF在创伤愈合过程中的表达变化与损伤时间关系的研究[J].法医学杂志,2001,17(4):198-201,204.
[3]TIAN Z L,JIANG S K,ZHANG M,et al.Detection of satellite cells during skeletal muscle wound healing in rats:time-dependent expressions of Pax7 and MyoD in relation to wound age[J].Int J Legal Med,2016,130(1):163-172.
[4]LOBODA A,DAMULEWICZ M,PYZA E,et al.Role of Nrf2/HO-1 system in development,oxidative stress response and diseases:an evolutionarily conserved mechanism[J].Cell Mol Life Sci,2016,73(17):3221-3347.
[5]KANSANEN E,KUOSMANEN S M,LEINONEN H, et al.The Keap1-Nrf2 pathway: Mechanisms of activation and dysregulation in cancer[J].Redox Biol,2013,1:45-49.
[6]LIU N, NELSON B R, BEZPROZVANNAYA S,et al.Requirement of MEF2A,C,and D for skeletal muscle regeneration[J].Proc Natl Acad Sci USA,2014,111(11):4109-4114.
[7]SENF S M,HOWARD T M,AHN B,et al.Loss of the inducible Hsp70 delays the inflammatory response to skeletal muscle injury and severely impairs muscle regeneration[J].PLoS One,2013,8(4):e62687.
[8]HORIE M,WARABI E,KOMINE S,et al.Cytoprotective role of Nrf2 in electrical pulse stimulated C2C12 myotube[J].PLoS One,2015,10(12):e0144835.
[9]LI C Q,KIM M Y,GODOY L C,et al.Nitric oxide activation of Keap1/Nrf2 signaling in human colon carcinoma cells[J].Proc Natl Acad Sci USA,2009,106(34):14547-14551.
[10]KEUM YS.Regulation of Nrf2-mediated phase II detoxification and anti-oxidant genes[J].Biomol Ther(Seoul),2012,20(2):144-151.
[11]SCHERZ-SHOUVAL R,ELAZAR Z.Regulation of autophagy by ROS:physiology and pathology[J].Trends Biochem Sci,2011,36(1):30-38.
[12]ADAMS D O, JOHNSON W J, MARINO P A.Mechanisms of target recognition and destruction in macrophage-mediated tumor cytotoxicity[J].Fed Proc,1982,41(6):2212-2221.
[13]MACKANESS G B.The monocyte in cellular immunity[J].Semin Hematol,1970,7(2):172-184.
[14]BRYAN H K, OLAYANJU A, GOLDRING C E,et al.The Nrf2 cell defence pathway:Keap1-dependent and-independent mechanisms of regulation[J].Biochem Pharmacol,2013,85(6):705-717.
[15]ZHAO M,GUO H,CHEN J,et al.5-aminolevulinic acid combined with sodium ferrous citrate ameliorates H2O2-induced cardiomyocyte hypertrophy via activation of the MAPK/Nrf2/HO-1 pathway[J].Am J Physiol Cell Physiol,2015,308(8):C665-C672.
[16]SAW C L, YANG A Y,HUANG M T,et al.Nrf2 null enhances UVB-induced skin inflammation and extracellular matrix damages[J].Cell Biosci,2014,4:39.
[17]SHELAR S B,NARASIMHAN M,SHANMUGAM G, et al.Disruption of nuclear factor (erythroid-derived-2)-like 2 antioxidant signaling: a mechanism for impaired activation of stem cells and delayed regeneration of skeletal muscle[J].FASEB J,2016,30(5):1865-1879.
