漳州紫泥围垦区海水中弧菌类群研究
2018-03-30陈明霞郑计瑞李和阳
陈明霞,郑计瑞,李和阳
(1.华侨大学化工学院,福建厦门 361021;2.国家海洋局第三海洋研究所,福建厦门 361005)
弧菌作为近海、河口环境中微生物区系的主要成员,广泛分布于自然水域及渔业生物中,是引发人类细菌性疾病的主要病原之一。人们通过饮用不洁水,食用未加工或未加工熟的带有致病弧菌的食物,特别是海产品而感染发病[1-4]。近年来,海水养殖业的快速发展,加快了海水生境的破坏,养殖环境不断恶化,使养殖动物病害不断发生。弧菌病(Vibriosis) 主要是由弧菌属(Vibrio)细菌引起的一类细菌性疾病,也是海水养殖动物主要的细菌病害之一。已知海水养殖动物弧菌病病原菌超过20种,危害到鱼类、贝类及甲壳类中各种养殖动物,不仅给养殖业造成巨大的经济损失[5],而且导致野生海水动物大量死亡,进而导致食用人员肠道疾病或食物中毒。弧菌病相关病原的研究已经成为养殖病害及养殖环境治理的主要研究领域之一。
福建省漳州龙海市东北部的紫泥镇,地处福建省第二大河九龙江出海口,属于咸淡水交汇处,水质较好,水产养殖发达。紫泥围垦区是其中重要的海水养殖区域,同样存在着养殖环境恶化及水产致病菌严重等问题。笔者采用传统的TCBS培养基分离筛选菌株及分子鉴定方法,对该养殖区域的弧菌类群进行分析,探讨该养殖区潜在的弧菌病病原菌种类及其可能的风险。
1 材料与方法
1.1样品采集海水样品采集点位于福建漳州龙海紫泥围垦区养殖区域的01站位(117.908 916°E,24.448 861°N),03站位(117.906 578°E,24.449 108°N)和06站位(117.907 878°E,24.446 680°N),样品采集时间为2011年2月。
1.2培养基2216E和TCBS培养基(Thiosulfate Citrate Bile Salts Sucrose)参考文献[6]中描述。
1.3弧菌的分离培养将01、03、06这3个站位的海水样品进行梯度稀释,得到100、10-1、10-2共3个样品梯度,每个梯度分别取200 μL于TCBS琼脂平板上,涂布均匀,于25 ℃培养箱培养;每个梯度做2个重复。随机挑取分离良好的48个菌落接种于2216E 琼脂平板上,尽可能保证挑取到所有的菌落类型。对所分离的菌株在2216E 平板上进行3次以上纯化,以保证得到纯培养物。
1.4弧菌的鉴定对所分离得到的TCBS菌株进行16S rRNA基因-RFLP酶切谱型分析,挑选各RFLP谱型代表菌,通过16S rRNA基因序列比对及系统发育分析进行菌种分子鉴定,16S rRNA 基因的PCR扩增及酶切分析方法参考文献[7-8]中描述。菌株16S rRNA基因序列由南京金斯特生物技术有限公司测定,所得序列校正后在EzBioCloud数据库比对分析并获取相近菌种的16S rRNA基因序列。利用DNAman(version 5.1,Lynnon BioSoft)软件进行序列同源性分析及构建16S rRNA基因系统进化树。
2 结果与分析
2.1弧菌16SrRNA基因-RFLP分析不同样品在TCBS培养基上生长的菌落皆属于典型的黄色或绿色,随机挑取48个菌落(尽可能包括所有不同菌落类型),纯化后,使用细菌通用引物27F和1492R对所分离的48个菌株进行16S rRNA基因-PCR扩增(图1),用AfaI和MspI限制性内切酶对48个菌株16S rRNA基因扩增片段进行双酶切并进行聚丙烯酰胺凝胶电泳分析(RFLP分析)。结果表明,48个菌株可分为6种不同的RFLP分子谱型(Ⅰ~Ⅵ),每种RFLP谱型挑出1个代表菌株进行16S rRNA基因的序列及系统发育学分析。
注:M.DL 2000;1~15.紫泥围垦区06站位菌株编号Note:M.DL2000;1~15.Strains numbers of station 06 of Zini marine aquaculture area图1 部分弧菌菌株16S rRNA基因PCR扩增结果Fig.1 16S rRNA gene PCR amplification results of some Vibrio strains
2.2弧菌16SrRNA基因序列及系统发育学分析对6个代表菌株进行16S rRNA基因的序列比对鉴定(表1)及系统发育分析(图2),6个菌株属于4种弧菌。Ⅰ型代表菌株JR-5和Ⅱ型代表菌株JR-12属于同一个物种(group 1),与V.crassostreaeLGP7T(大黄鱼弧菌)、V.celticusRd 8.15T(凯尔特人弧菌)、V.gigantisCAIM 25T(牡蛎弧菌)的16S rRNA基因序列相似度皆为100.00%,无法区分,但从系统发育树上明显可见菌株JR-5、JR-12与V.crassostreaeLGP7T距离更为接近,处在一个小分支上;Ⅲ型代表菌株JR-10和Ⅳ型代表菌株JR-19属于同一个物种(group 2),与V.atlanticusVb 11.11T(大西洋弧菌)、V.tasmaniensisLMG 21574T(塔斯马尼亚弧菌)皆有99%以上的同源性,但系统发育树分析显示菌株JR-10、JR-19与V.atlanticusVb 11.11T具有更近的亲缘关系;Ⅴ型代表菌株JR-15与V.splendidusATCC 33125T(灿烂弧菌)有99.85%的同源性,为group 3;VI型代表菌株JR-20与V.lentus4OM4T(缓慢弧菌) 有98.60%的同源性,为group 4。不同弧菌类群所占比例不同,group 2 占有58.3%,具有绝对的优势,其他3类比例相当:group 1和4各占14.6%、group 3占12.5%。
3 讨论
紫泥围垦区属于海水养殖区域,盐度相对较高,以TCBS培养基分离获取的菌株100%为弧菌,不包含有其他非弧菌TCBS类群,该结果与陈明霞等[6]、李和阳等[9]研究结果相符,TCBS培养类群中弧菌所占的比例与盐度息息相关。
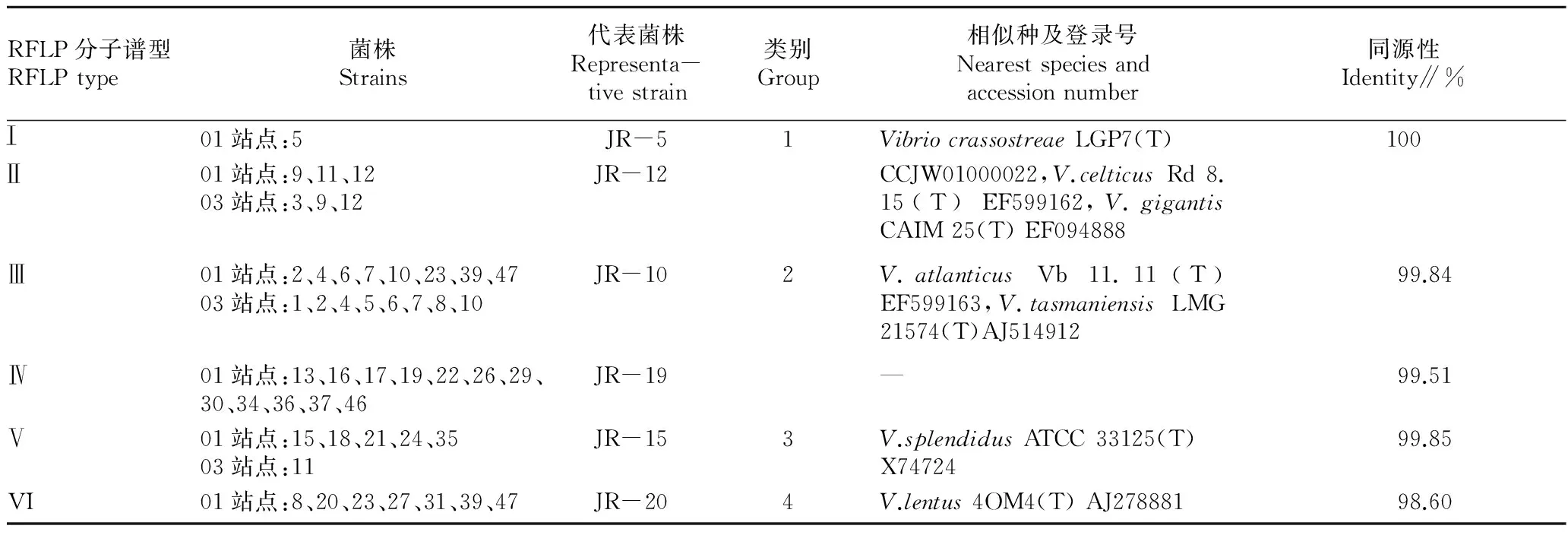
表1 不同RFLP谱型代表菌株16S rRNA基因序列系统关系分析结果
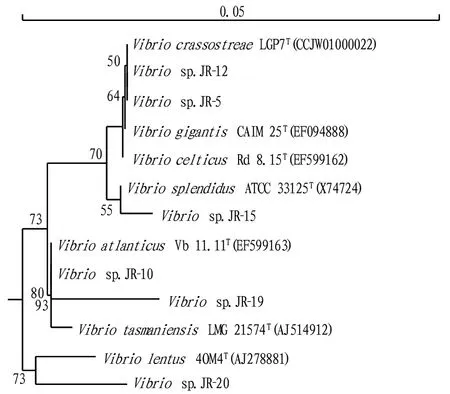
注:结点处数字表示Bootstrap 1 000 次重复检验的自举值(仅显示高于50%的数值;括号中为每个16S rRNA基因序列的登录号;比例尺代表每100 bp 5个碱基替换数Note:The bootstrap values above 50% from 1 000 replicates are shown.The accession number of each 16S rRNA gene sequence is given in parenthesis.The scale bar represents 5 substitutions per 100 bp图2 根据16S rRNA基因序列构建的紫泥围垦区海水弧菌代表菌株系统发育树Fig.2 Phylogenetic tree of representative Vibrio strains from Zini marine aquaculture area based on bacterial 16S rRNA gene
根据Drancourt 等[10-11]提出16S rRNA基因序列同源性鉴定规则及相关的系统进化树分析,紫泥围垦区主要的弧菌类群有4类,分别为group 1-V.crassostreae;group 2-V.atlanticus;group 3-V.splendidus和group 4-V.lentus。其中V.crassostreae和V.atlanticus至少含有2种类型的16S rRNA基因拷贝,因此具有2个的RFLP谱型。这4类弧菌都属于专性需盐细菌,是海水或咸水养殖水体的重要弧菌成员。
弧菌属包含100多个不同物种,分属于14个进化分支[12],紫泥围垦区的4种弧菌类群皆属于V.splendidus进化分支[13-15]。V.splendidus可引起鱼类、对虾和牡蛎的疾病[5];V.crassostreae于2004年分离自生病的长牡蛎(Crassostreagigas)血淋巴[13],是长牡蛎的条件致病菌[16];V.atlanticus最早分离自海湾扇贝(Ruditapesphilippinarum)[15],目前并无实例证明该菌属于致病菌[12],但其近似种V.tasmaniensis却被报道可以引起柳珊瑚疾病[17];V.lentus可引起野生章鱼(Octopusvulgaris)疾病[18],其对养殖生物同样具有严重威胁。
据调查,许多养殖户会自购现成的TCBS培养基平板进行弧菌的分离培养,并通过观察菌落的颜色和数量以判断可能潜在的副溶血弧菌(V.parahemolyticus)病害危机,这显然并不科学而且经常会背道而驰。该研究明确了特定时间段内紫泥围垦区弧菌的类群组成,即该区域的弧菌主要为V.splendidus相关种类,对于针对性地防控这些弧菌引起的养殖动物疾病具有一定的指导价值。
[1] FARMER J J,JANDA J,BIRKHEAD K.Vibrio[M]//MURRAY P,BARON E,JORGENSEN J,et al.Manual of clinical microbiology.8th ed.Washington,DC:ASM Press,2003:706-718.
[2] JOHNSON C N,BOWERS J C,GRIFFITT K J,et al.Ecology ofVibrioparahaemolyticusandVibriovulnificusin the coastal and estuarine waters of Louisiana,Maryland,Mississippi,and Washington (United States) [J].Appllied & environmental microbiology,2012,78(20):7249-7257.
[3] HLADY W G,KLONTZ K C.The epidemiology ofVibrioinfections in Florida,1981-1993 [J].Journal of infectious diseases,1996,173(5):1176-1183.
[4] 郑经川.弧菌性腹泻的若干问题[J].中国实用内科杂志,1995,14(3):133-135.
[5] 郑天伦,王国良,金珊.海水养殖动物弧菌病防治的研究进展[J].台湾海峡,2002,21(3):372-378.
[6] 陈明霞,李和阳,马云飞,等.九龙江口沉积物TCBS (Thiosulfate Citrate Bile Salts Sucrose)菌群的分布[J].微生物学报,2012,52(5):637-644.
[7] 陈明霞,李和阳,陈维维,等.68株北极产蛋白酶菌株的筛选、鉴定以及部分酶学性质[J].微生物学报,2013,53(7):702-709.
[8] DELONG E F.Archaea in coastal marine environments [J].Proceedings of the national academy of sciences of the United States of America,1992,89(12):5685-5689.
[9] 李和阳,陈明霞,郑天凌,等.深圳海域水体和九龙江口沉积物中TCBS菌群与弧菌相关性的研究[J].台湾海峡,2011,30(3):394-399.
[10] DRANCOURT M,BOLLET C,CARLIOZ A,et al.16S ribosomal DNA sequence analysis of a large collection of environmental and clinical unidentifiable bacterial isolates[J].Journal of clinical microbiology,2000,38(10):3623-3630.
[11] DRANCOURT M,BERGER P,RAOULT D.Systematic 16S rRNA gene sequencing of atypical clinical isolates identified 27 new bacterial species associated with humans[J].Journal of clinical microbiology,2004,42(5):2197-2202.
[12] ROMALDE J L,DIÉGUEZ A L,LASA A,et al.NewVibriospecies associated to molluscan microbiota:A review[J].Frontiers in microbiology,2013,4(1):413.
[13] FAURY N,SAULNIER D,THOMPSON F L,et al.Vibriocrassostreaesp.nov.,isolated from the haemolymph of oysters (Crassostreagigas)[J].International journal of systematic & evolutionary microbiology,2004,54(6):2137-2140.
[14] LE ROUX F,GAY M,LAMBERT C,et al.Phylogenetic study and identification ofVibriosplendidus-related strains based ongyrBgene sequences[J].Diseases of aquatic organisms,2004,58(2/3):143-150.
[15] DIÉGUEZ A L,BEAZ-HIDALGO R,CLEENWERCK I,et al.Vibrioatlanticussp.nov.andVibrioartabrorumsp.nov.isolated from the clamsRuditapesphilippinarumandRuditapesdecussatus[J].International journal of systematic & evolutionary microbiology,2011,61(10):2406-2411.
[16] BRUTO M,JAMES A,PETTON B,et al.Vibriocrassostreae,a benign oyster colonizer turned into a pathogen after plasmid acquisition[J].The ISME Journal,2017,11(4):1043-1052.
[17] VATTAKAVEN T,BOND P,BRADLEY G,et al.Differential effects of temperature and starvation on induction of the viable-but-nonculturable state in the coral pathogensVibrioshiloiandVibriotasmaniensis[J].Applied & environmental microbiology,2006,72(10):6508-6513.
[18] FARTO R,ARMADA S P,MONTES M,et al.Vibriolentusassociated with diseased wild octopus (Octopusvulgaris)[J].Journal of invertebrate pathology,2003,83(2):149-156.
