乳腺癌不同方案新辅助化疗后对粒细胞减少的影响及处理*
2018-03-29罗恩茜
罗恩茜,倪 青
(1.贵州医科大学第二临床医学院乳腺外科,贵阳 550001;2.贵州省人民医院乳腺外科,贵阳 550001)
新辅助化疗(neoadjuvant chemotherapy,NCT)即术前化疗,能缩小肿瘤直径,降低临床分期,变不可手术为可手术切除,同时提高保乳率,RASTOGI等[1]提出,在NCT中获得病理完全缓解(pathologic complete remission,PCR)的患者可获得更好的无病生存期和总生存期。如今,蒽环联合紫杉醇的化疗方案已成为乳腺癌新辅助化疗的常用方案,但化疗药物会引起许多不良反应,粒细胞减少则是化疗后最严重的不良反应之一[2]。3~4度粒细胞减少症常与年龄、生活质量、化疗药物有关[3]。研究显示,在乳腺癌化疗患者中发生3~4度粒细胞减少的情况占11%[4];而表柔比星+环磷酰胺(EC方案)化疗后粒细胞减少性发热(febrile neutropenia,FN)的发生率为25.2%,半数以上FN发生在化疗第1周期[5]。目前多项研究已证明预防性应用重组人粒细胞集落刺激因子(recombinant human granulocyte colony-stimulating factor,rhG-CSF)可有效降低白细胞(WBC)和中性粒细胞(ANC)减少的发生,减轻骨髓抑制的程度及持续时间[6-8]。但不同化疗方案的粒细胞减少情况及对比分析少有报道。故本研究回顾性分析2013-2015年贵州省人民医院接受EC、吡柔比星+多西他赛(THP+T方案)不同化疗方案进行新辅助的乳腺癌患者粒细胞减少发生的情况,并分析不同人群、不同治疗方式对粒细胞减少的影响及对策,现将结果报道如下。
1 资料与方法
1.1一般资料 选取贵州省人民医院乳腺外科2013年1月至2015年12月收治的共186例乳腺癌患者病例,患者均为女性且为单侧乳腺癌,患者年龄26~75岁,中位年龄47岁,为初诊患者,民族为汉族或苗族,化疗前经空心针穿刺活检明确为浸润性导管癌,完成4周期EC或THP+T方案新辅助化疗备手术,全身检查排除远处转移并除外化疗禁忌。
1.2方法
1.2.1分组 选取符合条件的使用EC或THP+T化疗方案的患者分为2组,EC组90例,THP+T组96例,每组根据患者是否预防性使用rhG-CSF进一步分成对照组和预防组两个亚组,经统计学分析,THP+T及EC组组间患者年龄、肿瘤大小、淋巴结状态、雌激素受体、人表皮生长因子、民族、BMI差异均无统计学意义(P>0.05),具有可比性。见表1。
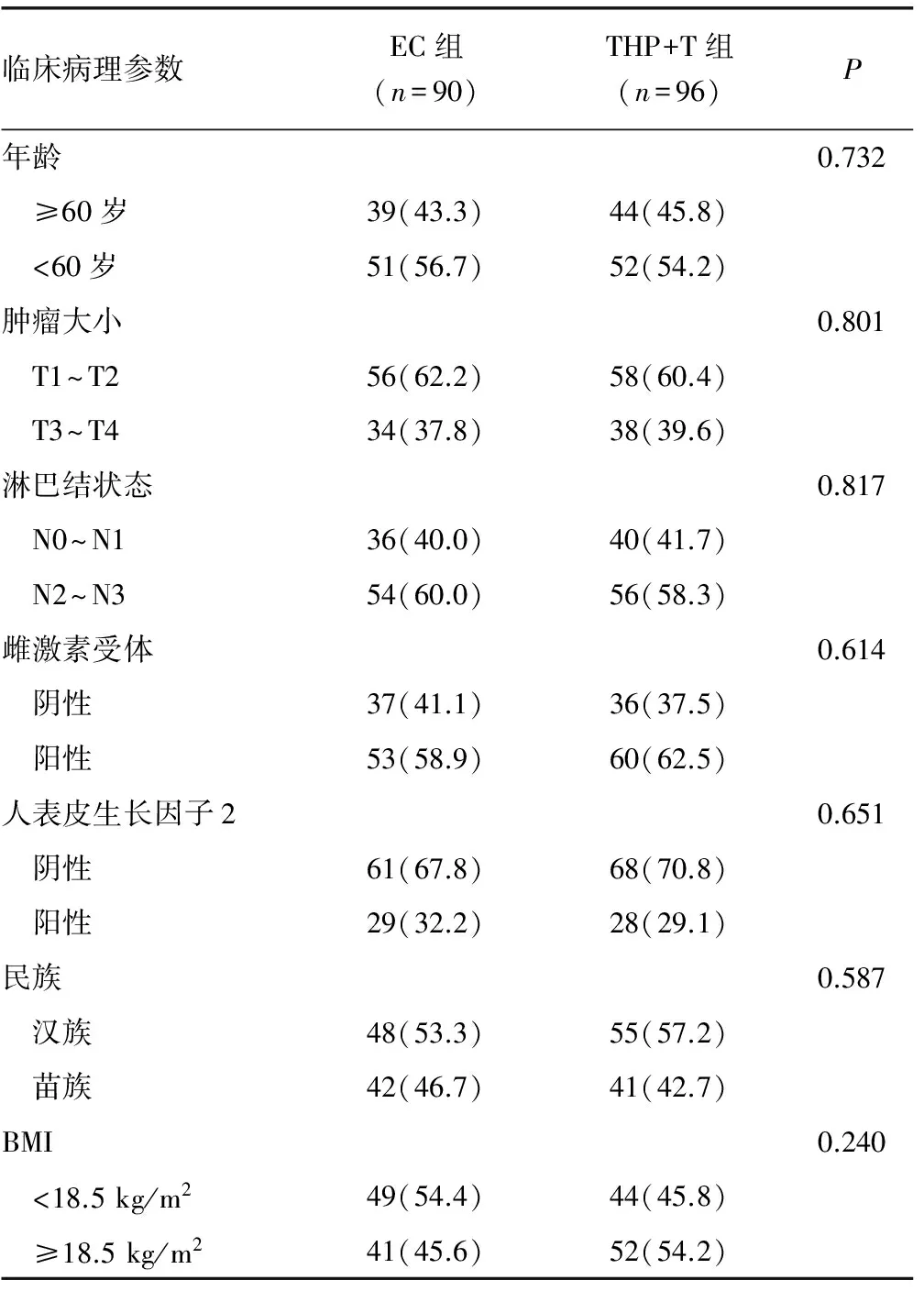
表1 EC组及THP+T组的基本临床资料[n(%)]
1.2.2化疗方法 EC组:表柔比星90 mg/m2,静脉滴注,环磷酰胺600 mg/m2,静脉滴注,21 d为1周期。THP+T组:第1天,吡柔比星50 mg/m2,静脉滴注;第3天,多西他赛75 mg m2,静脉滴注,21 d为1周期,预防组在第1个周期使用化疗药后48 h内给予rhG-CSF 5μg·kg-1·d-1皮下注射1次,连续注射3 d,对照组在48 h内未给予rhG-CSF。表柔比星为海正辉瑞制药有限公司产品,规格为每支10 mg;吡柔比星为深圳万乐药业有限公司产品,规格为每支10 mg;环磷酰胺为江苏盛迪有限公司产品,规格为每瓶0.1 g;多西他赛为江苏恒瑞医药股份有限公司产品,规格为每支0.5 mL。
1.2.3观察指标 分别统计患者化疗前及第1周期化疗初次给药后第6天的WBC和中性粒细胞绝对值,初次给药后第6天的WBC和中性粒细胞绝对值的数目作为本研究讨论用。参照WHO标准:3度粒细胞减少为1.0×109/L≤WBC<2.0×109/L,或0.5×109/L≤ANC<1×109/L;4度粒细胞减少为WBC<1.0×109/L,或ANC<0.5×109/L[9];粒细胞减少性发热(febrile neutropenia,FN)的定义:排除其他因素所致单次腋温大于或等于38.0℃或大于或等于37.7℃持续超过1 h[10]。
1.3统计学处理 统计学分析应用 SPSS 21.0统计软件。计数资料以频数或百分率表示,比较采用χ2检验,以P<0.05为差异具有统计学意义。
2 结 果
2.1两组方案发生3~4度粒细胞减少及FN的情况 按是否预防性使用rhG-CSF,对各组发生3~4度粒细胞减少的情况进行统计,EC组中,3~4度粒细胞减少的发生率为对照组13.3%(6/45),预防组4.4%(2/45),差异无统计学意义(P=0.128)。THP+T组中,3~4度粒细胞减少的发生率为对照组72.9%(35/48),预防组41.7%(20/48),差异有统计学意义(P=0.003)。见表2。在EC方案化疗组中,FN的发生率为对照组4.4%(2/45),预防组2.2%(1/45),差异无统计学意义(P=0.557)。在THP+T组中,FN的发生率为对照组25%(12/48),预防组8.3%(4/48),差异有统计学意义(P=0.028)。见表3。

表2 各化疗组粒细胞减少情况[n(%)]
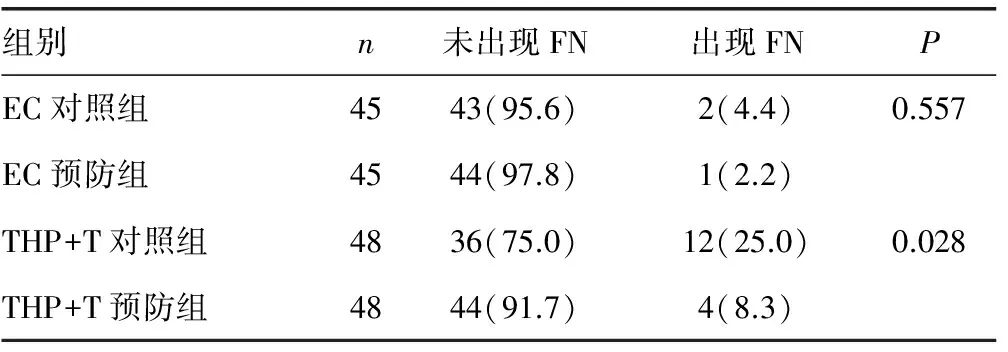
表3 各化疗组FN的发生情况[n(%)]
2.2THP+T组乳腺癌患者的临床资料 将THP+T方案组单独分析,THP+T组中,<60岁者44例(45.8%),≥60岁者52例(54.2%);肿瘤大小T1~T2期者58例(60.4%),T3~T4期者38例(39.6%);淋巴结状态N0~N1者40例(41.7%);N2~N3者56(58.3%);孕激素受体阴性68例(70.8%),阳性28例(29.1%);雌激素受体阴性36例(37.5%),阳性60例(62.5%);汉族55例(57.2%),苗族41例(42.7%);BMI<18.5 kg/m2者44例(45.8%),≥18.5 kg/m2者52例(54.2%)。
2.3THP+T组3~4度粒细胞减少情况 汉族患者55例,THP+T对照组、预防组发生3~4度粒细胞减少总数分别为18例、4例;苗族患者41例,其对照组、预防组发生3~4度粒细胞减少总数分别为17例、16例,汉族及苗族组3~4度粒细胞减少情况差异具有统计学意义(P=0.022)。而其他临床或病理特征与3~4度粒细胞减少差异均无统计学意义。见表4。

表4 THP+T组3~4度粒细胞减少情况(n)
3 讨 论
乳腺癌是我国常见的恶性肿瘤和主要的肿瘤死亡原因,并呈明显上升趋势[11]。而新辅助化疗是目前乳腺癌的主要治疗手段,化疗药物都是细胞毒性药物,不但对肿瘤细胞有杀灭作用,对新陈代谢活跃的组织细胞如骨髓干细胞、胃肠黏膜上皮细胞等亦有着很强的抑制作用,所以其常见的不良反应有骨髓抑制、消化道反应、肝肾损害、脱发等。骨髓抑制是化疗后发生率最高的剂量限制性不良反应,而骨髓是粒细胞的生发中心,故在化疗期间容易出现严重的粒细胞减少甚至FN,这将严重制约化疗的进行和化疗剂量强度,延误后续化疗周期[12]。rhG-CSF能选择性作用于粒系造血祖细胞诱导其向中性粒细胞分化。大量临床试验证实,在非霍奇金淋巴瘤、乳腺癌等恶性肿瘤中,预防性应用rhG-CSF对WBC和ANC减少的发生有较好的防治作用,并可减轻粒细胞减少的程度及持续时间,减轻化疗后WBC的下降程度,降低FN发生率,避免发生化疗延迟[13]。
蒽环类化疗药物为一种细胞周期非特异性药物,能嵌入细胞DNA碱基而干扰细胞的复制和转录过程,对各个增殖周期及G0期的癌细胞均有杀伤作用[14]。本研究中预防性使用rhG-CSF在EC方案中差异无统计学意义(P>0.05),其原因可能是因为蒽环类药物对细胞的杀伤力与药物剂量的相关曲线呈指数性。随着药物剂量的增加,骨髓抑制的程度也随之增加,但在使用药物规定剂量化疗的情况下,粒细胞减少的发生在可控范围内,基本不影响化疗方案的实施。因此EC方案不必预防性使用rhG-CSF,若化疗结束后患者出现了粒细胞减少的情况,再予使用rhG-CSF。这样可以避免患者未出现粒细胞减少的情况下多次皮下注射,避免患者出现全身骨骼、肌肉疼痛、疲乏等不良事件;同时节约医疗费用,在临床上真正做到精准处理化疗不良反应、合理用药。
本研究中在THP+T方案预防性使用rhG-CSF,THP+T预防组3~4度粒细胞减少者明显少于对照组,差异有统计学意义(P<0.05)。多西紫杉醇属于细胞周期特异性药物,通过干扰细胞有丝分裂和微管网络而起抗肿瘤作用[15],能将细胞阻断于M期,对增殖细胞的作用大于非增殖细胞。当和细胞周期非特异性的蒽环类药物联合使用时,对骨髓抑制有叠加作用[16]。有相关研究显示,THP+T方案在无预防性使用rhG-CSF的情况下,FN的发生率为10%~20%[17];这与本研究中预防使用rhG-CSF显著降低THP+T化疗方案化疗后WBC、ANC减少(P=0.003),降低FN发生率(P=0.028)的结论一致,提示THP+T方案需要预防性使用rhG-CSF。
为了进一步研究THP+T方案中与骨髓抑制发生可能相关的因素,把THP+T组中对年龄、民族、肿瘤T分期、雌激素受体、孕激素受体与3~4度粒细胞减少发生例数比较分析,结果发现民族与粒细胞减少差异具有统计学意义(P<0.05),而其他临床病理特征差异圴无统计学意义(P>0.05)。这可能是由于在贵州地区的苗族乳腺癌患者多为农民,生活在偏远的农村,地质高寒,体格瘦弱,BMI普遍偏低,导致统计结果中苗族乳腺癌患者对rhG-CSF反应较差。这除了与居住环境、生活习惯、BMI偏低等有一定关系之外,在基因层面,可能与X线修复交叉互补基因1(XRCC1)可能也有一定的关系。有学者发现XRCC1基因可能是少数民族的乳腺癌易感基因,在维吾尔族和汉族乳腺癌中表达水平具有种族差异性[18]。XRCC1基因通过调节乳腺癌细胞损伤修复能力而影响乳腺癌对化疗药物的敏感性,因而XRCC1高表达的人群对化疗药物更敏感,更易出现粒细胞减少。那么XRCC1基因在本地区苗族和汉族乳腺癌中的表达是否也具有差异性?本课题组目前已在贵州省人民医院乳腺外科开展研究,以期有新的发现。THP+T组中苗族乳腺癌患者预防性使用rhG-CSF后粒细胞减少百分数改善并不显著,提示苗族乳腺癌患者使用rhG-CSF预防性升白效果远没有汉族好,由此可以提示对于汉族乳腺癌患者,在实施THP+T方案新辅助化疗时,提倡预防性使用rhG-CSF,能使患者获得更多益处,不必被动地等待粒细胞减少后再去治疗;而对于苗族乳腺癌患者,在实施THP+T方案新辅助化疗时,可能需要联合其他治疗手段来预防新辅助化疗后粒细胞减少的情况。目前关于苗族乳腺癌患者新辅助化疗后发生粒细胞减少风险的研究还不够充分,亟待建立一套准确便捷的预测模型,希望通过对这些因素的掌控,能为更多偏远地区苗族的乳腺癌患者进一步减轻THP+T方案化疗带来的不良反应,顺利地完成化疗,避免化疗的延迟。
在乳腺癌EC、THP+T方案新辅助化疗中,EC方案新辅助化疗后3~4度粒细胞减少较少发生,不必预防性使用rhG-CSF;THP+T方案新辅助化疗后易发生3~4度粒细胞减少,应该预防性地使用rhG-CSF。rhG-CSF升高WBC的效果与民族有一定的关系,汉族患者使用效果明显好于苗族患者。
[1]RASTOGI P,ANDERSON S J,BEAR H D,et al.Preoperative chemotherapy: updates of national surgical adjuvant breast and bowel project protocols B-18 and B-27[J].J Clin Oncol,2008,26(5): 778-785.
[2]MELIEF C J,FINN O J.Cancer immunology[J].Curr Opin Immunol,2011,23(2): 234-236.
[3]CHAN A,LEE C P,CHIANG J,et al.Breakthrough febrile neutropenia and associated complications among elderly cancer patients receiving myelosuppressive chemotherapy for solid tumors and lymphomas[J].Support Care Cancer,2013,21(8): 2137-2143.
[4]JOLIS L,CARABANTES F,PERNAS S,et al.Incidence of chemotherapy-induced neutropenia and current practice of prophylaxis with granulocyte colony-stimulating factors in cancer patients in Spain: a prospective,observational study[J].Eur J Cancer Care (Engl),2013,22(4): 513-521.
[5]KIM C G,SOHN J,CHON H,et al.Incidence of febrile neutropenia in korean female breast cancer patients receiving preoperative or postoperative doxorubicin/cyclophosphamide followed by docetaxel chemotherapy[J].J Breast Cancer,2016,19 (1): 76-82.
[6]李娇,张晟,张瑾.重组人粒细胞集落刺激因子预防乳腺癌化疗后骨髓抑制的疗效分析[J].中国癌症杂志,2014,24(12):925-930.
[7]徐清亮,赵春武,房黎亚.rhG-CSF预防性治疗乳腺癌化疗骨髓抑制的效果[J].中国实用医刊,2015,42(24):105-106.
[8]孔谦.重组人粒细胞集落刺激因子对乳腺癌化疗后骨髓抑制的疗效分析[J].中外医疗,2017, 36(1):17-19.
[9]尤海生,陈思颖,胡萨萨,等.乳腺癌患者化疗引起Ⅲ度或Ⅳ度粒细胞减少风险因素及治疗费用研究[J].中国医院药学杂志,2016,36(11):926-929.
[10]中华医学会血液学分会.中国医师协会血液科医师分会.中国中性粒细胞缺乏伴发热患者抗菌药物临床应用指南(2016 年版)[J].中华血液学杂志,2016,37(5):353-358.
[11]陈万青,郑荣寿.中国女性乳腺癌发病死亡和生存现状[J].中国肿瘤临床,2015,42(13):668-674.
[12]OZER H,ARMITAGE J O,BENNETT C L,et al.2000 update of recommendations for the use of hematopoietic colony-stimulating factors:evidence-based,clinical practice guidelines[J].J Clin Oncol,2000,18(20): 3558-3585.
[13]KUDERER N M,DALE D C,CRAWFORD J,et al.Impact of primary prophylaxis with granulocyte colony-stimulating factor on febrile neutropenia and mortality in adult cancer patients receiving chemotherapy:a systematic review[J].J Clin Oncol,2007,25(21): 3158-3167.
[14]BERETTA G L,FRANCO Z.Molecular mechanisms of anthracy-cline activity[J].Top Curr Chem,2008,283(1): 1-19.
[15]SINGH S,DASH A K.Paclitaxel in cancer treatment: perspectives and prospects of its delivery challenges[J].Crit Rev Ther Drug Carrier Syst,2009,26(4): 333-372.
[16]凌霄,王冰,骆小敏.紫杉醇注射液化疗的不良反应分析[J].中国医药指南,2012,10(5):190-191.
[17]AAPRO M S,BOHLIUS J,CAMERON D A,et al.2010 update of EORTC guidelines for the use of granulocyte-colony stimulating factor to reduce the incidence of chemotherapy-induced febrile neutropenia in adult patients with lymphoproliferative disorders and solid tumours[J].Eur J Cancer,2011,47(1): 8-32.
[18]傅亚婷,成芳.XRCC1基因在维吾尔族、汉族乳腺癌组织中的表达及差异[J].武汉大学学报(医学版),2012,33(6):829-832.
