基于Illumina Miseq平台分析胆囊结石及黏膜微生物群落的多样性*
2018-03-29黄洁,张捷
黄 洁,张 捷
(昆明医科大学第二附属医院肝胆胰外科三病区,昆明 650101)
本研究利用“下一代”测序技术(NGS),首次针对不同胆囊结石类型患者的胆囊黏膜和微生物群落的16S rDNA进行Illumina Miseq检测和分析,进一步探讨胆囊结石发病机制,现报道如下。
1 资料与方法
1.1一般资料 选取2014年1-12月在本院肝胆胰外科三病区行胆囊切除术的60例胆囊结石患者为病例组,分胆固醇、胆色素和混合性结石组3组,每组各20例。选取肝右前叶血管瘤切除胆囊的11例患者为对照组。术后胆汁培养和厌氧菌培养阳性的病例不纳入本次研究,所有样本均经病理证实。所有患者均知情同意,本研究通过医院伦理委员会批准。
1.2方法
1.2.1采集 完成胆囊切除术,切开并取出结石,对结石表面附着物用生理盐水冲洗。用无菌组织剪剪取胆囊黏膜1块,大小约2.0 cm×2.0 cm。无菌螺口离心管收集样本,完成后立即放置于-80 ℃液氮瓶中储存。
1.2.2DNA提取 从-80 ℃的冰箱中取出样本并解冻,用无菌刀片将结石均分成4份。收集每份的核心部分,烘干至37 ℃后粉碎,取180~220 mg提取细菌DNA,余下的样本用于胆固醇含量测定;称取患者及对照者的黏膜各180~200 mg;分别放置于2 mL离心管(含200 μL 0.1 mm氧化锆/硅珠),加入2 mL 缓冲液ATL(由QIAamp®DNA Stool Mini Kit提供的细胞裂解液),均质化后,首先20 ℃下物理破碎2 min,6 000 r/min离心1 min,95 ℃裂解5 min。DNA提取的试剂使用OMEGA E.Z.N.A.土壤DNA提取试剂盒进行微生物DNA的提取。
1.2.3PCR扩增 使用带有样本特异标签序列(barcode)的PCR引物对(341F/805R),对每个样本进行16S rRNA基因V3~V4可变区进行扩增。341F引物:CCT ACA CGA CGC TCT TCC GAT CTN(barcode)CCT ACG GGN GGC WGC AG;805R引物:GAC TGG AGT TCC TTG GCA CCC GAG AAT TCC AGA CTA CHV GGG TAT CTA ATC C。其中barcode为各样本的条形码,用于后续Raw Data的分配。
1.2.4文库构建及Miseq测序 使用Illumina自带的Miseq Control Software (MCS)软件进行监控和原始数据的校检。主要包含以下5个步骤:制作样本数据表,解冻试剂盒,加载DNA文库到试剂盒,上样,设置程序参数并按照MCS的提示进行操作和监控。
1.2.5细菌分类单元(Operational Taxonomic Units,OTU)的鉴定 采用QIIME1.9.1软件进行分类单元的鉴定和生物多样性的评估分析。

2 结 果
2.1研究样本基本情况 3组胆囊结石患者性别、年龄比较,差异无统计学意义(P>0.05),胆固醇含量比较,差异有统计学意义(P<0.05)。见表1。

表1 不同类型胆囊结石患者基本条件的比较
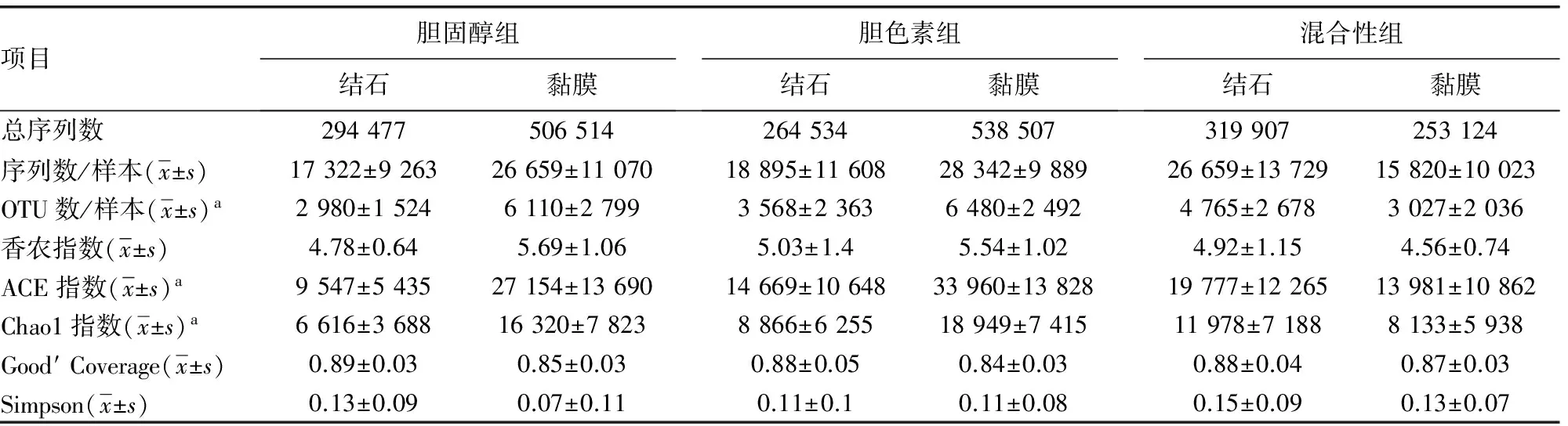
表2 样本的测序情况汇总表
a:P<0.05
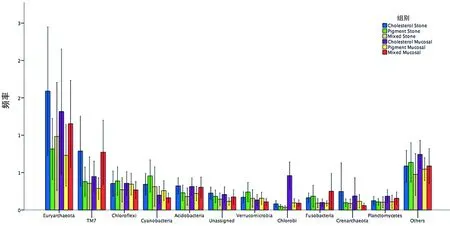
图1 不同类型的胆结石、不同部位的属的分布(显示前11个属和其他)
2.2胆囊结石和黏膜样本的DNA提取结果 对照组中未检测出细菌微生物群落DNA。病例组结石样本中有6例未提取出微生物群落DNA,1例黏膜样本未提取出微生物群落DNA,总微生物群落DNA提取率为94.2%。
2.3Miseq测序数据结果 各组样本的测序情况,3组OTU数/样本、ACE指数、Chao1指数比较,差异有统计学意义(P<0.05),见表2。丰度最高的为变形细菌门(Proteobacteria),其余丰度最多的3个门分别为厚壁菌门(Firmicutes),拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria)。占比超过1%的其他稀有细菌门类群中,同一类型的结石患者的结石和黏膜成比较为一致,而不同类型的组成差异较大,见图1、2。
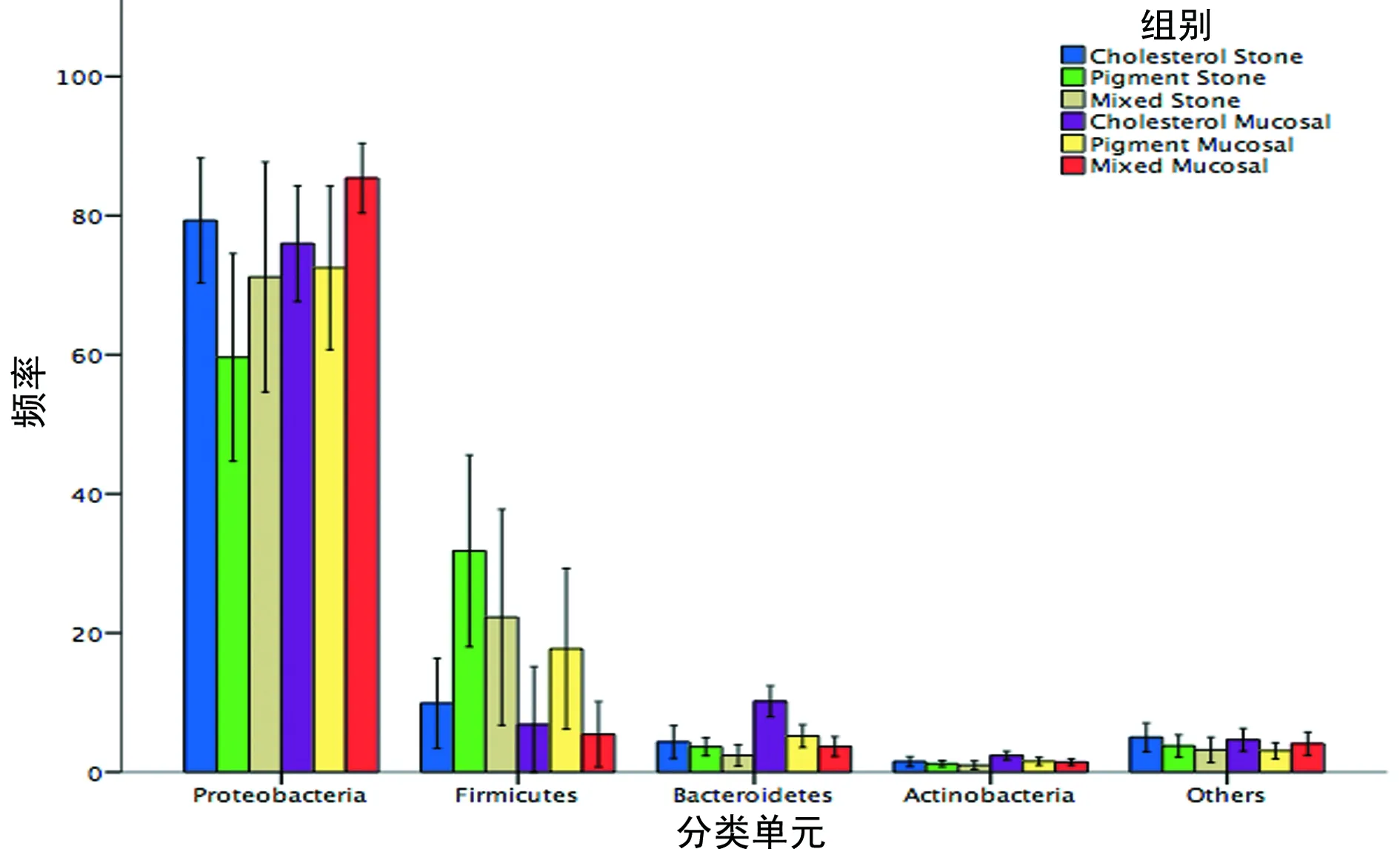
图2 不同类型的结石黏膜优势菌门的分布
所有的样本进行热图分析,可看出样本主要分两类,结石和黏膜样本分别聚集在不同支,且在不同细菌类群上有明显差异分布。细菌分布较集中的是胆固醇结石,在大多数差异大的类群有较高的分布,而胆色素结石的细菌主要集中在Pseudomonas、stutzeri和Enterococcus类群,见图3。
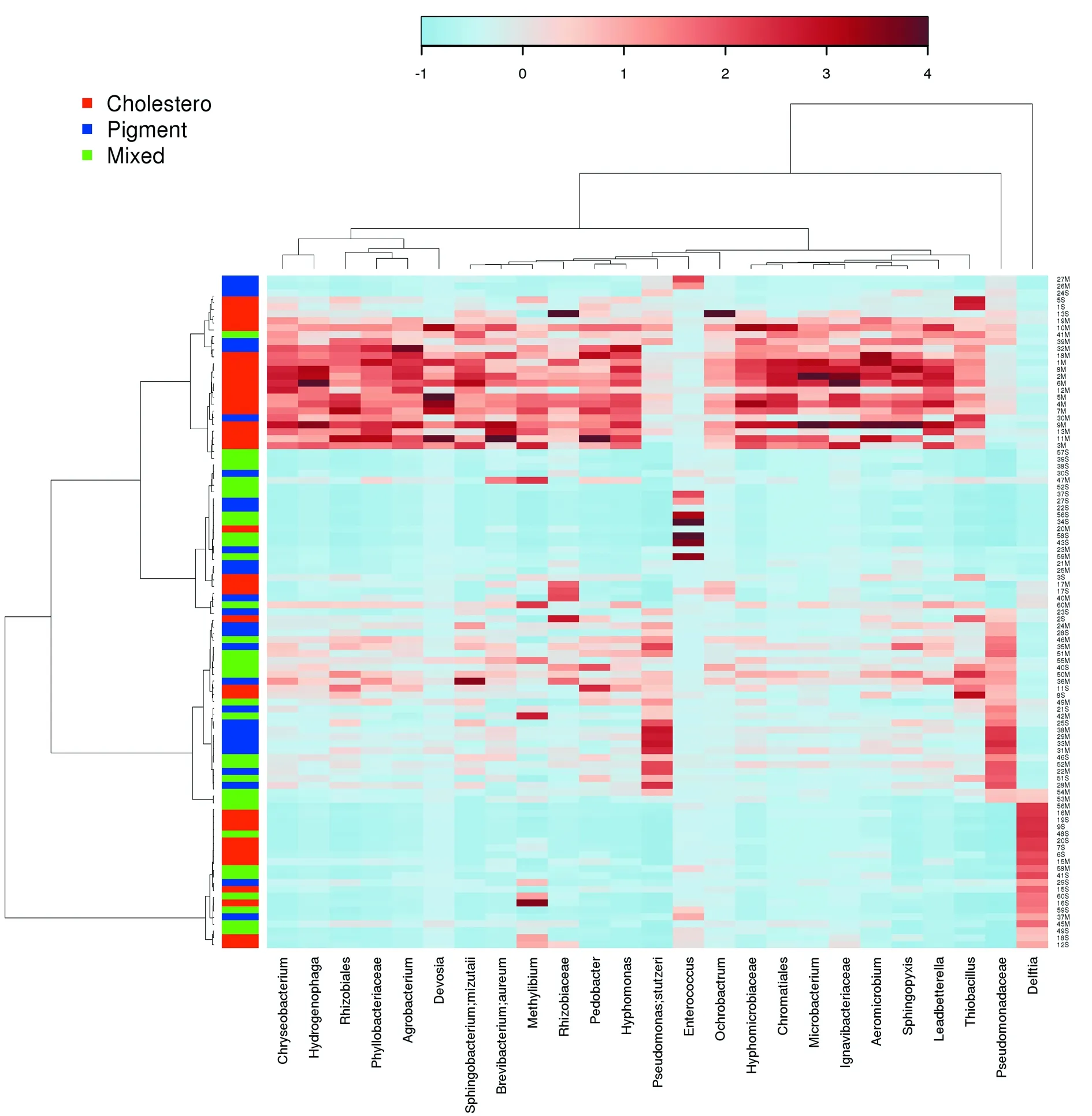
图3 全部OTU水平进行热图分析
3 讨 论
本研究通过Illumina Miseq测序对胆囊内微生物群落样本进行分析,发现香农指数、Chaol指数和ACE指数在不同类型结石组间,差异有统计学意义(P<0.05),且同一类型结石组黏膜和微生物群落ACE指数和Chao1指数差异也有统计学意义(P<0.05)。同一组内结石和黏膜样本,微生物群落菌群多样性都有明显的个体差异。总体规律为,在胆固醇结石和胆色素结石组胆囊黏膜样本的生物多样性指数显著高于其对应的结石样本,而混合性结石组则相反。
同一类型患者的结石和黏膜胆囊微生物群落多样性构成比较相似,而不同类型患者的结石和黏膜胆囊微生物群落多样性构成比差异较大。在微生物门、纲、目这些较高分类水平上结石和黏膜微生物群落多样性分布并不是很高,而在属种水平则表现出了丰富的多样性。笔者发现,由于稀有菌群比例较大,导致即使在胆固醇含量高于90%的胆固醇结石和黏膜中,胆囊微生物群落也显示多样性分布,且有极为复杂的群落分布。根据Illumina Miseq测序分析,由于个体变异性的存在可能导致胆囊微环境中的微生物群落有着极大的分散性和差异性。但由于样本量较小,还需大样本量去证实。而目前惟一能够肯定的是由于胆囊对胆汁的浓缩功能,胆汁中含有一些物质,如胆汁酸盐、胆固醇和微量元素,可作为电子受体或营养物质支持细菌生长代谢,并使结石细菌群落表现出多样性[2-10]。
本研究尚有许多不足之处:(1)未将与胆囊微生物群落密切相关的肠道微生物群落纳入研究,进行关联分析。(2)未探讨胆囊结石形成过程中胆囊微生物群落的动态变化过程。(3)未涉及胆囊微生物群落与宿主的相互关系。
低浓度的微生物群落通过局部免疫机制对胆囊黏膜微环境产生影响,可进一步研究结石形成及发生、发展过程中胆囊微生物群落的生态作用。
[1]PORTINCASA P,DI CIAULA A,WANG H H,et al.Medicinal treatments of cholesterol gallstones:old,current and new perspectives[J].Curr Med Chem,2009,16(12):1531-1542.
[2]TOLLER I M,NEELSEN K J,STEGER M,et al.Carcinogenic bacterial pathogen Helicobacter pylori triggers DNA double-strand breaks and a DNA damage response in its host cells[J].Proc Natl Acad Sci U S A,2011,108(36):14944-14949.
[3]SALAMA N R,HARTUNG M L,MUELLER A.Life in the human stomach:persistence strategies of the bacterial pathogen Helicobacter pylori[J].Nat Rev Microbiol,2013,11(6):385-399.
[4]WU T,ZHANG Z G,LIU B,et al.Gut microbiota dysbiosis and bacterial community assembly associated with cholesterol gallstones in large-scale study[J].BMC Genomics,2013,14(1):669.
[5]杨斌,张捷,刘斌,等.高通量测序分析胆囊结石患者基因表达谱差异[J].中华肝胆外科杂志,2014,20(9):683-685.
[6]徐鹏,甘明宇,高谦.二代测序技术在结核分枝杆菌研究中的应用进展[J].微生物与感染,2015, 10(1):54-60.
[7]黄飞燕,李莉,周燕,等.基于 denovo 测序分析 Bt 菌株 S3299-1 基因组特征[J].基因组学与应用生物学,2015,6(2):28-29.
[8]陈重,李多云,程航,等.一株肠致病性大肠杆菌的全基因组序列分析[J].中国热带医学,2015,15(5);525-528.
[9]黄继续,黄浩南.胆道感染患者196例胆道细菌培养及耐药分析[J/CD].中华普通外科学文献(电子版).2014,6(12):14.
[10]黄洁,丁绍晖,孙敏,等.胆囊结石患者结石成分及微生物群落结构的多样性[J].世界华人消化杂志,2014,1(7):418-422.
