粉防己碱对先天性膈疝大鼠模型胎仔肺Rho/Rho激酶表达的影响和意义*
2018-03-29党红星陈应富
周 昉,党红星,陈应富,白 科,方 芳,许 峰
(重庆医科大学附属儿童医院重症医学科/儿童发育疾病研究教育部重点实验室/儿童发育重大疾病国家国际科技合作基地/儿科学重庆市重点实验室 400014)
先天性膈疝(congenital diaphragmatic hernia,CDH)发病率为1/2 000~1/3 000,病死率为20%~60%[1]。其死亡的主要原因是肺发育不良(pulmonary hypoplasia,PH)和持续性肺动脉高压(persistent pulmonary hypertension,PPH)[2]。目前对这些主要致死病因的处理仍是临床治疗CDH的瓶颈。探索致畸因素及诱发机制,寻找积极有效的方法产前改善肺发育不良和肺动脉高压将是CDH基础与临床研究的重点及防治的重要突破口之一。既往研究表明,Rho/Rho激酶信号传导通路主要参与了肺动脉高压的发病和肺纤维化形成,而粉防己碱(tetrandrine,TET)也具有肺保护作用。本研究拟测定除草醚诱导的CDH大鼠模型肺组织中Rho蛋白A和Rho激酶ROCK1的水平及产前给予TET干预后的变化,探讨TET肺保护作用的可能机制。
1 材料与方法
1.1材料
1.1.1动物模型建立和实验动物分组 SD大鼠由陆军军医大学大坪医院实验动物中心提供,雌雄鼠按2∶1分笼定时配种,以配种12 h后见到雌鼠阴道孕栓为孕0.5 d。孕9.5 d将受孕成功的15只孕鼠随机分为3组:对照组、膈疝组和TET组,每组5只。采用除草醚灌胃法[3](除草醚购自浙江化工二厂,每只125 mg +2 mL橄榄油灌胃)建立膈疝组与TET组CDH模型,对照组予每只2 mL橄榄油灌胃。孕16.5 d,TET组给予TET灌胃(TET购自上海克拉玛尔试剂公司,批号ZY160301,30 mg·kg-1·d-1,每日1次,3 d),对照组和膈疝组给予2 mL/kg孕鼠体质量生理盐水灌胃。本研究符合重庆医科大学实验动物伦理学标准。
1.1.2胎肺标本收集 妊娠21.5 d,所有孕鼠在戊巴比妥钠(0.04 g/kg)腹腔注射麻醉下剖宫产,取出胎鼠称质量后断头处死。再经胸骨正中切口剖胸,完整取出左右两侧肺组织分别称质量,计算胎鼠肺质量/体质量比(Lw/Bw),在放大镜下观察膈疝形成情况。
1.2方法
1.2.1胎肺组织形态学检查和免疫组化染色 每组随机取出22份胎肺标本(每份含双侧肺组织)常规固定、石蜡包埋,切片(同一张切片要包括每份标本的左右肺组织)后行苏木素-伊红(HE)染色。使用Image Pro Plus5.0图像分析软件对光镜下图像计算反映肺泡与肺泡腔面积的百分比,即肺泡面积比(PAA%)作为肺发育的形态学指标;同时测定肺小动脉管壁厚度占血管外径百分比(WT%)、中膜厚度百分比(MT%)及管腔面积与血管总面积比值(LA%)作为胎鼠肺血管形态学指标,并进行统计学分析。免疫组化染色采用SP法,以磷酸盐缓冲液(PBS)代替一抗作为空白对照,抗体采用anti-RhoA兔抗鼠多克隆抗体及ROCK1兔抗鼠单克隆抗体(均购自英国Abcam公司)。细胞质或细胞膜出现棕黄色染色为阳性,观察RhoA、ROCK1在各组胎鼠肺组织中的表达情况。用Nikon图像采集仪在400倍视野下计算阳性染色颗粒积分光密度(IOD)值,IOD值与目的抗体表达强弱呈正相关。
1.2.2Western blot法检测胎肺组织RhoA蛋白及Rho激酶表达情况 实验3组分别取10份肺组织标本提取蛋白质,Bradford法定量,电泳、转膜、封闭加入抗体RhoA或ROCK1一抗(均购自英国Abcam公司)、孵育后加二抗、DAB显色。将目的条带蛋白表达量转换为内参照β-actin校正的灰度值进行定量分析。

2 结 果
2.1胎鼠膈疝形成情况 对照组获得胎仔49只,无膈疝形成;膈疝组获胎仔55只,形成膈疝36只,致畸率65.45%;TET组获胎仔51只,形成膈疝32只,致畸率62.75%;除草醚总致畸率为64.15%;膈疝组和TET组的致畸率差异无统计学意义(P>0.05)。膈疝形成大多位于左侧(共56只,占膈疝总数的83.82%),疝内容物主要为胃、小肠,其次为肝脏,左侧膈疝中巨大膈疝共21只,占左侧膈疝37.5%;右侧膈疝胎仔共11只,均无巨大膈疝形成;双侧膈疝1只。
2.2胎肺形态学观察及肺发育的形态学指标检测结果 HE染色观察,对照组肺组织发育良好,肺泡结构明显,腺泡大,肺泡间质薄而均匀,呼吸性支气管末端呈囊泡状,肺小动脉血管壁薄腔大,内皮细胞分布均匀,中膜无增厚;膈疝组胎肺发育差,肺泡少且小,间质厚,肺泡、肺泡管及肺泡囊呈假腺体样改变,有明显肺发育不良表现,肺小动脉血管肌层肥厚,管壁明显厚且管腔窄;TET组肺发育接近对照组,好于膈疝组,光镜下示肺泡变大,肺泡间质变薄,肺小动脉管壁变薄,管腔狭窄程度较膈疝组减轻(图1)。实验各组肺发育的形态学指标Lw/Bw、PAA%、肺小动脉WT%、MT%和LA%计算结果表明,膈疝胎鼠存在肺发育不良和肺血管重构,TET能有效地改善肺组织发育,与膈疝组相比差异有统计学意义(P<0.05),见表1。
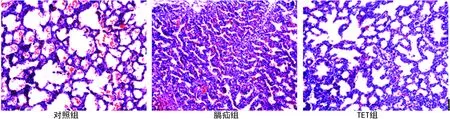
图1 各组胎肺HE染色(×200)
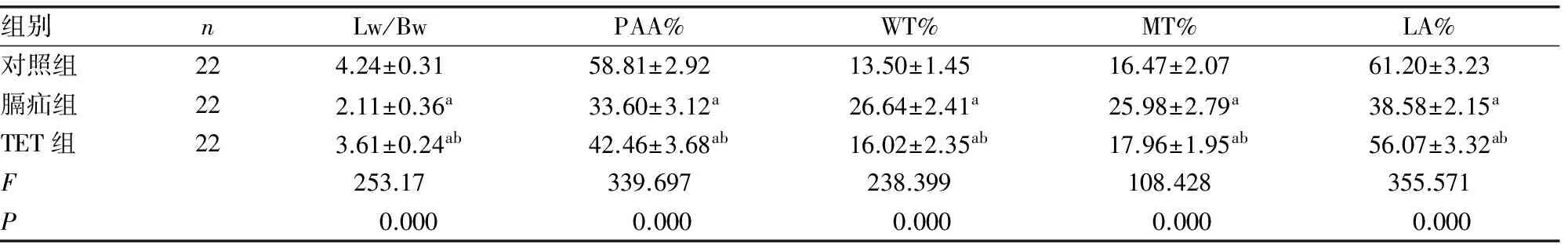
组别nLw/BwPAA%WT%MT%LA%对照组224.24±0.3158.81±2.9213.50±1.4516.47±2.0761.20±3.23膈疝组222.11±0.36a33.60±3.12a26.64±2.41a25.98±2.79a38.58±2.15aTET组223.61±0.24ab42.46±3.68ab16.02±2.35ab17.96±1.95ab56.07±3.32abF253.17339.697238.399108.428355.571P0.0000.0000.0000.0000.000
a:P<0.05,与对照组相比;b:P<0.05,与膈疝组相比
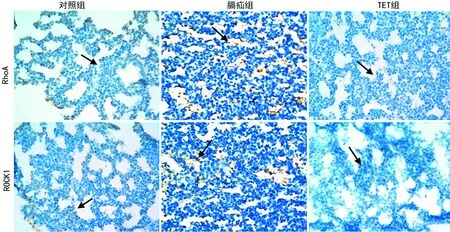
图2 各组胎肺RhoA及ROCK1表达情况(免疫组化×400)
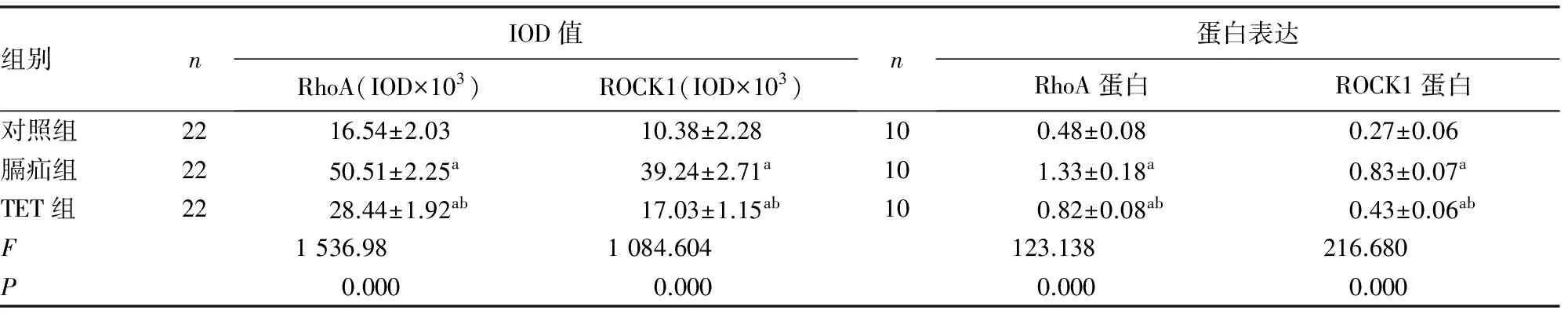
组别nIOD值RhoA(IOD×103)ROCK1(IOD×103)n蛋白表达RhoA蛋白ROCK1蛋白对照组2216.54±2.0310.38±2.28100.48±0.080.27±0.06膈疝组2250.51±2.25a39.24±2.71a101.33±0.18a0.83±0.07aTET组2228.44±1.92ab17.03±1.15ab100.82±0.08ab0.43±0.06abF1536.981084.604123.138216.680P0.0000.0000.0000.000
a:P<0.05,与对照组相比;b:P<0.05,与膈疝组相比
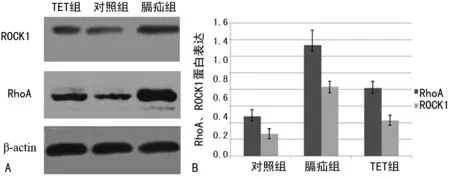
A:Western blot;B:RhoA、ROCK1蛋白表达情况
图3 Western blot检测RhoA、ROCK1蛋白水平的表达
2.3胎肺组织免疫组化检测结果 膈疝组中,胎肺支气管上皮细胞、肺血管内皮细胞及肺间质内见大量棕黄色颗粒,RhoA及ROCK1的表达明显强于对照组;TET组RhoA、ROCK1的表达较膈疝组降低,阳性范围面积缩小,接近于对照组(图2)。实验各组RhoA和ROCK1表达情况由低到高依次是对照组、TET组、膈疝组(P=0.000),3组间两两比较差异均有统计学意义(P=0.000),见表2。
2.4胎肺组织RhoA及Rho激酶ROCK1蛋白表达情况 膈疝组胎肺组织RhoA、ROCK1蛋白表达量较对照组显著增加(P=0.000),与膈疝组相比,TET组RhoA、ROCK1蛋白表达量明显降低(P=0.000),见表2、图3。
3 讨 论
自1990年KLUTH等[4]报道以来,用除草醚灌胃诱导怀孕大鼠产生膈疝胎鼠已经成为一种相对成熟的经典的CDH建模方法,广泛用于国内外关于膈疝的研究。本研究成功复制CDH模型,致畸率64.15%。CDH患儿的根本死亡原因是肺发育不良和持续性肺动脉高压,这些病理过程在患儿出生前即已完成。本研究中,膈疝组光镜下可观察到,与正常胎肺相比,膈疝组胎肺相对质量轻,胎肺肺泡小而少,间质增厚,呼吸性支气管末端囊泡状结构少见;肺小动脉管壁明显增厚,管腔狭窄,这些形态学改变支持膈疝胎鼠存在肺发育不良和肺血管重构。目前治疗膈疝的方法多样,但无论是产前使用糖皮质激素、胎儿外科还是产后手术、使用肺表面活性物质、降肺动脉高压等治疗手段均不能实现病因治疗,也不能改善存活率。
Rho/Rho激酶信号传导通路的关键信号分子包括Rho蛋白、Rho激酶和肌球蛋白磷酸酶,Rho蛋白属于Ras蛋白超家族,RhoA是最常见的Rho蛋白异构体之一。Rho激酶属于丝氨酸/苏氨酸蛋白激酶家族成员,是RhoA的下游靶效应分子。近年来,Rho/Rho激酶信号传导通路被证实在肺动脉高压发病机制中发挥重要作用,该信号通路的选择性抑制剂能够显著抑制肺动脉高压动物肺血管收缩和肺血管重建的进展[5]。TAKAYASU等[6]对除草醚诱导的CDH模型研究发现CDH胎仔肺血管中RhoA表达增高且具有促进血管平滑肌细胞增殖作用,认为RhoA介导的血管收缩参与了CDH中PH的发病机制。本实验发现,与对照组相比,膈疝组RhoA及Rho激酶ROCK1在肺泡上皮细胞和肺间质内呈阳性表达,在肺小动脉平滑肌细胞也能见到明显的棕黄色颗粒;同时Western blot检测结果也发现,RhoA及ROCK1蛋白表达在膈疝组明显升高。已有研究发现,肺动脉平滑肌细胞(pulmonary arterial smooth muscle cells,PASMCs)内肌球蛋白轻链(myosin light chain,MLC)磷酸化是肺动脉高压的分子基础,PASMCs的收缩取决于细胞质内MLC磷酸化程度,而MLC磷酸化受肌球蛋白轻链激酶(myosin light chainkin-ase,MLCK)和肌球蛋白磷酸酶(myosin phosphatase,MP)之间动态平衡的调节,这一过程受到Rho/Rho激酶信号通路的活化调控,促进PASMCs钙调敏感性收缩及细胞增殖、迁移,使血管中膜明显增厚,非肌性小动脉肌化,管腔狭窄,从而在肺血管重构中发挥重要作用[7-8]。另还有研究发现,成肌纤维细胞增殖和细胞外基质沉积作用有赖于RhoA信号转导,Rho激酶特异性抑制剂可抑制肺纤维化的发生,对肺有保护作用[9]。结合前述免疫组化及Western blot的研究结果,联系本实验光镜下膈疝组与对照组相比胎仔肺发育及肺血管形态学的指标变化,提示在除草醚诱导的膈疝中存在Rho/Rho激酶信号通路的作用。据此推测该信号通路在除草醚诱导膈疝模型胎仔肺血管重构过程中起重要作用,并能影响膈疝胎鼠的肺发育,它可能通过直接影响平滑肌细胞收缩、调节细胞功能参与肺动脉高压和肺发育不良的形成。
本研究也对除草醚诱导的膈疝孕鼠产前给予TET灌胃干预。TET是一种双苄基异喹啉类生物碱,为传统中药粉防己的主要成分[10];作为一种新型的钙通道阻滞剂,TET具有调节血管舒缩、抗纤维化、抗氧自由基、抗炎等生物学效应,其药理作用广泛[11-12]。有动物实验发现,TET可显著降低慢性低氧性肺动脉高压大鼠平均肺动脉压和肺血管阻力,并能抑制肺组织和肺动脉壁胶原水平的增加[12-13]。细胞水平的研究发现,TET具有抑制体外培养的PASMCs增殖的作用,这种作用可能有助于抑制伴有肺血管重构的肺动脉高压[12]。产前干预研究还发现TET可改善CDH胎鼠肺组织发育[3]。如前所述,Rho/Rho激酶信号通路有参与肺动脉高压发病机制及参与肺纤维化的作用,而作为钙通道阻滞剂的TET恰好具有调节血管舒缩、抗纤维化的作用,且已被应用于矽肺、高血压、肺动脉高压、肿瘤放疗增敏等的临床治疗[11-12]。本实验检测了TET产前干预的CDH胎鼠肺组织RhoA及ROCK1表达情况,与膈疝组相比,RhoA及Rho激酶ROCK1的表达水平均有明显下降,提示TET的干预抑制了RhoA及Rho激酶的作用。同时在光镜下观察TET干预的CDH胎鼠肺组织,与膈疝组相比,胎鼠肺Lw/Bw、PAA%等肺发育指标及WT%、MT%和LA%等肺血管重构指标明显更优,差异有统计学意义(P<0.05),提示与膈疝组相比,TET组改善了CDH胎鼠肺发育不良;同时,改善了肺小动脉管壁变厚管腔变窄的情况,表明TET在促进CDH胎鼠肺发育,改善肺血管重构方面有效。由此推测TET可通过调节Rho/Rho激酶信号通路对胎肺发挥保护作用。
[1]BROWNLEE E M,HOWATSON A G,DAVIS C F.The hidden mortality of congenital diaphragmatic hernia:a 20-year review[J].J Pediatr Surg,2009,44(2):317-320.
[2]KEIJZER R,PURI P.Congenital diaphragmatic hernia[J].Semin Pediatr Surg,2010,19(3):180-185.
[3]LIN H,WANG Y,XIONG Z,et al.Effect of antenatal tetrandrine administration on endothelin-1 and epidermal growth factor levels in the lungs of rats with experimental diaphragmatic hernia[J].J Pediatr Surg,2007,42(10):1644-1651.
[4]KLUTH D,KANGAH R,REICH P,et al.Nitrofen-induced diaphragmatic hernias in rats:an animal model[J].J Pediatr Surg,1990,25(8):850-854.
[5]BADEJO A M,DHALIWAL J S,CASEY D B,et al.Analysis of pulmonary vasodilator responses to the Rho-kinase inhibitor fasudil in the anesthetized rat[J].Am J Physiol Lung Cell Mol Physiol,2008,295(5):L828-836.
[6]TAKAYASU H,MASUMOTO K,HAGIWARA K,et al.Increased pulmonary RhoA expression in the nitrofen-induced congenital diaphragmatic hernia rat model[J].J Pediatr Surg,2015,50(9):1467-1471.
[7]SOMLYO A P,SOMLYO A V.Ca2+sensitivity of smooth muscle and nonmuscle myosin Ⅱ:modulated by G proteins,kinases,and myosin phosphatase[J].Physiol Rev,2003,83(4):1325-1358.
[8]FUKUMOTO Y,TAWARA S,SHIMOKAWA H.Recent progress in the treatment of pulmonary arterial hypertension:expectation for rho-kinase inhibitors[J].Tohoku J Exp Med,2007,211(4):309-320.
[9]WATTS KL,COTTRELL E,HOBAN P R,et al.RhoA signaling modulates cyclin D1 expression in human lung fibroblasts;implications for idiopathic pulmonary fibrosis[J].Respir Res,2006,7(1):88(1-14).
[10]SUN Y F,WINK M.Tetrandrine and fangchinoline bisbenzylisoquinoline alkaloids from Stephania tetrandra can reverse multidrug resistance by inhibiting P-glycoprotein activity in multidrug resistant human cancer cells[J].Phytomedicine,2014,21(8/9):1110-1119.
[11]王永刚,刘文英,林涵,等.汉防己甲素对先天性膈疝大鼠模型胎仔肺内表皮生长因子及其受体的影响和意义[J].中国修复重建外科杂志,2006,20(11):1109-1113.
[12]蔡晓辉,王帅,陈保安.汉防己甲素药理作用的研究进展(英文)[J].中国天然药物,2011,9(6):473-480.
[13]RAO M R.Effects of tetrandrine on cardiac and vascular remodeling[J].Acta Pharmacol Sin,2002,23(12):1075-1085.
