载VEGF荧光PLGA亚微米缓释微球的制备及体外控释特性*
2018-03-29封建立颜加强刘元丰孙道冬
周 山,封建立,高 瑾,颜加强,舒 勇,刘元丰,孙道冬
(中国人民解放军第三二四医院肾病泌尿科,重庆 400000)
血管内皮生长因子(vascular endothelial growth factor,VEGF)是一种在体内诱导血管生成的细胞因子,当其在组织局部应用,能够增加缺血部位的微血管生成,因此在缺血性疾病(如冠状动脉缺血)、组织工程支架等中有广泛应用[1]。但VEGF半衰期短,体内降解速度快,使其临床应用受到限制[2]。目前广泛采用的解决方案是使用载药缓释微球,使VEGF在组织局部以恒定的释药速率释放,保证组织修复过程中始终保持一定的VEGF水平,从而促进新生微血管的形成。制备的载药微球尺寸由数十纳米至数百微米不等,其中0.5~1.0 μm称为亚微米微球,0.5 μm以下称为纳米微球。体积越小,在脱细胞真皮基质(acelluar dermal martrix,ADM)中缓释时药物分布更均匀,但同等材料下缓释时间会缩短,并且制备难度更大[3]。目前国内少有亚微米聚乳酸羟基乙酸共聚物(PLGA)微球的制备与性质研究,本文提供一种PLGA载药亚微球制作方法,并在其中负载荧光物质,实现微球追踪并研究其体外特性。
1 材料与方法
1.1材料 PLGA(丙交酯∶乙交酯=50∶50;分子量40.6×103,Evonik,德国),异硫氰酸荧光素4(LWABX021-139911,宝曼生物,中国),重组人 VEGF 165蛋白(600310,Abbiotec,美国),VEGF-ELISA试剂盒(ab100663,Abcam,英国),二氯甲烷(Adamas-01226780,Adamas,中国),聚乙烯醇(PVA,0520224325,MP,美国),T25均质器(IKA-Laboratechnik,德国),LS13 320激光粒度分析仪(Beckman Coulter,美国),真空冷冻干燥仪(LDGZJ28,北京松源华兴,中国),扫描电子显微镜(HT7700,日立,日本),激光共聚焦显微镜(LSM510,Carl Zeiss,德国)。
1.2方法
1.2.1PLGA荧光载VEGF微球制备 采用复乳溶剂蒸发法(W/O/W)制备PLGA亚微米微球[4]。0.4 g PLGA溶于10 mL二氯甲烷作为油相(O),0.2 mg VEGF加2 μg绿色荧光素溶于2 mL去离子水中作为内水相(W1),外水相(W2)为50 mL的PVA(8%,w/v)。将W1 倒入O中,在15 000 r/min速率下均质5 min后形成W1/O,迅速倒入W2中形成复乳(W1/O/W2),磁力搅拌器固化6 h(400 r/min)。固化后使用去离子水清洗数次,冻干,获得微球。
1.2.2微球粒径测量及形貌观察 取少量制备好的PLGA微球悬浮于水中,振荡使其均匀分散,加入激光粒度分析仪样品池中,进行测量。Span值表示粒径分布,Span值越大表明颗粒尺寸越不均一。取适量冷冻干燥的 PLGA 微球溶于适量水中,吸取少量悬液滴于锡箔纸,晾干,表面喷金处理,扫描电子显微镜观察其形貌[5]。将PLGA微球悬浮于水中,在倒置相差荧光显微镜下观察PLGA微球尺寸,以及荧光强度,并在不同时间观察微球降解情况。
1.2.3包埋率及装载率测量 称取VEGF缓释微球冻干粉2 mg溶解在200 μL二甲基亚砜(DMSO)中,萃取VEGF,VEGF的水平通过定量ELISA试剂盒测定。依据试剂盒说明书操作。VEGF装载率和包埋率由以下公式计算[6]:VEGF装载率(%)=(微球的VEGF质量/微球质量)×100%;VEGF包埋率(%)=(测量VEGF装载率/理论蛋白装载率)×100%。
1.2.4体外VEGF释放研究 精确称取微球2 mg装于EP管,以磷酸盐缓冲液(PBS,100 μL)作为释放介质,加入0.1% BSA作为稳定剂,0.8%(w/v)甘露醇作为湿润剂,37 ℃恒温振荡,分别在1 h、6 h、1 d、2 d、4 d、7 d、14 d、21 d、28 d、35 d收集上清液。上清液中的VEGF水平通过VEGF-ELISA试剂盒测定。计算出累计释放量,绘制载VEGF-PLGA微球累计释放曲线。
1.3统计学处理 应用 SPSS13.0软件行统计学分析,使用Excel制作图表。
2 结 果
2.1载VEGF荧光PLGA亚微米微球粒径与形貌观察 在扫描电镜下,制备的微球呈圆球形,表面光滑,尺寸大小不一,但粒径分布范围较窄(图1)。激光共聚焦显微镜可见微球荧光分布均匀,微球在水中分散度好,无粘连(图2、3)。微球粒径分布见图4,微球粒径为0.72 μm,Span值为1.127,表明制备的微球粒径较为均匀。

图1 微球扫描电镜成像
2.2包埋率及装载率 将2 mg载药微球完全溶解,萃取出全部VEGF并测量,由包入微球的VEGF总量与总VEGF量百分比计算出包封率为51.42%,由包入微球内的VEGF量与微球质量百分比计算出载药率为3.91%。
2.3微球降解观察 2周之后,部分微球表面开始出现膨胀、侵蚀、变形,微球之间出现粘连,另有少量微球崩解,另一部分微球形状继续保持原状(图5)。激光共聚焦显微镜下微球聚集严重,部分微球膨胀、崩解后导致荧光面积变大(图6)。

图2 微球激光共聚焦显微镜扫描(白光)

图3 微球激光共聚焦显微镜扫描(绿色荧光)

图4 VEGF微球粒径分布图
2.4微球体外VEGF释放研究 将PLGA微球置于释放介质中,规定时间取出上清液,通过ELISA法测定VEGF水平,绘制出累积释放曲线(图7)。可看出PLGA微球在24 h内没有出现突释效应,在24 h之后VEGF释放量缓慢地增加,1周之后释放速度加快,到21 d进入平台期,到35 d累计释放量接近80%。

图5 两周后微球崩解扫描电镜影像
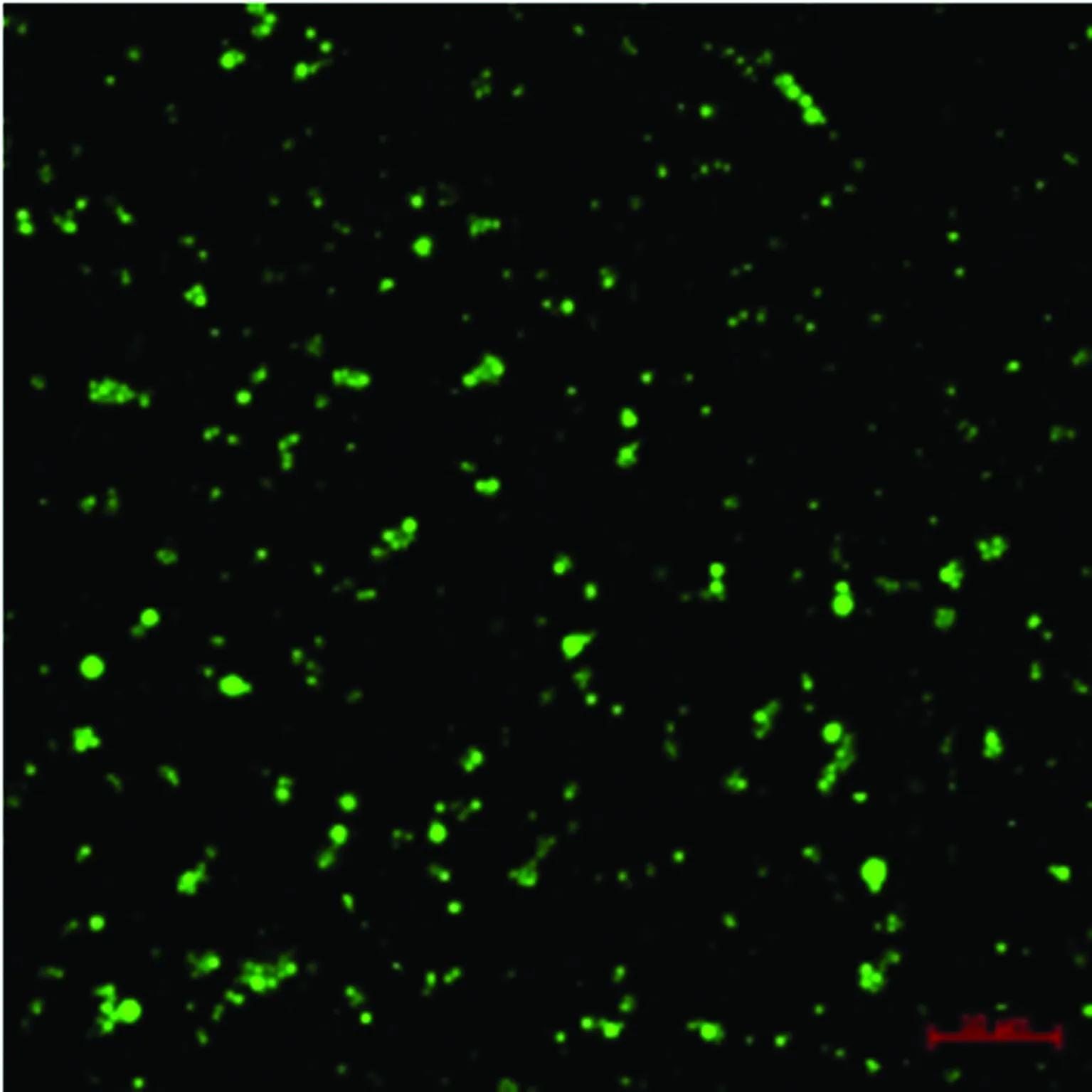
图6 两周后微球崩解激光共聚焦影像

图7 微球体外累计释放曲线
3 讨 论
本研究所使用的细胞因子VEGF在生理条件下半衰期短,在体内降解速度过快,需要对VEGF进行缓释处理,使其在局部缓慢匀速释放,以达到临床应用的需要[7]。本研究所采用的微球材料为PLGA。PLGA是缓释微球材料,其降解速率适中,性质稳定,具有良好的生物相容性与可降解性,无毒性、无致敏性、无致热性、无致畸致癌作用、无细胞毒性,被广泛应用[8]。
本研究成功制备的亚微米微球粒径约为0.72 μm,观察其药物缓释时间长(30 d左右),短期时间内未出现药物突释现象。根据文献报道,PLGA制备的微球体积不一,可制备成纳米微球或微米微球,直径由数百纳米至数百微米不等,包裹药物或细胞因子后可使其延长释放达到1~3个月。其中0.5~1.0 μm称为亚微米微球,0.5 μm以下称为纳米微球。体积越小,在缓释时药物分布更均匀,但同等材料下缓释时间会缩短,并且制备难度更大[9]。
复乳溶剂蒸发法是目前制备PLGA微球的常用方法,它不需要相分离剂,操作简单,工艺相对成熟[10]。W/O/W 型复乳可以有效阻碍水溶性药物进入连续相,能够提高药物的包封率。因此,本实验采用 W/O/W 法制备载 VEGF的荧光PLGA 微球。在实验中,多种条件可以影响最终制成的微球粒径,如PLGA浓度、PVA浓度、均质化搅拌速度等。其中提高PLGA 浓度,可以使内水相黏度变大,提高微球载药量与包封率,增大微球的粒径。而当PVA 浓度增加,微球粒径缩小。搅拌速率同样影响较大,速度过低,剪切力小,使成球性差,速度过高会破坏乳液的稳定性,VEGF流失量大[11]。本研究通过参考文献[4,12]以及调整上述试剂浓度[PLGA 40 mg/mL、PVA(8%,W/V),搅拌速度15 000 r/min],最终制成粒径为0.72 μm左右的亚微球。
本研究VEGF释放结果表明,微球没有出现突释效应,并且随着时间VEGF逐渐释放,实现了缓释作用。一般情况下,载药微球的释放呈现三相释放模式,即扩散,持续释放以及平台期。Ⅰ相是指黏附于微球表面的细胞因子迅速释放;Ⅱ相是指随着微球的降解,细胞因子逐渐释放;Ⅲ相是指当大部分微球出现崩解,细胞因子释放基本完毕,速度趋于平稳。
因此,本研究制备的PLGA载VEGF亚微米微球,实现了所期望的微球粒径,有较好的包埋率与装载率,并在其中加入了绿色荧光,实现了微球可视,具有较好的研究与应用前景。
[2]刘云龙,李奇,林荔军,等.BMP-2及VEGF双基因骨髓干细胞复合磷酸钙支架生物相容性的体外实验研究[J].重庆医学,2013,42(18):2060-2063.
[3]黄建文.生长因子在泌尿系统组织工程中的可控释放策略研究进展[J].组织工程与重建外科,2013,9(3):173-176.
[4]SALVADOR A,IGARTUA M,HERNNDEZ R M,et al.Combination of immune stimulating adjuvants with poly(lactide-co-glycolide)microspheres enhances the immune response of vaccines[J].Vaccine,2012,30(3):589.
[5]LAMPRECHT A,SCHFER UF,LEHR C.Characterization of microcapsules by confocal laser scanning microscopy:structure,capsule wall composition and encapsulation rate[J].Eur J Pharm Biopharm,2000,49(1):1-9.
[6]黄建文.生长因子在泌尿系统组织工程中的可控释放策略研究进展[J].组织工程与重建外科,2013,9(3):173-176.
[7]KANG B S,CHOI J S,LEE S E,et al.Enhancing the in vitro anticancer activity of albendazole incorporated into chitosan-coated PLGA nanoparticles[J].Carbohydr Polym,2017,159:39-47.
[8]赵锋,高永良.聚乳酸微球生物降解机制和生物相容性研究进展[J].中国新药杂志,2002,11(1):67-71.
[9]ACHARYA G,SHIN C S,VEDANTHAM K,et al.A study of drug release from homogeneous PLGA microstructures[J].J Control Release,2010,146(2):201-206.
[10]KINGTW,PATRICKCWJR.Developmentandinvitrocharacterizationofvascularendothelialgrowth
factor(VEGF)-loaded poly(DL-lactic-co-glycolic acid)/poly(ethylene glycol)microspheres using a solid encapsulation/single emulsion/solvent extraction technique[J].J Biomed Mater Res,2000,51(3):383-390.
[11]DANHIER F,ANSORENA E,SILVA J M,et al.PLGA-based nanoparticles:an overview of biomedical applications[J].J Control Release,2012,161(2):505-522.
[12]SALVADOR A,SANDGREN K J,LIANG F,et al.Design and evaluation of surface and adjuvant modified PLGA microspheres for uptake by dendritic cells to improve vaccine responses[J].Int J Pharm,2015,496(2):371-381.
