划时代的冷冻电镜技术
2018-03-28李忠东
李忠东

2017年10月4日, 2017年度诺贝尔化学奖授予了英国分子生物学家及生物物理学家理查德·亨德森、美国哥伦比亚大学德裔生物物理学家约阿基姆·弗兰克以及瑞士洛桑大学生物物理学家雅克·迪波什。获奖理由是“开发出冷冻电子显微镜技术(也称为低温电子显微镜技术)用于确定溶液中的生物分子的高分辨率结构”,简化了生物细胞的成像过程,提高了成像质量。

成绩斐然 实至名归

亨德森 选择高分辨率观察生物大分子
现年72岁的理查德·亨德森出生于苏格兰,现为剑桥大学医学研究理事会MRC分子生物学实验室主任,发起了一场高分辨率观察生物大分子的革命。1975年,电子显微镜诞生40年之际,因亨德森在细菌视紫红质上的尝试,证明了电子显微镜在生物领域的适用性。他将未脱离细胞膜的细菌视紫红质直接放置在电子显微镜下进行观察,借助表面覆盖的葡萄糖防止真空干涸,并采用强度更低的电子束流,观察到细菌视紫红质在细胞膜上规整排列且朝向一致。
之后,亨德森和同事获得了细菌视紫红质较为粗糙的三维立体结构图像,这也是历史上第一张膜蛋白领域的三维结构图像。1990年,亨德森又成功地使用电子显微镜显示蛋白质的三维图像,达到原子级分辨率。这一突破性成果证明了用电子显微镜进行生物分子成像的潜力。

弗兰克 冷冻电镜单颗粒分析的鼻祖
现年77岁的德裔生物物理学家约阿基姆·弗兰克,最大的贡献是让冷冻电镜技术变得具有普遍应用价值。弗兰克在1981年完成了一种算法,利用计算机识别图像把相同蛋白质的不同影子收集起来,并且将轮廓相似的图像进行分类对比,通过分析不同的重复模式将图片拟合成更加清晰的2D图像。
在此基础上,通过数学方法,在同一种蛋白质的不同2D图像之间建立联系,以此为基础拟合出3D结构图像,他的图形拟合程序被认为是冷冻电镜发展的基础。此外,他对细菌和真核生物的核糖体结构和功能的研究也做出重要贡献。

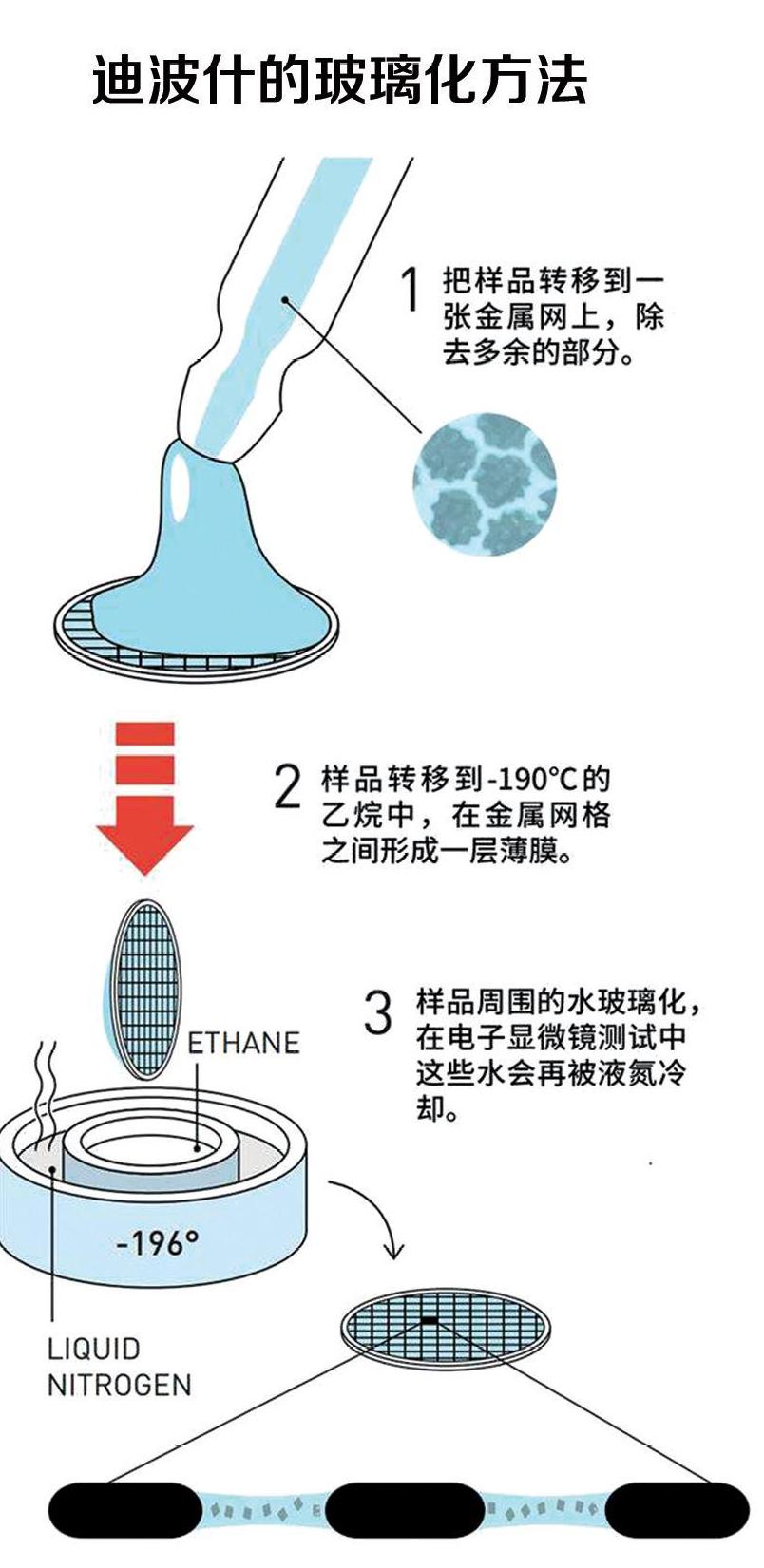
迪波什 在真空环境下使生物分子保持自然形状
现年75岁的雅克·迪波什出生于瑞士,他的重要贡献是在真空环境下使生物分子保持自然形状。大致于1978年,迪波什开始解决电子显微镜领域的样品干涸并遭破壞的问题。如前所述,亨德森在细菌视紫红质成像上曾用葡萄糖来保护样品,但这种方法并不普遍适用。
迪波什得出的方法是对生物样品进行玻璃化。一般情况下,通过氢键的相互作用,水分子会在凝固过程中有序排列,形成晶体。而迪波什想到的即是在水分子相互作用之前就让其凝固,方法是将生物样品浸入事先经液氮冷却的乙烷中,这样就能使水在数毫秒之内完全凝固。这种方法得到的就不是晶体而是无定形态,而玻璃也是处于无定形态,玻璃化名称由此而来。生物样品嵌在无定形冰中,堪称留下了真实的一瞬间。1982年,迪波什开发出真正成熟可用的快速投入冷冻制样技术制作的不形成冰晶体的玻璃态冰包埋样品。1984年,迪波什首次发布不同病毒的结构图像。随着冷台技术的开发,冷冻电镜技术正式推广开来。
传统方法 难以为继
核酸和蛋白质是生命活动的关键密码,核酸携带遗传物质,备受科学家关注,蛋白质是生命活动的主要执行者。人们对蛋白质结构的解析始于20世纪60年代。结构生物学领域有一条不成文的观点:结构决定功能。只有知道生物分子的原子排布,科学家们才能了解这个蛋白的功能。蛋白质结构解析的常用实验方法有两种:X射线衍射晶体学成像和核磁共振成像。
作为最早用于结构解析的实验方法之一,X射线衍射晶体学成像运用了几十年。X射线是一种高能短波长的电磁波(本质上属于光子束),被德国科学家伦琴发现,故又被称为伦琴射线。理论和实验都证明了,当X射线打击在分子晶体颗粒上的时候,X射线会发生衍射效应,通过探测器收集这些衍射信号,可以了解晶体中电子密度的分布,再据此获得粒子的位置信息。由于X射线对晶体样本有着很大的损伤,因此常用低温液氮环境来保护生物大分子晶体,但是这种情况下的晶体周围环境非常恶劣,可能会对晶体产生不良影响。而且X射线衍射方法不能用来解析较大的蛋白质。
核磁共振成像的基本理论是,带有孤对电子的原子核(自选量子数为1)在外界磁场影响下,会导致原子核的能级发生塞曼分裂,吸收并释放电磁辐射,即产生共振频谱。这种共振电磁辐射的频率与所处磁场强度成一定比例。利用这种特性,通过分析特定原子释放的电磁辐射结合外加磁场,可以用于生物大分子的成像或者其他领域的成像。核磁共振结构解析多是在溶液状态下的蛋白质结构,一般认为比起晶体结构更能够描述生物大分子在细胞内的真实结构,而且能够获得氢原子的结构位置。然而核磁共振也并非万能,有时候也会因为蛋白质在溶液中结构不稳定难以获取稳定的信号,因此,往往需要借助计算机建模或者其他方法来完善结构解析流程。
但事实上,以上两种常用的传统手段都不能让研究者获得高分辨率的大型蛋白复合体结构,致使生物结构学领域的发展受困于成像技术。
迅速发展 大有作为

2013年,冷冻电镜技术出现突破:不需要结晶且需要样品量极少,即可迅速解析大型蛋白复合体原子分辨率的三维结构。电子直接探测相机和三维重构软件两项关键技术在结构生物学领域产生重大影响,传统X射线、传统晶体学长期无法解决的许多重要大型复合体及膜蛋白的原子分辨率结构,一个个被迅速解决,并纷纷强势占领顶级期刊和各大媒体版面。研究人员通过对运动中的生物分子进行冷冻,即可在原子层面上进行高分辨成像,无需将大分子样品制成晶体。随后这项技术应用也正式迎来井喷式发展阶段。2015年,国际著名期刊《自然》旗下子刊《自然方法》将冷冻电镜技术评为年度最受关注的技术。
引领这些技术突破的背后离不开亨德森、弗兰克和迪波什三位冷冻电镜领域的开拓者分别在基本理论、重构算法和实验方面的早期重要贡献。诺贝尔奖官方表示:“三人的贡献令生物分子的成像变得更简单和清晰,让生物化学进入了一个新时代。我们可能很快就能在原子分辨率上获得复杂的生命装置的精细图像。”甚至有媒体称:“冷冻电镜是可与测序技术、质谱技术相提并论的第三大技术。”
冷冻电镜技术,指的是应用冷冻固定术,在低温下使用透射电子显微镜观察样品的显微技术,能将生物分子“冻起来”, 让人们前所未有地观察分析其运动过程,对于生命化学的理解和药物學的发展都有决定性影响。具体操作时,先将样品冷冻起来,然后在低温状态下放进显微镜,让高度相干的电子作为光源从上面照下来,透过样品和附近的冰层,造成散射。再利用探测器和投射系统把散射信号成像记录下来,最后进行信号处理,得到样品结构。
这项用于扫描电镜的超低温冷冻制样及传输技术可实现直接观察液体、半液体及对电子束敏感的样品,如生物、高分子材料等。样品经过超低温冷冻、断裂、镀膜制样(喷金/喷碳)等处理后,通过冷冻传输系统放入电镜内的冷台(温度可至-185℃)即可进行观察。其中,快速冷冻技术可使水在低温状态下呈玻璃态,减少冰晶的产生,从而不影响样品本身结构,冷冻传输系统保证研究人员在低温状态下对样品进行电镜观察。
将电子显微镜和计算机建模成像结合在一起的大量实践,是在新世纪之后开始流行的。冷冻电镜时代的真正来临,还得益于样品制备技术、新一代电子探测器发明、软件算法优化等多方面技术的进步,更多的信息和更低的噪音保证了高分辨率的图像。
科学家希望能制造出更灵敏的电子探测器,以及更好地制备蛋白样本的方法。这样的话,就能够对更小的、更动态的分子进行成像,并且分辨率更高。在大数据时代的基因组、蛋白质组、代谢组、脂类组等飞速发展的今天,蛋白质结构组理应得到更加广泛的重视,针对蛋白质的药物筛选和计算机辅助的药物研究不应被低估。发展高精度、高效的结构解析技术有着重要意义,可以预见未来在蛋白质结构领域有着更多的惊喜。
