大肝癌的综合性微创介入治疗研究及预后分析
2018-03-27冀春亮陈正光
冀春亮, 陈正光
原发性肝癌是我国常见的恶性肿瘤之一,据统计,每年全世界的新发原发性肝癌有600000余例,82%以上患者在发展中国家,其中我国占55%[1]。肝癌已成为恶性肿瘤中导致死亡的第二位“杀手”[2]。由于肝癌恶性程度高、浸润和转移早,缺乏特异性临床表现等原因,致使大多数患者确诊时已属中晚期,且多数为直径超过5 cm的大肝癌。
从传统治疗来看,外科切除(包括肝移植)仍然是肝癌根治的首选方式,然而由于诸多因素的限制,仅有10%~30%的原发性和转移性肝癌患者具有外科手术机会[3]。汤钊猷院士多次指出“肝癌是全身病变”,其新的治疗理念是“既要尽可能消灭肿瘤,又要最大限度保存机体”,故肝癌的治疗模式正趋向微创及多学科共同协作的综合治疗[4]。近几年,国内外已有多数文献报道:对于直径≤3.0 cm的单发小肝癌,一些区域性局部治疗的方法,如射频消融(radio-frequency ablation,RFA)的疗效与手术切除的疗效相当,可达到根治性的治疗效果并已得到多数学者的认可[5]。但对临床上很常见的大肝癌(≥5.0 cm),其介入治疗方法、治疗模式的选择及其疗效目前国内外报道尚少,更未见远期疗效的报道。综合性微创介入治疗大肝癌以提高对大肝癌的疗效是重要的临床研究课题。
本研究旨在探讨综合性微创介入治疗大肝癌及其合并症的具体疗效,明确综合性微创介入治疗大肝癌及其合并症的临床价值;同时对大肝癌患者的预后影响因素进行分析。
材料与方法
1.一般资料
入组标准:①HCC的诊断符合由中国抗癌协会肝癌专业委员会制定的原发性肝癌诊断标准[6]。②年龄18~75岁。③无外科手术指征或患者无手术意愿。④≤3个病灶,有且只有一个病灶直径>5.0 cm,规定其为主瘤,其余为子瘤。⑤没有重要血管、脏器和淋巴结侵犯,无远处转移。⑥肝功能Child-Pugh A/B级。⑦凝血功能无异常。所有患者均签署知情同意书。
排除标准:①患者身体条件无法耐受介入手术、肝功能Child-Pugh C级。②肝内弥漫性肿瘤灶。
搜集2014年8月-2016年7月北京中医药大学东直门医院符合肝癌介入治疗标准的50例原发性大肝癌患者,肿瘤最大径5.1~16.7 cm,平均(8.52±2.68) cm,共计92个肿瘤,多发病灶者选其中最大径肿瘤为观察目标。男43例、女7例,年龄39~73岁,平均(58.48±8.83)岁。全部患者随访4~24个月,平均(13.26±4.94)个月。TACE与RFA联合组(研究组):20例先行TACE治疗后再行RFA治疗;TACE组(对照组):30例行单纯TACE治疗。两组病例的性别、年龄、慢性肝病情况、治疗前的主瘤直径、乙型肝炎表面抗原(HbsAg)、AFP情况、门静脉癌栓、肝功能分级(Child-Pugh法)及肿瘤数目经统计学检验差异均无统计学意义(P>0.05)。
2 方法
研究组患者先行经肝动脉灌注化疗栓塞术(transcatheter arterial chemoembolazition,TACE),一周后肝功能正常者紧接着行RFA治疗,对于肿瘤形态不规则的病灶予以单针多次射频治疗。一次TACE治疗后在规定时间内行一次RFA治疗为一个疗程,研究组每位患者必须接受一次以上疗程。若联合治疗后增强CT或增强MRI检查提示病灶仍有血供,患者条件仍符合纳入标准则进行第二疗程治疗,否则,可根据患者肝功能水平及临床综合情况,考虑单独或混合行TACE或RFA治疗。对照组行单纯TACE治疗。
3.药品及实验设备
药品:吡柔比星10 mg/瓶、丝裂霉素2 mg/瓶、卡铂50 mg/瓶、超液态碘化油10 mL/瓶、2%利多卡因等。对比剂采用碘普罗胺(300 mg I/mL,100 mL)。
实验仪器:①Philips Allura Xper FD20大平板数字血管造影机;②RFA-Ⅰ型多极射频肿瘤消融系统及RFA-1315型多极射频肿瘤消融电极(北京博莱德光电技术开发有限公司),射频工作频率330 KHZ,最大输出功率300 W;电极针采用15G的套针,配有一个电极导线与射频发生器相连,内套针顶端有13根细针展开呈“伞状”包绕肿瘤,针尖可随肿瘤大小调节,通常分为三级。通电后电极针能将射频热能均匀播散到肿瘤组织内,一次治疗最大可形成直径4.0 cm的凝固坏死灶;体外电极(负极板)即回路电极板大小为45 cm×15 cm;③超声:日本东芝公司EUB-5500型超声诊断仪,配备EUP-B514凸阵穿刺探头;④3.0T MR仪;⑤Siemens 64排双源CT。
4.疗效评价标准
术后于1个月通过CT、MRI,观察肿瘤缩小情况、病灶血流情况、肿瘤内碘化油沉积情况以及肿瘤组织坏死和存活情况,并结合WHO实体瘤疗效国际标准及《肝癌综合性介入治疗规范》疗效标准进行判定[7]。①完全缓解(CR):肿瘤病灶基本消失或最大双径乘积缩小≥75%,病灶内碘化油沉积密实,MRI检查显示肿瘤组织完全或大部分坏死,DSA无肿瘤血管和肿瘤染色。②部分缓解(PR):肿块最大双径乘积缩小≥50%但<75%,病灶内碘化油沉积密实,充填面积≥肿块面积的80%,MRI检查显示肿瘤组织大部分坏死,仅在肿瘤周缘有少许肿瘤血管和肿瘤染色。③稳定(SD):肿块最大双径乘积缩小≥25%但<50%,病灶内碘化油非均匀性沉积,充填面积≤肿块面积的50%。MRI检查显示肿瘤组织部分存活,部分坏死,坏死区域约占30%~50%。④进展(PD):肿块不均匀性增大,病灶内碘化油呈散在斑点状或无碘油沉积,充填面积≤肿块面积的10%,MRI检查显示肿瘤组织大部分存活,肿瘤血管明显增多,肿瘤染色明显,可见新的肿瘤病灶。
以AFP的含量变化即治疗前后AFP的差值作为衡量疗效的标准。
以治疗后生存期作为衡量疗效的标准。治疗后患者生存期的长短反映了治疗的最终效果,所以是最有价值的疗效标准。
5.统计学处理
采用SPSS 17.0统计学软件,正态分布或近似正态分布的计量资料用t检验或单因素方差分析;计数资料当行或列无序时采用卡方检验,行或列有序时采用秩和检验;用Log-rank检验比较患者生存率,并进行Cox回归多因素分析。以P<0.05为差异具有统计学意义。
结 果
1.治疗后肿瘤的有效缩小情况
本组资料以CR及PR为有效缩小,并计算有效缩小率。采用Ridit分析进行比较,TACE+RFA组肿瘤有效缩小率明显高于与TACE组有效缩小率,其差异具有统计学意义(P=0.000,表1,图1)。TACE+RFA组的病例经治疗后,其肿瘤有效缩小率明显优于TACE组的病例。

表1 两组患者肿瘤缩小情况评价 (例)
2.AFP变化
两组患者治疗术后1个月复查AFP水平。采用两独立样本的秩和检验比较两组病例治疗前后AFP差值,TACE+ RFA组治疗前后AFP差值明显高于TACE组,差异具有统计学意义(Z=2.02,P=0.043)。
3.术后生存率
对所有患者建立详细的临床资料档案,并通过电话及门诊等方式进行随访、追踪,直至患者死亡,随访至2012年2月,共有6例失访。统计患者治疗术后6个月、1年、2年的生存率来评价两组患者的治疗效果,到随访结束日止,仍存活的病例作截尾值处理(表2)。TACE+RFA组患者生存率明显高于TACE组的患者,差异有统计学意义(χ2=4.059,P=0.044)。TACE+RFA组患者中位生存期(17个月)也较TACE组的患者(13个月)长。

表2 两组患者生存率
4.Cox回归模型单因素分析
原发性肝癌介入治疗的预后影响因素是多方面的,本研究共选择了12项可能影响预后且临床数据完整的指标:性别、年龄、肝炎病史、HbsAg(+)、肿瘤癌栓、肿瘤数目、治疗前主瘤直径、治疗前AFP值、治疗前肝功能、治疗方式、治疗后肿瘤有效缩小率、治疗前后AFP值差值。12项指标在统计学上的分类赋值见表3。
将12项指标引入Cox模型进行单因素分析,结果显示治疗方式、年龄、HbsAg(+)、肿瘤癌栓、肿瘤数目、治疗前主瘤直径和治疗后肿瘤有效缩小率与预后显著相关(表4)。
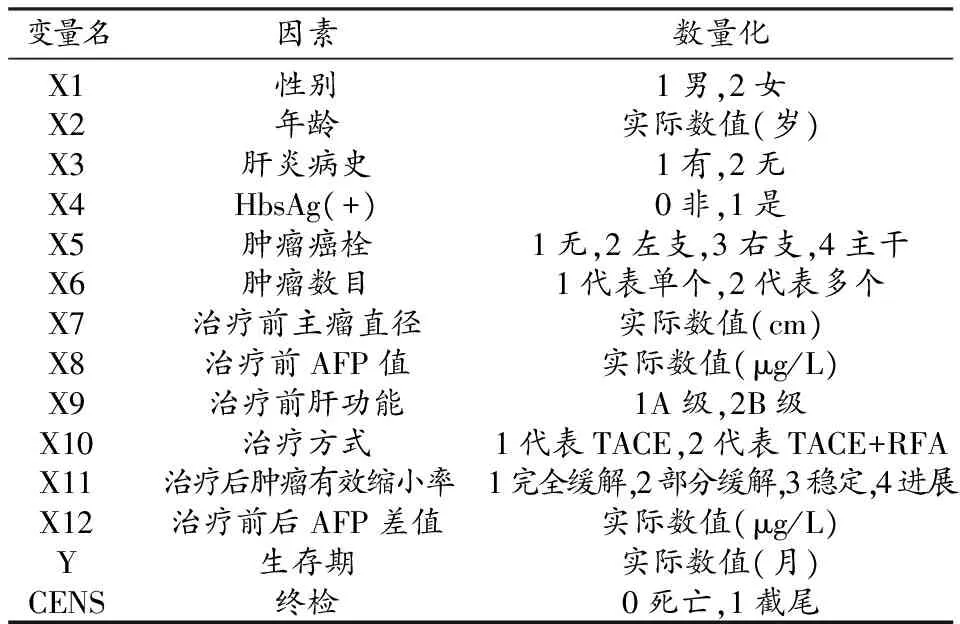
表3 影响PLC介入治疗预后因素的分类赋值表
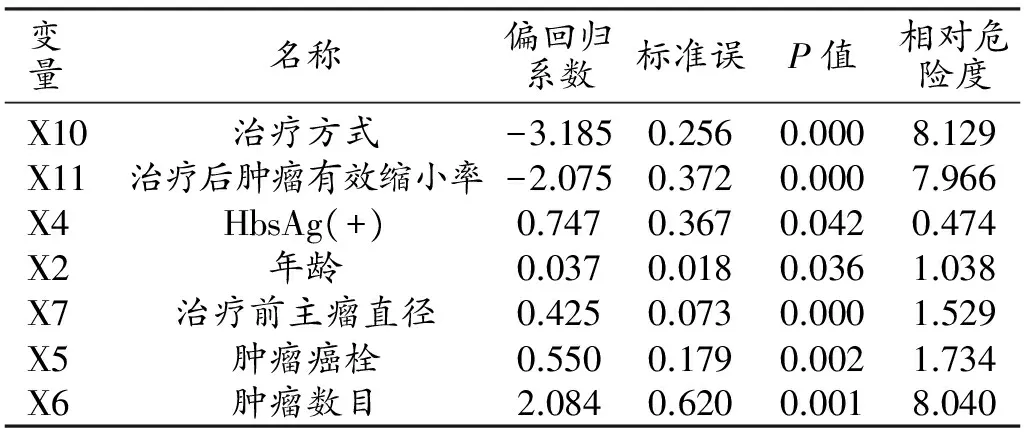
表4 Cox模型单因素分析入选变量
影响原发性肝癌介入治疗预后的众多因素之间可能存在着相互影响,单因素分析价值有限,多因素分析可以更为准确、全面地判别对预后有显著影响的因素。故再将12项指标一同引入Cox模型进行多因素分析,结果显示HbsAg(+)、治疗前主瘤直径、治疗方式和治疗后肿瘤有效缩小率4项指标与预后显著相关,具有统计学意义,其相对危险度分别为0.356、1.461、9.881、9.083(表5)。

表5 Cox模型多因素分析入选变量
讨 论
1.两种介入治疗方法的比较
1979年Nakakuman等采用碘油与化疗药物混合后注入肿瘤供血动脉的方法,即TACE,令肝癌非手术治疗获得了突破性进展,疗效瞩目,并已被医学界公认为不能切除的肝癌以及肝癌术后复发者的最佳治疗方法[8-9]。可视为评价其它介入手段疗效的金标准和理想参照。Varela等[10]采用TACE治疗的HCC患者,其1年、2年的生存率分别是92.5%和89.9%。Takayasu等[11]报道8510例行TACE治疗的HCC患者,其1年、3年、5年、7年生存率分别为82%、47%、26%和16%。总结本组单独行TACE的病例,其半年、1年、2年生存率分别为83.33%、56.67%和30.00%,中位生存期为13个月。但TACE作为一种姑息性治疗方法,对绝大多数肿瘤不能“根治”,而且单纯依靠TACE反复治疗易对正常肝实质造成损害,加重患者的肝功能障碍,直接影响其生存率。本研究显示单纯TACE组肿瘤有效缩小率为33.3%,而联合组肿瘤有效缩小率为70%,两组肿瘤有效缩小率差异具有统计学意义,联合组的病例经治疗后,其肿瘤有效缩小情况明显优于TACE组的病例。故行TACE术后当瘤体血供不丰富或者供血血管不明显、碘油沉积不好、有肝动脉门静脉瘘存在、肿瘤位置特殊等,疗效不理想、症状控制不佳,需根据患者实际情况行联合局部治疗。其中,RFA是目前应用最为广泛、成熟的一种局部治疗方式。总之,单独应用TACE或RFA治疗肝癌都具有局限性,但从各自的特点则可发现它们具有互补性。TACE联合RFA治疗肝癌理论上完全可行,联合治疗可发挥二者的优势并有协同放大作用。TACE联合RFA治疗肝癌的优势主要为:①血管栓塞后,癌细胞处于缺氧状态,对温度更加敏感,此时射频治疗效果更明显[12];②有研究认为局部沉积的重离子碘能够增强RFA的高温效应,扩大治疗范围[13];③射频消融能够杀灭碘油沉积区及周围残存的肿瘤细胞,并使肿瘤周围血管闭塞;④在RFA治疗过程中,温度升高使肿瘤细胞对化疗药物更加敏感,使化疗作用更加明显[14];⑤栓塞后碘化油可显示肿瘤的位置、边缘和大小,确定RFA治疗的范围,对RFA治疗起引导作用,同时肝动脉造影能够发现B超或螺旋CT检测不到的病灶,防止漏治。TACE与RFA相互弥补,使肝癌的完全坏死率明显提高,从而进一步提高对肝癌的治疗效果。国际上已有关于TACE联合RFA治疗大肝癌的报道,但入组患者以及治疗标准不一,患者生存获益不同。Veltri等[15]报道56例TACE+RFA治疗不可切除3~8 cm大肝癌的1年、2年生存率分别为89.7%和67.1%。Peng等[16]报道120例<7 cm或病灶≤3个,每个≤3 cm肝癌的联合治疗1年、2年、3年、5年生存率分别为93%、83%、75%和50%。国内学者代向党等[17]报道58例TACE+RFA治疗平均直径5.4 cm中晚期肝癌患者1年、2年和3年生存率分别为93%、88%和79%,中位生存期为2.296年。本研究结果为TACE与RFA联合治疗大肝癌患者术后半年、1年、2年的生存率分别为90.00%、75.00%和55.00%,中位生存期为17个月,并采用Log-rank检验法将此结果与单纯TACE组病例的生存率进行统计比较,发现联合治疗组患者的生存率明显高于单纯TACE组。
2.大肝癌预后影响因素的分析
影响中晚期原发性肝癌介入治疗的预后因素分析的文献报道较多。以往大多数应用单因素分析各变量对生存率的影响。由于中晚期原发性肝癌患者介入治疗中存在许多影响生存期的因素,某些因素间可能存在相互影响,如门静脉内有癌栓势必会影响患者肝功能状态,弥漫性肝癌也会因无法进行节段性栓塞而影响碘油沉积等。单因素分析只能对该因素下疗效进行统计分析而不能反映因素之间的相互影响,价值有限,而多因素分析可以更为准确、全面地判别对预后有显著影响的因素。
Cox回归模型作为一种多因素分析方法,可以较全面的综合分析对原发性肝癌预后有显著意义的影响因素。经Cox模型多因素分析后显示:HbsAg(+)、主瘤直径、治疗方式和治疗后肿瘤有效缩小率是具有显著作用的预后指标,为独立的影响因素。每个独立因素与大肝癌预后的相对危险度见表5。从表中可以看出:治疗方式是负系数的高危度因素,为最重要的保护性因素,而本研究结果显示TACE+RFA的肿瘤缩小率明显优于单纯TACE,因此再次充分说明TACE+RFA可以显著改善大肝癌的预后。
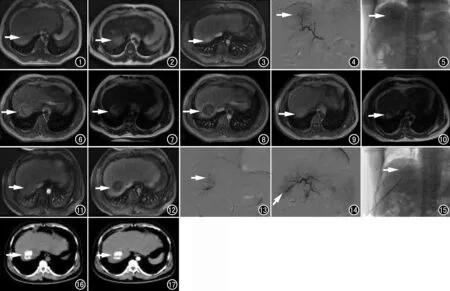
术后造影见病灶碘油沉积良好(箭)。 图6 TACE术后首次复查横轴面T1示肝右后叶上段团块状稍短T1病灶(箭)。 图7 横轴面T2示肝右后叶上段团块状稍长T2病灶(箭)。 图8 横轴面T1增强动脉期示肝右后叶上段团块状稍短T1病灶未强化(箭),提示病灶完全坏死。 图9 TACE术后第二次复查横轴面T1示肝右后叶上段一类圆形稍短T1信号灶(箭)。 图10 横轴面T2示肝右后叶上段可见一类圆形稍长T2信号灶(箭)。 图11 横轴面T1增强动脉期示肝右后叶上段病灶明显不均匀强化(箭)。 图12 横轴面T1增强门脉期示肝右后叶上段病灶对比剂消退快,病灶下后方有三角形强化区(箭),尖端指向肝门,提示病灶复发。 图13 DSA示肝右叶多发斑片状异常染色。 图14 肝左、右动脉分支参与供血,以右侧为主(箭)。 图15 CT引导下行RFA。 图16 联合治疗后复查 CT横轴面平扫示肝右叶肿块较前进一步缩小(箭)。 图17 CT动脉期示肝右叶肿块无明显强化(箭)。
图1 男,39岁,肝右后叶上段原发性肝癌。横轴面T1示肝右后叶上段片状长T1信号影(箭),边缘欠清。图2 横轴面T2示肝右后叶上段片状长T2信号影(箭)。图3 横轴面T1增强动脉期示肝右后叶上段片状长T1信号影强化(箭)。图4 DSA示肝右叶片状肿瘤染色,供血血管为肝右动脉。图5 TACE
治疗方式与大肝癌预后:经过多年大量临床病例的治疗实践,国内外文献公认TACE能提高患者的生活质量,延长生存期,且TACE较安全,严重并发症少。研究表明,TACE治疗不能切除的肝癌虽然取得了一定的疗效,但由于肿瘤血管、侧支循环等问题及TACE本身的局限性,使得其仅能使少数病例的肿瘤发生完全坏死,多数病灶内仍可见残存的肿瘤细胞,从而成为肿瘤复发转移的根源[18]。陈孝平等[19]曾对56例经TACE后手术切除标本进行病理研究,结果仅5例肿瘤完全坏死,其余病例坏死均不完全。而栓塞后肿瘤组织恢复血供是导致肿瘤细胞残存的重要原因。肿瘤组织恢复血供的可能原因包括肿瘤供血血管栓塞不完全、已栓塞的血管部分再通、肿瘤有双重供血,即肝动脉和门静脉供血,当肝动脉阻塞后门静脉可替代肝动脉供血、侧支循环形成及潜在的交通支开放等,血管内皮细胞生长因子表达增高及新生血管形成可能是另一重要因素。为了达到更好的疗效,有学者[20]将TACE与其它局部治疗方法相结合,结果均显示联合治疗优于单一TACE治疗。刘亚民等[21]用TACE+RFA联合治疗原发性肝癌与单独用TACE治疗比较,1年生存率差异无统计学意义,3年生存率差异有统计学意义,说明TACE+RFA的远期疗效优于单一TACE。本组病例研究证实,TACE+RFA组患者生存率高于TACE组的患者,其中位生存期(17个月)也长于单纯行TACE组的患者(13个月)。TACE+RFA组与TACE组的生存率相比,差异有统计学意义(χ2=4.059,P=0.044)。
肿瘤有效缩小率与大肝癌预后:关于肿瘤有效缩小率与预后的关系,目前有不同的看法,多数学者认为肿瘤有效缩小率与预后显著相关。徐克等[22]在原发性肝癌肝动脉化疗栓塞术预后多因素分析的研究中报道:应用Recist法测量,部分缓解、稳定和进展三组的中位生存期分别为17、14和22个月,从而证实肿瘤有效缩小率对预后影响有显著意义。本课题采用Kaplan-Meier法得出完全缓解、部分缓解、稳定和进展的中位生存期分别为24个月、16个月、11个月和7个月,同时将结果经Log-rank检验发现差异有统计学意义(χ2=57.798,μ=3,P=0.000)。本课题研究过程中,对肿瘤疗效评价采用的是国际上通用的实体瘤疗效评估标准(response evaluation criteria in solid tumor,RECIST),但随着介入治疗方法的不断改进,最近有学者[23]认为传统RECIST标准已不能客观、全面反映治疗的效果。传统RECIST标准设立的初衷是对细胞毒药物的疗效(肿瘤缩小)进行评价,并没有考虑肿瘤的内在变化。而目前在肿瘤治疗中,应用越来越多的介入治疗的主要作用是引起肿瘤坏死,肿瘤体积变化不大,甚至有增大,但肿瘤内部并无存活瘤细胞或很少存活细胞,例如肿瘤内出现空洞或坏死,而肿瘤总体积不变,患者却得到很大的生存获益,实现长期带瘤生存的目标。因此,传统RECIST标准在评价介入治疗的疗效时往往出现低估的情况。鉴于此,欧洲肝脏研究协会(EASL)专家组建议以影像增强扫描中显示的"存活肿瘤"区域的变化来评估肿瘤疗效。所谓“存活肿瘤”,即动态CT或MRI动脉期显示对比剂摄取的病变范围或区域。美国肝脏病研究协会(AASLD)同样认可这一观点,建议在临床试验中采用以“存活肿瘤”对靶病灶进行疗效评价,即改良RECIST标准,从而能更客观、真实和全面地评估疗效,更准确地反映患者的生存获益与预后。由于改良RECIST标准最近刚提出,而本课题已在此之前进行,所以采用的仍然是传统RECIST标准。随着实体肿瘤进入微创治疗时代,改良RECIST标准也将得到更加广泛的应用。
乙肝表面抗原阳性与大肝癌预后:中国的肝癌患者中约90%合并有HBV感染的背景[24],然而病毒感染作为贯穿肝癌发生、发展全过程的持续影响因素,在HBV感染相关肝癌治疗中远未得到应有的关注。采用荧光定量聚链反应PCR法进行HBV-DNA阳性率达90%以上[25]。说明绝大多数肝癌患者体内HBV处于活动状态,手术、化疗等可使患者免疫状态抑制,进一步激发病毒的复制。病毒复制可引起一系列的组织病变和肝细胞的大量坏死,严重时可引起重症肝炎而影响后续的肿瘤治疗,甚至危及患者的生命,从而严重影响肝癌患者经综合介入治疗术后的预后。对于原发性肝癌,已有临床研究表明抗病毒治疗能减缓肝脏移植术及根治性切除治疗后肝癌患者的术后复发,延长术后生存期,国内开展抗病毒治疗在肝癌经肝动脉碘油化疗及射频消融治疗中的预防性应用也显示了良好效果[26-28]。张侠等[29]报道采用拉米夫定联合介入栓塞化疗治疗HBV相关原发性肝癌17例,并与同期单独介入栓塞化疗患者对比提示,拉米夫定联合经肝动脉栓塞化疗治疗肝癌较单独肝动脉栓塞化疗可以明显提高患者1年和2年生存率、延长生存期。同时该研究证实肝动脉栓塞化疗对病毒活动存在激发作用,而抗病毒药物联合肝动脉栓塞化疗,可降低肝动脉栓塞化疗对病毒活动的激发作用,保障抗肿瘤治疗的顺利进行,从而提高生存率,延长生存期。
主瘤直径与大肝癌预后:本研究将50例大肝癌根据主瘤直径分为5 cm≤主瘤直径<10 cm和主瘤直径≥10 cm两组,其中主瘤直径为5 cm≤主瘤直径<10 cm的肿瘤中位生存期为17个月,主瘤直径≥10 cm的肿瘤中位生存期为8个月,两组患者采用Log-rank法进行生存率比较后显示: 5 cm≤主瘤直径<10 cm的患者生存率明显高于主瘤直径≥10 cm的患者,差异具有统计学意义(χ2=23.919,P=0.000)。肿瘤大小对肝癌预后影响的原因可能为:①瘤体越大,癌细胞数量越多,新生血管丰富,将会增强癌细胞转移的几率;②肿瘤体积增大,正常肝组织体积相对缩小,影响肝脏贮备功能;③介入治疗要求碘油尽量充分充填肿瘤血管,随着肝癌直径的增大,碘油用量越多,将会增加肝功能损害,肝功能衰竭必然缩短患者的生存期。
总之,由于研究重点、入选指标以及研究对象的差异,Cox回归模型分析的结果也会有所不同,因此本课题中未被Cox模型入选的指标并不意味着一定对预后没有影响,本研究入选的指标仅为临床提供一定的参考。
[1] Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics,2002[J].CA Cancer J Clin,2005,55(2):74-108.
[2] 刘厚钰.原发性肝癌[M].北京:人民卫生出版社,2005:450.
[3] Guan YS,Liu Y.Interventional treatments for hepatocellular carcinoma[J].Hepatobiliary Pancreat Dis Int,2006,5(4):495-500.
[4] 汤钊猷.原发性肝癌的研究进展[J].中国肿瘤临床,1998,25(2):133-142.
[5] Zhang FJ,Wu PH,Zhao M,et al.Evaluation of combined percutaneous radio-frequency ablation and percutaneous ethanol injection after transcatheter arterial chemoembolization for hepatocellular carcinomal[J].Zhonghua Zhong Liu Za Zhi,2005,27(4):248-250.
[6] 中国抗癌协会肝癌专业委员会.原发性肝癌的临床诊断与分期标准[J].中华肝脏病杂志,2001,9(6):324.
[7] 段训柏.肝癌综合介入治疗方法疗效比较的临床研究[D].广东:广州医学院,2009.
[8] Livraghi T,Goldberg SN,Lazzaroni S,et al.Hepatocellular carcinoma:radiofrequency ablation of medium and large lesion[J].Radiology,2000,214(7):761-768.
[9] Dong BW,Liang P,Yu XL,et al.Percutaneous sonographically guided microwave cagulation therapy for hepatocellular carcinoma:result in 234 patients[J].AJR,2003,180(15):1547-1555.
[10] Varela M,Real MI,Burrel M,et al.Chemoembolization of hepatocellular carcinoma with drug eluting beads:efficacy and doxorubicin pharmacokinetics[J].Hepatol,2007,46(3):474-481.
[11] Takayasu K,Arii S,Lkai I,et al.Prospective cohort study of transarterial chemoembolization for unresectable hepatocellular carcinoma in 8510 patients[J].Gastroenterology,2006,131(2):461-466.
[12] Kitamoto M,Imagawa M,Yamada H,et al.Radiofrequency ablation in the treatment of small hepatocellular carcinoma:comparison of the radiofrequency effect with and without chemoembolization[J].AJR,2003,181(4):997-1003.
[13] Peng ZW,Zhang YJ,Chen MS,et al.Risk factors of survival after percutaneous radiofrequency ablation of hepatocellular carcinoma[J].Surg Oncol,2008,17(1):23-31.
[14] Buscarini L,Buscarini E,Di SM,et al.Percutaneous radiofrequency thermal ablation combined with transcatheter arterial embolization in the treatment of large hepatocellular carcinoma[J].Ultraschall Med,1999,20(2):47-53.
[15] Veltri A,Moretto P,Doriguzzi A,et al.Radiofrequency thermal ablation (RFA) after transarterial chemoembolization (TACE) as a combined therapy for unresectable non-early hepatocellular carcinoma (HCC)[J].Eur Radiol,2006,16(3):661-669.
[16] Peng ZW,Chen MS,Liang HH,et al.A case-control study comparing percutaneous radiofrequency ablation aloneor combined with transcatheter arterial chemoembolization for hepatocellular carcinoma[J].Eur J Surg Oncol,2010,36(3):257-263.
[17] 代向党,王赢,程喆,等.肝动脉化疗栓塞联合射频消融治疗中晚期肝癌的临床疗效分析[J].放射学实践,2010,25(7):799-802.
[18] Hsieh MY,Chang MY,Wang LY,et al.Treatment of hepatocellular carcinoma by transcatheter arterial chemoembolization and analysis of prognostic factors[J].Cancer Chemother Pharmacol,1992,31(suppl):82-85.
[19] 陈孝平,吴在德,裘法祖.原发性肝癌经肝动脉栓塞化疗后施行肝切除术的评价[J].肝胆外科杂志,1997,5(1):12-14.
[20] Clavien PA,Kang KJ,Selzner N,et al.Cryosurgery after chemoembolization for hepatocellular carcinoma in patients with cirrhosis[J].Gastrointest Surg,2002,6(1):95-101.
[21] 刘亚民,秦皓,王崇宝,等.原发性肝癌综合介入治疗的疗效分析[J].中华肿瘤杂志,2007,29(3):232-235.
[22] 商春雨,苏洪英,徐克,等.原发性肝癌肝动脉化疗栓塞术(TACE)预后多因素分析[J].现代肿瘤医学,2011,19(12):2466-2469.
[23] Edeline J,Boucher E,Rolland Y,et al.Comparison of tumor response by response evaluation criteria in solid tumors (RECIST) and modified RECIST in patients treated with sorafenib for hepatocellular carcinoma[J].Cancer,2012,118(1):147-156.
[24] Yang JD,Roberts LR.Hepatocellular carcinoma:a global view[J].Nat Rev Gastroenterol Hepatol,2010,7(8):448-458.
[25] Yim HJ,Iok AS.Natural history of chronic hepatitis B virus infection:what we know in 1981 and what we know in 2005[J].Hepatology,2006,43(2 Suppl 1):173-181.
[26] Miao RY,Zhao HT,Yang HY,et al.Postoperative adjuvant antiviral therapy for hepatitis B/C virus-related Hepatocellular carcinoma:a meta-analysis[J].World J Gastroenterol,2010,16(23):2931-2942.
[27] 方程,宣吉晴,雷正明.手术切除联合阿德福韦酯应用对原发性肝癌复发和生存期的影响[J].当代医学,2010,16(4):73-74.
[28] 彭齐荣,肖必,程涛,等.拉米夫定联合微波消融治疗原发性肝癌40例[J].现代肿瘤医学,2010,18(4):755-757.
[29] 张侠,阮新建,刘畅,等.拉米夫定在肝癌介入栓塞化疗中的作用[J].中国药物警戒,2011,8(8):449-451.
(投稿日期:2017-01-11)