天敌互作对乌桕生长及生物量的影响
2018-03-27刘亚珍覃志伟莫长明李晓琼郭文锋
刘亚珍 覃志伟 项 瑶 张 玉 李 忠 莫长明 李晓琼 郭文锋
(1. 广西大学林学院,广西 南宁 530005; 2. 广西作物遗传改良生物技术重点开放实验室,广西 南宁 530007)
空间分离的地上和地下天敌通过共同宿主植物发生密切的相互作用,并对植物适合度产生加性效应、协同效应或拮抗效应[1-2]。天敌互作类型及强度变化是植物防御特性进化的重要驱动力[3-4],植物则进化出了一系列资源调配及防御策略 (如直接防御、诱导防御、抗性和耐受性等) 以应对地上、地下天敌胁迫[5]。研究地上、地下天敌互作及其对植物的影响,能深入了解不同空间天敌间相互作用关系以及植物在不同天敌互作下的响应机制,丰富植物与天敌互作及协同进化理论。然而大多数研究都集中在地下天敌对地上天敌的影响[6-7],很少关注地上天敌对地下天敌的影响或二者间的互作[8]。此外,不同食性(广食性、专食性)天敌对植物的生长和生物量也会产生不同影响[4,7]。
乌桕 (Sapiumsebiferum) 是大戟科 (Euphorbiaceae) 乌桕属 (Sapium) 落叶乔木,作为中国应用前景广泛的能源、观赏树种而被广泛种植[9]。随着乌桕的不断开发利用,其病虫害问题也备受关注[10]。乌桕害虫种类繁多[9],现已知的乌桕害虫有108种,分属昆虫纲7目38科[11],其中,危害较为严重的地上天敌有专食性的癞皮夜蛾 (Gadirthainexacta)、乌桕卷象 (Apoderusbicallosicollis),红胸律点跳甲 (Aphthonomorphacollaris) 及广食性的黄刺蛾 (Cnidocampaflauescens)、斜纹夜蛾 (Prodenialitura)、桔蚜 (Toxopteracitricidus)[9-10]等,地下有害生物主要是南方根结线虫 (Meloidogyneincognita)。这些天敌经常相伴发生,共同对乌桕形成危害。研究乌桕在不同空间天敌互作下的生长和生物量情况,能深入了解其资源分配策略,为今后更好地开发利用乌桕及其害虫防治提供理论依据。以往关于乌桕地上、地下天敌互作的研究较少。Huang等[1]发现地上红胸律点跳甲成虫的胁迫能促进地下同种幼虫的发育。而Li等[12]发现乌桕介导的异种地上、地下天敌间产生拮抗效应。因此,本研究通过比较地上专食性癞皮夜蛾、广食性斜纹夜蛾与南方根结线虫互作对乌桕生长及其生物量分配的影响,以揭示不同空间天敌种间互作关系及乌桕的资源分配策略,进一步阐明地上、地下天敌互作及植物-天敌间的协同进化机制。
1 材料与方法
1.1 植物与昆虫材料的准备
试验所需的植物材料均采用乌桕幼苗,乌桕种子采集于广西科学院桂林植物研究所。将乌桕种子放在10 g/L的洗衣粉溶液中浸泡2 d以去除种子的外蜡质层,再将种子放入5~10 cm深的沙中并置于4 ℃冰箱中层积处理40 d。6月初,将乌桕种子放在装有体积为50%壤土和50%草炭土的苗盘中,放在温室内萌芽。2016年7月底,选取长势一致的幼苗移入装有灭菌土壤 (V(壤土)∶V(草炭土)=1∶1) 的花盆 (高16 cm,直径25 cm) 中,每盆1株。植物随机摆放,并用80目尼龙网罩 (高100 cm,直径27 cm) 罩住整个植株以隔绝其他昆虫。
试验所需南方根结线虫从番茄根上扩繁。斜纹夜蛾和癞皮夜蛾从野外采集幼虫,并在实验室内人工饲养至成虫,产卵,取虫龄一致的二龄幼虫供试。
1.2 地上和地下天敌取食处理
参照刘维志[13]的方法配置成约500头/mL的二龄幼虫线虫悬浮液。用打孔器在乌桕苗根部钻3个深度约为3 mm的小孔,再用加样器向线虫处理组乌桕根部小孔里加入上述根结线虫悬浮液2 mL,对照组加入2 mL无菌水,最后用土壤将小孔覆盖。
1个月后,轻轻扒开乌桕根部,检验根结形成情况。选取根部有明显根结形成、长势一致的乌桕幼苗开展实验,在相应地上天敌处理组分别放入1头癞皮夜蛾或斜纹夜蛾的二龄幼虫。由于2种昆虫的幼虫期较短、且危害较严重,3 d后移走地上天敌。每隔15 d重复地上部分昆虫取食操作,共重复3次。地下 (南方根结线虫、对照) 与地上 (癞皮夜蛾、斜纹夜蛾、对照) 互作,共6个处理,每个处理10盆,共60盆植物。昆虫处理结束后,让所有植株生长20 d。
1.3 植物收获与测定
用卷尺测定所有植株的株高,用游标卡尺测定地径,数植物叶片数。分别收获植株的地上部分和地下部分,将样品在烘箱内65 ℃烘干至恒质量,用万分之一天平称量地上部分生物量干质量、地下部分生物量干质量,计算总生物量和根冠比。
1.4 分析统计
采用双因素方差分析比较地上、地下天敌处理对乌桕生长特性 (地径、株高和叶片数) 及生物量 (地上生物量、地下生物量、总生物量及根冠比) 的影响,将地下天敌处理 (根结线虫、对照)、地上天敌处理 (斜纹夜蛾、癞皮夜蛾、对照) 作为固定因素,并考虑二者的交互效应。对差异显著的因变量,再采用S-N-K法进行多重比较。所有数据均采用SPSS 18.0进行统计分析,并用Sigmaplot 13.0绘图。
2 结果与分析
2.1 天敌互作对乌桕生长的影响
地上、地下天敌互作对乌桕生长性状影响的方差分析结果见表1,可知地上、地下天敌互作对乌桕地径形成显著的交互影响。在无南方根结线虫胁迫情况下,2种地上天敌均显著减少了乌桕地径;而有南方根结线虫的植株,2种地上天敌对乌桕地径的影响差异不显著。且无论是否存在地下天敌,2种地上天敌对乌桕地径的影响差异并不显著 (图1)。
地上、地下天敌互作对乌桕株高也形成显著的交互影响 (表1)。无南方根结线虫胁迫情况下,癞皮夜蛾处理组植株株高显著低于对照组,与斜纹夜蛾处理组无显著差异;而南方根结线虫处理组,地上天敌处理对乌桕株高的影响差异不显著 (图2)。
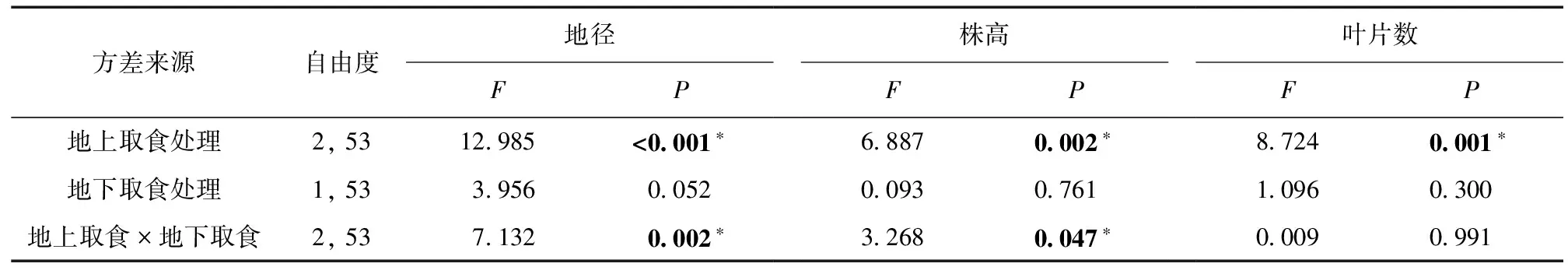
表1 地上与地下天敌互作对乌桕生长性状影响的方差分析结果Table 1 ANOVA results of effects of interactions between AG and BG natural enemies on the growth traits of S.sebiferum
注:“*”表示影响显著。

不同小写字母表示差异显著。
图1地上与地下天敌互作对乌桕地径的影响
Fig.1 Effects of interactions between AG and BG natural enemies on the ground diameter ofS.sebiferum
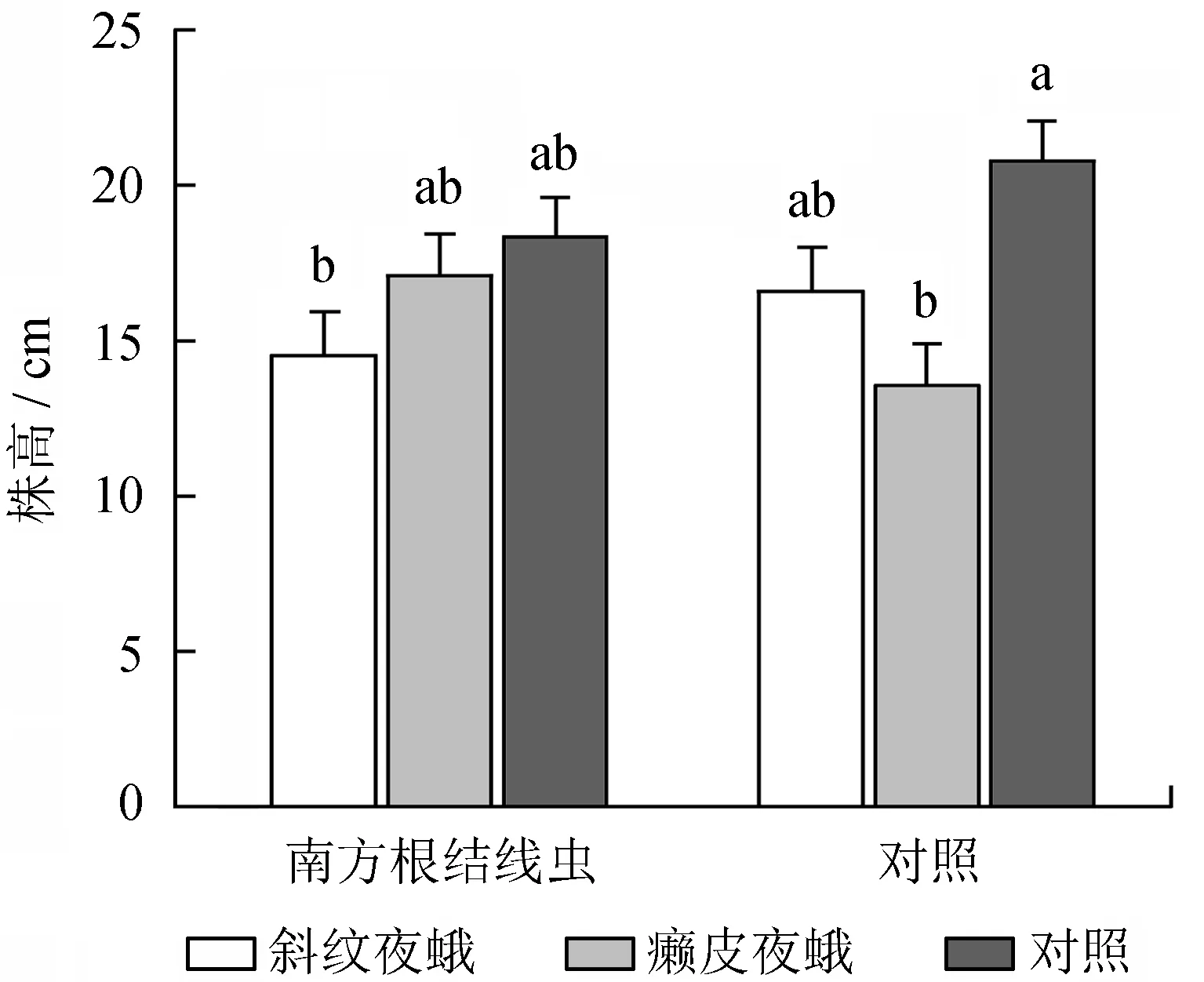
不同小写字母表示差异显著。
图2地上与地下天敌互作对乌桕株高的影响
Fig.2 Effects of interactions between AG and BG natural enemies on the height ofS.sebiferum
地上天敌处理对乌桕叶片数形成显著影响,地下天敌处理及地上、地下天敌互作对乌桕叶片数未形成显著影响 (表1)。癞皮夜蛾和斜纹夜蛾处理组的乌桕叶片数显著少于对照组 (图3),而2种天敌间对乌桕叶片数的影响无显著差异。
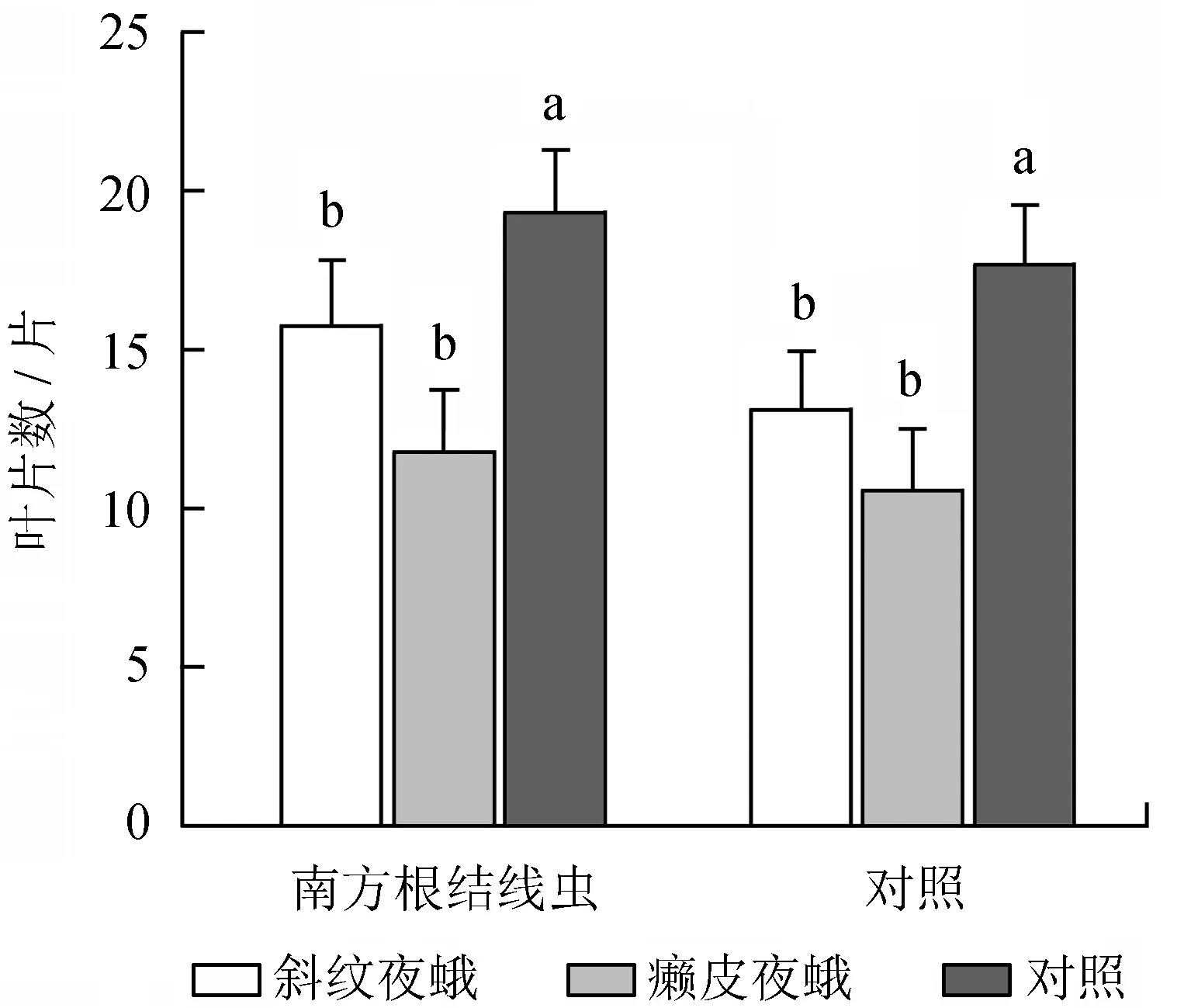
不同小写字母表示差异显著。
图3地上与地下天敌互作对乌桕叶片数的影响
Fig.3 Effects of interactions between AG and BG natural enemies on the leaf number ofS.sebiferum
2.2 天敌互作对乌桕生物量的影响
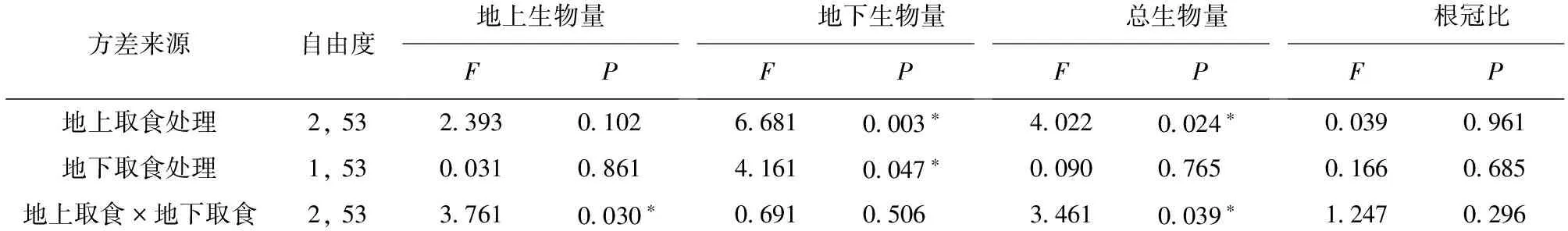
地上、地下天敌互作对乌桕生物量影响的方差分析结果见表2。由表2可知,地上、地下天敌互作对乌桕地上生物量、总生物量形成显著的交互影响 (表2)。南方根结线虫对斜纹夜蛾处理组及对照组乌桕的地上生物量、总生物量无显著影响,但显著增加了癞皮夜蛾处理组乌桕的地上生物量及总生物量 (图4~5)。
表2 地上与地下天敌互作对乌桕生物量影响的方差分析结果Table 2 ANOVA results of effects of interactions between AG and BG natural enemies on the biomass of S.sebiferum
方差来源自由度地上生物量FP地下生物量FP总生物量FP根冠比FP地上取食处理2,532393010266810003∗40220024∗00390961地下取食处理1,530031086141610047∗0090076501660685地上取食×地下取食2,5337610030∗0691050634610039∗12470296
注:*表示影响显著。
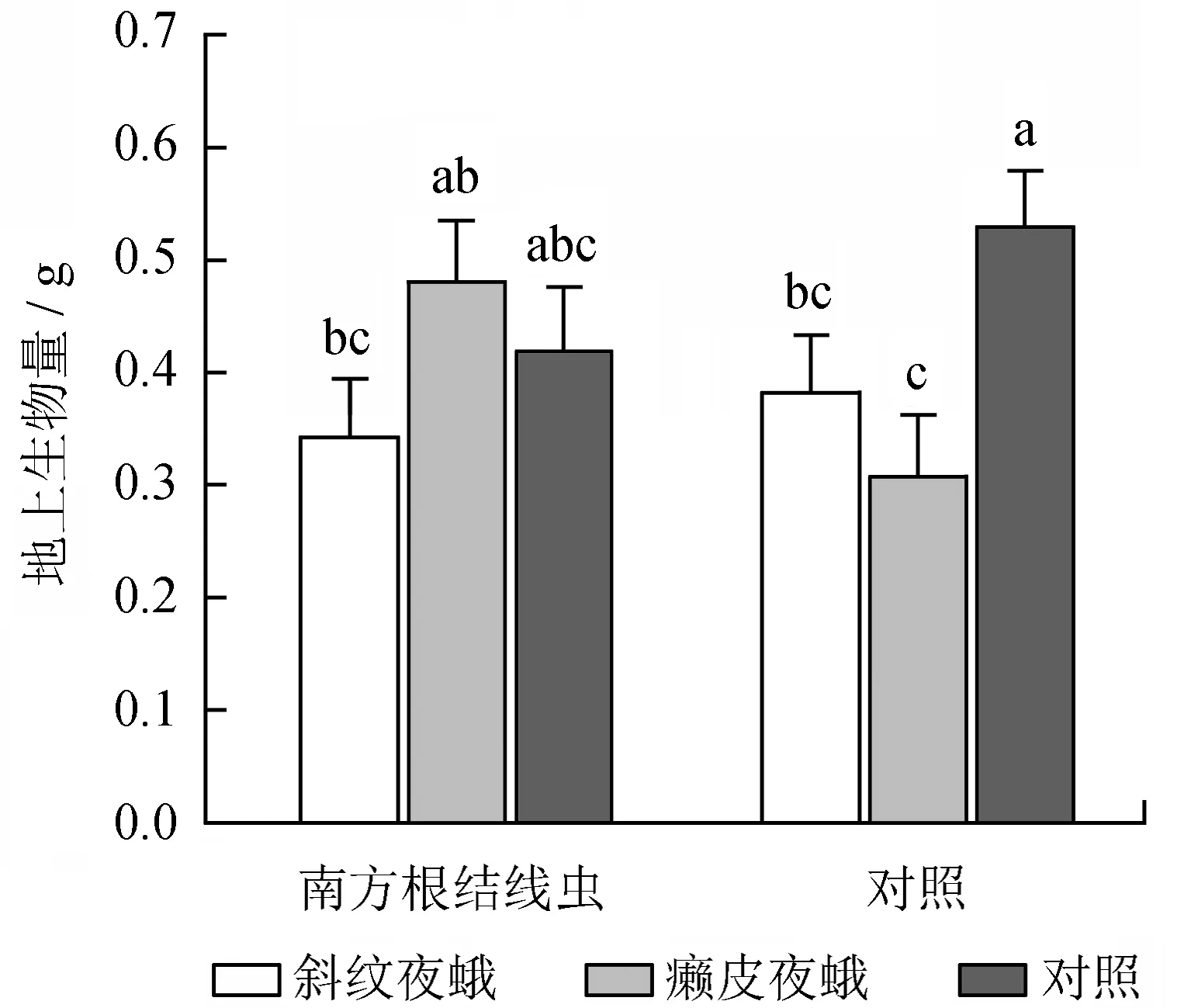
不同小写字母表示差异显著。
图4地上与地下天敌互作对乌桕地上生物量的影响
Fig.4 Effects of interactions between AG and BG natural enemies on the AG biomass ofS.sebiferum
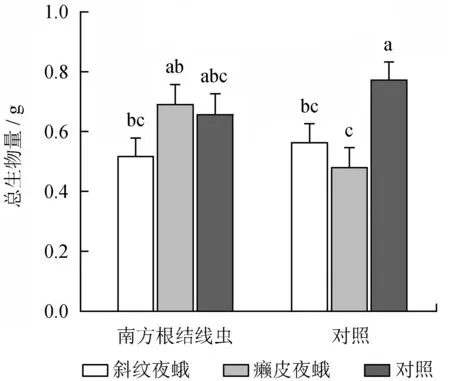
不同小写字母表示差异显著。
图5地上与地下天敌互作对乌桕总生物量的影响
Fig.5 Effects of interactions between AG and BG natural enemies on the total biomass ofS.sebiferum
地上天敌和地下天敌处理显著影响了乌桕地下生物量,而地上、地下天敌互作并未对乌桕地下生物量形成显著的交互影响 (表2)。与对照组相比,癞皮夜蛾、斜纹夜蛾均显著减少了乌桕地下生物量,但2个处理组间并无显著差异。与此相反,南方根结线虫显著增加了乌桕地下生物量 (图6)。地上、地下天敌及其天敌互作对乌桕根冠比均未形成显著影响 (表2)。

不同小写字母表示差异显著。
图6地上与地下天敌互作对乌桕地下生物量的影响
Fig.6 Effects of interactions between AG and BG natural enemies on the BG biomass ofS.sebiferum
3 结论与讨论
本研究发现,在南方根结线虫胁迫下,癞皮夜蛾对乌桕株高、地上生物量及总生物量的减少低于没有南方根结线虫的情况,说明南方根结线虫与癞皮夜蛾间形成了一种拮抗效应,从而对乌桕生长及生物量产生了加性效应;而这种抑制效应在斜纹夜蛾与南方根结线虫间并不存在,说明地上与地下天敌互作类型与昆虫食性相关[14]。类似地,Van Grunsven等[15]发现地上、地下天敌对番木瓜 (Caricapapaya) 及独行菜 (Lepidiumapetalum) 的生长产生加性效应;而危害根部的蛀虫与危害花朵、种子的昆虫对羽扇豆 (Lupinusmicranthus) 种子产量具有拮抗效应[16]。除了天敌食性,地上与地下天敌间的互作类型及其对植物的影响还受到植物种类及基因型、昆虫的取食类型及取食顺序等多种因素的影响[17-19]。Li等[12]研究不同来源地的乌桕种群发现,地上乌桕卷象与红胸律点跳甲的表现都受到地下天敌的抑制。Huang等[1]研究发现种内促进和种间抑制是决定群落地上地下组成和多样性的关键,同种地上与地下天敌间一般会相互促进,表现为地上成虫的取食提高了地下幼虫的存活率,地下幼虫提高了地上成虫的取食率。然而,异种地上、地下天敌相互作用类型较为复杂,但总体上表现为相互抑制。
研究地上、地下天敌互作下植物的生长和生物量情况,有助于研究植物应对地上、地下天敌的资源分配及防御策略[20-21]。郭素民[22]在模拟天敌取食的实验中发现,喜旱莲子草 (Altemantheraphiloxeroides) 在受到去叶处理后将资源更多的投入到地下部分,以供给地上部分资源消耗,维持生长。而本研究中,地上天敌显著减少了乌桕地下生物量,而南方根结线虫取食显著增加了乌桕地下生物量,说明地上天敌对植物的影响要大于地下天敌,而乌桕能通过增加根系的生长来应对南方根结线虫胁迫,以增加其对营养物质和水分的吸收能力。Huang等[23]发现被专食性跳甲取食后,与中国乌桕种群相比,美国乌桕种群的地上生物量和总生物量更高,说明美国乌桕种群采用了一种“地上优先”策略,调配更多的资源到地上,以提高竞争能力和对地上天敌的耐受性。植食性天敌还能通过影响植物初级及次生代谢产物,从而影响其他部位天敌的生长、发育及存活[8]。千里光 (Senecioscandens) 在被甘蓝夜蛾 (Mamestrabrassicae) 危害叶片后,会减少根部吡咯烷生物碱的合成量[24]。感染桔蚜的鼠耳芥 (Arabidopsisthaliana) 会增加根部羟脂的合成量,并向枝条转运,从而增加了危害叶片的桔蚜取食量、身体含水量及繁殖能力[25]。因此,有必要进一步研究地上、地下天敌互作对乌桕不同部位初生、次生代谢产物的影响。
天敌的食性对植物的生长及防御水平的影响也很大[26-28]。例如,在新生境中,入侵植物只是逃逸了专食性天敌的危害,而没有完全逃逸广食性天敌,有些入侵植物上甚至会聚集更多的广食性天敌[17]。因此,入侵植物种群可能会降低对专食性天敌的防御,维持或增强对广食性天敌的防御[26,28-29]。本研究中,2种不同食性地上天敌对乌桕生长及生物量的影响并未检测到显著差异。然而,王毅[27]和Huang等[30]研究发现乌桕的美国种群对专食性天敌的抗性降低、对广食性天敌的抗性不变。因此,其他空间天敌或者不同营养级生物的存在可能会直接或间接地影响植物与天敌互作结果。此外,寄主植物基因型[21]和天敌口器类型 (如咀嚼式口器和刺吸式口器天敌)[31-32]也能对植物适合度产生不同影响[1-2]。因此,研究不同空间天敌互作下乌桕的生长及生物量情况,能了解其资源分配策略,并深入阐明植物-天敌互作及协同进化机制,对今后更好地开发利用乌桕及其害虫生物防治具有重要的理论指导意义。目前地上、地下互作研究主要集中在植物根部害虫与地上部分生物间互作[6-7,33],很少对地上、地下天敌以及更高营养级生物(如寄生生物、降解者、共生微生物、传粉者)间互作进行整合研究[34-35],未来应加强对地上、地下天敌互作以及植物与天敌的共同演化的研究[6],丰富植物与不同空间天敌互作及协同进化理论。
[1] Huang W, Siemann E, Yang X, et al. Facilitation and inhibition: changes in plant nitrogen and secondary metabolites mediate interactions between above-ground and below-ground herbivores[J]. Proc Biol Sci, 2013, 280(1767): 20131318.
[2] Stephens A E A, Srivastava D S, Myers J H. Strength in numbers? Effects of multiple natural enemy species on plant performance[J]. Proc Biol Sci, 2013, 280(1760): 20122756.
[3] Bezemer T M, Wagenaar R, Van Dam N M, et al. Interactions between above- and belowground insect herbivores as mediated by the plant defense system[J]. Oikos, 2003, 101(3): 555-562.
[4] Soler R, Bezemer T M, Van Der Putten W H, et al. Root herbivore effects on above-ground herbivore, parasitoid and hyperparasitoid performance via changes in plant quality[J]. Journal of Animal Ecology, 2005, 74(6): 1121-1130.
[5] 黄伟, 王毅, 丁建清. 入侵植物乌桕防御策略的适应性进化研究[J]. 植物生态学报, 2013, 37(9): 889-900.
[6] Ali J G, Agrawal A A. Specialist versus generalist insect herbivores and plant defense[J]. Trends in Plant Science, 2012, 17(5): 293-302.
[7] Blossey B, Hunt-Joshi T R. Belowground herbivory by insects: influence on plants and aboveground herbivores[J]. Annual Review of Entomology, 2003, 48: 521-547.
[8] Soler R, Erb M, Kaplan I. Long distance root-shoot signalling in plant-insect community interactions[J]. Trends in Plant Science, 2013, 18(3): 149-156.
[9] 张家亮, 王毅, 丁建清. 乌桕害虫名录[J]. 中国森林病虫, 2015, 34(5): 25-35.
[10] 陈景震, 张良波, 李培旺. 乌桕开发利用研究进展[J]. 湛江师范学院学报, 2012, 33(3): 110-112.
[11] 洪承昊, 陈京元, 查玉平. 乌桕主要害虫及防治策略[J]. 湖北林业科技, 2010(6): 65-67.
[12] Li X Q, Guo W F, Siemann E, et al. Plant genotypes affect aboveground and belowground herbivore interactions by changing chemical defense[J]. Oecologia, 2016, 182(4): 1107-1115.
[13] 刘维志. 植物病原线虫学[M]. 北京: 中国农业出版社, 2000: 213-281.
[14] Kaplan I A N, Sardanelli S, Denno R F. Field evidence for indirect interactions between foliar-feeding insect and root-feeding nematode communities onNicotianatabacum[J]. Ecological Entomology, 2009, 34(2): 262-270.
[15] Van Grunsven R H A, Van Der Putten W H, Martijn Bezemer T, et al. Plant-soil interactions in the expansion and native range of a poleward shifting plant species[J]. Global Change Biology, 2010, 16(1): 380-385.
[16] Maron J L, Simms E L. Rodent-limited establishment of bush lupine: field experiments on the cumulative effect of granivory[J]. Journal of Ecology, 2001, 89(4): 578-588.
[17] Agrawal A A, Kotanen P M. Herbivores and the success of exotic plants: a phylogenetically controlled experiment[J]. Ecology Letters, 2003, 6(8): 712-715.
[18] Huang W, Siemann E, Xiao L, et al. Species-specific defence responses facilitate conspecifics and inhibit heterospecifics in above-belowground herbivore interactions[J]. Nature Communications, 2014, 5: 4851.
[19] Johnson S N, Clark K E, Hartley S E, et al. Aboveground-belowground herbivore interactions: a meta-analysis[J]. Ecology, 2012, 93(10): 2208-2215.
[20] Smilanich A M, Fincher R M, Dyer L A. Does plant apparency matter? Thirty years of data provide limited support but reveal clear patterns of the effects of plant chemistry on herbivores[J]. New Phytologist, 2016, 210(3): 1044-1057.
[21] Wardle D A, Bardgett R D, Klironomos J N, et al. Ecological linkages between aboveground and belowground biota[J]. Science, 2004, 304(5677): 1629-1633.
[22] 郭素民. 入侵植物喜旱莲子草对天敌的响应及机制研究[D]. 太原: 山西师范大学, 2014.
[23] Huang W, Carrillo J, Ding J, et al. Invader partitions ecological and evolutionary responses to above- and belowground herbivory[J]. Ecology, 2012, 93(11): 2343-2352.
[24] Gera Hol W H, Macel M, van Veen J A, et al. Root damage and aboveground herbivory change concentration and composition of pyrrolizidine alkaloids ofSeneciojacobaea[J]. Basic and Applied Ecology, 2004, 5(3): 253-260.
[25] Nalam V J, Keeretaweep J, Sarowar S, et al. Root-derived oxylipins promote green peach aphid performance onArabidopsisfoliage[J]. The Plant Cell, 2012, 24(4): 1643-1653.
[26] Müller-Schärer H, Schaffner U, Steinger T. Evolution in invasive plants: implications for biological control [J]. Trends in Ecology & Evolution, 2004, 19(8): 417-422.
[27] 王毅. 外来入侵植物防御昆虫能力的进化: 以乌桕为例 [D]. 北京: 中国科学院研究生院, 2012.
[28] Orians C M, Ward D. Evolution of plant defenses in nonindigenous environments[J]. Annual Review of Entomology, 2010, 55: 439-459.
[29] Van Der Meijden E. Plant defence, an evolutionary dilemma: contrasting effects of (specialist and generalist) herbivores and natural enemies[J]. Entomologia Experimentalis et Applicata, 1996, 80(1): 307-310.
[30] Huang W, Siemann E, Wheeler G S, et al. Resource allocation to defence and growth are driven by different responses to generalist and specialist herbivory in an invasive plant [J]. Journal of Ecology, 2010, 98(5): 1157-1167.
[31] Fereres A, Moreno A. Behavioural aspects influencing plant virus transmission by homopteran insects[J]. Virus Research, 2009, 141(2): 158-168.
[32] Powell G, Tosh C R, Hardie J. Host plant selection by aphids: behavioral, evolutionary, and applied perspectives[J]. Annual Review of Entomology, 2005, 51(1): 309-330.
[33] Bardgett R D, Cook R, Yeates G W, et al. The influence of nematodes on below-ground processes in grassland ecosystems[J]. Plant and Soil, 1999, 212(1): 23-33.
[34] Forister M L, Dyer L A, Singer M S, et al. Revisiting the evolution of ecological specialization, with emphasis on insect-plant interactions[J]. Ecology, 2012, 93(5): 981-991.
[35] Rzanny M, Voigt W. Complexity of multitrophic interactions in a grassland ecosystem depends on plant species diversity[J]. Journal of Animal Ecology, 2012, 81(3): 614-627.
