刺楸叶总皂苷的酶法提取及其抗氧化活性评价
2018-03-27薛思慧张枫源张晓红
薛思慧,张枫源,向 福,2*,张晓红,项 俊,2
(1.经济林木种质改良与资源综合利用湖北省重点实验室,湖北 黄冈 438000;2.大别山特色资源开发湖北省协同创新中心,湖北 黄冈 438000)
刺楸(Kalopanax septemlobus)为五加科刺楸属落叶、阔叶乔木,植株多刺,是我国珍稀濒危树种[1-2]。刺楸嫩芽、嫩叶可食用,气味清香,营养保健价值高,是一种绿色无污染的木本山野菜[3-4];其根茎皮和花均可入药,用于治疗神经痛、风湿骨痛及跌打损伤等[2,5],集药用食用于一体,是一种极具开发利用价值的野生植物资源。现代研究表明,刺楸功效成分主要是总皂苷,具有抗炎镇痛、抗真菌、抗类风湿等功效活性[2,6-8]。程东岩等[9]发现刺楸叶中总皂苷含量高于树皮,从而建议刺楸叶亦可入药。
目前关于刺楸化学成分结构、药理活性的研究较多[6-8,10],对其茎皮中皂苷成分提取也有报道[11],但其叶中皂苷的提取工艺及抗氧化活性鲜见报道。目前关于药材中皂苷的提取在虽然引入了微波提取[12]、超声提取[13]、超临界流体萃取[14]等新型方法,但实际生产中仍是主要利用乙醇溶液进行渗漉、浸渍、回流、酶解等方法提取[15-16]。其中,酶通过改变中药材细胞壁和细胞间质结构可显著促进皂苷的提取[15,17]。
大别山地区野生刺楸资源丰富,大量的刺楸树叶可供开发利用。本试验以大别山地区的刺楸叶为原材料,采用酶法辅助乙醇提取总皂苷并对其进行抗氧化活性评价,以期为大别山刺楸植物资源的深加工和综合利用提供试验依据。
1 材料与方法
1.1 材料与试剂
刺楸叶:采自大别山国家森林公园,阴干、粉碎备用;无水乙醇、甲醇(均为分析纯):天津市凯通化学试剂有限公司;香兰素、冰乙酸、L(+)-抗坏血酸(分析纯):国药集团化学试剂有限公司;高氯酸(分析纯):天津市鑫源化工有限公司;人参皂苷Re标准品(纯度≥98%,批号20161218)、纤维素酶(酶活≥1 800 U/mg,CAS 9012-54-8):上海金穗生物科技有限公司;羟基自由基试剂盒(批号20170901):南京建成生物工程研究所。
1.2 仪器与设备
FA2104电子分析天平:上海精细天平有限公司;Cary-100紫外可见分光光度计:美国Varian公司;DZKW-D-2电热恒温水浴锅:北京西城区医疗器械厂。
1.3 实验方法
1.3.1 标准曲线及总皂苷提取率测定
根据文献[18]的方法,精确称取人参皂苷Re标准品0.005 0 g,用甲醇溶解并定容至5 mL,作为标准品溶液。分别取标准品溶液0.01mL、0.02mL、0.03mL、0.04mL、0.05mL、0.06 mL、0.07 mL、0.08 mL、0.09 mL、0.10 mL于具塞试管,水浴挥干溶剂后,加入0.20 mL现配的5%香草醛-冰乙酸溶液,0.80 mL高氯酸,60℃条件下水浴15 min,冰水冷却,加入5 mL冰醋酸并摇匀,室温条件下静置20 min。测定波长546 nm处有最大吸收,空白对照为甲醇溶液。以人参皂苷Re的取样质量(C)为横坐标,吸光度值(A)为纵坐标,拟合标准曲线回归方程为:A=5.340 8C-0.030 3,相关系数R2=0.999 3,表明人参皂苷Re取样质量在0.01~0.10 mg范围内与吸光度值呈良好的线性关系。刺楸叶总皂苷提取率计算公式为:
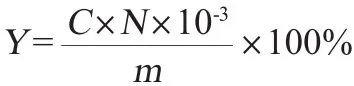
式中:Y为总皂苷提取率,%;C为样品中总皂苷质量,mg;N为稀释倍数;m为刺楸叶的质量,g。
1.3.2 单因素试验
称取5份刺楸叶粉末各3 g置于圆底烧瓶,分别探究乙醇体积分数(50%、60%、70%、80%、90%)、料液比(1∶10、1∶15、1∶20、1∶25、1∶30(g∶mL))、纤维素酶添加量(刺楸叶质量0.4%、0.7%、1.0%、1.3%、1.6%)、酶解温度(40℃、50℃、60℃、70℃、80 ℃)和酶解时间(1 h、2 h、3 h、4 h、5 h)对刺楸叶中总皂苷提取率的影响。
1.3.3 响应面优化试验
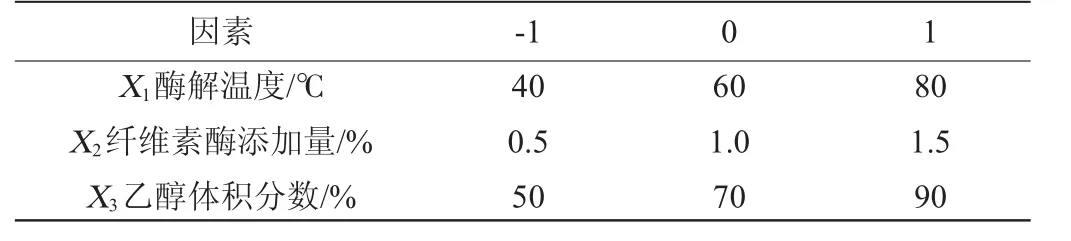
表1 响应面试验因素与水平Table 1 Factors and levels of response surface experiments
为进一步优化提取人参皂苷的工艺条件,在单因素试验基础上,选择对总皂苷提取率影响比较显著的酶解温度(X1)、纤维素酶添加量(X2)和乙醇体积分数(X3)三个因素为自变量,用-1,0,1编码每一个变量的低、中、高试验水平(见表1),以总皂苷提取率(Y)为响应值,利用Box-Behnken方法设计响应面优化试验。
1.3.4 传统水提和醇提工艺制备总皂苷提取液
根据文献[19]中人参叶总皂苷的热水浸提条件,即刺楸叶和水的料液比为1∶16(g∶mL)、在沸腾状态下回流提取时间4.2 h,制得刺楸叶总皂苷的水提液。
按照酶法提取的最佳料液比、提取时间和乙醇体积分数在80℃条件下回流提取,制得刺楸叶总皂苷的醇提液。根据1.3.1节方法计算水提液和醇提液的总皂苷提取率。
1.3.5 抑制羟基自由基能力评价
将刺楸叶总皂苷的酶法提取液、水提液调整到相同浓度,并分别稀释2倍、3倍和4倍,制得系列质量浓度溶液,以相同质量浓度的VC溶液为阳性对照,按照羟基自由基试剂盒的说明书配制相应的溶液,在波长550nm处测定空白管、测定管、标准管、对照管样液的吸光度值。
每1 mL溶液在37℃条件下反应1 min,使反应体系中H2O2浓度降低1 mmol/L定义为一个抑制羟自由基能力单位,U/mL。
抑制羟自由基能力计算公式如下:
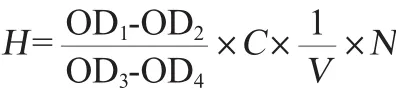
式中:H为抑制羟基自由基能力,U/mL;OD1为对照管吸光度值;OD2为测定管吸光度值;OD3为标准管吸光度值;OD4为空白管吸光度值;C为标准品浓度,8.824mmol/L;V为取样量,本实验中均为0.2 mL;N为样本测试前的稀释倍数,此实验中均为1。
2 结果与分析
2.1 单因素试验结果
2.1.1 乙醇体积分数对总皂苷提取率的影响
称取5份3 g刺楸叶粉末,按料液比1∶15(g∶mL)分别加入体积分数为50%、60%、70%、80%、90%的乙醇溶液,添加刺楸叶质量1%的纤维素酶,在60℃条件下酶解2 h,考察乙醇体积分数对总皂苷提取率的影响,结果见图1。
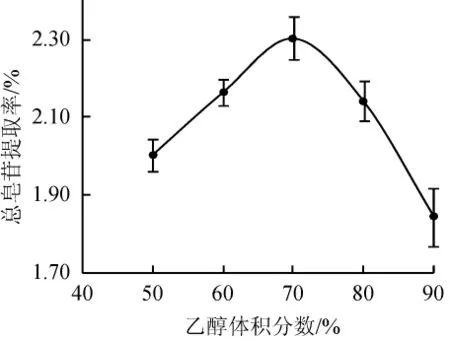
图1 乙醇体积分数对总皂苷提取率的影响Fig.1 Effect of ethanol concentration on the extraction rate of total saponins
由图1可知,当乙醇体积分数<70%时,总皂苷提取率随着乙醇体积分数的增加而升高;乙醇体积分数为70%时,总皂苷提取率达到最高,为2.30%,继续增加乙醇体积分数,总皂苷提取率开始降低。这可能是由于乙醇体积分数较低时,一些亲水性物质(如多糖、果胶、蛋白质等水溶性杂质)会溶出,影响皂苷提取;当乙醇浓度较高时则有亲脂性物质、色素等成分溶出,与皂苷类物质竞争,且乙醇体积分数太大时易形成较大渗透压[20-21],导致皂苷溶解性差,从而使刺楸叶总皂苷的提取率降低。因此乙醇体积分数对总皂苷影响明显,宜选70%。
2.1.2 料液比对总皂苷提取率的影响
称取5份3g刺楸叶粉末,按料液比1∶10、1∶15、1∶20、1∶25、1∶30(g∶mL)分别加入体积分数70%的乙醇溶液,添加刺楸叶质量1%的纤维素酶,在60℃条件下酶解2 h,考察料液比对总皂苷提取率的影响,结果见图2。
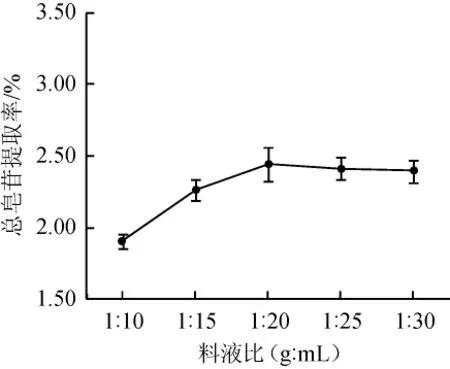
图2 料液比对总皂苷提取率的影响Fig.2 Effect of solid-liquid ratio on the extraction rate of total saponins
由图2可知,随着料液比增大,总皂苷提取率迅速增加,料液比达到1∶20(g∶mL)时,提取率达到最大,为2.44%,继续增加料液比,提取率趋于平稳。可能是由于增大料液比会增加刺楸叶粉末与溶剂的接触,加快了传质,促进皂苷提取,继续增大溶剂量,总皂苷提取率则无明显变化。统计分析发现,当料液比1∶15(g∶mL)和1∶20(g∶mL)时,所得提取率并无显著差异(P=0.085>0.05),考虑到工艺成本,宜选择料液比为1∶15(g∶mL)。
2.1.3 纤维素酶添加量对总皂苷提取率的影响
称取5份3 g刺楸叶粉末,按料液比1∶15(g∶mL)加入体积分数70%的乙醇溶液,分别添加刺楸叶质量0.4%、0.7%、1.0%、1.3%、1.6%的纤维素酶,在60℃条件下酶解2 h,考察纤维素酶添加量对总皂苷提取率的影响,结果见图3。
由图3可知,随着纤维素酶添加量的增加总皂苷提取率也逐渐升高,当酶量达到1.3%时,总皂苷提取率达到峰值,为2.44%,继续增大酶量,总皂苷提取率则明显下降。这是因为纤维素酶达到一定量时,酶分子过于饱和,且由于酶的粘附性,阻碍与底物的结合,导致水解变慢,总皂苷提取率降低[22]。因此,纤维素酶添加量对总皂苷影响明显,选择1.3%为宜。
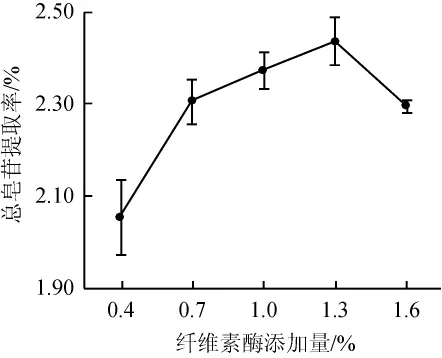
图3 纤维素酶添加量对总皂苷提取率的影响Fig.3 Effect of cellulase addition on the extraction rate of total saponins
2.1.4 酶解温度对总皂苷提取率的影响
称取5份3 g刺楸叶粉末,按料液比1∶15(g∶mL)加入体积分数70%的乙醇溶液,添加刺楸叶质量1%的纤维素酶,分别在40℃、50℃、60℃、70℃、80℃条件下酶解2 h,考察酶解温度对总皂苷提取率的影响,结果见图4。
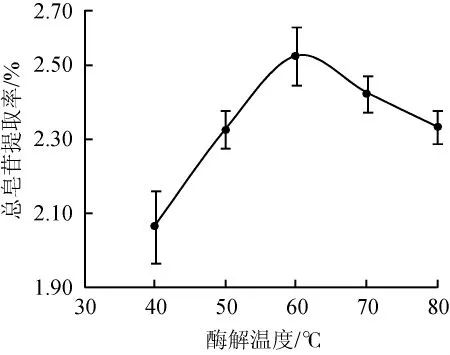
图4 酶解温度对总皂苷提取率的影响Fig.4 Effect of hydrolysis temperature on the extraction rate of total saponins
纤维素酶最适温度为50~70℃[23]。由图4可知,随着温度升高,总皂苷提取率先升后降趋势明显,在60℃时总皂苷提取率最高,为2.52%,继续增加酶解温度,提取率明显降低。因此,酶解温度对总皂苷提取影响明显,宜选60℃。
2.1.5 酶解时间对总皂苷提取率的影响
称取5份3 g刺楸叶粉末,按料液比1∶15(g∶mL)加入体积分数70%的乙醇溶液,添加刺楸叶质量1%的纤维素酶,在60 ℃条件下分别酶解1 h、2 h、3 h、4 h和5 h,考察酶解时间对总皂苷提取率的影响,结果见图5。
由图5可知,当酶解时间从1 h延长至2 h,总皂苷提取率迅速增加到最大,为2.31%,继续延长酶解时间,总皂苷提取率变化较小,且差异不显著(P>0.05)。这可能是由于2 h时,刺楸叶的细胞壁已酶解充分,继续增加酶解时间对总皂苷提取率无明显影响。因此,酶解时间宜选2 h。
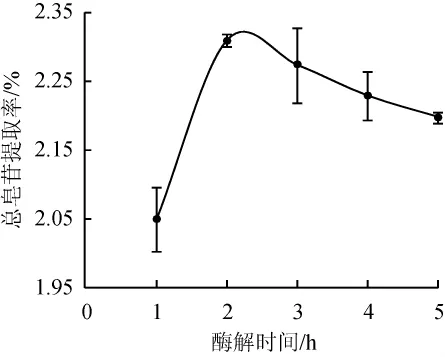
图5 酶解时间对总皂苷提取率的影响Fig.5 Effect of hydrolysis time on the extraction rate of total saponins
2.2 响应面试验结果
固定酶解时间、料液比分别为2 h和1∶15(g∶mL),以单因素试验中对总皂苷影响明显的酶解温度(X1)、纤维素酶添加量(X2)和乙醇体积分数(X3)3个因素为自变量,皂苷提取率(Y)为因变量,设计Box-Behnken法响应面优化试验方案及结果如表2所示。采用Design Expert 8.0.6软件对表2数据进行多元回归拟合,模型及方差分析结果见表3,所得二元回归方程为:
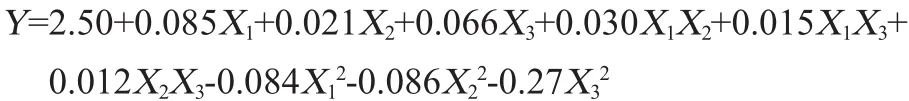
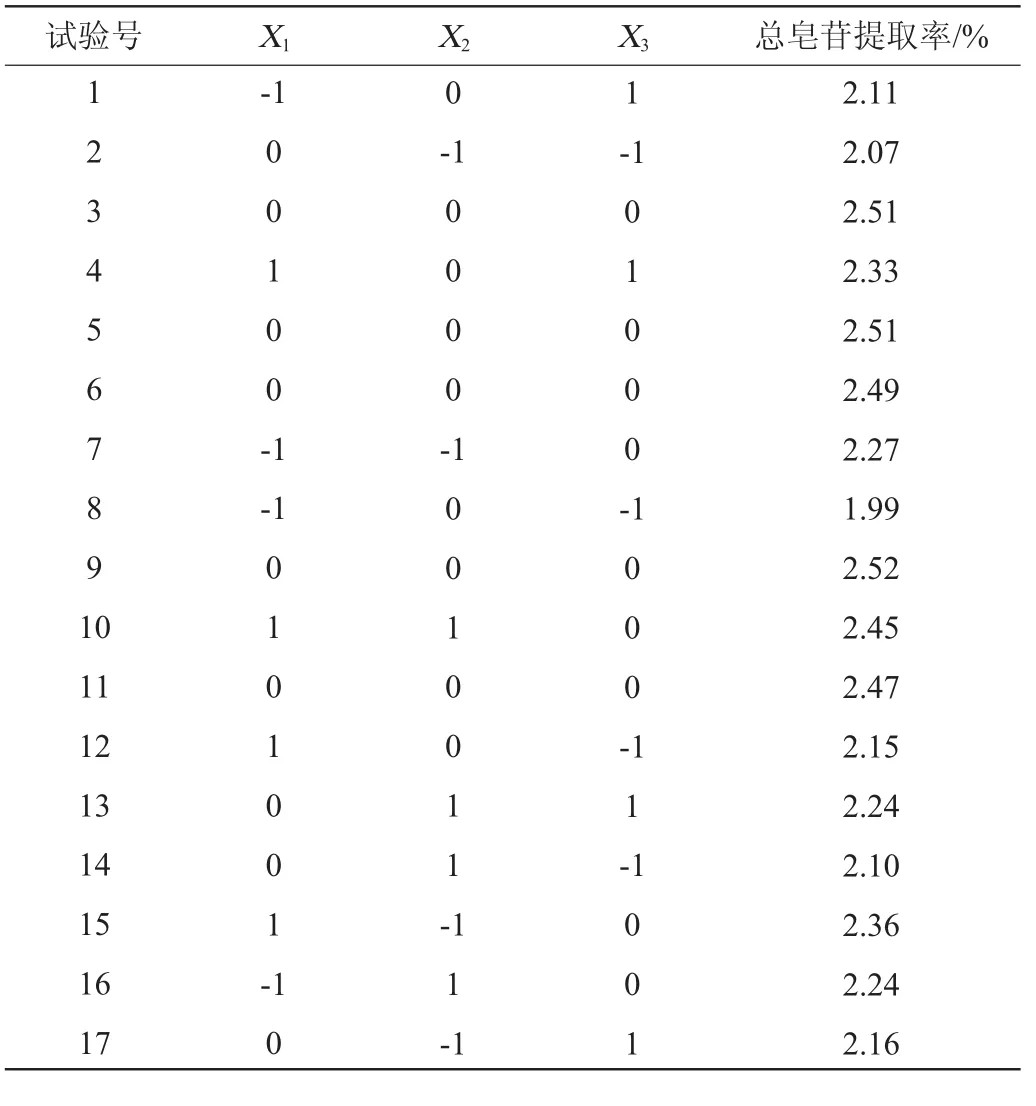
表2 响应面试验设计及结果Table 2 Design and results of response surface experiments
根据表3方差分析结果,二元回归拟合失拟项不显著(P=0.356 6>0.05),模型则极显著(P<0.000 1),表明预测模型对试验数据的拟合程度高。校正拟合度0.984 9和预测拟合度0.940 1一致,模型信噪比为29.389>4,变异系数为0.95%,表明回归模型可信度高、相关性好,操作稳定性良好,可用于预测。由表3中F(X1)=121.68>F(X3)=73.92>F(X2)=7.61可知,各因素对刺楸叶总皂苷提取率的影响为:酶解温度>乙醇体积分数>纤维素酶添加量;同时,X1X3和X2X3对总皂苷提取率无显著作用(P>0.05),X2、X1X2对总皂苷提取率的作用显著(P<0.05),而X1、X3、X12、X22和X32对总皂苷提取率的作用极显著(P<0.000 1),说明酶解温度、乙醇体积分数和纤维素酶添加量与总皂苷提取率间不是简单的线性关系,尽管各因子间交互作用对总皂苷提取率影响较小,但其二次项影响则及其显著。相关系数R2=0.993 4表明该回归拟合模型能解释99.34%的因变量变化,即只有约0.66%能影响总皂苷提取率的作用变量未纳入该预测模型。因此,该二元回归拟合方程能用于刺楸叶总皂苷提取工艺过程的预测。
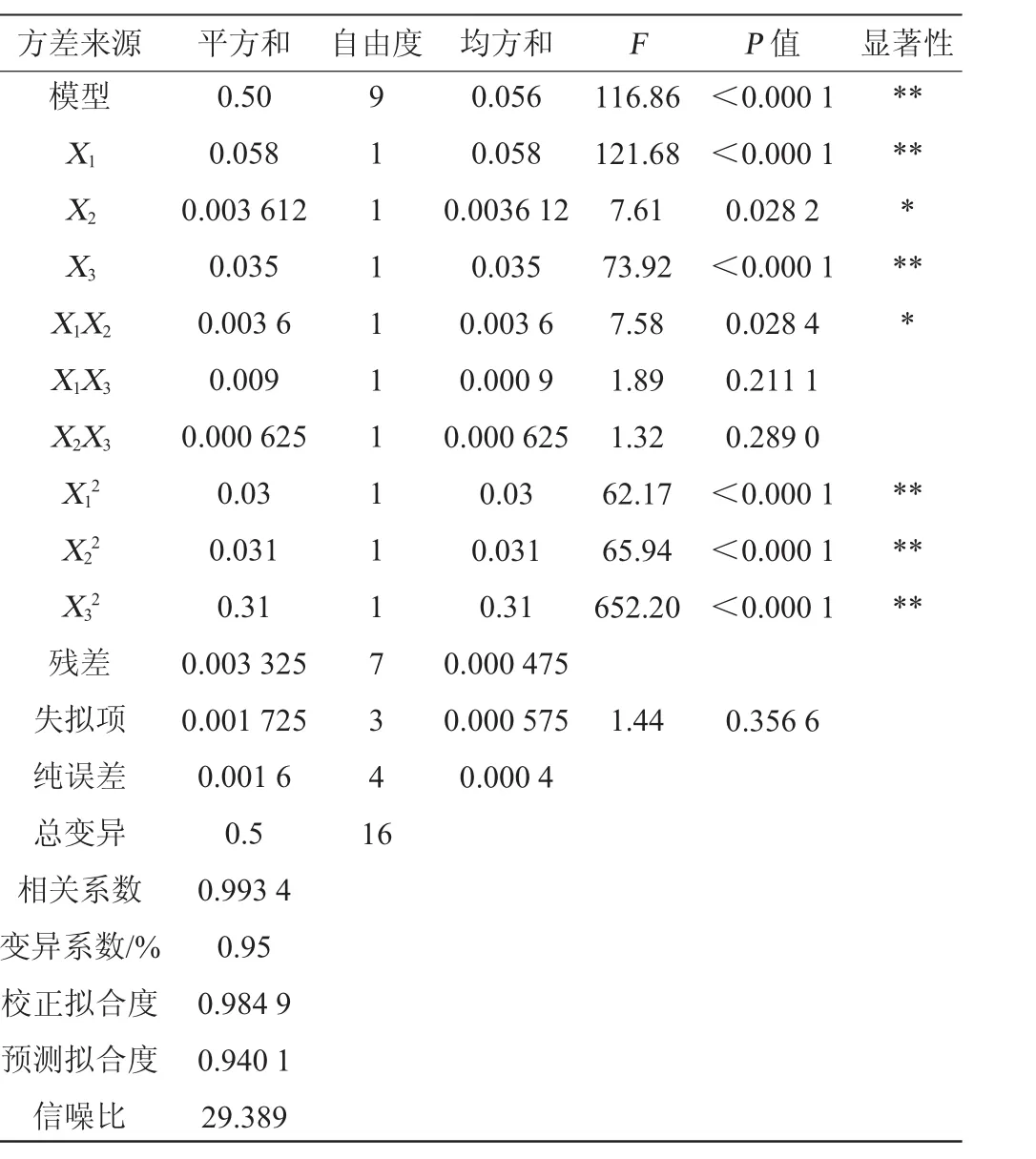
表3 回归模型方差分析Table 3 Variance analysis of regression model
二元回归多项式的响应面结果见图6,其中响应面和等高线形状可直观反映各因素的影响程度、交互作用及模型的极值情况。图6中酶解温度和乙醇体积分数、纤维素酶添加量和乙醇体积分数的等高线图中心区域均成椭圆形,交互作用明显;酶解温度与纤维素酶添加量的等高线图中心部分成圆形,交互作用不明显。此外,乙醇体积分数、酶解温度、纤维素酶添加量3个因素与总皂苷提取率的响应面均构成开口向下的凸面,表明在试验点连续区域内存在最大值。用Design Expert 8.0.6软件自动求解总皂苷最佳提取工艺为:酶解温度71.27℃、乙醇体积分数72.88%、纤维素酶添加量1.11%,提取率理论预测值为2.53%。
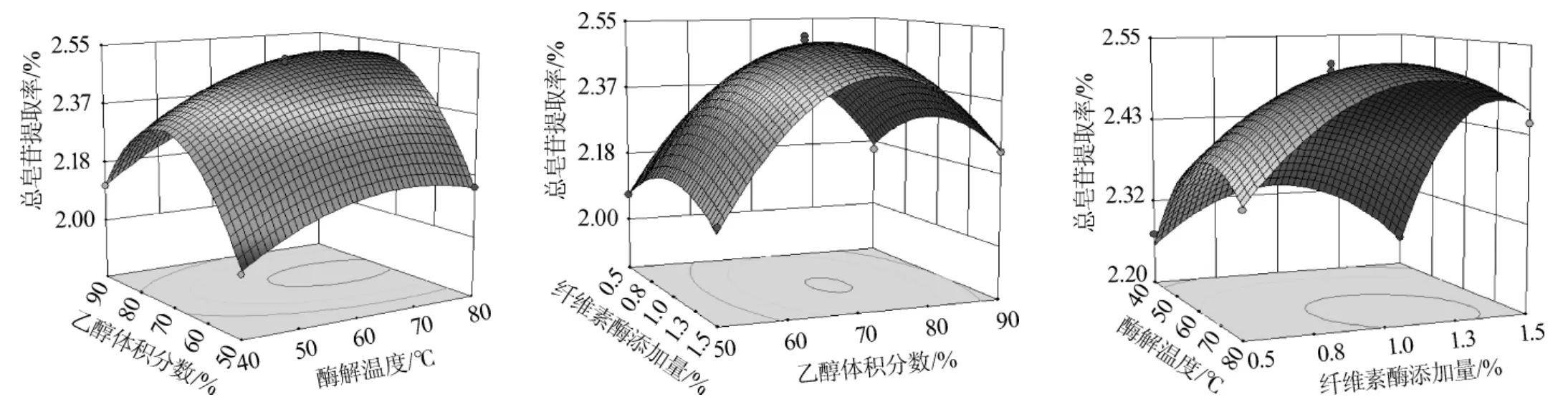
图6 乙醇体积分数、酶解温度和纤维素酶添加量交互作用对总皂苷提取率影响的响应面及等高线Fig.6 Response surface plots and contour line of effects of interaction between ethanol concentration,hydrolysis temperature and cellulase addition on extraction rate of total saponins
2.3 响应面验证试验
为方便实际操作,将最佳工艺条件修正为:酶解温度71℃、乙醇体积分数73%和纤维素酶添加量1.1%,其他提取条件为酶解时间2 h,料液比1∶15(g∶mL)。在此条件下,进行3次验证试验,实测总皂苷平均提取率为(2.52±0.06)%,与理论预测值2.53%吻合一致,表明拟合的二元多项式模型对刺楸叶中总皂苷的酶法提取工艺具有指导和预测作用。
本文利用传统水提法、醇提法得到刺楸叶总皂苷提取率分别为(1.25±0.02)%和(1.65±0.09)%,只有酶法提取工艺的49.60%和65.48%,且其费时更长、提取温度更高,因此酶法提取优势明显,更适合工业化生产。
2.4 羟自由基抑制能力评价
为比较酶法和水提法所得刺楸叶总皂苷的抗氧化活性,将两种溶液调整总皂苷质量浓度为0.37 g/L,并分别稀释2倍、3倍和4倍后制得0.19 g/L、0.13 g/L、0.09 g/L系列质量浓度的溶液,以相同质量浓度的VC标品液为阳性对照,测得羟基自由基抑制能力如图7所示。

图7 刺楸叶总皂苷和VC的羟自由基抑制能力比较Fig.7 Comparison of scavenging hydroxyl radical activities of VC and total saponins fromK.septemlobusleaves
羟自由基抑制能力是衡量抗氧化能力的重要指标。图7中各质量浓度下,总皂苷水提液和酶提液的羟自由基抑制能力均明显高于VC,其中水提液的羟自由基抑制能力均较强,酶提液和VC的羟自由基抑制能力均随着质量浓度升高而明显增强,到0.37 g/L时达到最高,此时水提液和酶提液的羟自由基抑制能力无显著差异(P=0.103>0.05),是VC标品液的1.79倍,表现出较强的羟自由基抑制能力。这是由于水提法有利于刺楸叶中苯丙烷类、酚酸以及多糖等水溶性抗氧化物质的析出,使得水提液在较低质量浓度0.09g/L时具有较强的羟自由基抑制能力,分别是酶提液和VC标品液的1.40倍和6.21倍;质量浓度增加至0.37 g/L时,总皂苷起主要作用,其他亲水性抗氧化物质的影响较小,导致酶提液与水提液的羟自由基抑制能力一致。
3 结论
针对大别山野生刺楸资源,本研究建立了刺楸叶总皂苷的酶法提取工艺,并利用响应面法获得最佳提取工艺条件为:酶解温度71℃,纤维素酶添加量1.1%,乙醇体积分数73%,料液比1∶15(g∶mL),酶解时间2 h。该条件下刺楸叶总皂苷提取率为2.52%,是传统醇提和水提工艺提取率的1.5倍和2倍,且费时更少、温度更低,适合产业化加工;所得酶提液的羟自由基抑制能力是相同质量浓度VC的1.78~4.45倍,且在质量浓度0.37 g/L时与水提液的羟自由基抑制能力无显著差异,具有较强的抗氧化活性,从而为大别山刺楸植物资源的综合利用提供了试验依据。
[1]杜 悦.濒危植物刺楸研究现状及保育对策[J].黑龙江农业科学,2013(9):138-141.
[2]贾 夏,朱 玮,张 檀,等.我国刺楸属植物资源与综合利用研究[J].西北林学院学报,2004,19(4):142-145.
[3]刘广平.刺楸营养成分分析[J].东北林业大学学报,1998(3):65-67.
[4]兑宝峰.用途广泛的刺楸[J].湖南林业,2006(10):18.
[5]南京中医药大学.中药大辞典[M].上海:上海科学技术出版社,2006:1848-1849.
[6]CHOI J,HUH K,KIM S H,et al.Antinociceptive and anti-rheumatoidal effects ofKalopanax pictusextract and its saponin components in experimental animals[J].J Ethnopharmacol,2002,79(2):199-204.
[7]KIM Y K,KIM R G,PARK S J,et al.In vitroantiinflammatory activity of kalopanaxsaponin A isolated fromKalopanax pictusin murine macrophageRAW264.7cells[J].Biol Pharm Bull,2002,25(4):472-476.
[8]LEE E B,DA W L,JIN E H,et al.Anti-inflammatory activity of methanol extract ofKalopanax pictusbark and its fractions[J].J Ethnopharmacol,2001,77(2):197-201.
[9]程东岩,王隶书,王海生,等.刺楸不同产地和不同药用部位中总皂苷的含量测定[J].时珍国医国药,2010,21(10):2494-2495.
[10]朱 玮,贾 夏,张鞍灵,等.刺楸属植物化学成分及生物活性研究进展[J].西北林学院学报,2004,19(3):119-124.
[11]杨 月,杨新平,刘笑甫,等.广西刺楸茎皮中主皂苷成分提取工艺研究[J].中药材,2009,32(9):1457-1459.
[12]王慧竹,陈 帅,朱 岩,等.纤维素酶-微波辅助法提取金樱子总皂苷的工艺研究[J].中国酿造,2016,35(3):84-88.
[13]马 超,贺 翠,王燕芳,等.响应曲面法优化昆仑雪菊皂苷提取[J].中国酿造,2013,32(9):109-112.
[14]蒙 英,赵旭壮,李明元.超临界CO2萃取黄芪皂苷的工艺研究[J].食品与发酵科技,2011,47(4):42-44.
[15]郭晓宇,陈建平,汤化琪,等.中药材皂苷提取方法与工艺研究[J].内蒙古医科大学学报,2013,35(S1):116-119.
[16]张丽华,孙 婷,王昌利,等.大孔树脂法纯化陕产重楼总皂苷工艺研究[J].中国酿造,2014,33(3):100-103.
[17]魏凤玉,方 春.酶法提取无患子皂苷的工艺研究[J].应用化工,2010,39(8):1149-1151.
[18]李 健,张令文,刘 宁,等.苦瓜总皂苷提取工艺的研究[J].食品工业科技,2005,26(10):117-119.
[19]程 晶,雷建都,刘 静,等.响应面法优化人参叶总皂苷提取工艺的研究[J].北京林业大学学报,2015,37(2):142-147.
[20]陈 瑶,吴龙月,向 福,等.泥蒿叶总黄酮的酶法提取及其抗氧化活性评价[J].中国酿造,2017,36(6):142-146.
[21]吴祥庭,朱 涛,郑巧敏,等.响应面法优化山药皮中皂苷提取的研究[J].中国粮油学报,2011,26(6):91-96.
[22]施 政,王建平,章建军,等.响应面法优化穿山龙总皂苷提取工艺[J].中国现代应用药学,2017,34(1):68-71.
[23]邓天福,杜开书,李广领.纤维素酶及其在酿造业中的应用[J].中国酿造,2011,30(12):17-19.
