酪酸菌MYS66发酵条件研究
2018-03-27李忠玲张红艳岳淑宁
李忠玲,张红艳,傅 博,岳淑宁*
(1.陕西省生物农业研究所,陕西 西安 710043;2.陕西省酶工程技术研究中心,陕西 西安 710043;3.中国科学院 西北生物农业中心,陕西 西安 710043)
酪酸菌即丁酸梭菌(Clostridium butyricum),存在于土壤、污泥、人和动物肠道以及干酪和自然发酵的酸奶、酒曲和窖泥中[1]。丁酸梭菌作为一种目前正被逐步广泛使用的益生菌,已被许多研究证明能促进动物生长、促进乳酸菌等其它有益菌群的增殖、产生B族维生素、维生素K、丁酸等物质,并能在肠粘膜表面形成微生物屏障,阻止有害菌的定植和入侵,有效地改善肠道内微生态环境,调节肠道菌群微生态平衡,对宿主产生各种健康作用[2-3]。丁酸梭菌也能对一些肠道炎症有治疗效果,HAYASHI A等[4]研究发现,丁酸梭菌诱使肠道巨噬细胞增殖以抑制结肠炎。KANAI T等[5]运用待测序技术等手段表明,丁酸梭菌可作为益生菌诱发骨髓分化巨噬细胞在炎症黏膜上通过Ⅱ型toll样受体来抑制炎症。除了能调节机体肠道菌落平衡,提高免疫力外,也有报道称酪酸菌对肝脏损伤有治疗和预防的效果[6],而且还有研究表明酪酸菌对治疗癌症也有一定功效[7-8]。酪酸菌具有耐高温、耐高压、耐胃酸及耐胆盐等生物学特性,并在畜禽生产中应用效果明显。作为绿色新型活菌制剂,丁酸梭菌有着十分广泛的研究前景。同时,有研究表明,酪酸菌还可用于制备丁酸、1,3-丙二醇[9-10]、酶制剂[11]等,随着相关研究的深入,酪酸菌必将越来越多的造福人类。目前对于酪酸菌的进一步推广应用,一方面需要更细化更系统地研究阐明其具体作用机制,另一方面则是其发酵工艺的优化。酪酸菌的相关报道中多以葡萄糖为碳源[12-14],成本较高,本研究以玉米淀粉糖化液为碳源,对酪酸菌MYS66的发酵条件进行研究,为该菌工业生产提供基础数据;并且研究了常用抗生素对该菌存活率影响,为其进一步的应用提供技术支持。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
酪酸菌(Clostridium butyricum)MYS66:初始菌种购自中国科学院微生物研究所,经陕西省生物农业研究所诱变筛选并编号保存。
1.1.2 培养基
种子培养基:蛋白胨5.0 g/L,胰蛋白胨5.0 g/L,酵母膏10.0 g/L,葡萄糖10.0 g/L,K2HPO40.5 g/L,KH2PO40.5 g/L,NaCl 0.5 g/L,pH 7.0。115℃灭菌20 min。
基础发酵培养基:玉米粉20 g/L(制成糖化液),豆粕粉10 g/L,蛋白胨10 g/L,酵母膏6 g/L,K2HPO4·3H2O 0.5g/L,KH2PO40.5g/L,NaCl 0.5g/L,pH 7.0。115℃灭菌20 min。
计数培养基:蛋白胨5.0 g/L,胰蛋白胨5.0 g/L,酵母膏10.0 g/L,葡萄糖10.0 g/L,K2HPO4·3H2O 0.5 g/L,KH2PO40.5 g/L,NaCl 0.5 g/L,pH 7.0。115 ℃灭菌20 min。
1.1.3 试剂
K2HPO4·3H2O、KH2PO4(分析纯):广西汕头市西陇化工厂;MgSO4·7H2O、MnSO4·H2O、NaHCO3、CaCl2、NaCl(均为分析纯):西安化学试剂厂;胰蛋白胨、蛋白胨和酵母膏(均为生化试剂):北京澳博星生物技术有限责任公司;硫酸粘杆菌素B:河南普华动物药业有限公司;杆菌肽:美国Sigma公司;莫能霉素钠、盐酸林可霉素、新霉素硫酸盐、磺胺嘧啶:上海源叶生物科技有限公司;酒石酸泰乐菌素:徐州金牌药业有限公司;液化酶、糖化酶:宁夏夏盛实业集团有限公司;玉米粉、豆粕粉均为市售。
1.2 仪器与设备
DV-650型桌上式(垂直送风)净化工作台:苏州博莱尔净化设备有限公司;PYX-DHS-35X40-BS-Ⅱ隔水式电热恒温培养箱:上海跃进医疗器械厂;YX280蒸汽灭菌锅:上海三中医疗器械有限公司;HH-W21-600-S电热恒温水温箱:上海医疗器械七厂;PHS-3C型酸度计:上海雷磁仪器厂。
1.3 方法
1.3.1 种子活化
取-20℃甘油管保藏的菌种,以1%接种于装有10 mL种子培养基的厌氧管中,37℃条件下静态厌氧活化20 h。
1.3.2 种子培养
将活化的种子液以5%的接种量接入装有100 mL种子培养基的250mL厌氧瓶中。置培养箱中,37℃静置培养20h。
1.3.3 玉米粉糖化液的制备
玉米粉20 g/L,添加0.5 mg/g原料的CaCl2,在80~85 ℃条件下添加10 U/g原料的液化酶,保温至液化结束,液化终点用稀碘液检测,稀碘液不变蓝;将液化液升温95~100℃保温10 min进行灭酶,之后,降温至55~60℃,调pH 4.5,添加300 U/g原料的糖化酶,保温2 h。
1.3.4 培养方法
将生长好的种子液以5%的接种量接入装有100 mL发酵培养基的250 mL厌氧瓶中。置于培养箱中,静置培养。
1.3.5 菌体浓度测定
采用平板活菌计数法:取培养结束的发酵液按10倍稀释法稀释成不同浓度稀释液,分别吸取3种合适的稀释液各0.1mL置于事先融化并冷却至50℃左右的牛肉膏、蛋白胨倒好的固体肉汤平板上,用无菌涂布棒涂均匀,每一个稀释度涂3个平皿,涂完后倒置厌氧罐中37℃培养48h进行菌落计数。
1.3.6 芽孢计数方法
菌液于80℃,10 min热处理杀灭营养体后,采用上述活菌计数法进行活菌计数,计算芽孢浓度,并以芽孢数与菌体浓度的比记为芽孢率。
1.3.7 发酵条件优化
以菌体浓度为评价指标,考察不同水平温度、初始pH、接种量、无机盐添加量对菌体浓度的影响,确定发酵参数。
1.3.8 抗生素添加方法
将相应抗生素按不同浓度过滤除菌后混入降温至50℃的计数培养基,同时以不加抗生素的培养基做空白对照。
2 结果与分析
2.1 生长曲线
将液体菌种按5%的接种量接于发酵培养基中,37℃条件下静置培养32 h,定时取样进行活菌计数,绘制生长曲线,结果见图1。由图1可知,该菌株在8 h达到生长对数期,18 h达到稳定期。
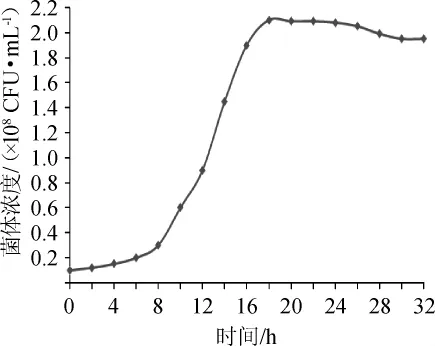
图1 酪酸菌MYS66的生长曲线Fig.1 Growth curve ofClostridium butyricumMYS66
2.2 培养温度对发酵的影响
温度通过影响蛋白质、核酸等生物大分子的结构与功能以及细胞膜的流动性及完整性来影响微生物的生长、繁殖和新陈代谢。过高的温度会导致蛋白质或核酸的变性失活,过低的温度会抑制酶活性,降低细胞的新陈代谢活动。分别在33℃、34℃、35℃、36℃、37℃、38℃、39℃和40℃条件下培养20h,观察培养温度对酪酸菌MYS66菌体浓度的影响,结果见图2。由图2可知,在温度低于37℃时随着温度的升高菌体浓度有一定的增长,在37℃达到最大值,之后随着温度的提高菌体浓度呈下降趋势。因此,确定酪酸菌MYS66的最适培养温度为37℃。
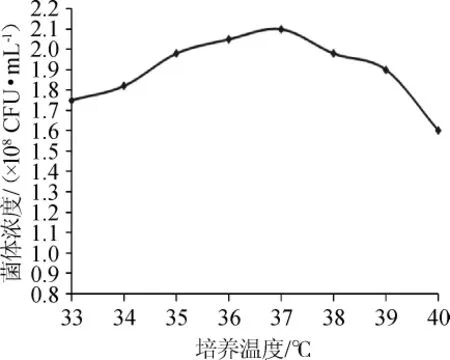
图2 培养温度对酪酸菌MYS66生长的影响Fig.2 Effect of culture temperature on the growth of Clostridium butyricumMYS66
2.3 初始pH值对酪酸菌MYS66生长的影响
pH可通过影响蛋白质等生物大分子所带电荷的变化引起细胞膜电荷变化,导致微生物细胞吸收营养物质能力改变,因此培养基的pH对微生物的生长有重要影响。试验将初始pH设为6.0、6.2、6.4、6.6、6.8、7.0、7.2、7.4、7.6、7.8和8.0,37℃条件下静置培养20 h,进行活菌计数,考察pH对菌株MYS66生长的影响,结果见图3。由图3可知,菌体浓度随着初始pH的升高有一定的增长,在初始pH为7.2时达到最大,之后随着初始pH的升高呈下降趋势,因此,确定酪酸菌MYS66的最适初始pH为7.2。在整体变化趋势上,初始pH在7.0~7.6比较平稳,说明此区间是该菌的耐受范围,在此区间之外菌体浓度下降趋势明显。
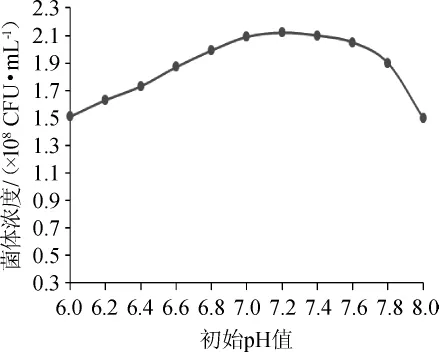
图3 初始pH对酪酸菌MYS66生长的影响Fig.3 Effect of initial pH on the growth ofClostridium butyricum MYS66
2.4 接种量对酪酸菌MYS66生长的影响
接种量的大小决定生产菌种在发酵罐中生长繁殖的速度,采用较大的接种量可以缩短延滞期,减少杂菌的生长机会。但接种量过大会因前期营养消耗过快而使最终菌体浓度降低,同时,接种量过大会移入过多代谢废物,也不经济;相反,接种量过小会延长培养时间,降低发酵的生产效率。试验分别采用2%、3%、4%、5%、6%、7%、8%、9%和10%的接种量,37℃静置培养20 h,进行活菌计数,结果见图4。由图4可知,菌体浓度随着接种量的增大而增加,在接种量为4%时达到最大值,之后随着接种量的增大菌体浓度呈下降趋势。因此,确定酪酸菌MYS66的最适接种量为4%。
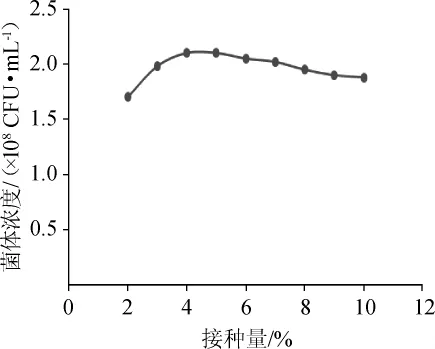
图4 接种量对酪酸菌MYS66生长的影响Fig.4 Effect of inoculum on the growth ofClostridium butyricum MYS66
2.5 无机盐对生长的影响
某些金属离子可促进菌体生长(如K+、Ca2+和Mg2+等);也有报道称添加适量CO32-可缓冲酸度变化,并且释放出的CO2有助于芽孢生成[15]。该试验主要研究了K2HPO4·3H2O、KH2PO4、MgSO4·7H2O、MnSO4·H2O、NaHCO3、CaCl2和NaCl添加量对发酵的影响,各无机盐单因素试验设计见表1。培养条件为初始pH7.2,37℃静置培养20h,进行活菌计数。试验结果见图5。
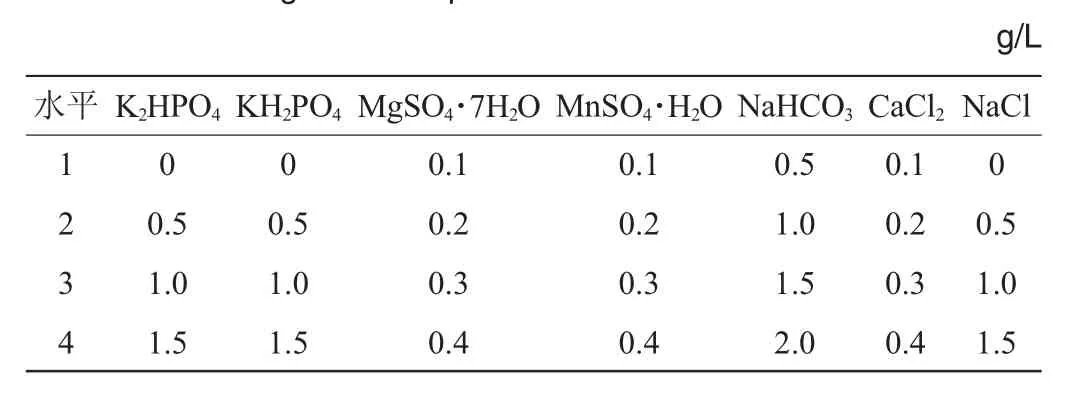
表1 无机盐优化单因素试验因素与水平Table 1 Factors and levels of single factor experiments for inorganic salt optimization
由表1和图5可知,各无机盐最佳添加量分别为:KH2PO41.0g/L,K2HPO4·3H2O1.0g/L,MgSO4·7H2O0.2g/L,MnSO4·H2O 0.2 g/L,NaHCO31.0 g/L,CaCl20.2 g/L,NaCl 1.0 g/L。
经过以上试验,得到了最佳培养条件和各无机盐单因素最佳添加量,并以此条件进行发酵试验,即将培养基组成优化为玉米粉20 g/L(制成糖化液),豆粕粉10 g/L,蛋白胨10 g/L,酵母膏6 g/L,K2HPO4·3H2O 1.0 g/L,KH2PO41.0 g/L,MgSO4·7H2O 0.2 g/L,MnSO4·H2O 0.2 g/L,NaHCO31.0g/L,CaCl20.2g/L,NaCl1.0g/L,在pH7.2,接种量4%,37℃的条件下静置培养20h,此时菌体浓度达到2.66×108CFU/mL。
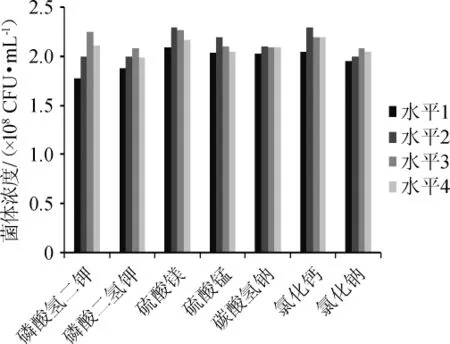
图5 无机盐对酪酸菌MYS66生长的影响Fig.5 Effect of inorganic salt on the growth ofClostridium butyricum MYS66
2.6 50 L发酵罐发酵
以优化的条件进行50 L发酵罐发酵试验,即50 L发酵罐,优化后的培养基装料量35 L,接种量4%,37℃静置发酵32 h,测菌体浓度,芽孢浓度,计算芽孢率,结果见图6。经50L发酵罐发酵,在发酵32h,菌体浓度为2.64×108CFU/mL,芽孢浓度达到2.49×108CFU/mL,芽孢率达到94.3%。
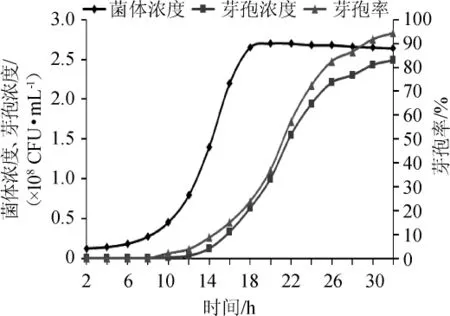
图6 酪酸菌MYS66在50 L发酵罐中的生长情况Fig.6 Growth ofClostridium butyricumMYS66 in 50 L fermenter
2.7 几种常用抗生素对酪酸菌存活率的影响
大量试验证明,将益生素分别与抗生素、寡糖、酸化剂、中草药、肽等合理配伍表现出了理想的使用效果[16]。在生产中因动物防病和治病的需要可能会使用某些抗生素类药物,这些药物也许会对饲用益生菌酪酸菌MYS66的生长产生影响,因此研究常用抗生素对该菌的影响非常必要,希望对其在养殖业中的应用有所帮助。主要研究了硫酸粘杆菌素B、杆菌肽、莫能霉素钠、盐酸林可霉素、新霉素硫酸盐、磺胺嘧啶、酒石酸泰乐菌素8种抗生素对酪酸菌MYS66存活率的影响,结果见图7。
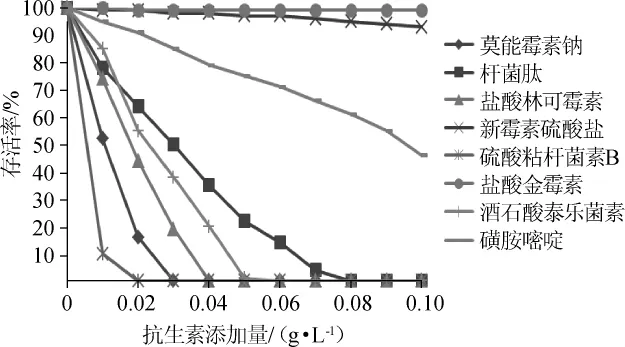
图7 几种常用抗生素对酪酸菌MYS66存活率的影响Fig.7 Effects of several common antibiotics on the survival rate of Clostridium butyricumMYS66
由图7可知,各抗生素对酪酸菌存活率的影响由低到高的顺序为硫酸粘杆菌素B<莫能霉素钠<盐酸林可霉素<酒石酸泰乐菌素<杆菌肽<磺胺嘧啶<新霉素硫酸盐<盐酸金霉素。
3 结论
通过对酪酸菌发酵条件的研究,得到了最佳发酵培养基组成为玉米粉20 g/L(制成糖化液),豆粕粉10 g/L,蛋白胨10g/L,酵母膏6g/L,K2HPO4·3H2O1.0g/L,KH2PO41.0g/L,MgSO4·7H2O 0.2 g/L,MnSO4·H2O 0.2 g/L,NaHCO31.0 g/L,CaCl20.2 g/L,NaCl 1.0 g/L;确定最佳发酵条件为初始pH 7.2,培养温度37.0℃,接种量4%。经50L发酵罐发酵32h时,菌体浓度为2.64×108CFU/mL,芽孢浓度为2.49×108CFU/mL,芽孢率达到94.3%。通过常用抗生素对该菌存活率影响的研究,结果表明:各抗生素对酪酸菌存活率影响由低到高的顺序为硫酸粘杆菌素B<莫能霉素钠<盐酸林可霉素<酒石酸泰乐菌素<杆菌肽<磺胺嘧啶<新霉素硫酸盐<盐酸金霉素。以上研究结果为酪酸菌MYS66进一步生产及应用提供了基础数据。
[1]夏会丽,陈思思,陈 雄,等.丁酸梭菌的鉴定与发酵培养基配方优化[J].食品科学,2017,38(8):56-62.
[2]陈旻远,贾聪慧,洪奇华,等.丁酸梭菌对动物肠道生态的影响及作用机制[J].饲料研究,2016(6):5-8.
[3]李贤宇,张 蕊,周 博.酪酸菌培养条件的优化[J].天津化工,2010,24(1):22-24.
[4]HAYASHI A,SATO T,KAMADA N,et al.A single strain ofClostridium butyricuminduces intestinal IL-10-producing macrophages to suppress acute experimental colitis in mice[J].Cell Host Microbe,2013,13(6):711-722.
[5]KANAI T,MIKAMI Y,HAYASHI A.A breakthrough in probiotics:Clostridium butyricumregulates gut homeostasis and anti-inflammatory response in inflammatorybowel disease[J].J Gastroenterol,2015,50(9):928-939.
[6]田口信洋.具有预防及治疗肝脏损害功能的丁酸梭菌,以及由其培养物制成的肝保护剂、食品和饲料CN1246144[P].2000-03-01.
[7]吕建平,徐秀丽,付孟莉.酪酸梭菌的药理作用及临床应用[J].临床合理用药杂志,2010,3(20):159-160.
[8]MASAHIDE S,MANO H,TAKASHI Y,et al.Clostridium butyricum MIYAIRI 588 shows antitumor effects by enhancing the release of TRAIL from neutrophils through MMP-8[J].Int J Oncol,2013,42(3):903-911.
[9]CHATZIFRAGKOU A AGGELIS G,KOMAITIS M,et al.Impact of anaerobiosis strategy and bioreactor geometry on the biochemical response ofClostridium butyricumVPI 1718 during 1,3-propanediol fermentation[J].Bioresource Technol,2011,102(22):10625-10632.
[10]PAPANIKOLAOU S,FICK M,AGGELIS G.The effect of raw glycerol concentration on the production of 1,3-propanediol byClostridium butyricum[J].J Chem Technol Biot,2004,79(11):1189-1196.
[11]姜芳芳,李圣杰,丁 轲,等.丁酸梭菌C.L24蛋白酶产酶条件的优化[J].家畜生态学报,2016,37(1):63-67.
[12]余国莲,杜云平,梁健良,等.丁酸梭菌培养条件优化[J].食品工业,2013(5):31-32.
[13]刘 寅,和晶亮,毛多斌,等.嗜热丁酸梭菌厌氧丁酸发酵条件的优化研究[J].食品工业,2013,34(6):50-53.
[14]江 丹.丁酸梭菌的培养基优化及发醇甘薦渣和小桐子果壳产氯气的研究[D].北京:中国科学技术大学,2016.
[15]陈秋红,孙 梅,施大林,等.益生菌酪酸菌CB-7发酵培养基及培养条件的研究[J].饲料研究,2009(4):7-10.
[16]乔家运,王志祥,李海花,等.益生素与几种饲料添加剂的配伍在养殖业中的应用[J].兽药与饲料添加剂,2005(1):15-17.
