雨生红球藻ZL-1生长和虾青素积累条件优化
2018-03-26李艳国杨柳徐年军孙雪张琳
李艳国, 杨柳, 徐年军, 孙雪, 张琳
雨生红球藻ZL-1生长和虾青素积累条件优化
李艳国, 杨柳, 徐年军, 孙雪, 张琳*
宁波大学海洋学院, 浙江省海洋生物工程重点实验室, 宁波 15211
分离鉴定了一株雨生红球藻ZL-1, 比较了不同接种密度和吲哚乙酸浓度对其生长的影响; 在此基础上, 探究了不同浓度水杨酸和盐度对雨生红球藻虾青素积累的影响。结果表明: (1)接种密度为2.00×104cell·mL–1时, 雨生红球藻生长快速, 最终生物量达到最大值0.43 g·L–1; 不动细胞比游动细胞更快的积累虾青素, 高光诱导不动细胞得到最高虾青素产量为8.44 mg·L–1; IAA终浓度为1.5 mg·L–1时, 雨生红球藻生长速度最快, 最终细胞密度和干重分别比对照组提高了24.28%和27.11%; (2)水杨酸具有缓解高光胁迫和促进虾青素积累的双重作用, 15和25 mg·L–1水杨酸诱导下, 雨生红球藻生物量较高, 虾青素产量分别比对照组提高了18.18%和18.94%; 使用4‰的盐度胁迫雨生红球藻, 虾青素产量较对照组提高了17.42%, 但盐度也会引起藻细胞的漂白、死亡, 导致生物量显著降低。
雨生红球藻; 接种密度; IAA; 水杨酸; 盐度; 虾青素
1 前言
虾青素(Astaxanthin)属于类胡萝卜素类物质, 它不仅是抗氧化活性最高的天然产物, 还是优良的天然着色剂[1]。虾青素在医药、食品保健、化妆品等行业已得到广泛应用; 亦用作观赏鱼、虾等经济水产动物的饲料添加剂[2-3]。雨生红球藻()是一种淡水单细胞绿藻, 因富含虾青素而被称为天然虾青素的“浓缩品”, 是天然虾青素最理想的来源之一[4]。雨生红球藻生产虾青素多采用两步培养法:首先优化培养条件以获得较高的生物量; 然后利用高光等胁迫条件, 诱导虾青素快速积累。
接种密度是影响微藻增殖速率和最终生物量的重要因素[5-6], 确定合适的接种密度是养殖雨生红球藻的基础。吲哚乙酸(IAA)分布广泛, 具有促进细胞分裂、增殖等作用[7]。研究表明, 适宜浓度IAA能促进藻类细胞增殖, 影响其生化组成[8, 9]。据报道, 水杨酸参与雨生红球藻虾青素合成的信号调控, 适宜浓度水杨酸可提高雨生红球藻类胡萝卜素基因的表达量[10], 增加其抗氧化活性和虾青素的积累量[10, 11]。盐度胁迫也可诱导雨生红球藻类胡萝卜素基因的表达[13, 14], 促进虾青素快速积累[15, 16]。蒋霞敏等[17]研究表明, 在促进雨生红球藻虾青素积累的方法中, 盐度胁迫要优于温度和光照。李晓梦等[18]使用乙酸钠调节盐度, 表明盐度胁迫比高光更能有效地促进虾青素积累, 但不同培养条件及藻种所需的最适盐度不同。本研究优化了促进雨生红球藻ZL-1生长的最适接种密度及最适IAA浓度, 并在此基础上探究了雨生红球藻ZL-1对水杨酸诱导和盐度胁迫的响应情况, 为雨生红球藻ZL-1藻株的研究及规模化养殖奠定基础。
2 材料与方法
2.1 藻种分离、鉴定及培养条件
雨生红球藻藻种由宁波大学微藻种质库提供。经多次平板纯化后挑取单克隆, 利用抗生素除菌得到纯种雨生红球藻。离心收集生长旺盛的藻细胞, 提取基因组DNA, 利用引物(Forward:5'-ACCTGGTTGATCCTGCCAG-3'; Recverse:5'-CCTTGTTACGACTTCTCCTTCCTCT-3')扩增序列并测序, 将扩增序列与NCBI数据库进行比对分析, 使用MEGA 7.0构建分子进化树, 结合藻细胞形态特征, 鉴定藻种。
经筛选, 使用NMB3#[19]作为基础培养基, 高压灭菌后使用。使用光照培养箱培养雨生红球藻, 培养温度为24 ℃, 光暗比为12 h:12 h, 光照强度为30 μmol·m–2·s–1。每天摇瓶数次, 保证受光均匀。
2.2 实验设计
2.2.1 接种密度
以对数生长期的雨生红球藻为接种原液(细胞密度为4×104cell·mL–1), 分别取10 mL、25 mL、50 mL、75 mL和100 mL原液至新鲜培养基, 至终体积均为150 mL, 最终接种密度分别为0.27、0.67、1.33、2.00、2.67×104cell·mL–1, 培养期间监测藻细胞形态及密度变化。培养13 d后, 转移藻液至70 μmol·m–2·s–1光强下诱导20 d, 收集藻液测定最终干重和虾青素含量。
2.2.2 吲哚乙酸浓度
将对数生长期的雨生红球藻接种至新鲜培养基中, 接种密度为2.00×104cell·mL–1, 终体积为150 mL。分别添加IAA至终浓度为:0、0.1、0.5、1、1.5、2.5和5 mg·L–1。藻液共培养13 d, 培养期间监测藻细胞形态及密度变化。
2.2.3 水杨酸诱导及盐度胁迫
将对数生长期的雨生红球藻接种至新鲜培养基中, 接种密度为2.00×104cell·mL–1, 终体积为150 mL, 添加IAA至终浓度为1.5 mg·L–1。培养13 d后, 分别进行水杨酸诱导及盐度胁迫实验, 实验分别设置水杨酸浓度梯度为0、5、15、25、50 mg·L–1; 使用氯化钠调节盐度至0、2、4、6、8‰。诱导同时, 将藻液转移至70 μmol·m–2·s–1光强下, 培养期间观察藻液颜色及细胞形态变化, 诱导5 d后测定最终干重及虾青素含量。
2.3 生长指标测定
使用浮游生物计数框测定雨生红球藻细胞密度; 藻液经离心、冷冻干燥后称重, 并计算干重; 细胞形态使用400倍光学显微镜观察。
2.4 虾青素含量测定
虾青素含量测定根据Boussiba等[20]方法改进:移取10 mL藻液(V), 8000 r·min-1离心5 min收集藻细胞, 加入3 mL CH3OH/KOH溶液(30% CH3OH和5% KOH混合液), 涡旋混匀后置于70 °C恒温水浴锅中温浴5 min, 8000 r·min-1离心5 min, 除去上清液; 加入3 mL含少量冰醋酸的二甲基亚砜(DMSO), 70 ℃温浴5 min, 离心收集上清液即为虾青素溶液; 重复提取, 直到藻渣透明为止。使用DMSO将虾青素溶液定容至体积V, 492 nm波长下测定吸光度A。
计算雨生红球藻虾青素含量C(mg·L–1):
公式中:V为藻液体积;V为提取液体积;A为吸光度值。
2.5 数据分析
所有实验均设置三组平行, 实验数据使用one-way ANOVA进行差异显著性分析(<0.05), 采用Duncan test进行多重比较并分析组间差异, 数据采用平均值±标准差(mean±SD)的形式表示。
3 结果与讨论
3.1 雨生红球藻的鉴定及进化分析
PCR扩增得到序列, 与NCBI数据库比对后, 使用最大似然法(Maximum Likelihood Method)构建分子进化树。如图1所示, 本藻株ZL-1与其他两株亲缘关系最近。藻株ZL-1在游动细胞阶段时, 藻细胞近似球形或椭圆形, 具有两条鞭毛, 细胞壁与原生质体分离形成明显的周质空间, 并有辐射状原生质丝贯穿其中。在高光诱导下, 藻细胞鞭毛脱落, 细胞内部逐渐出现微红色或橘色, 仅极少数细胞仍进行增殖, 表明游动细胞转化为不动细胞, 并开始积累虾青素; 随着诱导时间的增加, 细胞体积逐渐增大, 细胞壁明显加厚, 细胞内部红色不断加深(虾青素积累), 最终充满整个细胞, 以上形态特征与庄惠如等[21]描述的雨生红球藻超微结构类似。综上所述, 确定ZL-1为雨生红球藻, 命名为ZL-1。
3.2 接种密度对雨生红球藻生长及虾青素产量的影响
不同接种密度下, 雨生红球藻的生长曲线如图2所示。接种密度为2.67×104cell·mL–1的组分在前9 d始终保持较高的细胞密度, 随后则进入平稳期; 显微观察发现, 9 d后细胞鞭毛逐渐脱落, 游动细胞逐渐转为不动细胞, 藻细胞出现下沉、聚集现象。在整个培养过程中, 接种密度为0.27、0.67、1.33、2.00×104cell·mL–1的组分藻液状态均一, 细胞密度持续增长; 培养至第13 d, 2.00×104cell·mL–1的组分细胞密度高于其他组分, 达到26.52×104cell·mL–1, 藻细胞仍处于游动细胞期。结果表明:接种密度较低细胞密度增长缓慢, 较高则会缩短对数生长期, 2.00×104cell·mL–1为最佳接种密度。沈渊等[22]使用20 L光生物反应器通气培养雨生红球藻, 结果表明, 最佳接种浓度为2.3×104cell·mL–1, 最高细胞密度为30.40×104cell·mL–1。WANG等[6]使用3.6 L气升式光生物反应器培养雨生红球藻, 其接种密度为2.00×104cell·mL–1, 效果良好。本研究中, 培养体积虽远低于光生物反应器, 但最佳接种密度(2.00×104cell·mL–1)与之相近, 表明雨生红球藻在不同培养体积下, 具有相近的最佳接种密度。
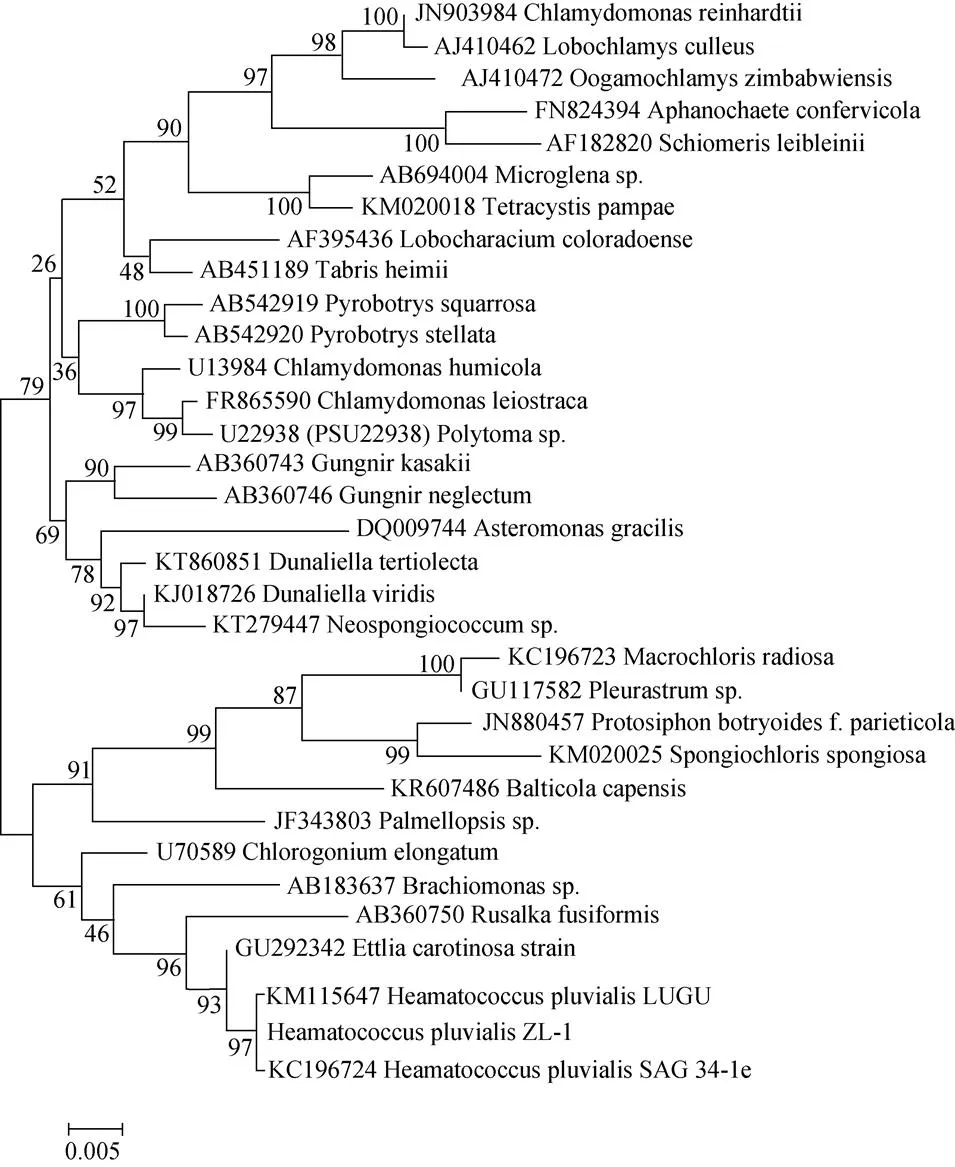
图1 雨生红球藻ZL-1分子进化树(最大似然法)
高光诱导处理后最终生物量及虾青素含量如表2所示。接种密度为2.00×104cell·mL–1的组分最终生物量达到最大0.43 g·L–1, 2.67×104cell·mL–1次之, 两组无显著差异。高光诱导时, 接种密度为2.67×104cell·mL–1的组分处于不动细胞期, 诱导20 d后, 其虾青素产量达到最大值8.44±0.32 mg·L–1, 但与接种密度为2.00×104cell·mL–1的组分无显著差异, 而两组虾青素占干重比例差异显著。结果表明, 虾青素产量不仅与生物量、诱导时间有关, 还与诱导之初藻细胞的状态有关, 不动细胞比游动细胞更快的积累虾青素。与大多研究者相同, 本研究选择对数生长期的藻细胞作为研究对象, 此时细胞处于游动细胞期, 细胞状态最佳, 具代表性, 但抗逆性较弱[10–15]。在大规模养殖过程中, 若选择处于不动细胞期的雨生红球藻作为诱导对象, 有利于减少生物量的损失, 促进虾青素快速积累, 缩短诱导时间。LV等[23]在研究中使用80 μmol·m–2·s–1的光强诱导处于游动细胞期的雨生红球藻, 21 d后虾青素含量约占干重1.2%, 低于本研究结果, 表明本藻种具有较好的应用潜力。
3.3 吲哚乙酸对雨生红球藻生长的影响
本研究表明IAA对雨生红球藻ZL-1的生长促进效果显著, 结果如图3、图4所示。随着IAA浓度的升高, 细胞密度和干重均呈现先升高后降低的趋势, IAA浓度为1.5 mg·L–1时效果最好, 其细胞密度始终保持最大, 最终干重也高于其他浓度处理, 与对照组相比, 分别提高了24.28%和27.11%; 超过适宜浓度后, IAA对雨生红球藻的生长不利, 当IAA达到5 mg·L–1时, 藻细胞基本处于停滞生长的状态。IAA具有调节微藻生长代谢的作用。有研究表明, 0.1—0.5 mg·L–1IAA可促进微拟球藻生长, 继续提高IAA浓度则产生抑制效果[8]; 同样, 在小球藻[24]、紫菜[25]等的研究中, IAA对生长代谢的影响均呈现低浓度促进、高浓度抑制的特点。本研究表明, 1.5 mg·L–1IAA对雨生红球藻的生长促进效果最佳, 过高浓度则产生抑制作用, 与IAA对其他微藻的作用相同。IAA凭借其成本低、微量高效等特性, 在微藻规模化养殖中具有重要应用价值。
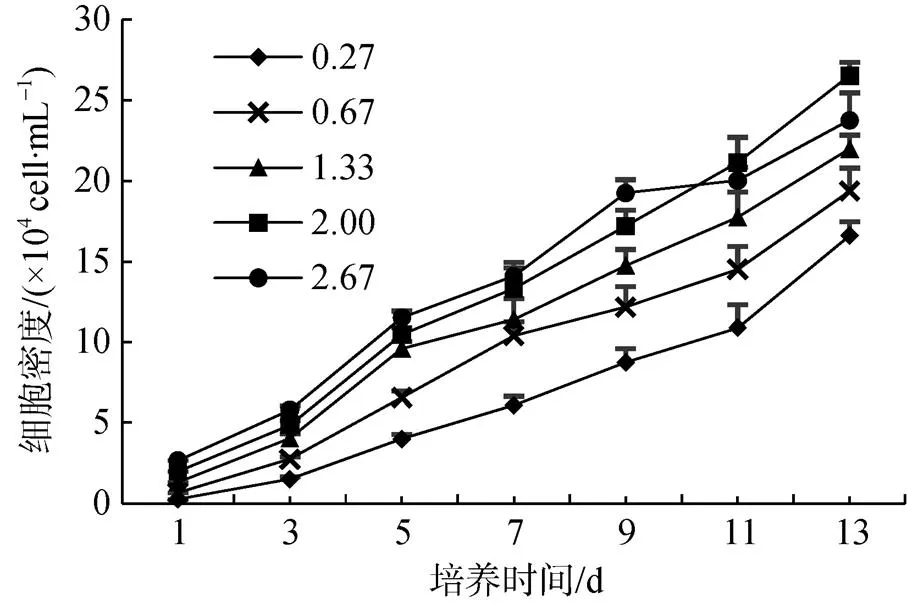
图2 不同接种密度下雨生红球藻的生长曲线
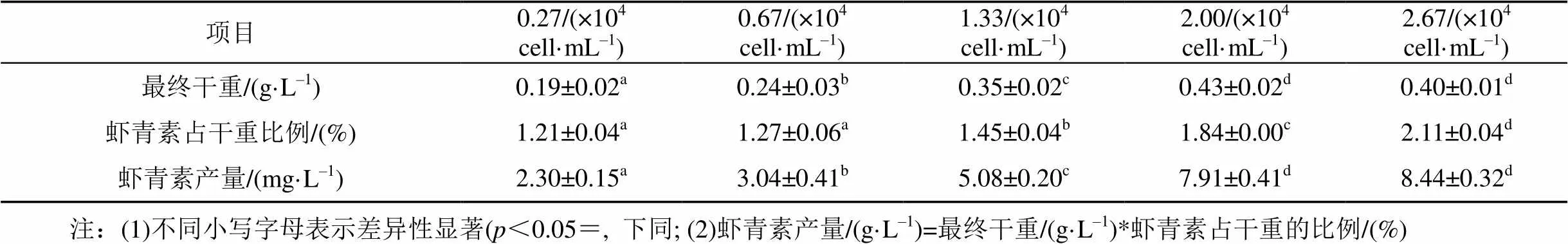
表1 不同接种密度下雨生红球藻的生物量及虾青素产量
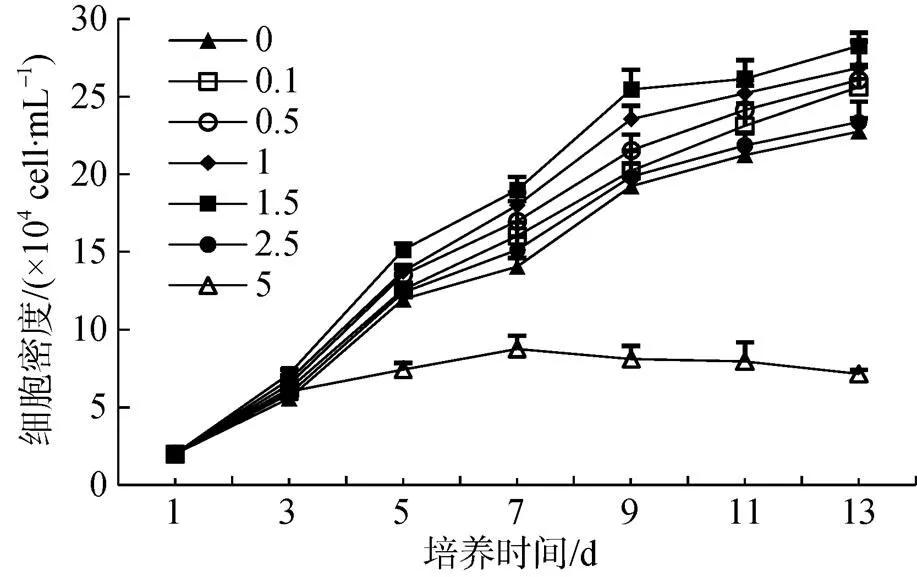
图3 不同浓度IAA处理下雨生红球藻的生长曲线
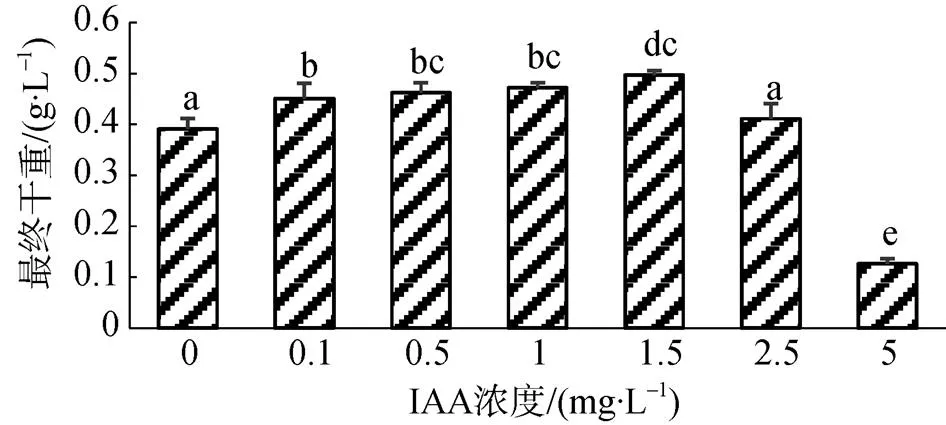
图4 不同浓度IAA作用下雨生红球藻的最终生物量
3.4 水杨酸对雨生红球藻生物量及虾青素产量的影响
水杨酸诱导3 d后藻液呈现不同程度的黄绿色, 显微观察发现细胞多处于不动状态, 胞浆微红; 培养5 d后, 藻液颜色变化更加明显, 周质空间基本消失, 细胞壁有所加厚。5 d后收集藻细胞测定干重及虾青素产量。结果如表3所示, 诱导5 d后, 对照组生物量低于3.3部分的处理结果, 表明高光导致雨生红球藻生物量下降[26]。随着水杨酸浓度升高, 生物量呈先上升后下降的趋势, 15 mg·L–1时达到最大值, 推测适宜浓度水杨酸可诱导细胞增强抗逆能力[27, 28], 从而缓解了高光对雨生红球藻的胁迫作用, 但水杨酸浓度过高时效果下降。
水杨酸具有诱导β-胡萝卜素酮化酶(bkt基因表达的作用[29], GAO等[10, 30]使用荧光定量PCR及比较转录组学技术分析了25 mg·L–1水杨酸对雨生红球藻基因表达的影响, 表明水杨酸可提高虾青素合成相关基因的表达, 推测水杨酸参与虾青素合成过程的信号调控。本研究发现, 水杨酸处理组虾青素产量均高于对照组, 即适宜浓度水杨酸可诱导虾青素积累。当水杨酸浓度为15和25 mg·L–1时, 虾青素产量最高, 分别达到3.12±0.02和3.14±0.10 mg·L–1, 较对照组提高了18.18%和18.94%; 当水杨酸浓度为50 mg·L–1时, 虾青素产量下降, 表现出低浓度促进高浓度抑制的双重作用。李梓楠等[12]研究表明, 12 mg·L–1水杨酸可显著促进虾青素合成, 但未做更高浓度的研究(>12 mg·L–1); 本研究扩大了水杨酸的浓度范围, 表明15—25 mg·L–1水杨酸诱导虾青素积累效果最佳, 实际养殖中使用15 mg·L–1水杨酸即可得到较高生物量和虾青素产量, 节省成本。
3.5 盐度对雨生红球藻生物量及虾青素产量的影响
培养3 d后, 盐度处理组藻液颜色明显转变, 盐度越高变化越明显。显微观察发现, 除对照组外, 各处理组均出现不同程度的藻细胞漂白、死亡现象, 盐度为8‰时最为严重。最终干重及虾青素产量如表4所示, 随着盐度升高, 生物量显著下降; 虾青素产量则呈先上升后下降的趋势, 在盐度为4‰时, 虾青素产量达到最大值3.10 mg·L–1, 较对照组提高了17.42%。
雨生红球藻是淡水微藻, 施加盐度会增加细胞渗透压, 影响其生长及代谢。GAO等[14]使用10‰的盐度和50 μmol·m–2·s–1光照处理三株雨生红球藻, 10 d后虾青素占干重比例最高为1.77%, 虾青素合成相关基因表达量上调, 该研究也发现盐度胁迫会造成藻细胞大量漂白、死亡。李晓梦等[18]使用乙酸钠调节盐度至2%, 发现盐胁迫能有效地促进虾青素积累, 但虾青素积累量仅为1.33 mg·L–1。Vidhyavathi等[31]使用营养胁迫、17 mM氯化钠、4.4 mM乙酸钠和60 μmol·m–2·s–1光照共同诱导雨生红球藻虾青素积累, 6 d后虾青素占干重比例2.45%,表明盐度与其他诱导条件结合效果更佳。本研究结果表明, 4‰盐度诱导效果最好, 所得到的虾青素产量较高, 但也会导致生物量的减少, 今后还应探索盐度胁迫与其他诱导条件相结合, 以降低氯化钠的使用, 使之既能维持较高的生物量, 又能促进虾青素快速积累。

表2 水杨酸对雨生红球藻最终干重及虾青素产量的影响

表3 盐度对雨生红球藻最终干重及虾青素产量的影响
4 结论
随着医疗保健、水产养殖等行业的快速发展, 虾青素的市场需求日益增加, 利用雨生红球藻生产虾青素一直是研究的热点, 但因藻种、培养及诱导方法的不同, 仍有很多问题亟待解决。本研究分离鉴定了一株雨生红球藻ZL-1, 研究发现接种密度为2.00×104cell·mL–1能够保持细胞旺盛生长, 提高生物量; 相同诱导条件下, 不动细胞比游动细胞更快的积累虾青素, 适合大规模养殖时作为诱导对象。IAA浓度为1.5 mg·L–1时, 雨生红球藻生长速度最快, 最终细胞密度和干重都有大幅提高, 而过高浓度IAA则产生抑制作用。15和25 mg·L–1的水杨酸及4‰的盐度均可显著提高虾青素的产量, 但水杨酸还具有缓解胁迫的作用, 盐度处理则导致细胞大量漂白、死亡, 生物量显著降低。本藻株在优化的细胞密度和IAA浓度下可快速生长, 在高光条件下, 水杨酸和盐度可促进虾青素快速积累, 具有一定的应用潜力, 后续研究将进一步研究雨生红球藻高密度养殖技术和促进雨生红球藻虾青素快速积累的方法。
[1] Sarada R, Vidhyavathi R, Usha D, et al. An efficient method for extraction of astaxanthin from green alga[J]. Journal of Agricultural and Food Chemistry, 2006, 54(20): 7585–7588.
[2] Hdde H, Netto F M. Recovery of components from shrimp () processing waste by enzymatic hydrolysis[J]. Journal of Food Science, 2006, 71(5): C298–C303.
[3] Guerin M, Huntley M E, Olaizola M.astaxanthin: applications for human health and nutrition[J]. Trends in Biotechnology, 2003, 21(5): 210–216.
[4] Li Jian, Zhu Daling, Niu Jianfeng, et al. An economic assessment of astaxanthin production by large scale cultivation of[J]. Biotechnology Advances, 2012, 29(6): 568–574.
[5] 温文, 黄旭雄, 乔玮. 接种密度对产油微绿球藻和三角褐指藻生长及油脂性能的影响[J]. 渔业现代化, 2012, 39(6): 26–32.
[6] Wang Junfeng, Han Danxiang, Sommerfeld M R, et al. Effect of initial biomass density on growth and astaxanthin production of, in an outdoor photobioreactor[J]. Journal of Applied Phycology, 2013, 25(1): 253–260.
[7] Leveau J H, Lindow S E. Utilization of the plant hormone indole-3-acetic acid for growth bystrain 1290. Applied and Environmental Microbiology, 2005, 71(5): 2365–2371.
[8] 焦媛媛, 俞建中, 潘克厚. 吲哚乙酸对微拟球藻生长和脂肪酸含量的影响[J]. 中国海洋大学学报, 2011, 41(4): 57–60.
[9] Jusoh M, Loh S H, Chuah T S, et al. Indole-3-acetic acid (IAA) induced changes in oil content, fatty acid profiles and expression of four fatty acid biosynthetic genes inat early stationary growth phase[J]. Phytochemistry, 2015, 111(5): 65–71.
[10] Gao Zhengquan, Meng Chunxiao, Zhang Xiaowen, et al. Induction of salicylic acid (SA) on transcriptional expression of eight carotenoid genes and astaxanthin accumulation in[J]. Enzyme and Microbial Technology, 2012, 51(4):225–230.
[11] Raman V, Ravi S. Effect of salicylic acid and methyl jasmonate on antioxidant systems of[J]. Acta Physiologiae Plantarum, 2011, 33(3): 1043–1049.
[12] 李梓楠, 陈绪清, 任建武, 等. 硝酸钠和水杨酸对雨生红球藻累积虾青素的影响[J]. 中国食品添加剂, 2016, 8: 131–134.
[13] Steinbrenner J, Linden H. Regulation of two carotenoid biosynthesis genes coding for phytoene synthase and carotenoid hydroxylase during stress-induced astaxanthin formation in the green alga[J]. Plant Physiology, 2001, 125(2):810–817.
[14] GAO Zhengquan, MENG Chunxiao, CHEN Yichung, et al. Comparison of astaxanthin accumulation and biosynthesis gene expression of three, strains upon salinity stress[J]. Journal of Applied Phycology, 2015, 27(5):1853–1860.
[15] Kobayashi M, Kurimura Y, Tsuji Y. Light-independent, astaxanthin production by the green microalgaunder salt stress[J]. Biotechnology Letters, 1997, 19(6):507–509.
[16] 董庆霖, 赵学明, 邢向英,等. 盐胁迫诱导雨生红球藻合成虾青素的机理[J]. 化学工程, 2007, 35(1):45–47.
[17] 蒋霞敏, 柳敏海, 沈芝叶. 温度、光照与盐度对雨生红球藻诱变株虾青素累积的调控[J].中国水产科学, 2005, 12(6): 714–718.
[18] 李晓梦, 齐安翔, 蔡明刚, 等. 雨生红球藻室外大体积培养与虾青素积累初步研究[J]. 厦门大学学报(自然版), 2006, 45(s1): 245–249.
[19] 王建沅, 周成旭, 严小军, 等. 雨生红球藻在红光下的生长及营养盐消耗特征[J]. 水生生物学报, 2014, 38(6): 1135–1142.
[20] Boussiba S, Fan L, Vonshar A. Enhancement and determination of astaxanthin accumulation in green alga[J]. Methods Enzymology, 1992, 213:386–391.
[21] 庄惠如, 陈文列, 卢海声, 等. 雨生红球藻不同形态细胞的超微结构研究[J]. 应用与环境生物学报, 2001, 7(5): 428–433.
[22] 沈渊, 蔡明刚, 黄水英, 等. 利用光生物反应器培养雨生红球藻的研究初探[J]. 海洋科学, 2010, 34(10): 83–89.
[23] LV Hexin, XIA Feng, LIU Miao, et al. Metabolomic profiling of the astaxanthin accumulation process induced by high light in[J]. Algal Research, 2016, 20(2016):35–43.
[24] 邓晓东, 吴小霞, 范新照, 等. 激素IAA和ABA对小球藻()生长和油脂积累的影响[J]. 中国油料作物学报, 2013, 35(1): 58–63.
[25] ZHANG W, Yamane H, Chapman D J. The Phytohormone Profile of the Red Alga[J]. Botanica Marina, 1993, 36(3): 257–266.
[26] 李颖逾, 刘建国, 林伟,等. 雨生红球藻细胞转化、虾青素积累与光照强度的关系及不同品系间的差异性[J]. 海洋科学, 2006, 30(9):36–41.
[27] 李德红, 潘瑞炽. 水杨酸在植物体内的作用[J]. 植物生理学报, 1995(2):144–149.
[28] 朱招波, 孙雪, 徐年军,等. 水杨酸对龙须菜抗高温生理的影响[J]. 水产学报, 2012, 36(8):1304–1312.
[29] CHUN Xiaomeng, CHENG Weiliang, ZHONG Liangsu, et al. There are two 5′-flanking regions ofencoding beta-carotene ketolase in[J]. Phycologia, 2006, 45(2): 218–224.
[30] GAOZhengquan, LI Yan, WUGuanxun, et al. Transcriptome Analysis in: Astaxanthin Induction by Salicylic Acid (SA) and Jasmonic Acid (JA)[J]. Plos One, 2015, 10(10):e0140609.
[31] Vidhyavathi R, Venkatachalam L, Sarada R, et al. Regulation of carotenoid biosynthetic genes expression and carotenoid accumulation in the green algaunder nutrient stress conditions[J]. Journal of Experimental Botany, 2008, 59(6):1409–1418.
Optimization of growth and astaxanthin accumulation ofZL-1
LI Yanguo, YANG Liu, XU Nianjun, SUN Xue, ZHANG Lin*
School of Marine Sciences,Key Laboratory of Marine Biotechnology, Ningbo University, Ningbo 315211, China
has received much attention as its high astaxanthin content under various stress conditions. Anovel strainZL-1wasisolated and identified; the effect of initial density and indole-3-acetic acid(IAA) on growth ofwas explored; then, salicylic acid and salinity were used to induce astaxanthin accumulation. Results showed that the final biomass with initial density of 2.00×104cell·mL–1was the largest(0.43 g·L–1).The accumulation of astaxanthin in non-motile cells which reached up to 8.44 mg·L–1, higher than that of the motile cells. IAA with the final concentration of 1.5 mg·L–1played the most significant role in promotinggrowth,and the cell concentration and dry weight were respectively improved by 24.28% and 27.11% compared with the control. Salicylic acid had the dual effects of alleviating high light stress and inducing the accumulation of astaxanthin. The biomass of groups with 15 mg·L–1and 25 mg·L–1salicylic acid was higher than others, and the astaxanthin yields were improved by 18.18% and 18.94% respectively than the control group. The proper salinity to induce astaxanthin was 4‰, which improved the astaxanthin yield by 17.42%.However, salinity could lead to bleach and death of algal cells, resulting in a significant decrease in biomass.
;initial density; indole-3-acetic acid; salicylic acid; salinity; astaxanthin
Q945.78
A
1008-8873(2018)01-020-07
2017-03-16;
2017-06-13
国家自然科学基金(31572638); 浙江省科技厅公益性项目(2015C32021); 宁波市自然科学基金项目(2015A610265); 宁波市科技计划项目(2014C10023); 宁波大学学科项目(xkl1526); 浙江省新苗人才计划(2016R405078)
李艳国(1992—), 男,河南三门峡人, 研究生, 主要从事藻类生物学研究, E-mail: 807573212@qq.com
张琳(1985—), 女, 博士, 讲师, 主要从事藻类分子生物学研究, E-mail:315308497@qq.com
10.14108/j.cnki.1008-8873.2018.01.003
李艳国, 杨柳, 徐年军, 等. 雨生红球藻ZL-1生长和虾青素积累条件优化[J]. 生态科学, 2018, 37(1): 20-26.
LI Yanguo, YANG Liu, XU Nianjun, et al. Optimization of growth and astaxanthin accumulation ofZL-1[J]. Ecological Science, 2018, 37(1): 20-26.
