烟管菌M-1菌株对油菜核盘菌的生防作用研究
2018-03-26张红楠张旭辉吴頔李勇
张红楠,张旭辉,吴頔*,李勇*
(1.西南大学园艺园林学院,重庆400715;2.西南大学资源环境学院,重庆400715)
由核盘菌(Sclerotiniasclerotiorum)引起的菌核病可侵害多种植物,是油菜(Brassicacampestris)植株最为严重的病害之一[1-3]。该病害在我国各油菜产区均有发生,常年发病率在10%~40%之间,严重时可达70%,极大地影响油菜的产量和品质[4],给农业生产和发展带来了巨大障碍。由于目前尚无理想的商品化抗病品种[3,5],农业上对油菜菌核病的防治主要为化学农药防治[6]。秦虎强等[7]研究发现腐霉利、多菌灵、甲基托布津和戊唑醇等4种农药对油菜菌核病菌具有一定的防治效果,其中50%多菌灵和80%甲基托布津的田间防效在76%左右。但是长期使用杀菌剂很容易产生抗药性,且不同地区的核盘菌抗性水平存有差异,同时药物残留和环境污染等问题已不符合农业健康可持续发展的要求[8]。轮作和土壤消毒等农艺措施虽有一定防治效果,但是由于油菜核盘菌寄主范围广,菌核在土壤中存活周期较长,使得防治不彻底;此外,轮作和土壤消毒的频率较高和劳动力要求较大,难以适应中国集约化农业种植模式的要求[9]。生物防治因其高效持久、环境友好和无药物残留等特点已成为当前国内外防治油菜菌核病的研究热点,并将逐渐成为植物病害防治的主流方向[10-11]。目前,已报道至少30种以上生防微生物对油菜菌核病具有防治效果,其中主要有芽孢杆菌(Bacillusspp.)[12]、假单胞菌(Pseudomonasspp.)和成团泛菌(Pantoeaagglomerans)[13]、放线菌(Actinomycetesspp.)[14]、木霉菌(Trichodermaspp.)[15]、盾壳霉(Coniothyriumminitans)[16]以及白僵菌(Beauveriabassiana)[17]等。
很多大型真菌的子实体从来不被病菌或昆虫所侵袭[18],而且受伤后的子实体能产生大量具有抗菌、杀虫等效果的活性代谢产物[19],因此可作为生物防治病害的重要资源。烟管菌(Bjerkanderaadusta)为木腐真菌,有研究发现,烟管菌能够有效地防治褐腐病在栎树(Quercusrobur)上发生[20]。Bak等[21]分离到1株烟管菌菌株,研究表明该菌株具有抑菌防病作用,能够有效防治欧美黑杨(Populuseuramericana)干腐病。国内则仅有汪华等[22]报道了烟管菌对纹枯病菌(Thanatephoruscucumeris)、黄萎病菌(Verticilliumdahliae)、青枯病菌(Ralstoniasolanacearum)等具有很好的防治效果。本课题组分离筛选获得1株对西瓜蔓枯病菌(Didymellabryoniae)具有明显拮抗作用的烟管菌[23],丰富了其生防作用研究。但目前尚无烟管菌对油菜核盘菌抑制作用的研究报道,此外,烟管菌最适液体培养条件及实际防病效果等均未见研究。本研究利用前期分离获得具有生防作用的烟管菌(B.adusta)为出发菌株,研究活体菌株及其代谢液对油菜核盘菌的防治效果,并在扫描电镜下观察其对油菜核盘菌的重寄生作用,进而通过温室盆栽试验检测其实际防病效果,为油菜菌核病生物防治提供又一理论依据。
1 材料与方法
1.1 试验材料
1.1.1生防真菌 本课题组于2015年7月在重庆北碚“国家紫色土肥力与肥料效益监测基地”(E 106°24′33″,N 29°48′36″)以五点取样法采集5~20 cm土层的土样,经分离筛选得到一株拮抗菌株,将其鉴定为烟管菌,命名为烟管菌M-1,其基因登录号为KX377676[23]。
1.1.2病原真菌 油菜核盘菌(Sclerotiniasclerotiorum)由西南大学植物生态病理研究所惠赠。
1.1.3培养基 马铃薯葡萄糖琼脂培养基(PDA):去皮马铃薯200 g,葡萄糖20 g,琼脂15~20 g,蒸馏水1000 mL,pH 自然;马铃薯葡萄糖液体培养基(PD):去皮马铃薯200 g,葡萄糖20 g,蒸馏水1000 mL,pH自然;液体基础培养基:葡萄糖2.0%,MgSO4·7H2O 0.1%,NH4Cl 1.0%, CaCl20.1%,KH2PO40.2%,pH自然;基础培养基:葡萄糖2.0%,NH4Cl 1.0%,KH2PO40.2%,MgSO4·7H2O 0.1%,CaCl20.1%,琼脂1.5%~2.0%,pH自然。
1.1.4其他材料 油菜种子品种为德杂油9号采购自四川绵阳特研种业有限公司;50%多菌灵可湿粉剂购于威海韩孚生化药业有限公司;70%甲基托布津可湿粉剂购于陕西美邦农药有限公司。用无菌水将两种农药粉剂分别配制为0.4 mg·mL-1和80 μg·mL-1的液体药剂,4 ℃保存备用;植物栽培土为西南大学二号试验田紫色土,将其过2 mm筛后高压蒸汽灭菌2 h。
1.2 试验方法
1.2.1菌株M-1抑菌效果测定 通过菌饼对峙抑菌试验[24]测定菌株M-1活体菌对油菜核盘菌的体外抑菌效果。在PDA的平板上相距3 cm的两点分别接种直径5 mm的菌株M-1菌饼和油菜核盘菌菌饼,构成两点对峙,以分别加入3 mL 0.4 mg·mL-1的多菌灵和甲基托布津的平板为农药处理,以只接种油菜核盘菌的平板为对照组,于28 ℃恒温培养48 h,十字交叉法[23]测量平板中油菜核盘菌菌落相对方向的菌落半径,计算菌株M-1对油菜核盘菌的抑菌率。每个处理均设3次重复。
抑菌率= (对照菌落半径-处理菌落半径)/对照菌落半径×100%
再通过液体培养液抑菌试验[25]测定菌株M-1无菌滤液对油菜核盘菌的抑菌效果。使用直径5 mm的无菌打孔器打取M-1菌株菌饼5块,接种在盛有100 mL液体基础培养基的无菌三角瓶中,在28 ℃、150 r·min-1条件下,震荡培养5 d,用0.22 μm无菌滤器过滤其代谢液至10 mL离心管中,取3 mL无菌滤液与15 mL基础培养基混合均匀,冷却后再将油菜核盘菌菌饼接种到此培养基上,以不接拮抗菌菌株M-1液体基础培养基的无菌滤液作为空白对照,以分别加入3 mL 0.4 mg·mL-1的多菌灵和甲基托布津作为农药对照。28 ℃恒温培养48 h,十字交叉法[23]测量油菜核盘菌菌落直径和其对照平板上的菌落直径,计算拮抗菌菌株M-1无菌滤液对油菜核盘菌的抑菌率,每个组合3次重复。
抑菌率=(对照菌落直径-处理菌落直径)/对照菌落直径×100%
1.2.2菌株M-1重寄生作用观察 在PDA平板中央接种5 mm的油菜核盘菌菌饼,在距其3 cm的上下左右各接种同样大小的菌株M-1菌饼,于28 ℃暗处恒温培养90 h后观察拮抗效果,以单接病原真菌的培养皿为对照组。再按1.2.1菌饼对峙抑菌试验的操作得到对峙平板,并在两者之间平铺一块无菌锡箔纸至菌丝接触,参考Shao等[26]的方法制备样品,进行显微观察和扫描电镜观察,揭示菌株M-1的重寄生作用。
1.2.3菌株M-1液体培养液热稳定性检测 按照1.2.1液体培养液抑菌试验的方法得到菌株M-1无菌滤液,于40、60、80和100 ℃水浴处理30 min,以与室温相近的水浴温度处理为对照,随后操作按照1.2.1的相关方法进行,计算不同温度水浴处理后菌株M-1液体培养液对油菜核盘菌的抑菌率,每个处理均设3次重复。
1.2.4菌株M-1液体培养条件选择 通过单因素试验确定菌株M-1液体培养条件。其液体培养的碳源在乳糖、可溶性淀粉、葡萄糖、麦芽糖和蔗糖中选择;在其他培养条件相同的条件下,其氮源在硝酸铵、氯化铵、蛋白胨、硝酸钾、酵母膏和牛肉膏中选择,无氮源的液体基础培养基作为空白对照;在其他培养条件相同的条件下,调节其液体基础培养基的C/N为1.2∶1、3.6∶1、4.8∶1、6.0∶1、7.2∶1、8.4∶1、12.0∶1和18.0∶1;在其他培养条件相同的条件下,碳源用量分别以5、10、15、20和25 g·L-1添加;在其他培养条件相同的条件下,液体基础培养基的初始pH分别调节为3.0、5.0、7.0和9.0,从而确定菌株M-1液体培养最适的pH;在其他培养条件相同的条件下,在20、25、30、35和40 ℃的温度下进行液体培养,150 r·min-1培养5 d;在其他培养条件相同的条件下,在250 mL三角瓶中按照15%、30%、40%、45%、50%、60%和75%(V/V)的装瓶量进行液体培养, 150 r·min-1培养5 d;在其他培养条件相同的条件下,于100、140、180和220 r·min-1的条件下摇床培养5 d;在其他培养条件相同的条件下,摇床震荡培养5、10、15、20、25和30 d后检测其抑菌率,其他操作按1.2.1中的相关方法进行,并计算不同条件下菌株M-1对油菜核盘菌的抑菌率。每组处理3次重复,确定液体培养最佳的碳源、氮源、C/N、碳源用量、pH、温度、装瓶量、转速和液体培养时间。
1.2.5响应曲面法优化液体培养条件 在确定最佳液体培养条件基础上,再根据响应曲面设计原理及方法[27],进行6因素3水平的响应面分析试验,每个因素取低、中、高3个水平,分别记做-1、0和+1,为避免掩盖其他因素的重要性,故某个因素高低水平的差值不能太大,因此,本试验设定高水平为低水平的1.4~1.8倍。以试验因子为自变量,以菌株M-1培养液对油菜核盘菌的抑菌率为响应值,探究各因素对抑菌率的影响,确定其液体培养条件的最佳组合。
1.2.6温室盆栽试验 盆栽试验于2016年3月至7月在西南大学1号温室进行,温度为28~40 ℃,相对湿度为45%~70%。将刚发芽的油菜种子移栽至盛有2 kg无菌土的花盆(Φ19 cm×13 cm)中,缓苗20 d,继续管理使其正常生长。最适液体培养条件下培养得到菌株M-1菌液后,采用牙签接种法[28]在生长一致的油菜植株第3、4片老叶及距离根部20 cm处的茎部分别进行接菌处理,试验设计4组处理,CK水:无菌水处理;CK病:油菜核盘菌处理;CT1:同时接种油菜核盘菌和菌株M-1的处理;CT2:接种油菜核盘菌并喷施10 mL 80 μg·mL-1多菌灵。每个处理组15株,各3次重复。温室生长两周后根据Smith 等[29]的分级标准及计算方法统计病情指数及拮抗菌的防病效果。0级:茎叶处均无病斑或叶片发病但病叶小于1%;1级:茎或者叶片出现小块病斑,病叶在1%~25%;2级:茎或者叶片有大块病斑,病叶在26%~50%;3级:茎或者叶片有大量病斑,叶片枯萎卷曲,病叶在51%~75%;4级:植株出现大量病斑,病叶在76%~90%;5级:病叶占到90%以上或者整株病死。
病情指数=∑(各级病株数×相应级数)/(调查植株总数×最高级数)×100
防病效果=(CK病病情指数-处理组病情指数)/CK病病情指数×100%
收获油菜植株并测定每株叶片数、株高、根长、茎围、湿重、烘干后的干重。
1.3 数据处理与分析
使用IBM SPSS Statistics 21软件进行数据的统计及分析;应用Microsoft Excel 2007进行图表制作;借助 Design Expert 8.0.6软件进行响应曲面条件优化分析。
2 结果与分析
2.1 菌株M-1抑菌效果
以菌饼对峙抑菌试验测定菌株M-1体外抑菌效果,表1显示,菌株M-1对油菜核盘菌的抑菌率达到67.9%,分别是多菌灵处理和甲基托布津处理的3.0和2.2倍,均达到显著差异水平(P<0.05)。而在液体培养抑菌试验中,菌株M-1无菌滤液的抑菌活性同样高于农药处理,其对油菜核盘菌的抑菌率达到51.8%,分别是多菌灵处理和甲基托布津处理的1.3和2.2倍,不同处理间均达到显著差异水平(P<0.05)。
2.2 菌株M-1重寄生作用
如图1所示,恒温培养90 h后,单接油菜核盘菌的菌落长满整个平板(图1A),而同时接种菌株M-1的病原真菌生长明显受到抑制, 其菌落四周均出现抑菌带(图1B)。显微观察发现, 在菌落交界处两者的菌丝形态均发生变化,菌株M-1菌丝由非拮抗区的疏松、分枝(图1C)变为拮抗区的浓密、笔直、无分枝(图1D),而油菜核盘菌的菌丝由非拮抗区的细且多分枝(图1E)变为粗且少分枝(图1F),说明两者已进入拮抗互作期。在扫描电镜下则清晰地观察到菌株M-1菌丝直接穿插、刺透油菜核盘菌菌丝,使后者菌丝膨大、变形甚至破裂,表现出强烈的重寄生作用(图1G,H)。
2.3 菌株M-1液体培养液热稳定性
由图2可见,M-1菌株对油菜核盘菌抑菌率最高的温度处理为40 ℃,80 ℃处理后抑菌率在38.9%,而100 ℃处理后抑菌率仍达到35.4%, 60、80和100 ℃处理间无显著差异(P>0.05),并且其抑菌率均在37%左右,说明菌株M-1液体培养液具有热稳定性。
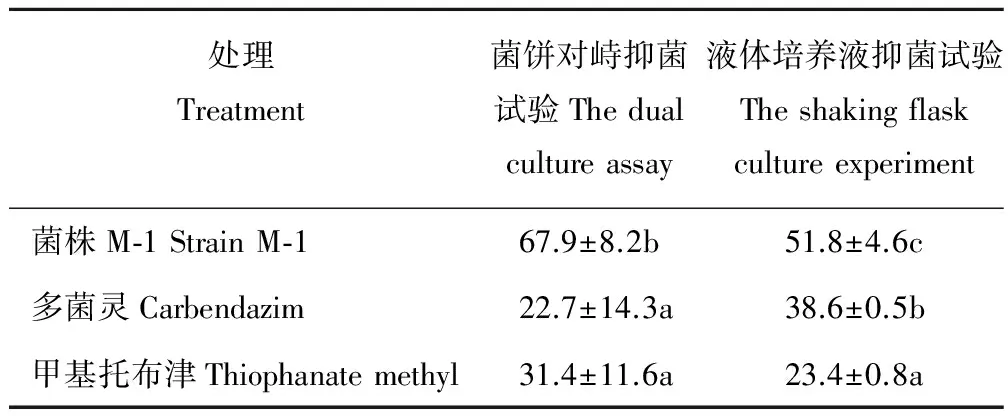
表1 各处理对油菜核盘菌的抑菌率Table 1 Inhibitory rates of different treatment against S. sclerotiorum (%)
注:均值±标准差(n=3). 不同小写字母表示不同处理间差异显著(P<0.05), 0.4 mg·mL-1多菌灵和甲基托布津为农药对照, 下同。
Note: mean±SD (n=3). The different lowercase letters represent the existence of significant differences atP<0.05, and 0.4 mg·mL-1carbendazim and thiophanate methyl were as control group, the same below.

图1 菌株M-1对油菜核盘菌的拮抗作用及重寄生作用 Fig.1 The antagonism and mycoparasitism of B. adusta M-1 against S. sclerotiorum A: 油菜核盘菌; B: 被抑制的油菜核盘菌; C: 生防菌非拮抗区菌丝; D: 生防菌拮抗区菌丝; E: 病原菌非拮抗区菌丝; F: 病原菌拮抗区菌丝; G,H: 烟管菌M-1对油菜核盘菌的重寄生作用。M-1为烟管菌菌丝,S为油菜核盘菌菌丝。 A: S. sclerotiorum; B: Inhibited S. sclerotiorum; C: B. adusta mycelium not in antagonistic region; D: B. adusta mycelium in antagonistic region; E: S. sclerotiorum mycelium not in antagonistic region; F: S. sclerotiorum mycelium in antagonistic region; G,H: The mycoparasitism of B. adusta M-1 against S. sclerotiorum. M-1 representative B. adusta strain, S representative S. sclerotiorum strain.
2.4 菌株M-1液体培养条件选择
通过单因素试验选择最适液体培养条件,如图3所示,不同条件对菌株培养液的抑菌率具有不同影响。菌株M-1对油菜核盘菌抑菌率最高时的液体培养碳源为麦芽糖(图3A),最适氮源为硝酸铵(图3B),对油菜核盘菌的抑菌率分别达到68.8%和66.2%,显著高于其他处理(P<0.05)。随着C/N升高,其抑菌率呈现先升高后降低的趋势,C/N为7.2∶1时抑菌率达到最大的100%(图3C)。20 g·L-1的碳源用量抑菌率达到最高,可确定其为最佳用量(图3D)。培养液酸碱性对其抑菌率有较大影响,酸性环境下抑菌率要明显高于中性和碱性,在pH为5.0时抑菌率最高(图3E)。培养温度对抑菌率的影响也表现出先升高后降低的规律(图3F),在25 ℃时抑菌率达到最高的53.8%,由此可确定25 ℃为最适液体培养温度。装瓶量为30%(v/v)时抑菌效果最好,50%装瓶量的抑菌率最低,均与其他处理间达到显著差异水平(P<0.05),确定30%为最佳装瓶量(图3G)。转速在140 r·min-1(图3H)、培养20 d(图3I)时均达到最大抑菌率,分别为90%和77.8%。

图2 不同温度处理对菌株M-1液体培养液抑菌率的影响Fig.2 Effects of different temperature treatments on the inhibitory rate of fermentation broth 不同小写字母表示差异显著,下同。The different lowercase letters represent the existence of significant differences at P<0.05, the same below.
2.5 响应曲面法优化液体培养条件
根据单因素水平试验,进行响应曲面法的Box-Behnken试验设计。对油菜核盘菌抑菌率的Box-Behnken试验设计因子与响应值以及回归方程的方差分析见表2和表3。
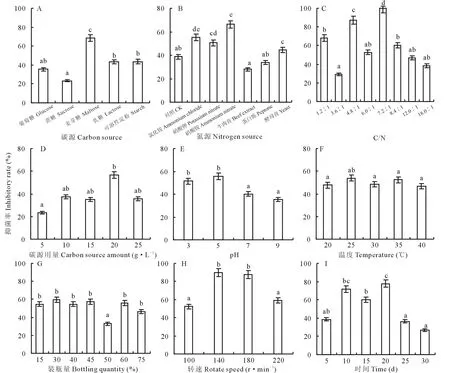
图3 不同液体培养条件对菌株M-1代谢液抑菌率的影响Fig.3 Effect of fermentation broth in different fermentation conditions on the inhibitory rate
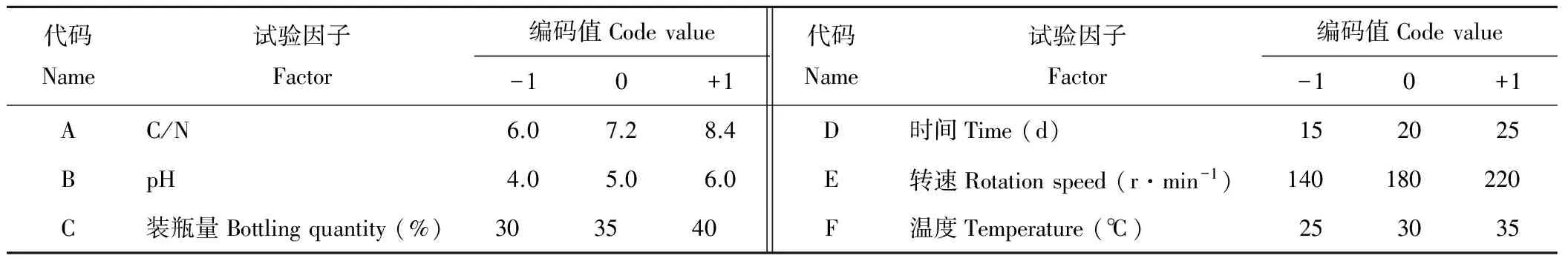
代码Name试验因子Factor编码值Codevalue-10+1代码Name试验因子Factor编码值Codevalue-10+1AC/N6.07.28.4D时间Time(d)152025BpH4.05.06.0E转速Rotationspeed(r·min-1)140180220C装瓶量Bottlingquantity(%)303540F温度Temperature(℃)253035
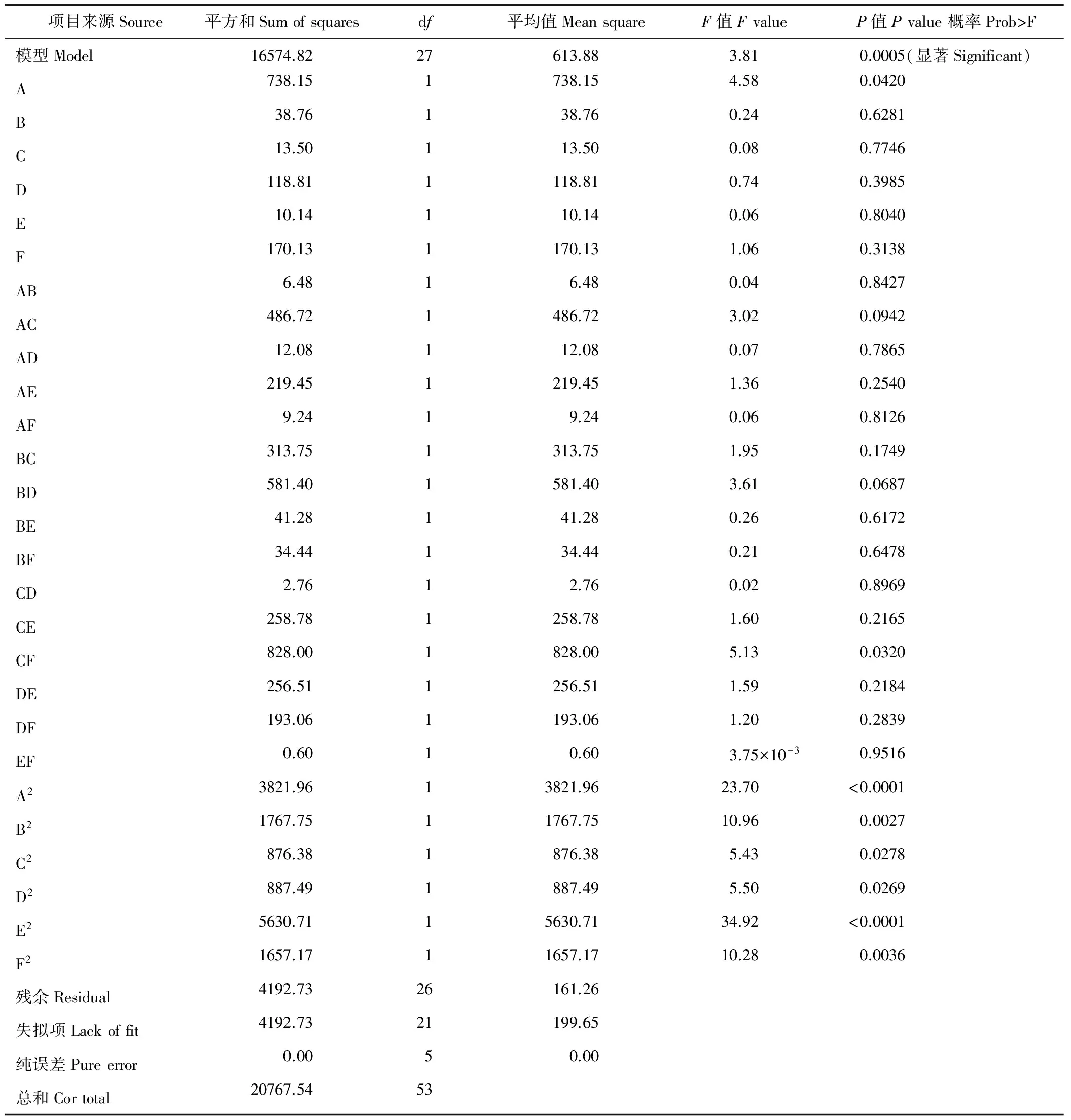
表3 试验设计回归方程的方差分析Table 3 ANOVA analysis of regression equation of test design
借助 Design Expert 8.0.6软件对以上数据进行二次多元回归拟合,得到抑菌率Y对编码自变量的二次回归多项方程为:Y=79.10+5.55×A-1.27×B-0.75×C+2.22×D+0.65×E+2.66×F-0.90×A×B-7.80×A×C+0.87×A×D-5.24×A×E+1.08×A×F+6.26×B×C-8.52×B×D+1.61×B×E-2.08×B×F-0.59×C×D-5.69×C×E-7.19×C×F+5.66×D×E+4.91×D×F+0.27×E×F-19.28×A2-13.11×B2-9.23×C2-9.29×D2-23.40×E2-12.69×F2。
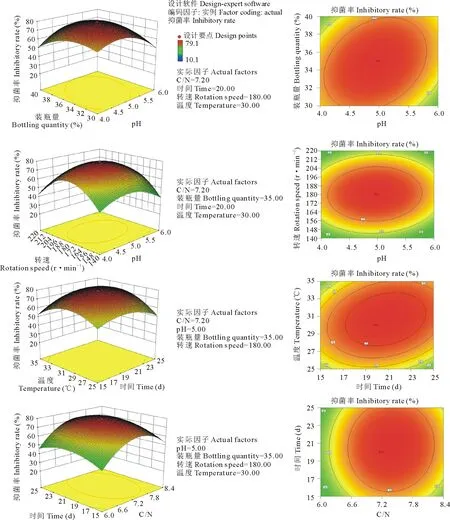
图4 响应曲面中两两因子间对响应值的影响Fig.4 The influence between any two factors on the response value in the surface response
以F-检验判断各项变量对响应值的显著性(表3)可知,拟合的二阶模型的F值为3.81,概率P (Prob>F)为 0.0005,小于0.01,说明模拟达到显著水平。方差分析发现其二次项对抑菌率的影响有显著差异,说明各试验因子对响应值的影响不是简单的线性关系。因此可以用该模型对培养液抑菌率进行分析和预测,也能够利用该回归方程确定最适液体培养条件。
根据回归方程得出不同因子的响应曲面分析图,如图4显示,固定其中4个因子而另2个变量因子可以三维模型展现其与响应值(抑菌率)的关系,响应面开口向下,存在最大值。由Design Expert 8.0.6软件预测出最大值点Y=80.9%,此时对应的最佳条件为:C/N为7.49,pH为4.71,装瓶量为33.13%,时间为21.79 d,转速为180 r·min-1,温度为31.56 ℃,但考虑到实际操作,可确定菌株M-1对油菜核盘菌抑制效果最好的液体培养条件为:C/N为7.5,pH为4.7,装瓶量为33%,时间为22 d,转速为180 r·min-1,温度为32 ℃。培养条件优化后,对油菜核盘菌的抑菌率高于未经优化的51.8%,抑菌效果大幅增加。
2.6 温室盆栽试验
由表4可见,各处理对油菜植株生长情况均有不同。CK水叶片数与CT2相等,略高于CT1,但3个处理间均未达到显著差异水平(P>0.05),CK病叶片数最少,与其他处理间均有显著差异(P<0.05)。CT1的株高、根长、茎围、湿重以及干重均高于CK病,仅根长、湿重和干重高于CT2。对油菜植株的病情指数和防病效果进行调查发现,菌株M-1处理的病情指数显著低于CK病和多菌灵处理(P<0.05),而防病效果达到71.4%,高于多菌灵处理,对油菜核盘菌的防病效果好于农药处理,说明菌株M-1具有田间应用潜力。
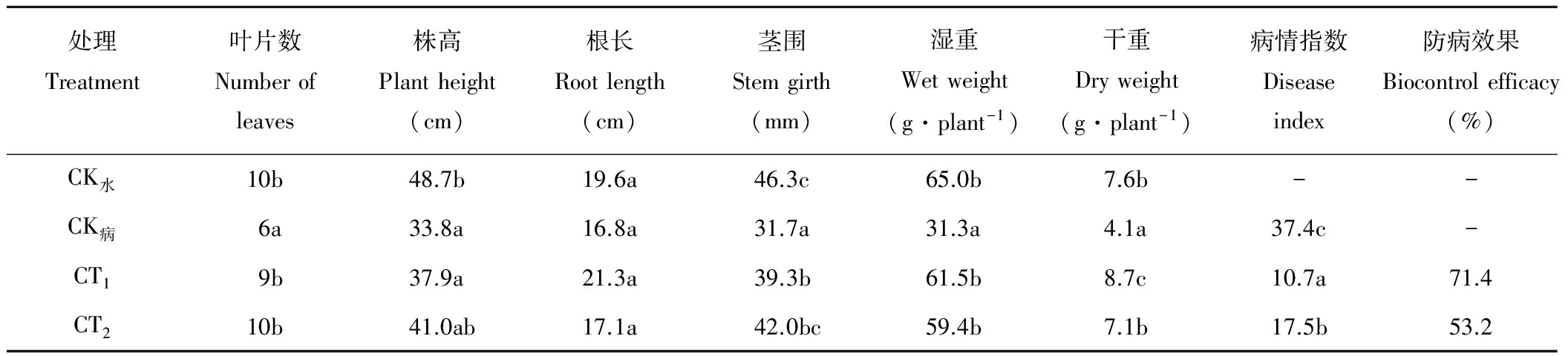
表4 盆栽试验中各处理对油菜生长及防病效果影响Table 4 Effects of different treatments on rapeseed growth and disease control in pot experiment
CK水为无菌水处理;CK病为油菜核盘菌的处理;CT1为接种油菜核盘菌和菌株M-1的处理;CT2为接种油菜核盘菌并喷施10 mL 80 μg·mL-1多菌灵的处理。CK-water was treatment with aseptic water; CK-disease was treatment withS.sclerotiorum; CT1was treatment withS.sclerotiorumand strain M-1 simultaneously; CT2was treatment withS.sclerotiorumand 10 mL 80 μg·mL-1carbendazim simultaneously.
3 讨论
利用生防菌进行油菜菌核病的防治已有大量研究,但是烟管菌对油菜核盘菌的生防研究至今未见报道。本研究以所分离、鉴定的烟管菌为出发菌株,初次探究了其对油菜核盘菌的抑制效果,进一步明确了其生防作用价值。结果表明,不论是活体菌株的体外抑菌还是菌株无菌滤液,对油菜核盘菌均有较好的抑制作用。显微观察发现,在菌落交界处两者的菌丝均发生变化,扫描电镜下显示菌株M-1菌丝直接穿插、刺透油菜核盘菌菌丝,使后者菌丝膨大、变形甚至破裂,表现出强烈的重寄生作用,而在盆栽试验中的防病效果达到71.4%,明显高于农药处理,充分说明菌株M-1对核盘菌具有较好的生防作用。与一些生防菌类似,烟管菌可通过与病原菌竞争营养物质、寄生于病原菌菌丝以及产生抑菌活性物质等作用机制来抑制或杀死病原菌,达到防病效果[30]。此外,烟管菌为木腐真菌,其子实体能产生大量具有抗菌活性代谢产物[19],这也可能会对油菜核盘菌的抑制效果起到重要作用。
生防菌寄生病原真菌的过程是通过产生吸器或者类似吸器的结构直接穿透靶标菌丝[31],或者是通过分泌溶解性及次级代谢产物来识别、接触并溶解病原真菌菌丝[32]。Ohberg等[33]发现盾壳霉能够寄生核盘菌的菌丝和菌核,从而控制由核盘菌引起的作物菌核病。也有研究[34-35]表明,盾壳霉在重寄生过程中,菌丝顶端可以直接穿透并侵入核盘菌的细胞壁。韩立荣等[14]报道了放线菌11-3-1菌株能够使油菜核盘菌的菌丝体发生畸形变化,菌丝肿胀、弯曲,菌丝体内原生质浓缩。本研究发现烟管菌M-1在生防作用中使油菜核盘菌菌丝形态发生变化,并可直接穿插、刺透油菜核盘菌菌丝,使后者菌丝膨大、变形甚至破裂,与前人研究基本相符。因此,可认为重寄生作用是生防菌对油菜核盘菌生物防治的主要作用机制之一。
利用微生物抑制油菜核盘菌的生防研究取得了一定进展,但是温度等环境因子会严重影响其防治效果[36]。杨蕊等[16]研究发现盾壳霉 Chy-1在改良的查彼液体培养基(Modified Czapek-Dox,MCD)的培养滤液经120 ℃处理后对核盘菌的抑菌活性有所下降,但其抑菌率仍达到49.5%,说明滤液中活性物质具有较强的热稳定性。为确保烟管菌M-1在温度较高的田间环境也能发挥生防作用,本研究检测了其代谢液的热稳定性,结果表明,其代谢滤液经80 ℃甚至100 ℃处理30 min后,抑菌率仍在35%以上,较好的热稳定性将有利于菌株在实际生产中有效防治油菜菌核病。
抗菌活性物质通常作为生防菌发挥生物防治作用的物质基础,其种类和产量均能影响生防菌株的实际应用效果。从盾壳霉培养滤液中鉴定出的内酯类抗生素和丝氨酸蛋白酶对核盘菌具有很强的抑制作用[37-38],而解淀粉芽孢杆菌(Bacillusamyloliquefaciens)产生的脂肽类代谢活性物质对油菜核盘菌具有强烈的抑制作用[39]。木霉菌则能够产生多种非挥发性代谢抑菌产物,诸如几丁质酶类、纤维素酶及木聚糖酶等蛋白酶类均参与核盘菌的生防作用[40]。本研究结果表明,菌株M-1无菌滤液对油菜核盘菌具有明显的抑制作用,说明其代谢液中抑菌物质的活性较高,但究竟是内酯类抗生素、脂肽类、蛋白酶类或其他活性物质在起抑菌作用尚不清楚,后续将针对其活性成分以及敏感性进行深入研究。
响应曲面法优化可以在合理范围内减少试验次数,考察不同变量及其之间的交互作用对相应值的影响,已经广泛应用于生物工程的条件优化中。蓝星杰[41]采用此方法优化了生防菌株SC11发酵条件,提升了发酵液对核盘菌的抑制效果。本研究采用单因素试验和响应曲面法对菌株M-1液体培养条件进行优化,确定了最佳条件组合:C/N为7.5,pH为4.7,装瓶量为33%,时间为22 d,转速为180 r·min-1,温度为32 ℃,优化后的抑菌率可以提升到80.9%。
本研究通过纯天然、无害化处理的生物防治手段对油菜菌核病进行了抑菌研究,其生防菌株完全来自自然生物,具有绿色、安全、无污染、无残留等特点,且在盆栽试验中的防病效果显著,但是,油菜植株-油菜核盘菌-烟管菌所构成的生物体系在病害发生与防治的复杂过程中的作用机制有待进一步深入研究,以便能够更好地开发利用该生防菌,从而最大效应地发挥其生防作用潜力。
4 结论
烟管菌M-1菌株作为生防真菌对油菜核盘菌具有一定的抑制效果,并且对核盘菌具有明显的重寄生作用,其无菌滤液具有热稳定性。通过单因素和响应曲面法对其液体培养条件优化后,确定了最佳条件组合,优化后的抑菌率可大幅提升。温室盆栽中对油菜菌核病的防病效果达到71.4%,高于多菌灵处理。因此,该菌株作为生防菌具有重要应用价值和开发前景。
References:
[1] Bolton M D, Thomma B H, Nelson B D.Sclerotiniasclerotiorum(Lib.) de Bary: biology and molecular traits of a cosmopolitan pathogen. Molecular Plant Pathology, 2006, 7(1): 1-16.
[2] Lu G. EngineeringSclerotiniasclerotiorumresistance in oilseed crops. African Journal of Biotechnology, 2003, 2(12): 509-516.
[3] Li H, Wen L, Liu K,etal. Research progress on resistance mechanism ofBrassicanapustoSclerotiniasclerotiorum. Crop Research, 2015, 29(1): 84-90.
李慧, 文李, 刘凯, 等. 油菜抗菌核病机制研究进展. 作物研究, 2015, 29(1): 84-90.
[4] Liu Z L, Liu C L. Progress on resistance to the sclerotinia stem rot ofBrassicanapus. Chinese Agricultural Science Bulletin, 2015, 31(15): 114-123.
刘正立, 刘春林. 甘蓝型油菜抗菌核病研究进展. 中国农学通报, 2015, 31(15): 114-123.
[5] Mei J, Qian L, Disi J O,etal. Identification of resistant sources againstSclerotiniasclerotioruminBrassicaspecies with emphasis onB.oleracea. Euphytica, 2011, 177(3): 393-399.
[6] Wang Y, Hou Y P, Chen C J,etal. Detection of resistance inSclerotiniasclerotiorum, to carbendazim and dimethachlon in Jiangsu Province of China. Australasian Plant Pathology, 2014, 43(3): 307-312.
[7] Qin H Q, Chen F Y, Fu D C,etal. Sensitivity ofSclerotiniasclerotioriumto 10 fungicides and controlling effect of different medicaments to the rapeSclerotiniastem rot in field. Journal of Northwest Agriculture and Forestry University (Natural Science Edition), 2011, 39(7): 117-122.
秦虎强, 陈芳颖, 付鼎程, 等. 油菜菌核病菌对10种杀菌剂的敏感性及不同药剂田间防效. 西北农林科技大学学报(自然科学版), 2011, 39(7): 117-122.
[8] Heydari A, Misachi I J. The role of rhizosphere bacteria in herbicide-mediated increase inRhizoctoniasolani-induced cotton seedling damping-off. Plant and Soil, 2003, 257(2): 391-396.
[9] Samuel M C, Zahangir K, Frank N M,etal. Comparison of crop rotation for Verticillium wilt management and effect onPythiumspecies in conventional and organic strawberry production. Plant Disease, 2009, 93(5): 519-527.
[10] Mancini V, Romanazzi G. Seed treatments to control seedborne fungal pathogens of vegetable crops. Pest Management Science, 2014, 70(6): 860-868.
[11] Kamalam A, Hashem M, Alie H. Integrated control of cotton root disease by mixing fungal biocontrol agents and resistance inducers. Crop Protection, 2009, 28(4): 295-301.
[12] Hu X J, Roberts D P, Xie L H,etal. Formulations ofBacillussubtilisBY-2 suppressSclerotiniasclerotiorumon oilseed rape in the field. Biological Control, 2014, 70(1): 54-64.
[13] Onaran A, Yanar Y. Screening bacterial species for antagonistic activities against theSclerotiniasclerotiorum(Lib.) de Bary causal agent of cucumber white mold disease. African Journal of Biotechnology, 2011, 10(12): 2223-2229.
[14] Han L R, Zhang H J, Gao B W,etal. Antifungal activity against rapeseedSclerotiniastem rot and identification of actinomycete strain 11-3-1. Journal of Plant Protection, 2012, 39(2): 97-102.
韩立荣, 张华姣, 高保卫, 等. 放线菌11-3-1对油菜菌核病的防治作用与菌株鉴定. 植物保护学报, 2012, 39(2): 97-102.
[15] Kausar N. Biocontrol potential ofTrichodermaspp. against rapeseed-mustard isolate ofSclerotiniasclerotiorum. Journal of Plant Protection and Environment, 2014, 11(2): 98-101.
[16] Yang R, Han Y C, Yang L,etal. Characterization of antifungal substances produced byConiothyriumminitansstain Chy-1. Chinese Journal of Biological Control, 2014, 30(4): 520-527.
杨蕊, 韩永超, 杨龙, 等. 盾壳霉菌株Chy-1抗真菌物质的基本特性研究. 中国生物防治学报, 2014, 30(4): 520-527.
[17] Xia L S, Lin H F. Antagonism ofBeauveriabassianaagainst several common pathogens. Chinese Journal of Biological Control, 2013, 29(2): 324-330.
夏龙荪, 林华峰. 白僵菌对几种常见植物病原菌的拮抗作用研究. 中国生物防治学报, 2013, 29(2): 324-330.
[18] Mier N, Canete S, Klaebe A,etal. Insecticidal properties of mushroom and toadstool carpophores. Phytochemistry, 1996, 41(5): 1293-1299.
[19] Stadler M, Sterner O. Production of bioactive secondary metabolites in the fruit bodies of macro fungi as a response to injury. Phytochemistry, 1998, 49(4): 1013-1019.
[20] Dománski S.Bjerkanderaadustaon youngQuercusrubraandQuercusroburinjured by late spring frosts in the upper Silesia industrial district of Poland. European Journal of Forest Pathology, 1982, 12(6): 406-413.
[21] Bak W C, Lee B H, Park Y A,etal. Characteristics of bed-log of shiitake damaged byBjerkanderaadustaand antagonism between these two fungi. The Korean Journal of Mycology, 2011, 39(1): 44-47.
[22] Wang H, Yu D Z, Guo J. Identification ofBjerkanderaadusta15 strain and study of antimicrobial activity//Proceedings of Academic Annual Conference of the China Society for the Protection of Plants in 2015. Changchun: Academic Annual Conference of the China Society for the Protection of Plants, 2015: 590.
汪华, 喻大昭, 郭坚. 一株多孔烟管菌菌株高氏15号的鉴定及抑菌活性研究//病虫害绿色防控与农产品质量安全-中国植物保护学会2015年学术年会论文集. 长春: 中国植物保护学会2015年学术年会, 2015: 590.
[23] Zhang X H, Zhang H N, Li Y,etal. Screening and identification of biocontrol fungi againstDidymellabryoniaeand optimization of fermentation conditions. China Biotechnology, 2017, 37(5): 76-86.
张旭辉, 张红楠, 李勇, 等. 抑制西瓜蔓枯病菌的生防真菌筛选、鉴定及发酵条件优化. 中国生物工程杂志, 2017, 37(5): 76-86.
[24] Xiang Y P, Chen Z Y, Luo C P,etal. The antifungal activities ofBacillusspp. and its relationship with lipopeptide antibiotics produced byBacillusspp. Scientia Agricultura Sinica, 2015, 48(20): 4064-4076.
向亚萍, 陈志谊, 罗楚平, 等. 芽孢杆菌的抑菌活性与其产脂肽类抗生素的相关性. 中国农业科学, 2015, 48(20): 4064-4076.
[25] Campanile G, Ruscellia, Luisi N. Antagonistic activity of endophytic fungi towardsDiplodiacorticolaassessed byinvitroand in planta tests. European Journal of Plant Pathology, 2007, 11(7): 237-246.
[26] Shao X, Cheng S, Wang H,etal. The possible mechanism of antifungal action of tea tree oil onBotrytiscinerea. Journal of Applied Microbiology, 2013, 114(6): 1642-1649.
[27] He Z, Wang J, Oh J,etal. Robust optimization for multiple responses using response surface methodology. Applied Stochastic Models in Business and Industry, 2010, 26(2): 157-171.
[28] Wang X Y. Screening ofVerticilliumdahliaepathogenicity-related mutants and functional analysis of the pathogenic gene VdCYP1. Beijing: Chinese Academy of Agricultural Sciences, 2015.
王新艳. 大丽轮枝菌致病相关突变体的筛选及致病基因VdCYP1功能初步研究. 北京: 中国农业科学院, 2015.
[29] Smith V L, Wilcox W F, Harman G E. Potential for biological control ofPhytophthoraroot and crown rots of apple byTrichodermaandGliocladiumspp. Phytopathology, 1990, 80(9): 880-885.
[30] Rosa D R, Herrera C J. Evaluation ofTrichodermaspp. as biocontrol agents against avocado white root rot. Biological Control, 2009, 51(1): 66-71.
[31] Chen Z M, Gu G, Chen S H,etal. Antagonism ofTrichodermaspp. toPhytophthoraparasiticavar.nicotianae. Journal of Fujian Agricultural and Forestry University (Natural Science Edition), 2009, 38(3): 234-237.
陈志敏, 顾钢, 陈顺辉, 等. 木霉菌对烟草疫霉的拮抗作用. 福建农林大学学报(自然科学版), 2009, 38(3): 234-237.
[32] Eziashi E I, Uma N U, Adekunile A A,etal. Biological control ofCeratocystisparadoxacausing black seed rot in oil palm sprouted seeds byTrichodermaspecies. Pakistan Journal of Biological Science, 2006, 9(10): 1987-1990.
[33] Ohberg H, Bang U. Biological control of clover rot on red clover byConiothriumminitansunder natural and controlled climatic conditions. Biocontrol Science and Technology, 2010, 20(1): 25-36.
[34] Vrije T D, Antoine N, Buitelaar R M,etal. The fungal biocontrol agentConiothyriumminitans: production by solid-state fermentation, application and marketing. Applied Microbiology and Biotechnology, 2001, 56(1): 58-68.
[35] Huang H C, Kokko E G. Penetration of hyphae ofSclerotiniasclerotiorumbyConiothyriumminitanswithout the formation of appressoria. Journal of Phytopathology, 1988, 123(2): 133-136.
[36] Kredics L, Antal Z, Manczinger L,etal. Influence of environmental parameters onTrichodermastrains with biocontrol potential. Food Technology and Biotechnology, 2003, 41(7/8): 37-42.
[37] Tomprefa N, Mcquiken M P, Hill R,etal. Antimicrobial activity ofConiothyriumminitansand its macrolide antibiotic macrosphelide A. Journal of Applied Microbiology, 2009, 106(6): 2048-2056.
[38] Xie X L, Yang L, Wu M D,etal. Culture condition and characterization of factors affecting activity of the extracellular proteases produced by mycoparasiteConiothyriumminitans. Chinese Journal of Biological Control, 2016, 32(3): 406-413.
谢晓莉, 杨龙, 吴明德, 等. 重寄生真菌盾壳霉胞外蛋白酶产生条件及酶活影响因子. 中国生物防治学报, 2016, 32(3): 406-413.
[39] Guo Z H, Huang J, Wei X W,etal. Isolation and identification of a broad spectrum antagonistic bacteria and its antibiotic component analysis. Journal of Hunan Agricultural University (Natural Sciences), 2014, 40(5): 513-518.
郭照辉, 黄军, 魏小武, 等. 1株广谱拮抗菌的分离鉴定及其抗菌活性成分分析. 湖南农业大学学报(自然科学版), 2014, 40(5): 513-518.
[40] Tijerino A, Cardoza R E, Moraga J,etal. Overexpression of the trichodiene synthase genetri5 increases trichodermin production and antimicrobial activity inTrichodermabrevicompactum. Fungal Genetics and Biology, 2011, 48(3): 285-296.
[41] Lan X J. Study on disease prevention and growth promotion effects of two biocontrol agents in the field and their mechanism by laboratory test. Shaanxi: Northwest Agriculture and Forestry University, 2015.
蓝星杰. 两种生防菌田间防病促生作用及其机理研究. 陕西: 西北农林科技大学, 2015.
