稻作条件下不同施肥模式对盐碱化土壤细菌和古菌群落结构的影响
2018-03-26肖国举
李 明,马 飞,肖国举
(宁夏大学环境工程研究院,银川 750021)
2000年以来,我国在黄河河套地区的内蒙古土默川平原、宁夏西大滩等地开展了利用脱硫废弃物改良盐碱地施用技术的田间试验研究,取得了初步成果。脱硫废弃物主要成分为CaSO4和CaSO3的混合物,并富含S、Ca、Si等植物必需或有益的矿质营养,Ca是排在N、P、K、S之后的第5种营养元素,它可以增强作物对病虫害的抵抗能力,使作物茎叶粗壮、籽粒饱满,增施钙肥可以显著提高作物的产量与品质。脱硫废弃物在一定程度上能够松土、保湿、改良土壤理化性质,促进植物对养分和水分的吸收,经过洗涤和滤水处理的脱硫废弃物含有10%~20%的游离水,颗粒细小、松散、均匀,粒径为 30~60 μm,纯度为 90%~95%,含碱量低,有害杂质少。据调查,脱硫废弃物为宁夏当地常见的废弃物,合理利用工业废弃物,不仅可以缓解环境压力,还可以获得巨大的经济效益。因此,脱硫废弃物用于盐碱土的改良有广泛的应用前景。
土壤细菌是土壤微生物的重要组成部分,在土壤有机质分解、腐殖质形成、养分转化与吸收等过程中起到重要作用,其群落结构组成及多样性变化是表征土壤环境质量的敏感指标,因此在土壤生态学研究中,土壤细菌群落的变化逐渐成为人们探索的重要方向之一。以往对稻田微生物的研究主要集中于有关物质转化的功能细菌群落,如硫氧化细菌[1]、硫酸盐还原细菌[2]、反硝化细菌[3]、甲烷氧化细菌[4]等。随着现代农业技术的快速发展,大量施用化肥[5]、化学农药[6]和种稻技术[7]的变革等对稻田土壤微生物多样性产生了很大的影响。宁夏地处西部干旱地区,水稻种植形成的湿地系统对于改善当地的生态系统起到极其重要的作用。开垦大面积盐碱化荒地种植水稻有利于改善当地生态环境,水稻种植过程中势必会引起土壤生物化学性质的改变,尤其是敏感的土壤微生物群落结构会发生相应变化,进而影响到土壤生态系统功能的发挥和稳定并带来一系列的生态问题。但是目前对于干旱区稻作盐碱化土壤细菌多样性及其与环境相互关系的研究还鲜见报道。
土壤古菌主要分布在广古菌和泉古菌两大门中,旱地土壤中以泉古菌为主[8]。尽管古菌在生态系统中的分布和数量已被广泛研究,然而在中国仅开展的少量研究多集中在水域系统,例如热泉[9]、海洋沉积物[10]和湖泊[11]等。近年来国内也有研究者对一些特殊的古菌如氨氧化古菌、产甲烷古菌等展开了研究,但对于稻作盐碱化土壤中古菌的丰度,特别是古菌在盐碱化土壤中的分布及其影响的相关报道较少。
施肥是提高农田生产力和作物产量的一项重要生产方式。本试验的研究对象为宁夏西大滩盐碱荒地,该区域存在的主要问题是地下水位高,土壤脱盐后返盐明显且速度快,土壤湿度大、通透性差,严重影响作物的出苗和生长,在不采取任何改良措施的情况下,种植作物一般难以成活。针对该区域特点,本试验在设置排盐沟、深松耕、施用脱硫废弃物等措施的基础上种植水稻。根据调查研究,在盐碱地种稻改良过程中增施有机肥不仅可以提高土壤有机质含量,而且可以改善土壤理化性状,增强土壤保水保肥能力,还可以抑制土壤返盐。所以我们设置不同有机肥梯度,试图在合理配施的条件下提高作物的利用效率,以期达到改良培肥的效果,探究在施用脱硫废弃物的条件下与有机肥配施时土壤微生物群落结构、有机质及有效养分、pH值、盐分的情况。
本研究以宁夏西大滩稻作盐碱化土壤为研究对象,借助高通量测序平台和现代生物信息学技术,表征施用化学改良剂和有机肥条件下土壤细菌和古菌的群落结构特征和组成差异,分析群落结构与环境因子的相关关系及主效环境因子,为揭示宁夏典型盐碱化土壤肥力演变机制、建立合理的施肥制度提供理论支持。
1 材料与方法
1.1 试验区概况
小区试验于2016年4月中旬—8月底在宁夏银北平罗县西大滩前进农场改良试验基地进行。试验基地位于东经 106°13′~106°26′,北纬 38°45′~38°55′,海拔 1091~1102 m,年均降水量 172.5 mm,7、8、9 三个月降水量占66.6%,年平均蒸发量达1755 mm,全年平均相对湿度为56%,年平均日照时数2800~3200 h,年最大风力9级,最大风速18 m·s-1,年平均气温8.5℃,昼夜温差8~15℃,极端最高气温30℃,极端最低气温-25℃;全年无霜期155 d[12]。
试验种植水稻为当地主栽耐盐品种吉粳105(节3),在大田中育秧至3叶期时,移栽至划分好的小区中。全生育期保持2~3 cm浅水层。脱硫废弃物的化学成分为 CaO 341.2 g·kg-1、SO3485.2 g·kg-1、Al2O310.0 g·kg-1、Fe2O35.5 g·kg-1、MgO 21.1 g·kg-1、TiO 0.5 g·kg-1、K2O 1.1 g·kg-1、Na2O 2.7 g·kg-1、MnO 0.2、P2O50.16 g·kg-1、Cl-5.7 g·kg-1,密度 1.03 g·cm-3,结晶水 111 g·kg-1,其他21.8 g·kg-1[13]。有机肥为腐熟羊粪,其理化性质为:pH 7.4,有机质 592 g·kg-1、全氮 20.4 g·kg-1、全磷 8 g·kg-1、碱解氮 1697 mg·kg-1、速效磷 741.2 mg·kg-1、速效钾 884.4 mg·kg-1。
1.2 试验设计
试验设置5个处理。对照CK:不施脱硫废弃物和有机肥;T1处理:单施脱硫废弃物31 250 kg·hm-2;T2处理:脱硫废弃物31 250 kg·hm-2+有机肥10 000 kg·hm-2;T3 处理:脱硫废弃物 31250kg·hm-2+有机肥 18000 kg·hm-2;T4处理:脱硫废弃物 31 250 kg·hm-2+有机肥25 000 kg·hm-2。每个处理3次重复,小区面积48 m2(6 m×8 m)。脱硫废弃物的施用量参照参考文献[13],有机肥的施用参照当地常规农用施肥量。
试验于2016年5月4日施肥翻地,5月7日灌水(引黄河水灌溉,生育期总灌水10次),5月19日播种,旱直播,每公顷播量375 kg,10月12日收获。
1.3 样品采集
于水稻成熟期2016年9月20日采集根层土壤(2~20 cm),采用多点采样的方法,每个试验小区分5点采集土样,充分混匀,将新鲜土样分成两份,一份低温冷藏带回实验室,在-20℃冷冻保存,用于土壤微生物的测定,另一份带回实验室室内风干用于测定pH值、电导率(EC)、有机碳和速效养分。
1.4 样品分析
1.4.1 土壤DNA的提取
土壤样品中总DNA的提取采用MoBio PowerSoil DNA Isolation Kit(Carlsbad,USA)试剂盒,提取过程按试剂盒说明书进行,得到DNA提取物后-20℃冻存。提取的DNA用浓度为1.0%的琼脂糖凝胶电泳确定DNA片段大小。
1.4.2 Illumina HiSeq测序及数据分析
本研究目标基因为细菌和古菌的16S rRNA V4区基因片段,所用引物为515F/806R。反应体系:15 μL Phusion High-Fidelity PCR Master Mix(New Eng land Biolabs,UK),Forward Primers(0.2 μmol·L-1),Reverse Primers(0.2 μmol·L-1),10 ng DNA 模板。扩增条件参照文献[14]。PCR产物用2%琼脂糖凝胶检测,将目标条带切胶回收纯化进行下一步分析。高通量测序由诺禾致源Illumina HiSeq 2500平台运行(Beijing,China,http://www.novogene.com/index.php),最后所测得数据在250~300 bp之间产生。
所测得原始序列截去Barcode序列和引物序列后,经 FLASH(V1.2.7,参数设置为-m 10-f 300—x 0.1-p 33—r 219-r 180-M 135)拼接获得原始数据Tags数据。原始Tags经QIIME过滤处理获得高质量Tags数据(Clean Tags),并与数据库(Gold database,http://drive5.com/uchime/uchime_download.html)进 行比对检测嵌合体序列,最终获得有效数据(Effective Tags)。测序深度为每个文库原始reads数不少于5万条。为获得土壤样品中细菌群落的多样性信息,使用UCLUST软件对所得序列进行聚类,并利用RDP classifier(V2.2)[15]软件与 GreenGene 数据库进行物种注释,统计每个样品在各分类水平上的构成。利用QIIME(V1.7.0)计算不同样品中细菌群落的α多样性和β多样性指数。
1.4.3 土壤属性和水稻产量测定
土壤pH值采用鲍士旦[16]的农化分析方法进行测定;电导率采用电导法;有机碳采用重铬酸钾容量法;全氮采用凯氏定氮法[16];全磷采用酸溶-钼锑抗比色法;碱解氮用碱解扩散法;速效磷用Oslen法;速效钾采用乙酸铵提取-原子吸收火焰光度计法;无机氮(NO-3-N、NH+4-N)以 2 mol·L-1氯化钾溶液浸提,采用连续流动分析仪(AA3,德国)测定。水稻产量每小区单打独收。
1.5 数据处理
利用SAS中Duncan法检验不同处理土壤属性和微生物指标间的差异显著性,RDA分析采用Conoco(5.0)软件,绘图使用 OriginPro 8 软件。
2 结果与分析
2.1 不同施肥模式水稻土壤细菌和古菌群落α多样性分析
不同施肥处理土壤细菌与古菌多样性指数Shannon、Simpson和丰富度指数Chao1如表1所示。Shannon指数和Simpson指数表明,与CK相比较,T2、T3和T4处理土壤细菌多样性升高,其中细菌Shannon指数在T4处理中显著高于CK和T1(P<0.05),Simpson指数各处理间差异不显著;4个施肥处理使得古菌的多样性下降,但与CK相比差异不显著。Chao1指数表明,T4处理细菌的丰富度最高,T3最低,但差异并不显著;4种施肥处理古菌丰富度均低于CK,其中T3最低。
2.2 细菌和古菌群落在门水平的变化分析
土壤样品细菌占总量的50.2%~67.3%,古菌占32.2%~49.4%。土壤细菌和古菌在门分类水平上的相对丰度如图1。其中,Proteobacteria和Bacteroidetes是盐碱化耕层水稻土壤(2~20 cm)细菌中的优势菌群,分别占细菌的25.7%~31.2%和22.9%~28.1%。
Proteobacteria在5个处理中都是相对丰度最高的门,与CK相比,施用脱硫废弃物和有机肥料的T2、T3和T4处理Proteobacteria相对丰度提高了14.0%~36.4%,T1处理降低了9.2%,不同施肥模式引起土壤Proteobacteria群落组成差异显著。Gammaproteobac teria、Alphaproteobacteria、Deltaproteobacteria 和 Be taproteobacteria是Proteobacteria中相对丰度最高的4个菌群,其中:Gammaproteobacteria相对丰度最高,占所有细菌的5.7%~11.8%;与CK相比,T2、T3和T4处理中Alphaproteobacteria的相对丰度分别升高了17.5%、18.6%和 28.7%;Deltaproteobacteria的相对丰度升高了14.3%、4.1%和11.1%。T1处理中Gammaproteobacteria、Alphaproteobacteria、Deltaproteobacteria和Betaproteobacteria的相对丰度均下降,与CK相比分别下降了 33.5%、19.9%、14.0%和13.2%(表 2)。
Bacteroidetes在5个不同处理中是第2大优势菌门,与CK相比,Bacteroidetes相对丰度在T1、T2、T3和T4中提高了29.3%~56.3%;不同施肥模式对Bac teroidetes群落结构影响显著。Bacteroidetes相对丰度较高的 6 个菌群为 Cytophagia、Flavobacteria、Bacteroidia、Clostridia、Sphingobacteria和vadinHA17(表2)。其中,与CK相比,4个施肥处理中Cytophagia在T1、T3和T4处理中相对丰度分别提高了0.7%、111.1%和5.5%;Bacteroidia的相对丰度在T2处理中提高68.5%;Clostridia的相对丰度在T1、T2、T3和T4中分别下降了 57.8%、72.2%、57.4%、42.0%;Sphingobacteria的相对丰度在 T1、T2、T3和 T4中分别下降了34.5%、19.4%、51.3%和61.5%。可见,脱硫废弃物和有机肥混合施用可以提高Cytophagia和Bacteroidia的相对丰度,降低了Clostridia和Sphingobacteria的相对丰度。
除此之外,其他类群的相对丰度也发生了改变:T4处理增加Chloroflexi、Bacteroidetes的丰度,降低了Acidobacteria和Actinobacteria的丰度。而Proteobacteria和Firmicutes的相对丰度对不同施肥响应存在差异。
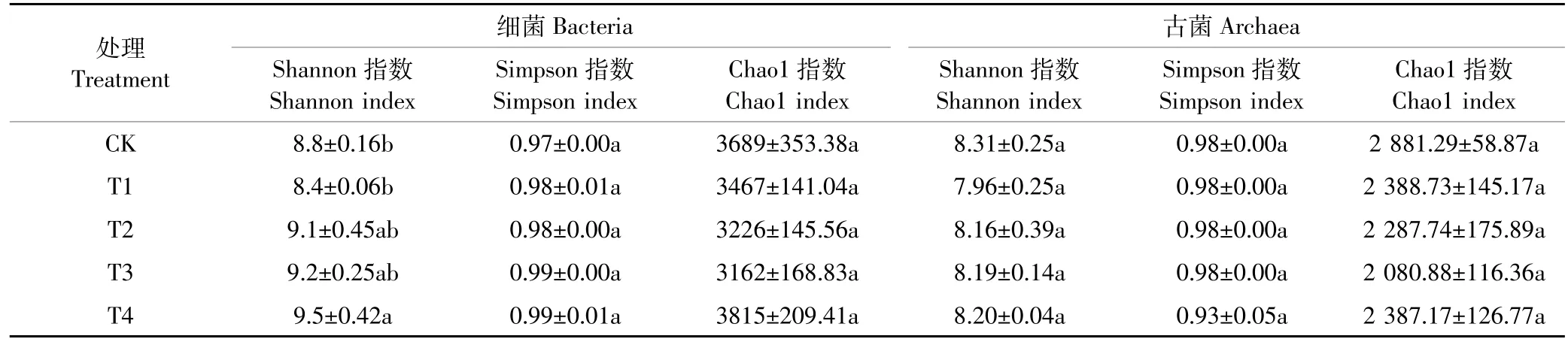
表1 不同施肥处理细菌和古菌α-多样性指数Table 1 α-diversity index of soil bacteria and archaea under different treatments

图1 不同施肥模式水稻土壤细菌各门类相对丰度图Figure 1 The relative abundance of bacterial phylum of different fertilization patterns in paddy soils

图2 不同施肥模式对门水平古菌相对丰度的影响Figure 2 The relative abundance of soil archaea on phylum level under different fertilization regimes
土壤古菌在门分类水平上的相对丰度见图2,包括 Euryarchaeota、MCG、Thaumarchaeota 和 Woesearcha-eota_.DHVEG-6.四类菌群。其中Euryarchaeota是盐渍化水稻土耕层土壤(2~20 cm)古菌中的优势菌群,占古菌的7.0%~27.5%。与CK相比,T1、T2和T3处理的Euryarchaeota相对丰度分别提高了115.2%、90.8%和41.6%;T4处理的Euryarchaeota相对丰度降低了41.1%,可见不同施肥模式可以影响土壤中Euryarchaeota的相对丰度,其中T2处理的影响更大。另外,T4处理显著提高了MCG的相对丰度,提高了61.3%。
2.3 细菌和古菌群落在属水平的变化分析
进一步从属水平对不同样品中细菌的相对丰度变化分析表明,相对丰度排名前35的细菌和古菌属的总比例占土壤测序read数的20.6%~27.2%。与CK相比,Lutibacter、Alkaliflexus、Galbibacter、Rhodonellum、Sphingorhabdus、Sunxiuqinia、MSBL7 的 相 对 丰 度 在T4处理组中较高,而 Halalkalicoccus、Halopiger、Haloterrigena、Candidatus_Halobonum、Anaerolinea、Halomicrobium在T1和T2处理中相对丰度较高(图3)。Gillisia、unidentified_Thaumarchaeota、Lysobacter、Romboutsia的相对丰度在CK组含量最高。
2.4 土壤化学性质和水稻产量分析
T4与CK组土壤相比,提高了有机碳(6.74%)、碱解氮(37.20%)、速效磷(47.83%)和铵态氮(96.26%),差异均达到显著水平(P<0.05)(表3)。可见随着有机肥含量的增加,土壤有机质含量呈增加趋势;在脱硫废弃物含量相同的情况下,土壤碱解氮和铵态氮都显著增加,原因可能是施用有机肥可增加土壤中有机氮的来源。另外,土壤速效磷含量随施用有机肥量的增加有逐渐增加的趋势,由此可见,土壤中速效磷含量与有机肥含量具有较高的相关性。因此,单施脱硫废弃物或少量配施有机肥对土壤的改良效果不及两者配施。另外,虽然统计分析结果不显著,但是pH值在不同施肥模式处理中都有所降低。从以上结果可以看出,脱硫废弃物和有机肥混合施用对土壤化学性质产生了显著影响。不同处理作物产量由高到低依次为T4>T3>T1>T2>CK,不同处理间差异显著,混合施用改良剂和有机肥对作物产量的贡献明显。
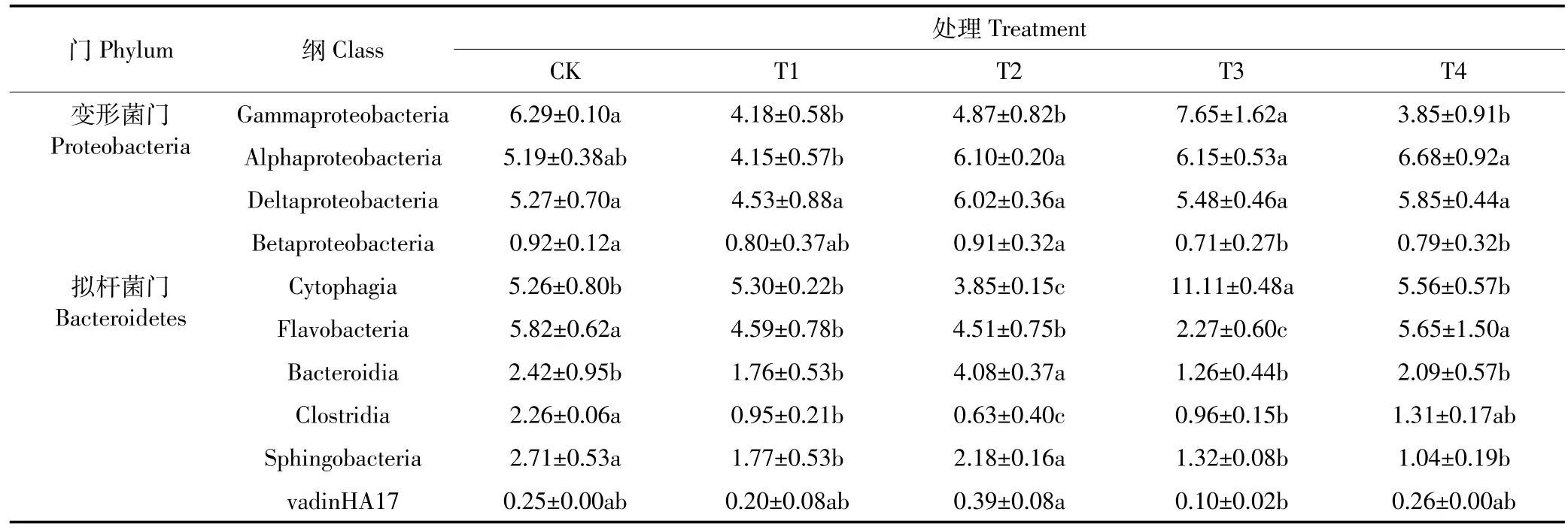
表2 细菌变形菌门和拟杆菌门在不同施肥处理水稻土壤中相对丰度(%)的变化Table 2 Changes of relative abundance(%)of Proteobacteria and Bacteroidetes of different fertilization patterns in paddy soils
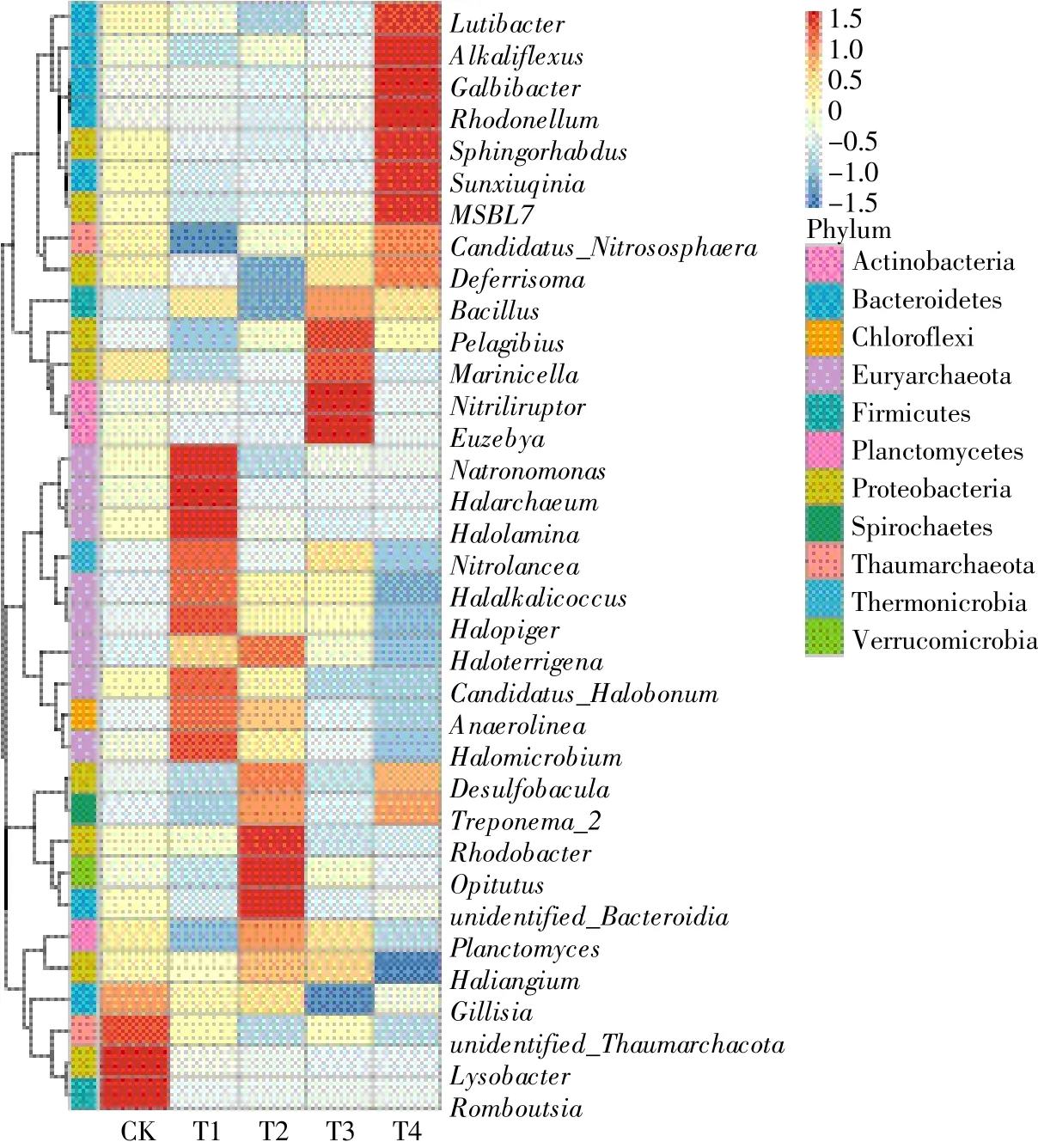
图3 不同施肥模式水稻土壤优势细菌和古菌属类相对丰度Figure 3 The relative percentages of the bacterial and archaea genus of different fertilization patterns in paddy soils
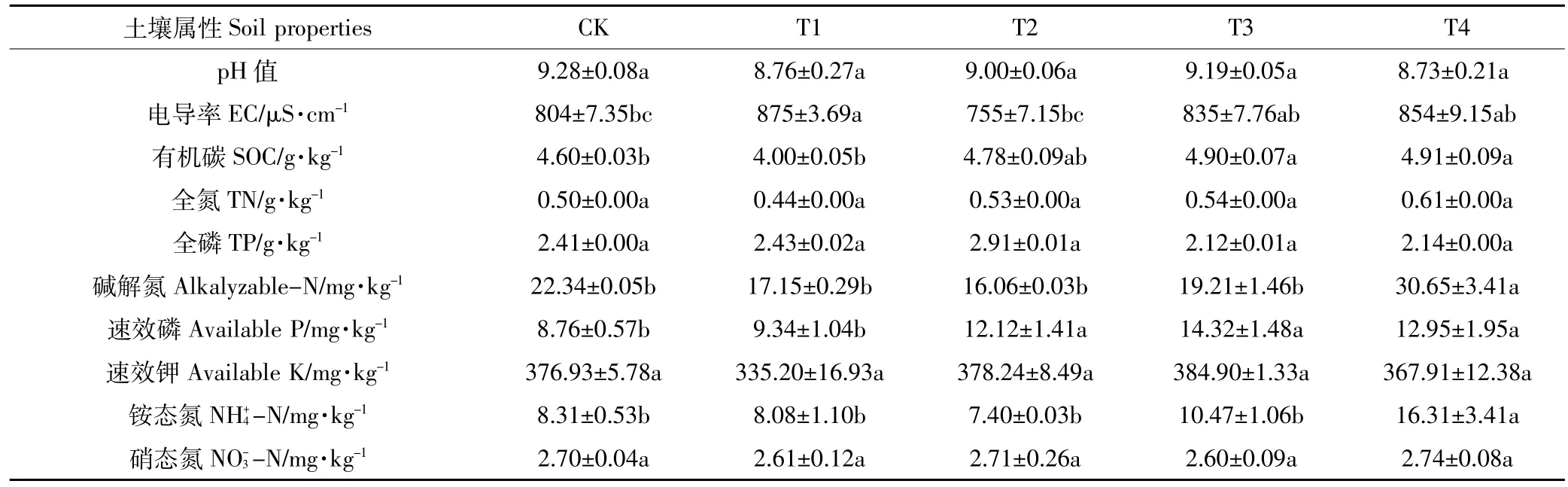
表3 不同施肥模式水稻土壤属性Table 3 The changes of soil properties under different fertilization patterns in paddy soils
2.5 RDA分析
将各处理所得的细菌和古菌门水平相对丰度与土壤环境因子进行了RDA分析,结果(图4)表明,所有的环境因子解释了细菌和古菌群落100%的变化,贡献大小依次为硝态氮>全磷>pH>速效钾>电导率。基于这个模型,两个排序轴共解释66.6%的变化,其中第一排序轴解释了43.5%的变化,第二排序轴解释了23.1%的变化。在二维排序图中,箭头连线的长短表示群落与该环境因子之间相关系数的大小,箭头连线与排序轴的夹角表示该环境因子与排序轴相关性的大小,夹角越大,其相关性越小。RDA分析结果表明,硝态氮解释了土壤细菌和古菌群落(P=0.04)70.9%的变化,是影响土壤细菌和古菌群落结构的主效环境因子。从图4中也可以看到,CK、T1、T2和T3处理的细菌和古菌群落结构变化较为相似,T4处理细菌和古菌群落结构变化显著。研究结果表明,硝态氮与细菌和古菌群落的影响最为显著,表明环境因子显著影响微生物群落结构变化。
2.6 影响土壤细菌和古菌菌群结构的因子分析
各处理的优势菌群相对丰度与土壤理化指标Pearson相关性检验结果见表4。Chloroflexi与全磷和硝态氮呈显著正相关;Acidobacteria与碱解氮和电导率呈显著正相关;Actinobacteria与速效磷和速效钾呈显著正相关;Gemmatimonadetes与碱解氮呈显著负相关;Euryarchaeota与pH值和速效钾呈显著负相关;Woesearchaeota与速效磷呈显著负相关;Gammaproteobacteria与pH值呈显著正相关;Sphingobacteriia与pH值呈显著正相关,与电导率呈显著负相关。RDA分析和Person相关性分析得出基本相似的结果:硝态氮、全磷、速效钾和pH值都是影响土壤细菌群落的主要环境因子。
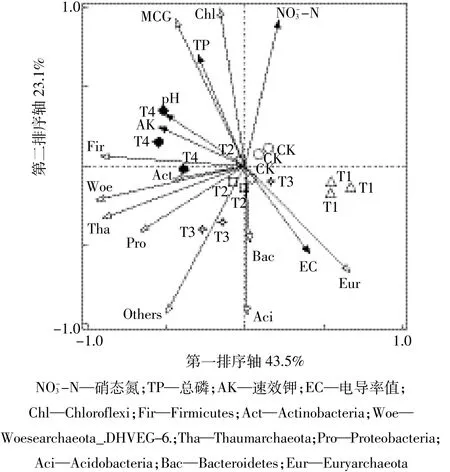
图4 不同施肥方式土壤性质与细菌和古菌群落的RDA分析Figure 4 Results from redundancy analysis(RDA)to explore the relationship between soil bacterial and archaeal community and soil physicochemical characteristics
3 讨论
本文采用Illumina高通量测序技术,分析了土壤细菌和古菌系统发育类群,研究了盐碱化水稻土壤微生物群落结构及其对不同施肥处理的响应。结果表明,土壤微生物种群多样性高,覆盖了9个细菌类群和2个古菌类群,其中Proteobacteria和Bacteroidetes是稻田的优势菌群,其次是Chloroflexi,而古菌域中Eurgarchaeota是优势古菌。以前研究多集中于单一细菌域或古菌域,没有同时对两个群落结构进行分析。如Jangid等[17]分析了不同类型的耕作土壤细菌种群结构,发现Proteobacteria占统治地位,占30.6%~43.2%;其次是Acidobacteria,占17.1%~26.2%。Hansel等[18]在不同地带性土壤中也发现了9种主要类型细菌,其中Proteobacteria和Acidobacteria分别占整个克隆文库的39%和20%。本研究发现,Proteobacteria和Bacteroidetes在盐碱化水稻土壤中占绝对优势,这可能是由于不同土壤类型导致土壤中优势菌群会有所差异。其中Proteobacteria的纯培养主要分离自土壤、粪便、厌氧活性污泥等,可利用淀粉、长链脂肪酸及氨基酸等,具有水解作用,部分具有脱氮作用[19]。Bacteroidetes是第二大优势种群,主要分离自海底、肠道、厌氧反应器等厌氧环境,有降解大分子碳水化合物产酸的功能。
本研究中,施用有机肥的T2、T3和T4处理组Proteobacteria、Bacteroidetes和 Chloroflexi相对丰度都提高了,可见施用有机肥可以通过其含有的营养元素直接影响土壤化学性质,也可以通过影响作物生长,进而影响作物分泌物和土壤有机碳含量,来改变不同土壤类型土壤微生物的生物量和相对丰度[20]。相反,单施脱硫废弃物处理(T1)土壤有机质、氮、磷等营养元素没有明显增加,但是脱硫废弃物的施用刺激了某一类或几类(群)微生物生长,特别是Euryarchaeota的生长,而其他类群微生物如:Gammaproteobacteria、Alphaproteobacteria、Deltaproteobacteria 和 Betaproteobacteria的相对丰度降低,以致与CK相比,土壤微生物多样性有所下降。
不同施肥处理导致稻田土壤微生物群落结构和多样性差异明显。本研究供试稻田土壤仅农田管理制度(施肥处理)不同,但造成土壤理化性质差异很大,从而影响土壤微生物群落结构和多样性。施用有机肥后碱解氮和铵态氮显著提高,其中T4处理的碱解氮和铵态氮分别提高了37.2%和96.26%,总氮也较CK提高19.60%。氮素是土壤微生物群落结构的重要影响因素,长期施用氮肥可改变土壤细菌群落结构[21]。本研究中硝态氮是影响微生物群落结构变化的主环境因子。水稻土氮磷钾等营养元素和有机质含量较高[22],脱硫废弃物和有机肥以及作物残茬为微生物的生长和繁衍提供了丰富的碳源和能源,因此施用脱硫废弃物和有机肥含量最高的处理土壤细菌的丰度高于不施肥和少量施肥处理。

表4 土壤优势菌群与土壤化学性质Pearson相关性分析Table 4 Pearson correlation coefficient between soil dominant bacterial communities and soil chemical characteristics
pH值的改变也会极大地影响微生物的群落结构[23]。在世界范围内,不同植被覆盖、不同土壤类型,微生物群落组成及群落相对丰度变化均与土壤pH值密切相关[24-26]。本研究中,pH值与Euryarchaeota、Gammaproteobacteria和Sphingobacteria均显著相关。供试土壤中T1~T4处理施用了脱硫废弃物,施用脱硫废弃物后盐碱化土壤pH值显著下降,在前期研究中已得到证实[27]。另外,施用的有机肥料中的氮素在溶解过程中产生大量H+,使土壤pH值下降。沈菊培等[28]研究发现在碱性潮土中,土壤古菌与pH值没有显著相关性,这与本研究结果不同,盐碱化水稻土壤中pH值从不施肥处理的9.28降到T4处理的8.73,尽管差异不显著,但pH值的变异较大。
磷是植物所必需的大量营养元素之一。目前的研究发现,土壤中存在的大量解磷微生物能够辅助植物吸收磷元素[29]。例如Rodríguez等[30]发现假单胞杆菌、芽孢杆菌和根瘤菌的许多菌株均具有强大的解磷功能。尹瑞玲[31]从土壤中分离出的巨大芽孢杆菌、节细菌、黄杆菌、欧文氏菌及假单胞菌均具有较强的溶磷能力。相关性分析发现,Chloroflexi与全磷,Actinobacteria、Woesearchaeota与速效磷显著相关,表明土壤磷含量升高能够对微生物群落产生较大影响。全磷及速效磷含量变化与稻作盐碱化土壤微生物群落组成仍有待进一步验证。
钾是作物生长发育过程中必需的营养元素之一,也是作物吸收量最多的元素之一。有机肥单施或与无机肥配施均可提高土壤速效钾含量[32],这也许是有机肥本身所含的钾不断施入,以及有机胶体在其交换表面具有保持养分的巨大能力的缘故。本研究结果表明随着有机肥施用量的增加,速效钾在各处理间无显著差异。当前农田常规施肥方式下的钾亏缺正在逐步加大,通过补充钾肥或配合施用有机肥来增加土壤中钾的含量的方式应当被重视。有研究表明,配施有机肥或秸秆均可显著提高灰漠土钾肥利用率[33]。Pearson相关性分析显示Actinobacteria和Euryarchaeota与速效钾显著相关。RDA分析结果也进一步证明速效钾对稻田土壤微生物群落结构影响显著。土壤钾含量与作物产量和微生物丰度呈显著相关,且缓效钾是被作物吸收的主要钾源。
Kemnitz等[34]用不同的引物定量了德国马尔堡附近森林土壤细菌(109)和古菌(108)16S rRNA 基因数量,发现细菌16S rRNA基因拷贝数远高于古菌数量,与本研究结果基本一致。本研究结果中发现细菌的多样性指数显著高于古菌多样性指数,究其原因,可能是细菌和古菌适应生存的生境不同:很多古菌生存在极端环境中,仅一些古菌是嗜中性的,能够在沼泽、废水和土壤中生存;而细菌包含多种代谢种类和营养类型,能够适应更多、更复杂的生态位[35]。因此复杂环境土壤中的细菌丰度和多样性远高于古菌。
本研究仅表征了短期施脱硫废弃物和有机肥条件下细菌和古菌群落结构与土壤化学性质,探讨了两者间的耦合关系,实际上,长期的改良剂和有机肥配合施用会对细菌和古菌群落结构存在影响,应将继续深入开展不同改良剂和不同有机肥的不同配比的长期施用对作物-微生物-环境因子三者间互作机理的研究,为根本上阐述不同施肥模式对宁夏盐碱化土壤肥力的影响提供参考。
4 结论
(1)在盐碱化地区水稻生产中脱硫废弃物配施一定比例有机肥是协调作物产量和环境效益的合理选择,以优化施用脱硫废弃物31 250 kg·hm-2并配施有机肥25 000 kg·hm-2效果最佳。
(2)施用脱硫废弃物和有机肥料提高了Proteobacteria和Euryarchaeota相对丰度。
(3)RDA分析表明,稻作条件下不同施肥模式盐碱化土壤环境因子对细菌和古菌群落结构的影响显著,其中硝态氮、全磷、速效钾和pH值都是影响土壤细菌群落的主要环境因子。
[1]Graff A,Stubner S.Isolation and molecular characterization of thiosulfate-oxidizing bacteria from an Italian rice field soil[J].Systematic and Applied Microbiology,2002,26(3):445-452.
[2]陈中云,闵 航,张夫道,等.农药污染对水稻土壤硫酸盐还原菌种群数量及其活性影响的研究[J].土壤学报,2004,41(1):97-102.CHEN Zhong-yun,MIN Hang,ZHANG Fu-dao,et al.Effects of pesticide-contamination on population and activity of sulfate-reducing bacteria in paddy rice soils[J].Acta Pedologica Sinica,2004,41(1):97-102.
[3]陈中云,闵 航,吴伟祥,等.农药污染对水稻田土壤反硝化细菌种群数量及活性的影响[J].应用生态学报,2003,14(10):1765-1769.CHEN Zhong-yun,MIN Hang,WU Wei-xiang,et al.Effects of pesticide-contamination on population size and denitrification activity of denitrifying bacteria in paddy soils[J].Chinese Journal of Applied Ecology,2003,14(10):1765-1769.
[4]Gundula E,Martin K,Peter F.Comparing field and microcosm experiments:A case study on methano-and methyl-trophic bacteria in paddy soil[J].FEMS Microbiolgy Ecology,2005,51(2):279-291.
[5]钟文辉,蔡祖聪,尹力初,等.用PCR-DGGE研究长期施用无机肥对种稻红壤微生物群落多样性的影响[J].生态学报,2007,27(10):4011-4018.ZHONG Wen-hui,CAI Zu-cong,YIN Li-chu,et al.The effects of the long-term application of inorganic fertilizers on microbial community diversity in rice-planting red soil as studied by PCR-DGGE[J].ActaEcologicaSinica,2007,27(10):4011-4018.
[6]李 慧,张 颖,苏振成,等.沈抚石油污水灌区稻田土壤细菌遗传多样性:16S rDNA PCR-DGGE 分析[J].土壤学报,2006,43(6):972-980.LI Hui,ZHANG Ying,SU Zhen-cheng,et al.Analysis of bacterial genetic diversity in paddy soil in Shenfu irrigation zone irrigated with wastewater from petroleum industry:By denaturing gradient gel electrophoresis and sequencing of PCR-amplified of 16S ribosomal DNA fragments[J].ActaPedologicaSinica,2006,43(6):972-980.
[7]王 英,腾齐辉,崔中利,等.免耕水稻土壤中细菌多样性及其空间分布的研究[J].土壤学报,2007,44(1):137-143.WANG Ying,TENG Qi-hui,CUI Zhong-li,et al.Diversity and spatial distribution of bacteria in non-tillage paddy fields[J].Acta Pedologica Sinica,2007,44(1):137-143.
[8]Timonen S,Bomberg M.Archaea in dry soil environments[J].Phytochemistry Reviews,2009,8(3):505-518.
[9]Song Z Q,Chen J Q,Jiang H C,et al.Diversity of crenarchaeota in terrestrial hot springs in Tengchong,China[J].Extremophiles,2010,14(3):287-296.
[10]Dang H Y,Zhang X X,Sun J,et al.Diversity and spatial distribution of sediment ammonia-oxidizing Crenarchaeota in response to estuarine and environmental gradients in the Changjiang Estuary and East China Sea[J].Microbiology,2008,154(7):2084-2095.
[11]Jiang H C,Dong H L,Yu B S,et al.Dominance of putative marine benthic archaea in Qinghai Lake,Northwestern China[J].Environmental Microbiology,2008,10(9):2355-2367.
[12]李凤霞,王学琴,郭永忠,等.宁夏不同类型盐渍化土壤微生物区系及多样性[J].水土保持学报,2011,25(5):107-111.LI Feng-xia,WANG Xue-qin,GUO Yong-zhong,et al.Microbial flora and diversity in different types of saline-alkali soil in Ningxia[J].Journal of Soil and Water Conservation,2011,25(5):107-111.
[13]肖国举,罗成科,白海波,等.脱硫石膏改良碱化土壤种植水稻施用量研究[J].生态环境学报,2009,18(6):2376-2380.XIAO Guo-ju,LUO Cheng-ke,BAI Hai-bo,et al.Research on the amount of desulfurized gypsum from the coal-burning power plant applied to improve the alkalized soil for paddy rice[J].Ecology and Environmental Sciences,2009,18(6):2376-2380.
[14]Caporaso J G,Lauber C L,Waters W A,et al.Global patterns of 16S rRNA diversity at a depth of millions of sequences per sample[J].PNAS,2011,108(Suppl):4516-4522.
[15]Caporaso J G,Kuczynski J,Stombaugh J,et al.QIIME allows analysis of high-throughput community sequencing data[J].Nature Methods,2010,7(5):335-336
[16]鲍士旦.土壤农化分析[M].三版.北京:中国农业出版社,2008:39-89.BAO Shi-dan.Soil and agriculture chemistry analysis[M].3rd Edition.Beijing:China Agriculture Press,2008:39-89.
[17]Jangid K,Williams M A,Franzluebbers A J,et al.Relative impacts of land-use,management intensity and fertilization upon soil microbial community structure in agricultural systems[J].Soil Biology and Biochemistry,2008,40(11):2843-2853.
[18]Hansel C M,Fendorf S,Jardine P M,et al.Changes in bacterial and archaeal community structure and functional diversity along a geochemically variable soil profile[J].Applied and Environmental Microbiology,2008,74(5):1620-1633.
[19]Lai Q L,Shao Z Z.Psedomonas xiamenensis sp.nov.,a denitrifying bacterium isolated from activated from activated sludge[J].Int J Syst Evol Microbiol,2008,58(8):1911-1915.
[20]Gao Q,Hasselquist N J,Palmroth S,et al.Short-term response of soil respiration to nitrogen fertilization in a subtropical evergreen forest[J].Soil Biology and Biochemistry,2014,76(1):297-300.
[21]武晓森,杜广红,穆春雷,等.不同施肥处理对农田土壤微生物区系和功能的影响[J].植物营养与肥料学报,2014,20(1):99-109.WU Xiao-sen,DU Guang-hong,MU Chun-lei,et al.Effects of different fertilization on structure and function of soil bacterial community[J].Journal of Plant Nutrition and Fertilizer,2014,20(1):99-109.
[22]袁红朝,吴 昊,葛体达,等.长期施肥对水稻田土壤细菌、古菌多样性和群落结构的影响[J].应用生态学报,2015,26(6):1807-1813.YUAN Hong-chao,WU Hao,GE Ti-da,et al.Effects of long-term fertilization on bacterial and archaeal diversity and community structure within subtropical red paddy soils[J].Chinese Journal of Applied Ecology,2015,26(6):1807-1813.
[23]Lauber C L,Hamady M,Knight R,et al.Pyrosequencing-based assessment of soil pH as a predictor of soil bacterial community structure at the continental scale[J].Applied and Environmental Microbiology,2009,75(15):5111-5120.
[24]Hackl E,Zechmeister B S,Bodrossy L,et al.Comparison of diversities and compositions of bacterial populations inhabiting natural forest soils[J].Applied Environmental Microbiology,2004,70(9):5057-5065.
[25]Kuske C R,Ticknor L O,Miller M E,et al.Comparison of soil bacterial communities in rhizospheres of tree plant species and the interspaces in an arid grassland[J].Applied Environmental Microbiology,2002,68(4):1854-1863.
[26]Sessitsch A,Weilharter A,Gerzabek M H,et al.Microbial population structures in soil particle size fractions of a long-term fertilizer experiment[J].Applied Environmental Microbiology,2001,67(9):4215-4224.
[27]Li M,Jiang L L,Sun Z J,et al.Effects of flue gas desulfurization gypsum by-products on microbial biomass and community structure in alkaline-saline soils[J].Journal of Soils and Sediments,2012,12(7):1040-1053.
[28]沈菊培,张丽梅,贺纪正.几种农田土壤中古菌、泉古菌和细菌的数量分布特征[J].应用生态学报,2011,22(11):2996-3002.SHEN Ju-pei,ZHANG Li-mei,HE Ji-zheng.Abundance of archaea,crenarchaea and bacteria in selected agricultural soils of China[J].Chinese Journal of Applied Ecology,2011,22(11):2996-3002.
[29]金术超,杜春梅,平文祥,等.解磷微生物的研究进展[J].微生物学报,2006,26(2):73-78.JIN Shu-chao,DU Chun-mei,PING Wen-xiang,et al.Advance in phosphorus dissolving microbes[J].Journal of Microbiology,2006,26(2):73-78.
[30]Rodríguez H,Fraga R.Phosphate solubilizing bacteria and their role in plant growth promotion[J].Biotechnology Advances,1999,17(4):319-339.
[31]尹瑞玲.我国旱地土壤的溶磷微生物[J].土壤,1988,20(5):243-246.YIN Rui-ling.The phosphate-solubilizing microorganisms in arid soil of China[J].Soils,1998,20(5):243-246.
[32]刘艳丽.长期施肥下水稻土土壤性质变化及其与生产力的关系研究[D].南京:南京农业大学,2007.LIU Yan-li.Changes in soil properties and its relation with soil productivity under long-term fertilization in paddy fields[D].Nanjing:Nanjing Agricultural University,2007.
[33]王西和,吕金岭,刘 骅.灰漠土小麦-玉米-棉花轮作体系钾平衡与钾肥利用率[J].土壤学报,2016,53(1):213-223.WANG Xi-he,LÜ Jin-ling,LIU Hua.Gray desert soil potassium balance and potassium utilization in maize-cotton rotation system[J].Acta PedologicaSinica,2016,53(1):213-223.
[34]Kemnitz D,Kolb S,Conrad R.High abundance of crenarchaeota in a temperate acidic forest soil[J].FEMS Microbiology Ecology,2007,60(3):442-448.
[35]Ellegaard K M,Klasson L,Näslund K,et al.Comparative genomics of Wolbachiaand the bacterial species concept[J].PLoS Genetics,2013,9(4):e1003381.
