应用Illumina高通量测序技术分析中华真地鳖肠道微生物多样性
2018-03-26冯飞斐王一丁
冯飞斐, 王一丁
(四川师范大学生命科学学院,四川成都 610100)
中华真地鳖(EupolyphagesinensisWalker),中药名土鳖虫,别称土元、地鳖虫、地乌龟、簸箕虫等,为蜚蠊目鳖蠊科地鳖亚科地鳖属昆虫。中华真地鳖雌虫干燥体是一种传统中药,是《中华人民共和国药典》中记载的正品药材。中华真地鳖的药用历史悠久,成书于汉代我国第一部药物著作《神农本草经》、东汉著名医学家张仲景的《金匮要略》以及明代李时珍的《本草纲目》等几乎所有著名药典都对其有明确的记载[1]。中华真地鳖肠具有破血逐淤、续筋接骨的功能,被广泛应用于中药处方中。现代药理学的研究表明,中华真地鳖对心脑血管系统有保健作用,能降脂调脂、抗凝血、抗血栓等,还具有抗肿瘤、抗氧化作用,此外还具有促进骨折愈合、镇痛、增强人体免疫等功效[2]。还有研究发现,中华真地鳖营养丰富,部分地区已把它加工成食品[3]。
最初,中华真地鳖主要靠野生药源满足市场,近年来,由于化肥、农药的大量使用,使其自然生存环境遭到破坏,野生药源日益枯竭,远远满足不了国内市场和出口创汇的需要[4],而人工饲养地鳖虫,不需要特殊设备,可因陋就简,投资少[5]。因此,人工饲养中华真地鳖很快成为各地开展经营的项目。到目前为止,我国中华真地鳖规模化养殖已有三十多年历史[6]。在影响中华真地鳖生命活动的各种不同因素中,人们对温度、湿度、光照度、食物等外界因素的关注较多,但对中华真地鳖肠道微生物的研究与阐述较少。昆虫肠道系统是随着取食、消化、排泄等活动而多变的环境,其中寄居的微生物与昆虫的营养生理活动有着密切的关系,一方面其群落结构、代谢活动受到昆虫肠道微环境的影响,另一方面它们也影响着昆虫的生命活动[7]。近年来,对一些重要昆虫的肠道微生物的研究日渐活跃。同为蜚蠊目的美洲大蠊、德国小蠊作为对人类危害较大的害虫,其肠道微生物也受到了研究人员的关注[8-9]。目前,中华真地鳖产业开发正在不断深入。为了深入研究中华真地鳖的营养生理状况,人为控制或改良中华真地鳖肠道微生态环境,开发中华真地鳖肠道微生物资源,研制微生态制剂,降低中华真地鳖人工繁育生产成本,笔者对中华真地鳖的肠道细菌进行了初步研究。
本研究采用基于Illumina Hiseq 2500平台的第二代测序技术对中华真地鳖肠道微生物种类组成进行分析,该方法相较于传统分析技术能够产生覆盖深度更大的数据量,检测到纯培养和传统非培养技术未能发现的低丰度肠道微生物种类。
1 材料与方法
1.1 虫源
雌性中华真地鳖成虫,购于山东省临沂市蒙山中华真地鳖养殖中心。
1.2 样品消毒
取3头健康的中华真地鳖雌性成虫,用无菌水冲洗干净后用75%乙醇浸泡3 min,再用无菌水冲洗3次,然后在蜡盘中进行无菌解剖,去除残留脂肪体后,取出其肠道内容物备用。
1.3 肠道总DNA的提取
使用TIANamp Stool DNA Kit提取中华真地鳖肠道内容物总DNA,将提取出来的DNA样品放在-70 ℃冰箱中保存。
1.4 16S rDNA-V4区的PCR扩增
以中华真地鳖肠道内容物总DNA为模板,使用16S rDNA-V4区特异引物515F(5′-GTGCCAGCMCCGCGGTAA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′),及TIANGEN 2×TaqPCR Master Mix进行PCR。用2%琼脂糖凝胶电泳检测PCR产物。
1.5 文库构建和测序
确定PCR产物浓度达到上机检测标准后。将3个样品送至北京诺禾致源生物信息科技有限公司测序。先分别用带不同条码(bar-code)的16S rDNA-V4区特异引物515F、806R进行PCR扩增,以区分样品。产物经2%琼脂糖凝胶电泳后,用Qiagen Gel Extraction Kit回收目的条带,再进行文库构建。文库构建采用TruSeq®DNA PCR-Free Sample Preparation Kit,质控合格后上机测序,测序平台为Illumina Hiseq 2500。
1.6 生物信息学分析
原始数据经FLASH软件拼接,QIIME软件过滤,UCHIME Algorithm软件去除嵌合体后得到有效数据[10-12]。再用UPARSE软件对有效数据在97%水平上进行操作分类单元(operational taxonomic unit,简称OTU)聚类,并用基于GreenGene数据库的RDP Classifier分类工具进行物种注释[13-14]。用QIIME软件计算每个样品的Alpha多样性。
2 结果与分析
2.1 序列数与OTU数量统计
3个样本 Y1、Y2、Y3中的原始数据经过分析处理,剔除蟑螂杆状体属(Blattabacterium)序列后,分别得到67 831、70 231、42 050条有效序列。对3个样本进行数据标准化(data normalization)后,每个样本均含42 050条有效序列,为统计方便,此后提到的有效序列均为标准化后的数据。按照16S rDNA相似性≥97%为一个OTU分类单元,Y1、Y2、Y3这3个样本分别含有1 765、1 852、1 602个OTU,其中1 437个OTU在3个样本中都有发现。
2.2 肠道菌群的α多样性
如图1所示,3个样本的稀释曲线斜率随着测序通量的增大而逐渐降低,趋于平坦。采用Shannon、Simpson 、Chao1、ACE等指数来表示样品中微生物的α多样性,如表1所示,3个样本的覆盖率(Good’s coverage)都较高,达到了99.0%~99.7%。以上结果说明,测序数据量合理,样本中的绝大多数菌都被检出。3个样本的α多样性随个体的不同而有所变化。
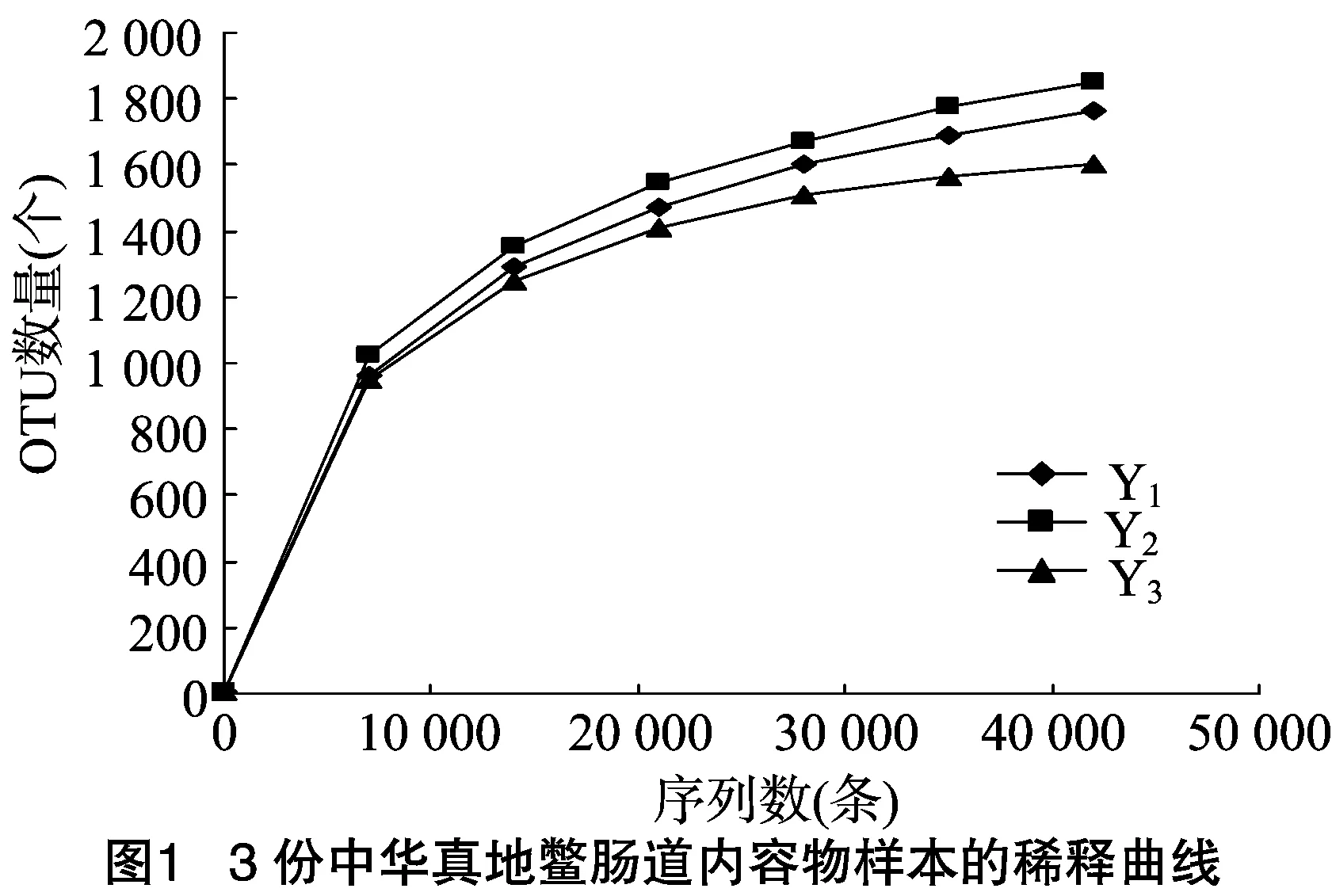
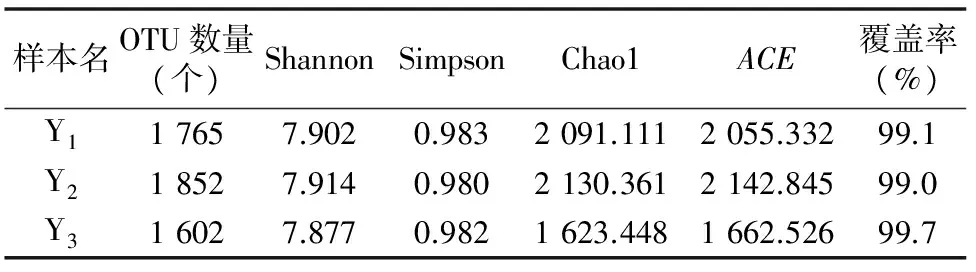
表1 3份中华真地鳖肠道内容物样本的多样性指数统计结果
2.3 中华真地鳖肠道菌群结构
2.3.1 门水平下的中华真地鳖肠道菌群结构 Y1、Y2、Y3这3个样本的有效序列分别有98.7%、89.5%、98.8%能够注释到门水平,共检测到31个菌门。数据标准化后相对丰度平均值排名前10的菌门见表2,可见其中相对丰度最高的是拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)和变形菌门(Proteobacteria),它们的相对丰度平均值均超过10%,是中华真地鳖肠道中的优势菌门。剩下的21个菌门中,Hydrogenedentes、CKC4只在2个样本中被检出,酸杆菌门(Acidobacteria)、Candidate division SR1、热微菌门(Thermomicrobia)、Omnitrophica只在1个样本中被检出。样品中鉴定出来的菌群数量,自纲水平起都较多,因此选择在门水平作聚类分析,如图2所示。关于样品中各菌门含量的浮动是否与不同菌群之间的相互作用有关,有待进一步研究。
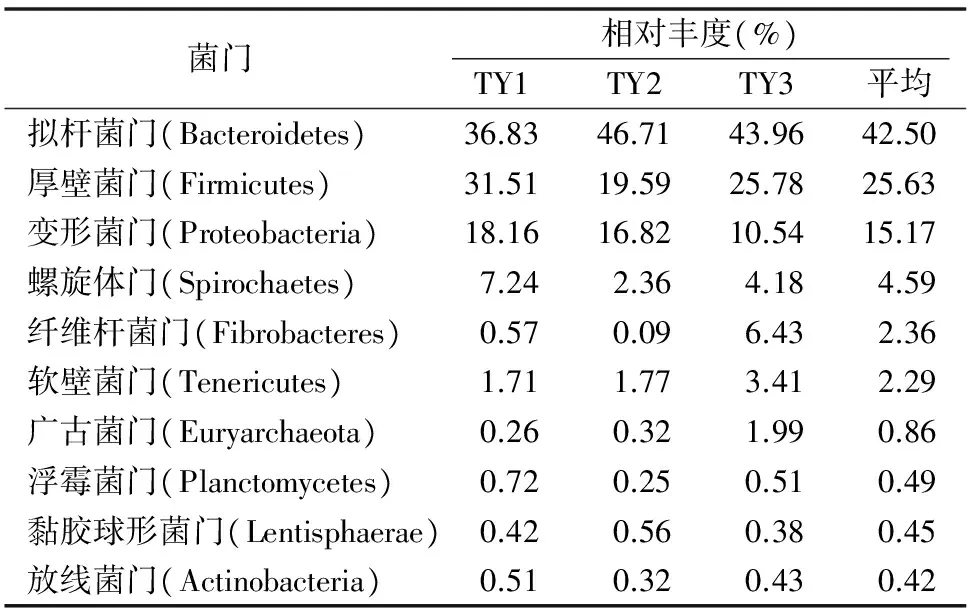
表2 3份样本中相对丰度平均值前10的菌门
2.3.2 属水平下中华真地鳖肠道菌群结构 Y1、Y2、Y3这3个样本的全部有效序列分别有36.0%、40.6%、42.1%能注释到属水平,大部分有效序列不能在数据库中进行属水平对应分类,说明中华真地鳖肠道内有许多待开发的新菌属。3个样本中共检测到309个菌属,其中223个菌属为3个样本所共有的,52个菌属在2个样本中被检出,34个菌属只在1个样本中被检出。数据标准化后相对丰度平均值前15的菌属见表3,其中Parabacteroides、Alistipes、沙雷氏菌属(Serratia)、ChristensenellaceaeR-7group、乳酸杆菌属(Lactobacillus)、CandidatusSymbiothrix、Clostridiumsensustricto1这7个菌属的相对丰度平均值大于1%,可看作中华真地鳖肠道内的优势菌属。
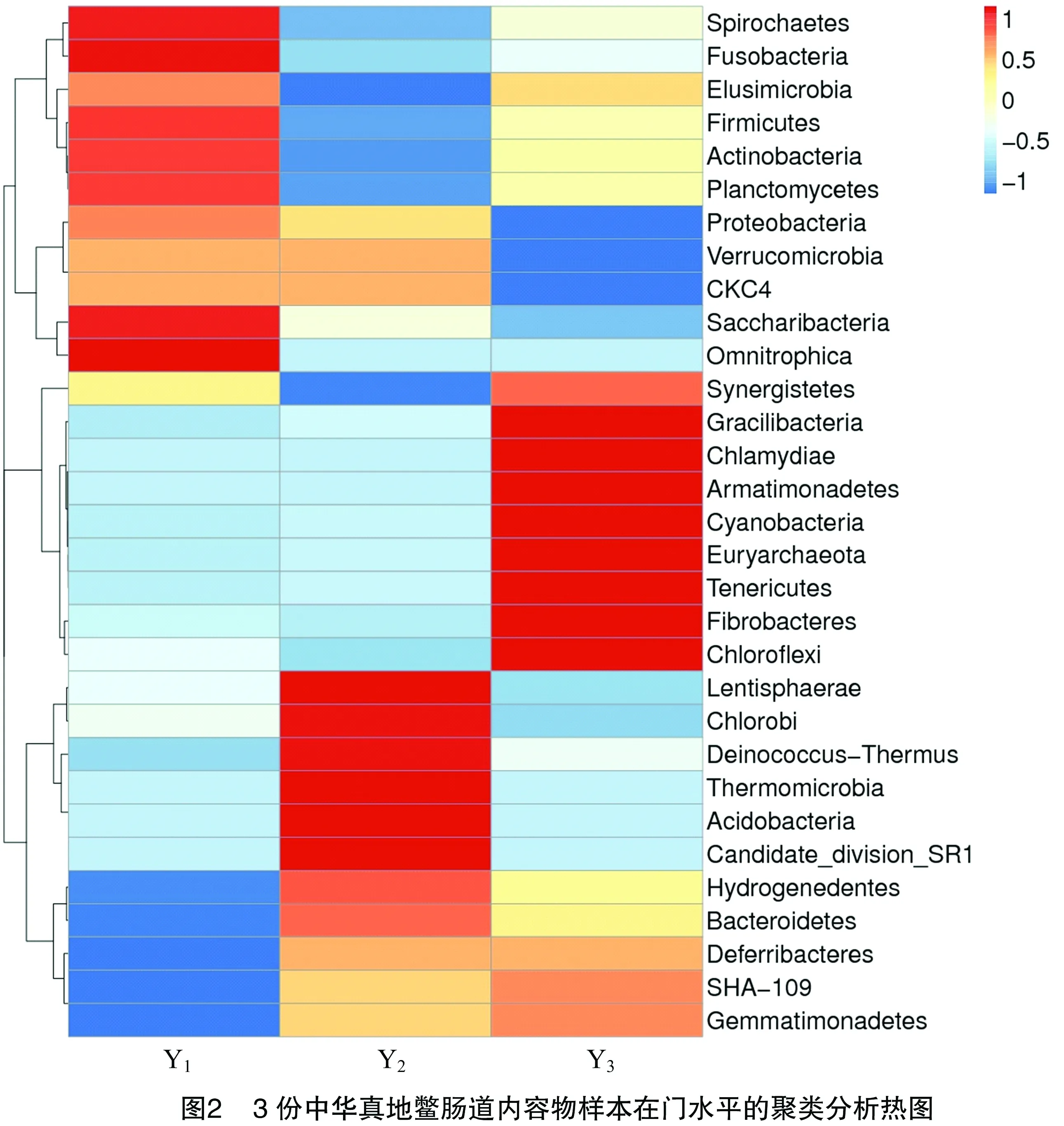
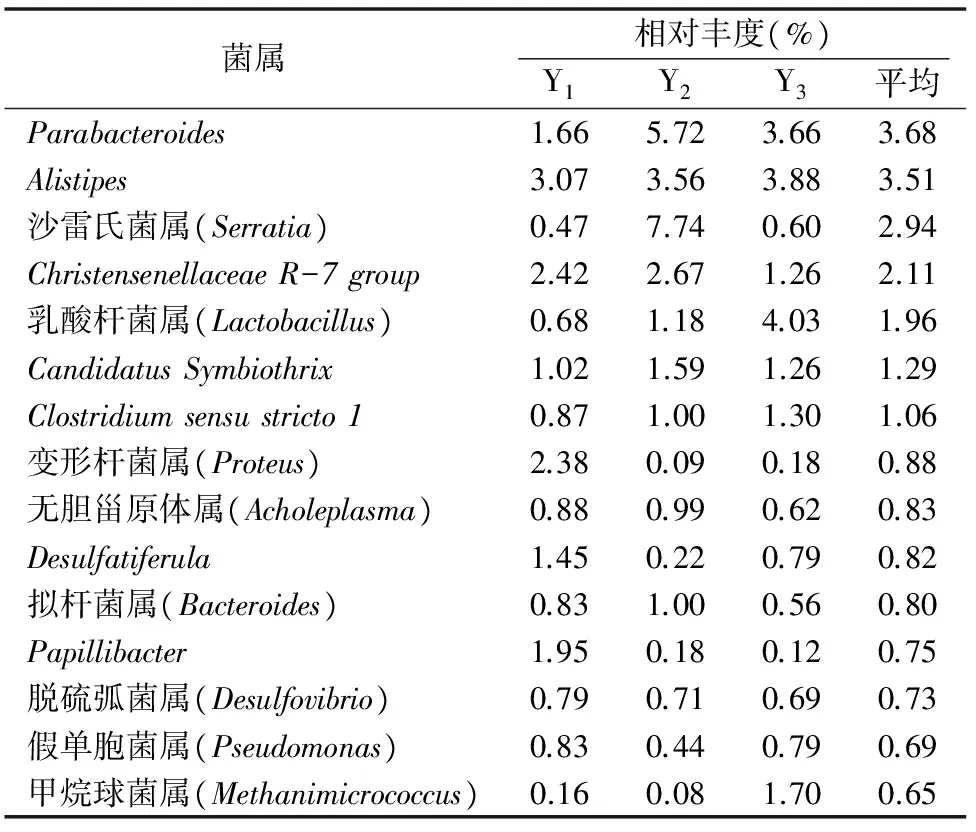
表3 3份样本中相对丰度平均值前15的菌属
3 讨论
近年来,Illumina测序技术开始应用于肠道微生物多样性的研究。该测序技术利用基于单分子簇的边合成边测序技术(sequencing by synthesis,简称SBS)和专有的可逆终止化学反应,可以在短时间内获得大量数据[15]。相较于分离培养方法和传统分子生物学方法,该技术有重大突破。分离培养方法分析的微生物只限于那些能够在人工培养基上生长的微生物,而能通过传统的分离培养方法鉴定的微生物只占全部微生物的1%~10%[16]。因此通过传统培养方法得到的结果并不能真实反映肠道菌群多样性,这就使得用分离培养方法在研究肠道菌群的种群结构与多样性方面受到了极大的限制。
与第一代测序技术相比,高通量测序技术通量更大,并且成本相对较低[17-18]。Illumina Hiseq 2500平台能在27 h内生成相当于人类基因组40倍覆盖率的数据[19]。与常用来分析微生物多样性的变性梯度凝胶电泳(DGGE)相比,高通量测序技术灵敏度更高[20]。高通量测序技术有完美的定量功能,不但能够测出某DNA属于哪个物种,还能统计出该DNA在测序的过程中被测的次数,即被测样品中该物种的数量,能够直接反映某种DNA的丰度[21]。
本研究发现,中华真地鳖肠道中相对丰度最高的菌属是Parabacteroides和Alistipes,这2个属的细菌在人类肠道中均有发现。肠易激惹综合征和溃疡性肠炎患者肠道内的Parabacteroides菌属含量较健康人体低,推测人体肠道内缺乏Parabacteroides属细菌可能会导致以上2种病症的发生[22]。与健康人相比,自闭症患者肠道中Alistipes菌属的含量较低,目前导致这种情况的原因尚不明确[23]。而通过摄取动物性食品则可让人体肠道中Alistipes菌属的含量上升[24]。除Parabacteroides和Alistipes这2个菌属外,中华真地鳖肠道中还有沙雷氏菌属等其他5个菌属的细菌含量较高,这些细菌与中华真地鳖之间的关系,有待于进一步研究。
人类肠道微生物是宿主生理系统的一部分,可将其比喻为微生物组织,对于昆虫而言,肠道微生物也十分重要,昆虫肠道微生物有帮助宿主消化食物,为宿主提供食物中缺乏的必需营养素,提高宿主抗病性,从而影响宿主生理和发育等作用[25-26]。在本研究的基础上进一步了解肠道内各微生物对中华真地鳖的作用,以及它们与宿主和环境之间的关系后,就可以以此为基础开发微生态制剂。微生态制剂是采用有益微生物及其代谢产物和生长促进物质制成的活菌制剂,无毒副作用、无残留、不产生抗药性[27]。
国内对中华真地鳖的研究主要集中于有效成分的分离和药用价值的研究。虽然我国已有多年中华真地鳖饲养历史,但对养殖技术的深入研究较少。目前针对中华真地鳖肠病原菌引起的病害,一般以预防为主,对于已经出现的病害,则采用施用广谱抗生素的手段治理[28]。在饲料中添加抗生素,若超时超量,可能会对人类健康造成危害[29]。早在2006年,欧盟各国已全面禁止抗生素作为动物饲料添加剂,而微生态制剂作为一种新型的生物制剂是较理想的替代品[30]。如果研发出适用的微生态制剂,则能够促进我国中华真地鳖产业的大发展,市场前景十分乐观。
4 结论
本研究首次应用Illumina HiSeq高通量测序技术初步分析了中华真地鳖肠道菌群多样性,共检测到了31个菌门,优势菌门是拟杆菌门、厚壁菌门和变形菌门;共检测到309个菌属,优势菌属是Parabacteroides、Alistipes、沙雷氏菌属、ChristensenellaceaeR-7group、乳酸杆菌属、CandidatusSymbiothrix、Clostridiumsensustricto1这7个。本试验结果为今后分析中华真地鳖生理生化特性、发展新型中华真地鳖养殖技术、研发适用于中华真地鳖的微生态制剂、开发中华真地鳖肠道微生物资源提供了理论基础。
[1]张安宁,桂仲争. 地鳖虫的利用价值及其开发前景[J]. 生物学杂志,2008,25(2):59-61.
[2]罗 情,巫秀美,郭娜娜,等. 地鳖虫的化学成分和药理活性研究进展[J]. 中国医药科学,2015,5(17):41-44.
[3]唐庆峰,吴振廷,王学林,等. 地鳖虫人工饲养和食用、药用研究进展[J]. 经济动物学报,2005,9(1):57-62.
[4]周维官,卢泳健,许伟峰,等. 杂交地鳖虫的人工养殖技术[J]. 广西畜牧兽医,2002,18(6):32-33.
[5]武深秋. 地鳖虫的饲养管理[J]. 河南畜牧兽医,2003,24(7):39-40.
[6]徐丽娜. 土元养殖现状浅析(上)[J]. 农业知识:科学养殖,2011(11):41.
[7]相 辉,黄勇平. 肠道微生物与昆虫的共生关系[J]. 昆虫知识,2008,45(5):687-693.
[8]房 伟,方泽民,刘智苗,等. 美洲大蠊(Periplanetaamericana)肠道微生物多样性分析[J]. 微生物学报,2013,53(9):984-994.
[9]刘 浩. 德国小蠊共生菌种群变化与抗药性的关系[D]. 济南:山东师范大学,2013:1-48.
[10]Magoc T,Salzberg S L. FLASH:fast length adjustment of short reads to improve genome assemblies[J]. Bioinformatics,2011,27(21):2957-2963.
[11]Bokulich N A,Subramanian S,Faith J J,et al. Quality-filtering vastly improves diversity estimates from Illumina amplicon sequencing[J]. Nature Methods,2013,10(1):57-59.
[12]Edgar R C. UPARSE:highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods,2013,10(10):996-998.
[13]Desantis T Z,Hugenholtz P,Larsen N,et al. Greengenes,a chimera-checked 16S rRNA gene database and workbench compatible with ARB[J]. Applied and Environmental Microbiology,2006,72(7):5069-5072.
[14]Edgar R C. MUSCLE:multiple sequence alignment with high accuracy and high throughput[J]. Nucleic Acids Research,2004,32(5):1792-1797.
[15]Quail M A,Kozarewa I,Smith F,et al. A large genome center’s improvements to the Illumina sequencing system[J]. Nature Methods,2008,5(12):1005-1010.
[16]Haraszthy V I,Zambon J J,Sreenivasan P K,et al. Identification of oral bacterial species associated with halitosis[J]. The Journal of the American Dental Association,2007,138(8):1113-1120.
[17]Mardis E R. The impact of next-generation sequencing technology on genetics[J]. Trends in Genetics,2008,24(3):133-141.
[18]Schuster S C. Next-generation sequencing transforms today’s biology[J]. Nature Methods,2008,5(1):16-18.
[19]Mason C E,Elemento O. Faster sequencers,larger datasets,new challenges[J]. Genome Biology,2012,13(3):314.
[20]夏围围,贾仲君. 高通量测序和DGGE分析土壤微生物群落的技术评价[J]. 微生物学报,2014,54(12):1489-1499.
[21]王 林,李 冰,朱 健. 高通量测序技术在人工湿地微生物多样性研究中的研究进展[J]. 中国农学通报,2016,32(5):10-15.
[22]Noor S O,Ridgway K,Scovell L,et al. Ulcerative colitis and irritable bowel patients exhibit distinct abnormalities of the gut microbiota[J]. BMC Gastroenterology,2010,10(1):134.
[23]Strati F,Cavalieri D,Albanese D,et al. New evidences on the altered gut microbiota in autism spectrum disorders[J]. Microbiome,2017,5(1):24.
[24]David L A,Maurice C F,Carmody R N,et al. Diet rapidly and reproducibly alters the human gut microbiome[J]. Nature,2014,505(7484):559-563.
[25]Backhed F,Ley R E,Sonnenburg J L,et al. Host-bacterial mutualism in the human intestine[J]. Science,2005,307(5717):1915-1920.
[26]周洪英,孙 波,吴洪丽,等. 昆虫肠道微生物功能及家蚕肠道微生物研究进展[J]. 北方蚕业,2015,36(4):1-4,33.
[27]王国花,钱彩源,李伟方. 微生态制剂在水产养殖中的应用[J]. 中国水产,2006(7):83-84.
[28]张群财. 土元的病害防治[J]. 农家参谋,2014(7):25.
[29]施 雱,梅雪芹. 美国畜牧养殖业滥用抗生素相关研究的历史考察[J]. 辽宁大学学报(哲学社会科学版),2013,41(3):143-149.
[30]李春慧,蒲万霞,吴 润,等. 微生态制剂应用研究概况[J]. 动物医学进展,2013,34(11):114-118.
