等离子体净化苯系物
2018-03-24杜长明黄娅妮巩向杰
杜长明,黄娅妮,巩向杰
等离子体净化苯系物
杜长明*,黄娅妮,巩向杰
(中山大学环境科学与工程学院, 广东 广州 510006)
苯系物是一种常见的工业污染物,它主要包括苯、甲苯、二甲苯、苯乙烯等,传统的处理方法有液体吸收法、吸附法、焚烧法、冷凝法、生物法等,本文对比分析了各传统方法的优缺点,提出了一项新型的等离子体技术,它具有对环境温度反应迅速、适用范围极广、系统紧凑性和操作简单的特性,同时还具备停留时间短暂等优点,尤其适用于处理挥发性有机化合物(VOCs).主要研究了使用不同类型的等离子体反应器处理苯系物的实验装置,分析了影响等离子体技术处理苯系物的相关影响参数,如施加的电压和电场强度、输入能耗、反应器类型、反应器尺寸、载气、停留时间、苯系物的种类等,例如催化剂可以提高分解效率,优化反应条件,同时分别阐述了苯、甲苯、二甲苯、苯乙烯的降解机理.最后提出,将等离子体技术与多种处理技术联合使用,将会成为未来净化挥发性有机物的主要研究方向.
等离子体;苯系物;影响参数;降解机理;净化
苯系物是空气中常见的污染物,通常包括:苯、甲苯、二甲苯、苯乙烯等,它的来源十分广泛,这些苯系物的主要来源是室内装修用的涂料、木器漆、胶黏剂、合成纤维、塑料、燃料、橡胶、以及各种胶粘剂、防水材料,同时也可以来自于燃料和烟叶的燃烧气等.苯是一种无色具有芳香气味的液体,通常将其称为“芳香杀手”[1-3].甲苯是一种典型的挥发性有机化合物,在工业应用中,甲苯主要应用于油漆生产、涂料、粘合剂、橡胶、印刷和皮革制作过程中[4-5].二甲苯是无色透明液体,它是苯环上两个氢被甲苯取代的产物,存在邻、间、对三种异构体,在工业上,二甲苯指的是上述异构体的混合物,它具有特臭、易燃、能够与乙醇、氯仿或乙醚任意混合的特点[6-7].苯乙烯主要用于有机合成,尤其是生产合成橡胶,苯乙烯还广泛用于生产聚醚树脂、增塑剂和塑料等[8-9].
通常认为苯系物存在致癌、导致畸形以及诱导突变的隐患.空气污染物能够通过呼吸进入人体,其毒性能够造成人体的寿命降低、呼吸系统疾病、肺的防御机制劣化并加剧心血管疾病[10-12].根据《工业企业设计卫生标准》中规定了居民区大气中最高的浓度不能超过2.4mg/m3.然而这一限值已经不能适应目前普通居民室内空气污染现状.在国家质量监督检验检疫总局、国家环保总局、卫生部发布的《室内空气质量标准》中,已经把苯、二甲苯列为室内污染控制项目[13].
1 常规处理技术
1.1 吸收法
吸收法的主要原理就是利用苯系物在某些溶剂中的高溶解性,因此通常会采用沸点较高且蒸气压较低的亲油性溶剂作为吸收含有苯系物的废气,但是吸收法所采用的溶剂在多数情况下其本身就是易挥发的有机溶剂,存在着易燃易爆的危险,并且容易造成二次污染,后续对吸收液的处理也十分繁琐,因此吸收法并不是最佳的处理苯系物的方法[14].
1.2 吸附法
在处理挥发性有机物的过程中,常常会用到吸附法,采用吸附法最重要的就是选择一种高效的吸附剂,吸附剂的化学组成和表面性质是吸附过程能否顺利进行的前提.在工业应用中,活性炭是最常见的吸收苯系物的吸附剂.目前已经研制出了一种新型的活性炭纤维,它的孔隙率大,孔径均一,吸附容量很大[15].但是,在吸附过程中依然会产生一些不需要的副产物.
1.3 燃烧法
燃烧法适用于处理低浓度的废气,燃烧法主要分为直接燃烧法和催化燃烧法.直接燃烧法是在未添加辅助燃料的情况下,使废气中的有机气体直接进行燃烧[16].催化燃烧法是在催化剂的辅助下,在温度较低的环境中,使有机气体发生无焰燃烧.燃烧法是目前应用较为广泛的一种方法,其对于各种挥发性有机污染物的处理效果极高,但是由于这种方法需要很高的成本以及较大的能量消耗,所以影响了燃烧法的长足发展.
1.4 冷凝法
由于废气中各成分在不同的温度下,其饱和蒸气压不同,因此,通常会通过降低系统温度或是提高系统压力的方法,使废气中达到了饱和蒸气压状态的污染物得到冷凝,从而对废气中的各种有机物进行分离.由于冷凝法对设备的要求较低,操作简单,因此得到了广泛的应用,但是它的能耗较大,并且不适用于处理温度较低的废气,因此通常需要将冷凝法与其它技术结合,才能达到更优的效果[17].
1.5 生物过滤法
生物过滤法就是在适宜的环境中,使微生物利用废气中的有机物作为营养物质和能源,经过微生物的降解,从而使有机物转化为简单的无机物.目前应用的生物过滤法设备主要有生物过滤塔、生物滴滤塔等.生物过滤同时也存在着一些不足,比如处理过程中所承载的污染物负荷不能太高,此外,由于它是一种新型的处理技术,因此缺少现场试验等数据支撑,还需要进一步研究才能广泛应用于实际运行中.
1.6 膜分离法
膜分离法即采用高分子有机膜在一定压力下,对废气中的有机物进行选择性渗透,从而使经过了净化后的有机废气留在未渗透处,从而达到排放标准.膜分离法去除有机污染物的效率虽然很高,且二次污染物较少,但是它的成本也很高,而且只适用于浓度较高的废气.
基于以上传统方法的一些缺点,近年来逐步成熟的等离子体技术已经得到了很好的发展[18].等离子体法的原理就是通过放电过程中产生的大量活性粒子与挥发性有机污染物进行反应,从而使难降解的污染物转化为对环境无害的小分子物质,或是简单的化合物.等离子体技术由于具有对环境温度反应迅速、适用范围极广、高电子能量的迅速吸收、系统紧凑性和操作简单的特性,以及停留时间短暂等优点,尤其是在处理低浓度污染气体中对挥发性有机化合物的过程中具有较高的分解率.因此许多学者已经指出了等离子体技术是能够有效地从废气中分解空气污染物的可替代方法[19-22].
2 等离子体处理苯系物系统
等离子体是区别于固、液、气这三种状态的第四种状态,它主要由正负带电粒子和中性粒子组成[23].通常根据等离子体发生器的电极结构、个数、气体放电产生的机理、气体的压力范围、电源性质以及电极的几何形状,气体放电等离子体又可以分为电晕放电、辉光放电、微波放电、射频放电、表面放电、介质阻挡放电[24].
2.1 电晕放电
电晕放电是通过在曲率半径很小的电极上施加高电压而发生非均匀放电的一种放电形式,电晕放电等离子体反应器是一种典型的等离子体装置,在目前的研究中,发展了几种电晕放电处理苯系物的系统[25-29].WU等[14]以甲苯为原料,利用电晕放电等离子体反应器对其进行处理,实验中的等离子体反应器是一个由有机玻璃制造的容器,容器的长、宽、高分别为500mm、100mm、100mm,两个不锈钢电极板(450mm×80mm)与反应器内的接地板相连作为阴极.一根长度为100mm,内径为4mm,外径为6mm的不锈钢管作为阳极,不锈钢管上有四对喷嘴,喷嘴的长度为5mm,内径为1mm,外径为1.6mm,喷嘴间的距离为20mm.该不锈钢管电极安装在接地板的中部,并与高压电极的阳极相连,另一方面,将添加气体(O2和H2O)通入不锈钢管电极中,O2和H2O在喷嘴顶端附近的电晕区域中通过电子碰撞过程得到分解.
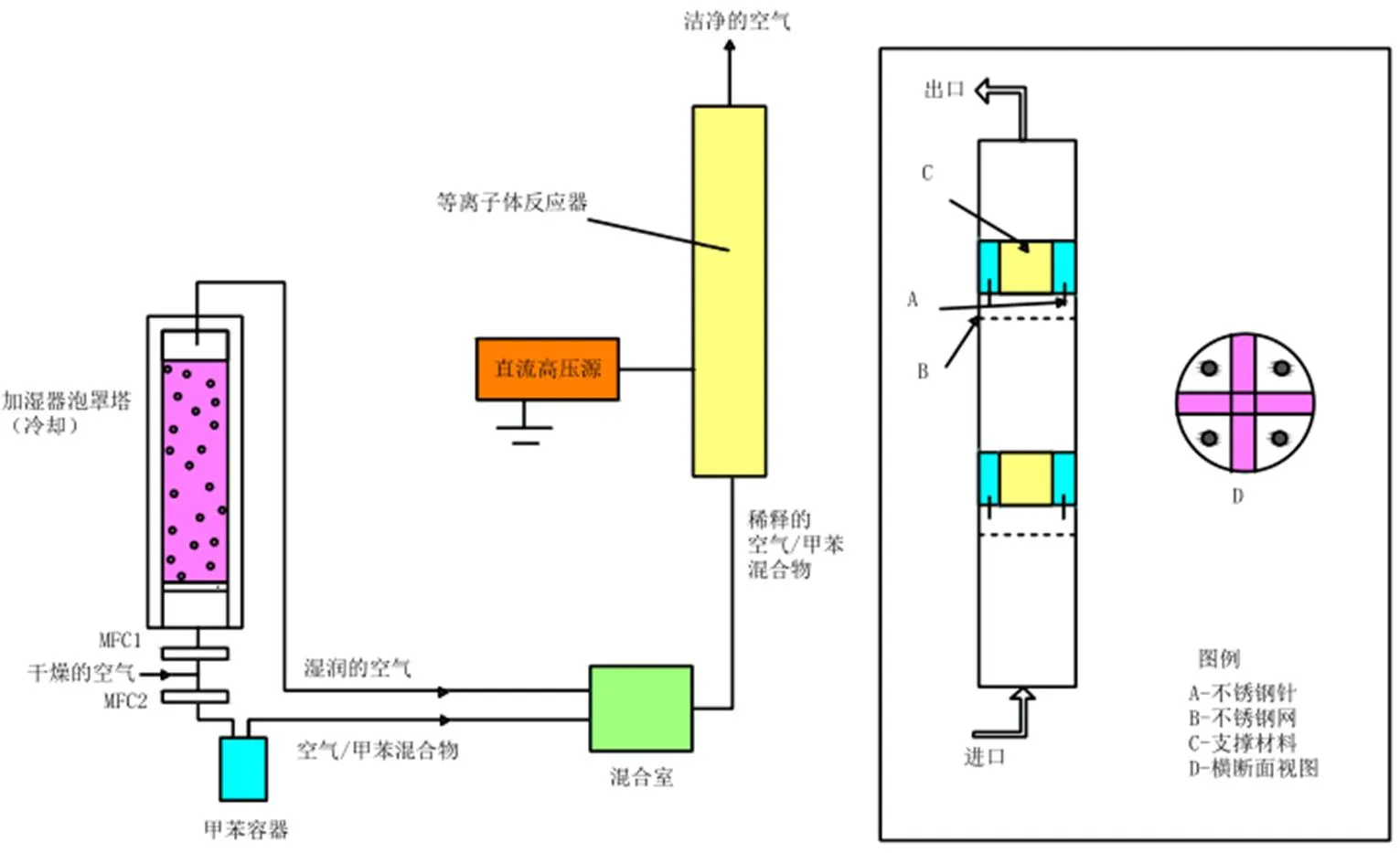
图1 采用了电晕反应器的反应装置流程示意
Kornev等[30]采用了电晕放电反应器对苯以及它的衍生物(苯、甲苯、乙苯、二甲苯)的降解进行研究,在该实验中,分别使用了各种不同浓度的苯,其浓度范围为8~90mg/L,其基本的反应装置主要包括电子放电反应器、携有循环泵的气液分离槽、高压脉冲发生器.在循环室中50L的苯溶液得到处理,在循环模式中对50L苯合成溶液样品进行处理,使用有1mm的孔的500×40mm的有孔平板,将液体浸在放电环境中.处理的溶液的泵入速率为4~20L/min,使得液体的喷涂率为1.2~6.0m/h.同时Zhang 等[31]还采用了阳极和阴极直流电晕放电反应器处理苯乙烯.此外,Van DJ等[26]也使用了电晕放电反应器处理甲苯.反应装置流程图如图1所示,该等离子体反应器主要由一个内径为40mm的圆柱形管组成,在该装置中,阴极为一个不锈钢网丝,阳极则由四个锯齿形不锈钢丝组成,以这样的方式安装这些针尖,因此在放电过程中,放电区域可以和每一根针上的八个典型的阳极区域连接.每一个针上面都连接有1.5MΩ的电阻,耗损在这些电阻器上的电功率最多占总功率的10%.针和网丝以这种方式安装在管中,因而可以使电极间的距离得到调节,本实验中的电极放电距离为20mm.
2.2 介质阻挡放电
介质阻挡放电等离子体技术是使用至少一个电极上面覆盖一层阻挡介质加交流高压进行放电的等离子体,它能够在高气压和宽频率的范围内工作,通常的工作气压为104~106Pa,电源频率为50Hz~1MHz,在目前开展的实验中,介质阻挡放电等离子体技术已经成为了一种广泛应用的技术[32-41].Huang等[32]采用了典型介质阻挡放电反应器处理甲苯,在实验中,干燥的空气以12mL/min的流速经过一个装有冰水的容器,并将甲苯一起带入一个缓冲区,在该缓冲区中,甲苯与从另一个通道输送来的空气混合,形成初始浓度为107×10-6的甲苯,混合后的气体首先进入介质阻挡放电反应器中,该介质阻挡放电反应器由高压交流源供电,一个80mm×80mm×1mm的正方形钢丝网和100mm×100mm×2mm的陶瓷片分别作为电极和介质阻挡材料,3个网丝电极和两个陶瓷片组成了介质阻挡放电反应器,网丝电极之间的间隔距离为4mm,实验系统流程如图2所示.

图2 采用了介质阻挡放电反应器的反应装置流程
Liang等[34]利用了铁电体填充床介质阻挡放电等离子体反应器处理甲苯,分析其分解率的研究.该研究中的实验装置由铁电体填充床反应器、高频交流电源(0~20kV,0~50kHz,正弦波)、一个连续气流供应系统、电气和气体分析系统组成.同轴圆柱型介质阻挡放电反应器由石英玻璃组成,反应器的内径为17.9mm,器壁的厚度为1.2mm,反应器包裹一层长度为20cm的铁丝网作为地电极,反应器的内部电极为钨丝(直径分别为1.06mm和1.62mm),钨丝安装在反应器的轴线上,反应器中的相对湿度大约为30%.
Najafpoor等[42]在介质阻挡放电反应器分别对苯、甲苯、苯乙烷、二甲苯进行降解,该反应器是一个圆柱体,该反应器是一个长为20cm,外径为10mm且厚度为1.1mm的石英管,一层覆盖在石英管上的铜箔作为地电极,一根长度为20cm,直径为1.6mm的钨丝作为内高压电极.石英管的两端用聚四氟乙烯进行密封,来保护石英管中心的电极,实验中采用10kV的高压发生器激发气体放电.此外Ognier等[35]也采用了介质阻挡放电的多点-平板反应器中对甲苯进行等离子体处理,但是在该反应器在是用硅酸铝对地电极进行覆盖的,实验中使用硅酸铝作为介质.
2.3 滑动弧放电
滑动弧放电属于低温等离子体放电,其温度在2000~4000K之间,放电过程中会产生选择性和产率都很高的高效等离子体,近年来,滑动弧放电技术也常用作为一项有效的技术处理苯系物[43-46].
Indarto等[43]研究了滑动弧放电等离子体降解苯系物的效果.该反应器主要由一根石英玻璃管组成,石英管的内径为45mm,长度为250mm,一对电极安装在反应器的底部,电极是三角形的,由不锈钢材料制造,长度为150mm,并且电极间的距离只有1mm,实验中采用一根内径为0.3mm的细管将速度极高的气体引入到电极间,气体的总体积流量范围在3~5L/min之间.处理过程中将一个高频交流电源连接到电极上以产生弧等离子体,该过程中最大的电压和电流分别为10kV和100mA,实验系统流程如图3所示.

图3 采用了滑动弧放电反应器的反应装置流程
Du等[44]在另一组滑动弧等离子体反应器中对甲苯进行了处理.该实验装置由一个连续气流产生系统、实验室规模的滑动弧等离子体反应器、气体采样和检测系统组成.通过一个质量气流控制器将空气和O2或N2的气流控制在0.8m3/h.实验中通过混合器、加热炉和喷嘴将反应气体注入等离子体反应器.在该实验中,使用的实验室规模的滑动弧等离子体反应器由一个包括绝热毛毡的不锈钢包层(15cm×6cm×30cm)组成.使用支架在反应器的底部安装两个不同金属制成的刀形电极,刀型电极的长为100mm,宽30mm,这两个电极间最小的电极间距为1~5mm.交流电压变压器和反应器相连接,从而产生等离子体,其输出电压为1~10kV.
2.4 射频放电
射频放电等离子体技术是利用高频率,通过电感和电容耦合作用是反应器中的气体放电形成等离子体,通常来说,它的频率为1~500MHz,电子能够在整个周期里获得能量,由于其具有空间分布均匀的特性,因此可以高效地处理许多挥发性有机污染物.Lee等[47-48]使用了射频放电反应器处理苯,在一个直径为8英尺的玻璃罩中,射频电源产生等离子体.宽度为1cm的环形铜电极包裹在玻璃罩周围,阴极和地电极之间的距离为5cm,盛装有苯的扩散器与输气管相连,用于样品进料.氦气和氢气作为载气,将射频功率控制在50~250W的范围中用于实验,同时使用傅里叶红外光谱仪控制处理过程中的气态产物.通过光导纤维使等离子体中的光辐射进入扫描单色器,同时对信号进行放大,缝隙宽度控制在0.01mm的范围内,曝光时间控制在500ms~10s的范围内,从而提高信噪比.
2.5 辉光放电
近年来,出现了一种能够运行于大气压下的辉光放电反应器处理苯系物,通常会将反应器与催化剂联合起来一起应用,有研究就将Cu-Mn/ Al2O3作为催化剂与辉光放电反应器联合后对甲苯进行了处理[49].在该实验中,放电室主要由一个矩形管构成,该矩形管的高度、宽度和长度分别为9mm、40mm和200mm,矩形管中安装有五根针和具有凹槽的板,内电极的距离为12.7mm.一个功率为1.5kW的电子加热器和Cu-Mn/ Al2O3催化装置也安装在放电室内,催化床的运行温度范围为室温至300℃,床的高度为460mm.
Trushkin等[50]使用了辉光放电反应器处理苯系物.该反应器运行在空气气流中,在气体放电室中进行自持的大气辉光放电,其截面面积20cm2、长度30cm,进而产生非平衡低温等离子体,气流方向和电流方向垂直.气体放电室的电极系统由一个突入气流棒的阴极炭块和一个有着球形孔的连续阳极平板组成.该实验装置包括风扇、蒸汽发生器、气体加热器和鼓泡塔,从而获得所需要的气流参数,比如速率和气体混合物的温度以及甲苯和水蒸气之间的比例.实验中的空气加热器、蒸汽发生器、混合室和气体输送线都由不锈钢制成,并通过独立的加热器进行加热,以防止壁上的水和甲苯凝结,气体放电室通过幅值为0~30kV的直流电压进行输送能量.
2.6 表面放电
为了研究等离子体反应器对甲苯的去除率,Oh等[51]使用了表面放电等离子体反应器对甲苯进行处理.两个反应器串联在一起,反应器的直径为10mm,厚度为1.5mm,第一个反应器是等离子体反应器,反应器中有一个直径为0.4mm的钨丝作为高压电极,铜箔包裹在管的外部作为地电极.第二个反应器的作用是研究活性物质对沸石表明上甲苯的催化作用,其中的活性物质来自于第一个反应器中.在两个反应器中,将沸石放置于两个反应器中的三个不同位置,第一个反应器的顶部安装有一个光纤温度计,其作用是测量排出气体的温度.
Kuroki等[52]使用了另外一种表面放电等离子体反应器,该反应器有十二个表面放电装置,这些放电装置安装在两条相反气流中,不锈钢板间有两条宽度为4mm的狭缝,因为等离子体发生在表面放电元件的表面上,钢板安装在表面放电装置前,使气体进行充分的放电.在该实验中,表面放电装置中的一个高压电极被包裹在陶瓷管(外直径12.1mm,厚度3mm)内,地电极的周围包裹着陶瓷,并安装在陶瓷管的表面.附着在一根铜杆上的散热片嵌入到陶瓷管的中间,并通过硅胶帽套固定住,从而使表面放电装置得到冷却,同时实验中还使用了一个两极脉冲高压电源对放电装置进行充电.
3 净化技术影响参数
阻碍等离子体处理苯系物应用于实际工业生产的因素有很多,由于降解条件不同,其降解机理存在一定的差别,所以其降解效果也有所差别.因此,寻求最优的降解条件是目前研究等离子体技术处理苯系物的重要工作.
3.1 施加电压
在离子体反应器处理甲苯的实验中,施加的电压和电场强度也会对VOCs的分解率造成一定程度的影响[40,53-54].为了研究这一现象,Zhu等[55]使用了低温等离子体反应器处理甲苯,在频率为200Hz的情况下,实验中施加的电压范围为12.5~22.5kV,对应的比耗能为160~295J/L,采用的内电极为Cu电极或催化SMF电极.经实验研究发现,SMF电极与Cu电极的活性相同,并且无论采用哪种电极材料,实验中都能观察到分解率随电压的增加而增加,在电压为20kV(265J/L)的条件下,采用SMF电极时所获得的甲苯分解率几乎达到了100%;在电压为17.5kV的条件下,采用CoO和MnO/SMF催化电极时获得的分解率也升高至100%.因此在综合考虑成本的情况下,适当地提高电压能够获得最优的甲苯的分解率.
硝基苯也是一种有害的苯系物,会对环境造成极大的污染,因此Karuppiah等[53]使用介质阻挡放电反应器对初始浓度为100×10-6的硝基苯进行了处理,实验中分别使用了SMF、MnOx/ SMF、Co/SMF这3种电极,将电压控制在14~ 22kV,即对应比耗能为60~310J/L时,研究向反应器施加的电压在处理硝基苯时的影响.当电压为14kV时,使用SMF电极、MnO/SMF、Co/SMF时获得的硝基苯分解率分别为20%、42%、55%左右;当电压为22kV时,使用SMF电极时获得的硝基苯分解率为67%,而在相同情况下,CoO/ SMF和MnO/SMF电极的分解率为80%和90%.经过对电压分别为14kV、16kV、18kV、20kV、22kV这五组电压条件下获得的硝基苯分解率进行对比分析后发现,从总体上而言,随着施加的电压增加,硝基苯的分解率也随之增加.此外,3种电极下获得的分解率也不同,究其原因是由于在臭氧的原位分解过程作用下,在金属氧化物表面生成了活性氧化物,由此可能使得CoOx/SMF和MnOx/SMF电极的性能更加优良.
3.2 频率
前期研究发现,向等离子体系统施加的频率也会对等离子体技术处理苯系物的去除率造成一定程度的影响,因此,在实际的工业应用中也需要考虑频率的影响.
Ogata等[56]采用填充有铁电颗粒的低温等离子体反应器处理苯,实验中将输入功率控制在0~20kHz的范围中,使用频率为50Hz和24kHz的变频器对苯的分解率进行研究.经过实验发现,当输入功率增加至10W时,在直流频率为50Hz(电场强度为3.5kV/cm)的条件下获得的分解率就快速达到了100%,相同条件下,而当直流频率为24Hz时,苯的分解率大约为50%,直到输入功率为20W(电场强度为1.6kV/cm)时,频率为24Hz时反应器的分解率才到达75%.分析原因可知,本实验中都实现了碳良好的物质料平衡, 50Hz系统的能量效率高于24kHz系统的能量效率.因此,直流频率越高,处理效果越好,同时还发现当使用高频变压器,由于火花的原因并不能提供高于1.6kV/cm的电场强度,所以在相同输入功率和分解率时,24kHz系统的NO和N2O浓度高于50Hz系统的NO和N2O浓度,因此,低频系统比高频系统更有效.
为了验证这一结果,在一组使用介质阻挡放电反应器产生等离子体处理二甲苯的实验中,Ye等[33]采用的二甲苯的初始浓度为(431.8±5)mg/m3,处理过程中将脉冲频率从100pps上升至300pps时,在电压为23.6kV的情况下,当脉冲频率分别为100pps、200pps、300pps时,使用了纳米-TiO2/SMF电极时获得的二甲苯分解率分别为83.5%、90.8%、92.7%.而在电阻丝电极的情况下获得的二甲苯分解率则为58.8%、62.2%、64.7%.这一实验结果表明,在使用等离子体反应器处理二甲苯的实验中,二甲苯的分解率随着脉冲频率的增加而增加.
3.3 输入能耗
在等离子体处理苯系物的实验中,输入能耗的值一般会对最终的处理效果造成较大的影响[53,57-58].Shang 等[59]使用了直流放电等离子体分别处理苯和甲苯,实验中分别设置了四组实验条件,第一组:100×10-6的甲苯;第二组:50×10-6的苯;第三组:50×10-6的苯;第四组:200×10-6的苯,运行过程中施加的电压范围为12.5~22kV,将输入功率从10W提高至80W,研究输入功率对苯和甲苯的分解率的影响.经过实验发现,甲苯和苯的分解率都随着输入功率的增加而增加,并且它们的分解率也随着甲苯和苯的初始浓度的增加而减小.在功率为10~80W的范围中,初始浓度为50×10-6的苯的分解率从8%上升至65%;初始浓度为100×10-6的苯的分解率则从7%上升至59%,此外,对于甲苯而言,初始浓度为50×10-6的甲苯的分解率从20%上升至95%;初始浓度为100× 10-6的甲苯的分解率则从15%上升至86%.因此,在考虑经济成本的条件下,尽可能提高输入功率可以提高挥发性有机物的分解效果.
为了更好地研究输入能量在苯系物分解中的作用,Karuppiah等[57]使用了低温等离子体对氯苯进行处理,实验中使用的是烧结金属纤维电极,按照实验需求将氯苯的初始浓度和比耗能分别控制在50×10-6~1000×10-6和60~650J/L的范围中.经过对实验结果进行研究后发现,当氯苯浓度为1000×10-6时,烧结金属纤维电极比较活跃,对于所有的电极而言,氯苯的转化率随着比耗能的增加而增加.当施加的比耗能为60J/L时,对应的转化率为30%左右;当比耗能增加至650J/L时,对应的转化率增加至65%.实验结果表明,当使用等离子体处理氯苯时,所施加的比耗能越高,处理效果越好.
3.4 反应器的类型
随着等离子体的技术发展,越来越多的等离子体反应器得到了研究,其中包括介质阻挡放电反应器、脉冲电晕放电反应器、表面放电反应器和铁电颗粒填充床反应器[60-61].不同的等离子体反应器具有不同的等离子体物理和电气性能.因此Kim等[62]使用了不同类型的等离子体反应器对苯进行处理,研究各种反应器处理苯时的效果,表1是各种等离子体反应器.
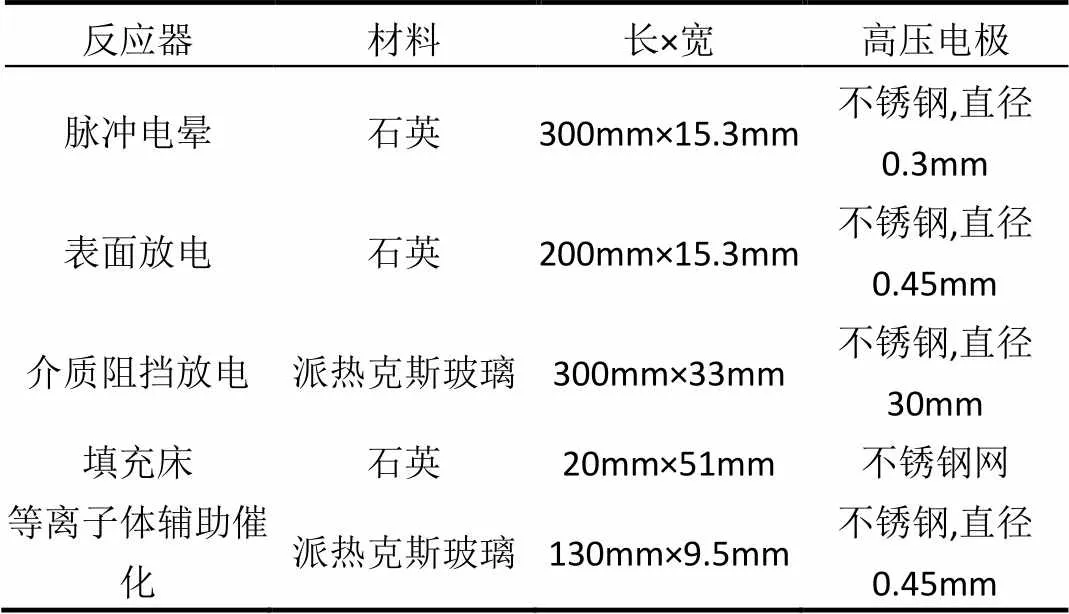
表1 等离子体反应器
为了对5种不同的等离子体反应器的性能进行比较,实验中分别在干燥和潮湿的条件下对苯进行处理.经过实验处理后发现,尽管数据点存在一定的分散性,但是气相同质的非热等离子体反应器(例如介质阻挡放电反应器、表面放电反应器和脉冲电晕反应器)在干燥和潮湿的条件下,其对苯的分解率相似.在五种反应器中,填充了Ag/TiO2催化剂的等离子体辅助催化反应器的苯的分解率最高.有研究提出在脉冲电晕过程中苯的分解和O原子的关系很紧密,综上所述,在处理苯系物时选择一种恰当的等离子体反应器是十分重要的.
3.5 反应器尺寸
在一系列研究等离子体反应器处理VOCs的实验中,反应器的内径也可能是影响实验处理效果的因素,因此Jiang等[63]使用了表面放电反应器处理苯,研究放电器的石英管内径对苯的分解率的影响.实验中交流电源的频率为50Hz,电线直径和线圈电极的螺旋距分别为1mm和7.5mm,并采用了玻璃颗粒作为填充材料.经实验发现,随着石英管内径的增加,比耗能的值也会发生极大的变化,在本研究中,当石英管内径为13mm时对应的比耗能范围为54~400J/L;当石英管内径为17mm时对应的比耗能范围为235~784J/L;当石英管内径为21mm时对应的比耗能范围为351~1020J/L.随着石英管内径的增加,放电区域会增加,并且更多的表面蒸汽将会沿着线圈电极和石英管之间的界面传播,经实验发现,在施加的电压为25kV的条件下,当石英管的直径分别为21mm、17mm和13mm时,获得的苯的分解率分别为75.1%、71.1%和67%,相对应的能量产量为3.7g/(kW×h)、4.5g/(kW×h)、8.5g/ (kW×h).分析原因可知,当石英管的内径较大时,流经石英管中心的苯很难与表面放电等离子体发生反应,因此,在本实验中,内径为13mm的石英管是最佳的内径选择.
3.6 电极形状
在等离子体反应器处理VOCs的反应中,电极形状也可能对VOCs的分解造成一定的影响,因此姜楠等[64]使用了无声-填充床放电类型的反应器处理苯,并分别采用了杆状电极和螺栓形电极,研究在该处理过程中电极形状对苯的分解率的影响.经实验发现,在外加电压为25kV时,螺栓形电极的反应器的分解率为60%,而杆状电极的反应器的分解率为50%,此时前者的能量输出比后者的能量输出要高一点.螺栓形电极的反应器的更高的分解率以及能量输出可以解释为:螺栓形电极的锐边缘相比于杆状电极的反应器能够更加有效地产生电子.因此,螺栓形电极产生了高电场强度和比耗能,所以采用了螺栓形电极的反应器中或得的苯分解率比采用了杆状电极的反应器更高.
3.7 载气
等离子体反应器的工作气体通常为Ar、He、H2和N2,同时水蒸气与上述气体的混合物也可以作为等离子体的工作气体,为了研究载气成分对二氯苯的分解率的影响,Indarto 等[65]使用了介质阻挡放电反应器对二氯苯进行处理,实验中分别采用了空气和N2作为载体,实验表明,以N2作为载气,在相同气流速率的条件下,初始浓度为100×10-6的二氯苯所获得的分解率最高,其次是300×10-6和500×10-6,二氯苯和N2之间的比例可能是一个重要的因素.根据之前的研究结果可知,由于N2激励能量水平较低,因此可以将自身状态转换为N2(A)或者N2(a),故N2可以作为分解剂.并且实验表明,当使用空气作为载气时,在二氯苯的初始浓度为100×10-6的情况下,与N2作为载气的情况相比,其分解率降低到了5~15%.而当二氯苯的初始浓度分别为300×10-6和500×10-6时,分解率却几乎一样.因此,总的来说,当空气作为载气时,造成分解率不一样的原因是因为氧气可以激发到更高的水平,并且进一步氧化二氯苯分子,其激发能量比N2更高.
3.8 气体停留时间和气体流速
为了研究在等离子体反应器中停留时间对苯系物的分解率的影响,在一组以甲苯为原料的实验中,WU等[14]使用电晕等离子体放电反应器在模拟气体的气流速率分别为100、50、33.3、20、15、11和9L/min的条件下对其进行处理,上述气体流速对应的停留时间分别为3、6、9、15、21、27、33s.通过改变停留时间的长短,来研究停留时间对电晕等离子体反应器处理甲苯时的影响.实验中分别设置了三组浓度(432、850、1653mg/m3)的模拟气体,实验发现,当延长停留时间时,能够观察到甲苯的分解率显著提高,当停留时间达到20s时,能够获得更高的分解效率的增长率.进一步延长停留时间,分解率的增长率开始下降,究其原因是因为在反应器和反应过程中自由基的寿命较短所限制.从经济效益方面考虑,尽可能地延长停留时间并不是最佳的选择,一般而言,通常将停留时间控制为20s.
Hakjoon等[66]在使用了低温等离子体-生物滤低法处理甲苯,甲苯的初始浓度范围为50× 10-6~100×10-6,平均浓度为58×10-6,实验中将气体流速从20L/min上调至200L/min,研究气体流速在等离子体反应器处理甲苯的实验中对其去除率的影响,经实验发现,当气体流速从20L/min上升至200L/min时,待处理物的停留时间也相应地从28.9s上升至2.6s,甲苯的去除率随气体流速的增加而降低,当气体流速达到200L/min时,甲苯的分解率降低至40%,经过分析后得出结论:当气体流速较高时,甲苯与生物种群之间的接触时间就会较短,从而使得甲苯的分解率降低.因此,在使用等离子体反应器处理苯系物时,将适当的气体流速范围中,气体流速越低,则获得的处理效果越好.
Sekiguchi等[67]使用了介质阻挡放电反应器处理苯的分解率,在实验中分别在存在0.5wt%Pt/Al2O3催化剂和催化剂的情况下对苯进行处理,其中苯的浓度分别为100×10-6和50×10-6,将停留时间从0延长至20s,研究停留时间在等离子体反应器处理苯的过程中所造成的影响,例如,在苯的浓度为100×10-6的条件下,当催化剂存在时,停留时间为0.5s时对应的分解率为70%,延长停留时间至0.7s时对应的分解率为98%左右;在苯的浓度为50×10-6的条件下,当催化剂存在时,将停留时间延长至0.7s,苯的分解率几乎达到100%,无论是否存在催化剂,苯的分解率都随着停留时间的增加而增加.
为了研究气体流速在等离子体反应器处理苯系物时对分解率的影响,Karuppiah等[53]使用了介质阻挡放电反应器对初始浓度为500×10-6的硝基苯进行处理,在硝基苯的分解过程中,将比耗能控制在50~650J/L的范围内.实验中设置了3组气体流速值,即气流速率为250、500和750mL/ min,对应的气体停留时间分别为3.1s、1.5s和1.03s.经实验发现,当停留时间为3.1s时,硝基苯的转化率在比耗能为684J/L时达到了100%;当停留时间为1.5s时,硝基苯的转化率在比耗能为324J/L时达到了95%;当停留时间为1.03s时,硝基苯的转化率在比耗能为216J/L时达到了85%.实验表明,在等离子体反应器中,硝基苯的分解率随着比耗能的增加以及气流速率的增加而降低.
3.9 初始浓度
通常来说,不同工业源排放出来的实际工业尾气中的VOCs浓度不同,因此,研究们需要对初始浓度对于苯的分解率的影响进行研究.一般而言,VOCs的分解率会随着VOCs的初始浓度的增加而减少[25,68-70].出现这一结果的原因是由于高能电子在单位时间间隔和单位体积内只能与一定数目的分子发生作用,所以当初始浓度越低时,单位VOCs分子与活性粒子的碰撞概率会增加.Subrahmanyam等[68]使用了介质阻挡放电反应器处理甲苯,该实验在电压为12.5kV,频率为200Hz的条件下进行,对应比耗能为160J/L,并且分别使用了一种传统铜电极和催化剂SMF作为内部电极.处理过程中将甲苯的初始浓度为从100×10-6提高至1000×10-6,研究甲苯分解率随初始浓度的变化情况,在使用铜电极的介质阻挡反应器中,甲苯浓度为100×10-6时的分解率为70%,甲苯浓度为1000×10-6时的分解率为45%.使用SMF催化剂电极的介质阻挡反应器的甲苯分解率也观察到了相似的趋势,这一实验结果表明甲苯的分解率随着甲苯浓度的增加而减少.
此外,Delagrange等[69]为了初步地了解单独使用等离子体以及存在催化剂(等离子体+1gMnO2/Al2O3)这两种情况下,将甲苯的初始浓度控制在0~300×10-6以内,研究不同初始浓度时获得的甲苯的分解率,实验中施加的电压和频率分别为32kV和280Hz,总气体流速为3000mL/ min,比耗能为99.5J/L.经过实验发现,等离子体与催化剂共同作用处理甲苯时获得的效果比单独的等离子体处理甲苯的效果要高,但是无论实验中是否存在催化剂,甲苯的分解率都随着甲苯初始浓度的增加而减少.
在等离子体催化剂反应器处理苯的实验中, Kim等[71]采用了Ag/TiO2作为催化剂,因为在选择最合适的排放物控制装置中,最重要的两个的参数是气流速率和浓度,但是由于低温等离子体过程并不适用于气流速率范围较宽的情况.因此从气体浓度上,了解等离子体驱动催化剂系统的兼容性是很重要的.实验中将苯的初始浓度控制在60×10-6~210×10-6,研究苯的分解特性.实验结果表明,在处理低浓度苯中,等离子体驱动催化剂反应器表现出了更好的性能.在比耗能为70J/L的条件下,当苯的初始浓度为202×10-6时,分解率为20%;当苯的初始浓度为60×10-6时,分解率增加到了98%.实验结果表明,在等离子体反应器处理苯的实验中,初始浓度越低,苯的分解率越高.
3.10 湿度
在实际生产中,大部分的工业废气中都包含着水蒸气,因此,水蒸气的含量也应该作为影响VOCs的分解率的因素进行探究[14,25,41,55,72].为了研究空气湿度对等离子体反应器处理苯系物的影响,WU等[14]采用了采用了电晕等离子体反应器对甲苯进行研究,实验中模拟废气的流速为1m3/h,其中甲苯的密度为750mg/m3,通过将相对湿度从0上升至100%,分别研究在20kV、22kV、24kV这3组电压下,处理甲苯的效果随相对湿度变化的情况.实验发现,在最开始时增加模拟废气的湿度能够显著地提高甲苯的分解率,当相对湿度达到50%~56%时,能够获得最高的甲苯分解率,随后,甲苯的分解率又呈现出下降趋势,一般来说,相对湿度为50%时能够取得较好的处理效果.同样,在使用电晕放电反应器处理苯的实验中[25],苯的初始浓度为200×10-6,并且使用了5wt%CuO/AC(活性炭)作为催化剂,将总流速控制为16.7L/min,研究在不同湿度条件下对等离子体反应器中处理苯的分解率的影响,实验中设置的四组湿度条件,第一组:45%的相对湿度;第二组:60%的相对湿度;第三组:75%的相对湿度;第四组:90%的相对湿度.经过实验研究发现,当相对湿度从45%上升至60%时,苯的分解率会略微地上升,这可能是由于产生了OH自由基的缘故,然而,继续增加相对湿度,使相对湿度从60%上升90%,观察到苯的分解率开始下降.出现这一结果的原因可以归结为:最初,当模拟废气中含有更多的水分子时,水分子与高能电子的碰撞频率会增加,因而产生更多能够促进甲苯分解的自由基.随着湿度的增加,当模拟废气中的湿度达到一定值时,电子能量的耗损量超过了水分子的碰撞,这将降低甲苯的分解效率.总而言之,在低温等离子体反应器中,水蒸气有多种作用.在低温等离子体反应器中水蒸气能够抑制电子以及活性分子,并产生OH自由基以及旋转振动的电激发态.水蒸气也会改变填充材料或者介质表面的表面状态.例如,水蒸气减小表面电阻,从而减小流体的数量,但是增强了单个流体的强度.水蒸气多方面的作用取决于反应条件或者反应器类型.当在低温等离子体反应器中有固体物质时,比如在填充床或者等离子体辅助催化反应器中,水蒸气的存在可能会导致表面状态的改变,这可能影响等离子体性质,导致化学反应的改变.在填充床反应器中,所观察到的水蒸气在苯系物的分解过程中的负面作用表明,水蒸气导致了催化剂表面的改变,这一点对于苯系物的分解是有害的[72].
3.11 占空比
Ma等[73]在干燥条件下采用了介质阻挡放电反应器对苯进行分解,当初始浓度为430×10-6,气流恒定为1.4L/min时,通过改变停留时间来研究苯的分解率,经实验发现,将电压控制为28.2kV,当占空比为20%时,获得的分解率为35%,但是当占空比从40%上升到70%时,获得的苯的分解率也从66%上升到90.5%.经过研究分析发现,分解率随占空比的增加而上升的原因是由于随着占空比的增加,活性粒子数量(如电子和自由基)也会相应的增加,这些活性粒子会进一步促进苯分解的化学反应,从而得到更好的分解效果.
3.12 待处理苯系物的类型
Karatum等[74]采用了介质阻挡放电反应器处理各种挥发性有机物,这些挥发性有机物包括甲乙酮、苯、甲苯、3-戊酮、甲基叔丁醚、乙苯、正己烷,研究在气体停留时间为0.016s,初始浓度为95×10-6~100×10-6的条件下所获得的分解率,实验中向系统输入的能量为350J/L,经过对实验的数据分析处理后发现,这些挥发性有机物的分解率从低到高的顺序为:甲乙酮(50%)<苯(58%)<甲苯(74%)<3-戊酮(76%)<甲基叔丁醚(80%)<乙苯(81%)<正己烷(90%).因此得出结论,正己烷分子结构中氢的占比最高,等离子体处理正己烷的分解率也最高.
3.13 催化剂
在目前已知的研究中已经提出了使用低温等离子体过程分解苯系物的不同方法.但是将等离子体与催化剂联合使用处理苯系物的研究很少.通常而言,等离子体催化过程中的苯系物分解的特征和低温等离子体过程分解苯系物的特征有着明显的区别.除了存在低温等离子体中的分解反应,还存在等离子体催化过程中更多的反应.催化剂与等离子体反应器联合是最近年来处理挥发性有机物的热点,它的主要原理是在等离子体反应器中通过添加催化剂,进一步更加有效地将有机污染物分解为不会对环境造成污染的CO2、H2O以及无机小分子物质,但是其处理效果与催化剂的种类和含量等都有着密不可分的联系[35,68-70,75-76].
3.13.1 催化剂的种类 Jiang等[77]采用了介质阻挡放电反应器处理氯苯,实验中采用了CeO2/ HZSM-5作为催化剂,并对氯苯的产物进行分析,结果证明,CeO2/HZSM-5是一种非常好的催化剂,它具有良好的稳定性,能够提高氯苯的降解效果,同时产生的分产物数量较少.实验中氯苯的初始浓度为1250mg/m3,停留时间为5s.实验结果显示,当比耗能为3.5kJ/L时,使用了CeO2/HZSM-5作为催化剂的实验组所获得的氯苯分解率为72.6%,其分解率远远超过了未使用催化剂时的两倍.这是由于CeO2/HZSM-5催化剂具有很强的酸性和氧化还原性.氯苯能够有效地吸附在催化剂的酸性点,并且氧化发生在氧化还原位点的附近,总的来说,氧化性是影响催化剂效果的最大因素.
Zhu等[78]采用了低温等离子体分解氯苯,实验在放电电压范围为5~9kV,停留时间为3~15s的条件下进行,在其它实验条件相同的情况下分别采用了CeO2/HZSM、CuO/MnO2、Ag/TiO2作为催化剂,对氯苯进行处理,经过试验发现,采用不同的催化剂所获得的氯苯分解率不同,催化剂的活性顺序为:CeO2/HZSM>CuO/MnO2> Ag/TiO2.
Chavadej等[79]在一组使用电晕反应器去除苯的实验中,采用了多级等离子体反应器作为实验装置,研究存在催化剂的实验条件下,不同的催化剂对苯的分解率的影响,实验中采用了四组催化剂:第1组:无催化剂(对比实验);第2组:商业性TiO2;第3组:溶胶凝胶TiO2;第4组:1%Pt/溶胶凝胶TiO2.经研究发现,在使用了催化剂的情况下,反应器分解苯的效率明显高于未使用催化剂的情况,并且在一至四级的反应器的级数情况下,当使用商业性TiO2和溶胶凝胶TiO2时,都观察到了CO2的选择性提高了6%~10%,CO的选择性降低了3%~4%,这一结果能够解释为TiO2能够促进形成的超氧自由基阴离子(O2·-)的积累,因此抑制了重组过程,同时增加了催化活性.而向溶胶凝胶TiO2中添加Pt后,不会提高苯的分解率,经过对研究中所有的催化剂进行比较之后发现,溶胶凝胶TiO2是最佳的催化剂,这是因为溶胶凝胶TiO2与商业性TiO2相比,具有更高的表面积.
在Huang等[32]使用介质阻挡放电-催化反应器处理甲苯的实验中,分别设置了5组催化剂的实验条件,第1组:无催化剂(对比实验);第2组:MnOx/ZSM-5;第3组:CoMnOx/ZSM-5;第4组CeMnOx/ZSM-5.研究在不同催化剂的作用下,介质阻挡放电反应器对甲苯进行处理时的效果,经实验发现,介质阻挡放电-催化反应器处理甲苯的效率远远高于单个等离子体处理系统,并且在比耗能为50~400J/L的范围内,使用了CoMnOx/ZSM-5的反应器呈现出最高的分解效率,在比耗能达到192.5J/L之前,在以上3种催化剂存在的情况下,等离子体反应器去除甲苯的效率上升得十分迅速,随后分解率缓慢上升至最大值,催化剂分别为MnOx/ZSM-5、CeMnOx/ZSM-5、CoMnOx/ZSM-5时,获得的最高的分解率分别为68.1%、86.1%、93.7%,综上所述,CeMnOx/ZSM-5和CoMnOx/ZSM-5与MnOx/ZSM-5相比,具有更高的分解效果,分析原因可知,CeMnOx/ZSM-5和CoMnOx/ZSM-5具有更高的分解率是由于复合金属材料之间的强烈反应能够促进中间体的氧化.
同样,Grossmannova等[49]使用了辉光-催化放电反应器对甲苯进行处理,甲苯的初始浓度为45×10-6,实验中采用了Cu-Mn/Al2O3作为催化剂,设置了三组实验条件作为对比实验,研究热催化活性对于处理甲苯过程中获得的分解率的影响,第一组:等离子体+催化剂;第二组:催化剂;第三组:等离子体.首先,在室温下(16℃)仅使用等离子体对甲苯进行处理,接着在不存在等离子体的情况下将催化床加热至300℃,最后,同时激发等离子体和催化剂对基本进行处理.经过实验后发现,在低温条件下,当等离子体和催化剂同时运行的协同作用时,能够得到最优的甲苯分解率.在室温条件下,使用催化剂后,甲苯的分解率从10.8%提高至22.8%,而当催化温度提高至300℃时,获得的最高分解率大约为96%.
同时Huang等[80]也使用NiO、CeO2、Fe2O3和CuO作为催化剂与等离子体联合处理甲苯.实验中的温度以上升速率为10℃/min的速率从室温增加至800℃,将混合气体以30mL/min的速率(10%H2和90%Ar)流经催化剂样品,其中催化剂样品的质量为0.05g.经过实验发现,上述物种催化剂对于甲苯的氧化性能各有不同,其结果为NiO/γ-Al2O3>MnO2/γ-Al2O3>CeO2/γ-Al2O3>Fe2O3/γ-Al2O3>CuO/γ-Al2O3,其中NiO/γ-Al2O3催化剂的性能明显高于其它催化剂.
Chang等[81]采用了介质阻挡放电反应器处理苯乙烯,实验中准备4种类型的填充床介质阻挡反应器用于处理苯乙烯,第1组:无填充物(对比实验);第2组:玻璃;第3组:Al2O3;第4组: Pt-Pd/Al2O3,经过实验发现,在施加电压分别为14kV和20kV的条件下,研究不同催化剂对苯乙烯的分解效果,其中,填充玻璃颗粒可以增强苯乙烯的分解率.例如,在外加电压为14kV时,未填充物质的介质阻挡放电反应器的分解率只有9%.当将玻璃球填充至介质阻挡放电反应器中时,分解率增加至49%.挥发性有机污染物的分解率得到增强的原因在于在每一个封装的玻璃球上产生的表面放电能够使等离子体在反应器内部均匀分布.当在我们的测试反应器中使用Al2O3颗粒作为填充床时,分解率得到了极大的增强.得到提高的原因是由于Al2O3的多孔表面的内体积上会生成短暂的氧化物质.此外,在外加电压为14kV的条件下,覆盖有Pt-Pd的小球表面的催化反应获得的苯乙烯的分解率达到了96%.同时,研究还发现了分解率随着施加电压的增加而增加.当施加电压增加到20kV时,苯乙烯在Al2O3介质阻挡放电反应器和Pt-Pd/介质阻挡放电反应器中可以得到彻底地分解.
目前研究中催化剂的情况如表2所示.
3.13.2 催化剂的量 在其它的实验中,Liang等[82]使用了电介质填充床等离子体反应器对甲苯进行了处理,在实验中采用了纳米级的BaTiO3、TiO2或BaTiO3/TiO2作为催化剂,实验中将BaTiO3: TiO2的比率分别设置为2:1、1:1和1:2,研究TiO2和BaTiO3之间的质量比对于甲苯分解率的影响,并且同时设置了一组未采用催化剂情况下的介质阻挡放电方式进行相比,经实验发现,TiO2和BaTiO3质量比为1:2的催化剂几乎没有催化效果;TiO2和BaTiO3的质量比为1:1的甲苯的分解率和质量比为1:2的结果几乎一致;TiO2和BaTiO3的质量比为2:1的对应的分解率最高.当BaTiO3: TiO2为2:1时,将比耗能从201J/L增加到363J/L,甲苯的分解率从20%增加到了38%.因此,在该研究中,TiO2/BaTiO3催化剂中的BaTiO3的含量越多,分解率越高.分析原因可能是因为BaTiO3能够增强电场,并且能够释放出更多的紫外光,这能够增强TiO2的活性,从而提高甲苯的分解率.
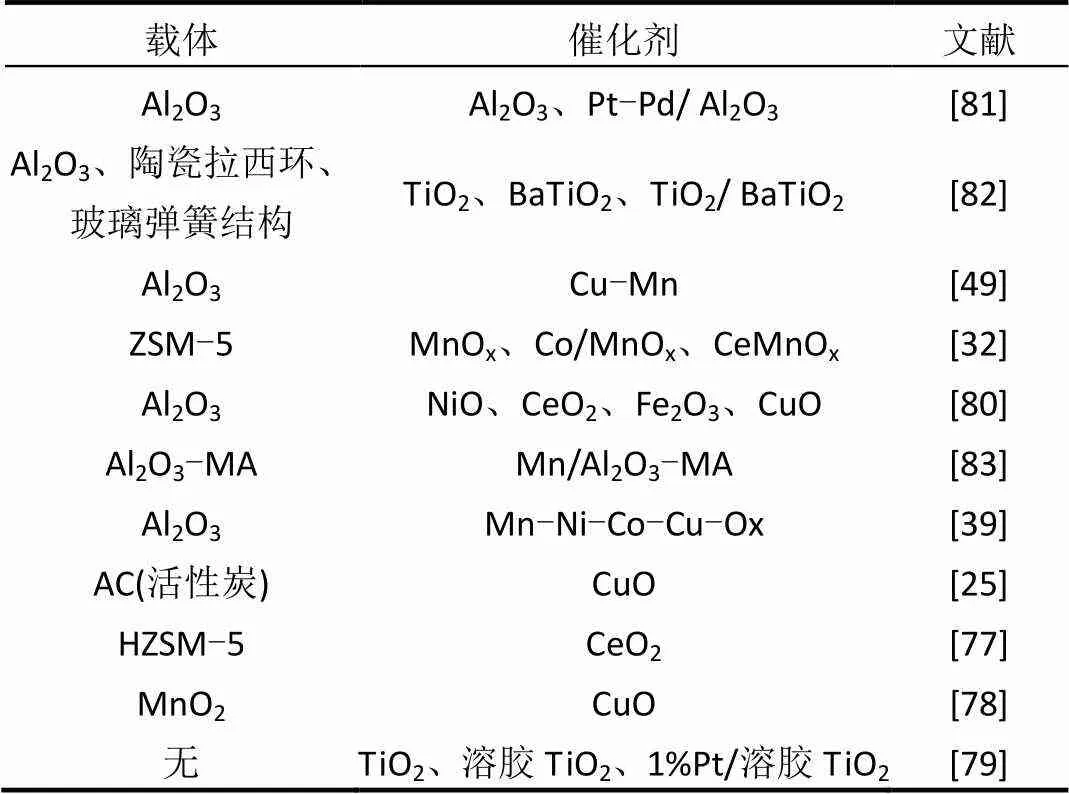
表2 催化剂类型
同时还发现,在等离子体反应器处理邻二甲苯的实验中,Wang等[83]采用了不同的Mn/Al2O3- MA催化剂的锰负载量,研究锰负载量对邻二甲苯的分解率的影响.实验中设置了5组实验条件,第1组:2wt% Mn/Al2O3-MA;第2组:4wt% Mn/Al2O3-MA;第3组:6wt% Mn/Al2O3-MA;第4组:8wt% Mn/Al2O3-MA;第5组:10wt% Mn/ Al2O3-MA.经实验发现,在5组实验中,第3组实验条件下(6wt% Mn/Al2O3-MA)获得的邻二甲苯的分解率最高.光电子能谱的分析结果表明,在不同负载量的Mn/Al2O3-MA催化剂情况中,6wt%的Mn/Al2O3-MA有着最高的Mn4+和Oα比例.针对使用了不同先导处理和不同负载量的Mn/ Al2O3-MA,X射线衍射和光电子能谱的分析证明了微晶MnO2和相对更多的Mn4+的存在,而更高含量的Oα对于提高邻二甲苯的分解率时有效的.
3.13.3 催化剂的位置 叶代启等[39]使用了线-筒型介质阻挡放电反应器处理甲苯,在该研究中,线筒型反应器的类型有4种,第1组:传统型反应器(无催化剂);第2组:二级反应器(催化剂置于二级反应器);第3组:填充床反应器(催化剂置于反应器中);第4组:反应区域内辅助催化.经实验发现,第3组类型的反应器获得的甲苯的分解率最高,第2组反应器中所获得的甲苯的分解率则最低.一般来说,有两种原因可以使等离子体区域与催化剂联合,并提高甲苯的分解效率,第一个原因是因为活性物质能够直接作用于催化剂的活性中心,并提高催化剂的活性,降低催化剂所需的温度,另一个原因是由于反应物分子能够通过放电获得能量,从而在催化剂的活性中心中促进化学吸收,并引起该反应.
3.13.4 催化剂的载体 在一个自主设计的电介质填充床等离子体反应器中,对甲苯进行了处理,Liang[82]采用了纳米级的BaTiO3、TiO2或BaTiO3/TiO2作为催化剂,并将催化剂载体与催化剂混合,研究实验中催化剂载体对甲苯的分解的影响,因此处理过程中分别将Al2O3粒子(粒子尺寸4~6mm)、陶瓷拉西环(外直径9.2mm,内直径5.6mm,长度10.5mm)、玻璃弹簧(外直径4.2mm,长度12~15mm)作为催化剂载体进行了讨论,同时还设置了一组未采用催化剂载体的条件作为对比实验.实验发现,在采用三种催化剂载体的情况下,甲苯分解率都有相同的趋势,即甲苯分解率随着比耗能的增加而增加.在相同实验条件下,上述四种反应器的分解率为Al2O3>陶瓷拉西环>玻璃弹簧>无;例如,当比耗能从210J/L增加到380J/L时,Al2O3粒子反应器中甲苯分解率从41%增加到73%,但是在玻璃弹簧反应器中,当比耗能从196增加到330J/L时,甲苯分解率从22%增加到46%.实验结果表明,当比耗能小于250J/L时,没有催化剂载体对应的甲苯分解率比采用玻璃弹簧时对应的甲苯分解率要高.分析原因可能是因为玻璃材料在较低的比耗能下不能进行极化.进一步地分析发现,O.或者OH.等反应物在等离子体区域会被玻璃材料吸收,进而导致了甲苯分解率的降低.
3.14 各反应条件影响程度的比较
经过大量的实验研究发现,许多因素都会对等离子体反应器处理苯系物的分解率造成一定程度的影响,为了更好地研究这些因素在降解苯系物时的影响程度,在一组使用等离子体催化辅助反应器处理苯的实验中,Xu等[25]分别对CuO载体、入口处苯的浓度、停留时间、反应湿度、能量密度这几个影响苯的分解率的因素做了测试,实验中观察到对苯的分解率影响程度最大的是停留时间,其次是CuO载体,接着是放电功率和苯的初始浓度,最后是相对湿度.不同影响因素对于苯的分解率的影响程度如下:停留时间>CuO载体>能量密度>苯的初始浓度>相对湿度.在该实验中,最优的反应条件如下:CuO载体为5.0wt%,相对湿度为50%,放电功率为48W,停留时间为40s,初始浓度为248×10-6,经过多因素正交实验分析之后发现,能够获得的最高的苯分解率为96.5%.
4 降解过程产物与降解机理
等离子体技术降解挥发性有机物的原理就是通过放电过程中产生大量活性离子,活性离子与挥发性有机污染物进行反应,将污染物分子分解为无毒无害的小分子或容易处理的化合物,从而达到分解的效果.
4.1 苯降解机理
在一组使用等离子体辅助催化剂反应器(采用CuO/AC作为催化剂)处理苯的实验中[25],经过对各个影响因素进行多因素正交实验分子之后,研究出了处理最优的反应条件:CuO载体为5.0wt%,相对湿度为50%,放电功率为48W,停留时间为40s,初始浓度为248×10-6.在以上最优的实验条件下,对苯进行一系列处理之后,使用气相色谱仪和傅里叶变换红外光谱对出口处气体的成分分析后可知,H2O、CO2和O3是最主要的产物,并且在苯分子彻底分解之前,中间过程会形成一系列副产物.苯的分子结构十分稳定,它具有π-电子键系统.苯分子中的C=C和C-H键之间的离解能分别为5.4eV和4.6eV.在处理过程中,只有当电子超过5.4eV时,能够使得苯分子的环发生断裂,因此,反应器中除了通过高能电子将苯分子环断裂之外,也存在着许多复杂的反应能够使苯分子分解,综上所述,在低温等离子体辅助催化剂反应器中,苯的分解机理如图4所示.
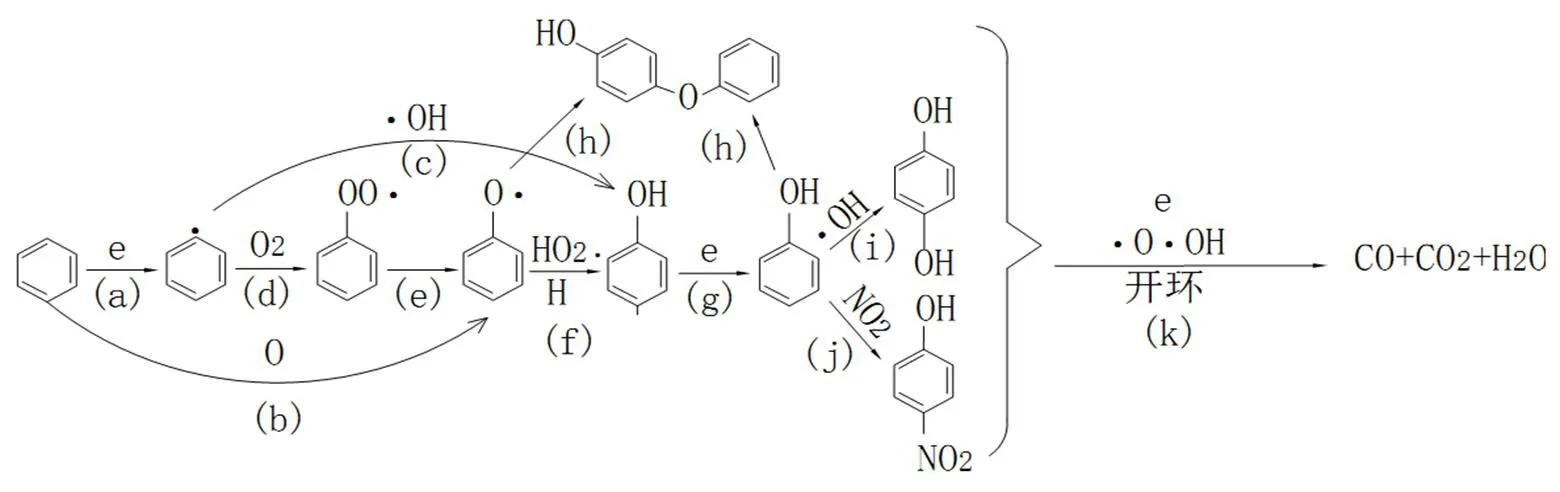
图4 苯的分解路径
首先,在高能电子作用下,苯分子中的C-H键断裂,生成苯基(步骤(a)).
e+C6H6→C6H5·+H· (1)
苯基和•OH发生反应生成苯酚(步骤(c)).
C6H5·+OH·→C6H5OH (2)
进一步,O(3P)原子和对苯分子发生亲电加成作用,生成苯氧自由基(步骤(b)),
O+C6H6→C6H5O· (3)
另外,在产生苯酚的过程中,苯基和O2的反应下,产生过氧化苯(步骤(d)),过氧化苯失去一个O原子,生成苯氧自由基(步骤(e)).
C6H5·+O2→C6H5OO·→C6H5O·+O (4)
在苯酚的生成过程中,苯氧自由基在•H或者HO2•粒子的作用下转化为苯酚(步骤(f)).
C6H5O·+H·→C6H5OH (5)
在高电子密度环境下,苯氧自由基或苯酚的4-亲电替换优先发生反应(步骤(g)).苯氧自由基和苯酚中的C4发生反应,生成4-苯氧基-苯酚(步骤(h)).苯酚中的C4发生NO2和•OH的亲电替换.
C6H5OH+e→C6H4OH·+H· (6)
进而生成苯二酚(步骤(i))以及4-氮-苯酚(步骤(j)).
C6H4OH·+OH·→C6H6O2 (7)
C6H5OH+NO2→OH-C6H4-NO2+H· (8)
O和OH自由基直接作用于苯环上,这些芳香族衍生物进一步得到降解.苯环打开后产生的主要化合物是甲酸,甲酸是芳香族化合物分解产生的一种普通的中间产物,但它对于CO的形成来说是一种重要的中间物,因为甲酸会进一步与高能电子和活性自由基反应,最终生成CO和H2O(步骤(k))[84].
通过苯分子和高能电子在等离子体中的碰撞,苯自由基导致了反应的发生.在等离子体反应器中,生成了大量的粒子如H、O、N和•OH,自由基的一系列反应导致了多种苯环衍生物的生成.
4.2 甲苯降解机理
通过低温等离子体分解甲苯有以下的3个途径:电子作用、离子碰撞和气相粒子(例如O和OH•)的轰击,离子碰撞的影响可以被忽略.考虑到反应速率常数、高能电子以及O原子的浓度,在低温等离子体过程中甲苯更容易在电子作用下发生分解.因此,电子的影响应该是最重要的过程,并且引起了甲苯分解的初始反应.在反应过程中,气相的O原子以及OH•大量地参与了甲苯的分解,尤其是在甲苯的芳香环打开之后的氧化过程中.在一系列基团的作用下会发生一些复杂的反应,比如取代反应、加成反应、氧化反应和硝化反应,并进一步生成直链烃,反应途径可以分为以下3种[85]:
甲苯的断键反应:
C6H5CH3+e→C6H5CH2+H (9)
C6H5CH3+e→C6H4•CH3+H (10)
C6H5CH3+e→C6H5+CH3(11)
高能电子作为主要物质导致甲苯的分解的可能途径如图5a所示.

图5 甲苯的分解路径
甲苯的主要分解过程为高能电子所导致的甲基中的H分离.甲基中的氢分离生成了苄基,苄基进一步和O或者OH•发生反应,从而生成苯甲醛,苯甲醛进一步氧化成苯甲酸.这些芳香族中间产物进一步被高能电子作用,导致了芳香环的断裂.在高能电子或者反应物质作用下,最终活化或者局部的分解产物氧化生成CO2和H2O.
高能电子的平均能量在1~10eV范围中发生变化.甲基和苯环之间的C-C键能为4.4eV.因此,C-C在能量大于4.4eV的高能电子的作用下能够被轻易分解,产生苯基和甲基.如图5a所示,苯基可以和活化的NO2•、O和OH•发生反应,分别产生硝基苯、苯和苯酚.这些芳香族中间产物进一步在高能电子作用下,最终氧化生成CO2和H2O.有研究总结了甲苯破坏所引起的等离子体的机制,环中的C-C键可以通过以下的两个途径打开:
C6H5•CH3+e→CH=CH+HC=CCH3-CH=CH
或者→CH=CH-HC=CH+CCH3=CH (12)
在等离子体催化过程中有更多的O和OH•生成,并同时存在于气相和催化剂表面.除了高能电子的作用,粒子作用同样也是导致甲苯分解的重要机制,在O/OH•的作用下引起的甲苯分解的可能途径如图5b所示.
因此,高能电子使得等离子体进一步将甲苯进一步分解,其机理如下[86]:
(1)O2和N2的离解和电离生成了O、O3、N、H、碳氢自由基和离子;
(2)原子-分子反应和离子-分子反应生成了OH自由基;
(3)OH自由基和负离子导致甲苯的离解,生成了烃类物质;
(4)烃类物质被氧化,生成CO、CO2和H2O;
(5)氮气和氧气被氧化,生成NO和O3,最终生成了N2O和HNO3.
烃类物质和硝酸盐在离子诱导作用下生成了气溶胶颗粒.
4.3 对二甲苯降解机理
在使用介质阻挡放电反应器处理对二甲苯的实验中,在等离子体的作用下,对二甲苯得到降解,处理过程中主要是通过对二甲苯与电子、原子、O自由基和OH自由基之间的碰撞实现的.
e+C6H4(CH3)2→产物 (13)
(O2+,O+,N2+或N+)+C6H4(CH3)2→产物 (14)
[O,O(1D),O2(b1Σ),N(2D),N(2p), N2(A3Σu+)]+C6H4(CH3)2→产物 (15)
OH+C6H4(CH3)2→C6H4CH2CH3+H2O (16)
→C6H4(CH3)2OH (17)
上述反应式中生成的产物是一些自由基或断裂产物,它们能进一步与O或OH和O3反应生成稳定的化学产物.
在N2等离子体气体中,由于对二甲苯不能直接与氮气分子发生反应,因此通过电子碰撞离解引导的对二甲苯的主要途径如下[87]:
C6H4(CH3)+e→2C6H3(CH3)2+e (18)
→C6H4CH3+CH3+e (19)
→CH2(C6H4)CH3+H+e (20)
→C6H8+C2H2+e (21)
4.4 邻二甲苯降解机理

图6 邻二甲苯的主要降解路径
在介质阻挡放电反应器中,根据反应器中检测到的产物,对邻二甲苯进行处理[88].图6显示了邻二甲苯的降解机理.在等离子体中高能电子作用下邻二甲苯得到分解,这是由于电子和基团引起邻二甲苯分子分解(O•、•OH)所造成的.邻二甲苯混合物的分解取决于两个分解机制,包括电子和邻二甲苯的直接碰撞直接导致的分解,以及邻二甲苯分子和气相基团(O•、•OH)之间的反应.
4.5 苯乙烯的降解机理
有研究使用了电晕放电反应器对苯乙烯的降解机理进行处理,经过研究发现[27],在处理过程中,空气中的H2O和O2与活性粒子碰撞产生O和OH自由基,如反应(22)和(23)所示.反应中自由基的产生效率取决于放射性体源和气体成分.
O2+e→O+O+e (22)
H2O+e→OH+H+e (23)
接着通过以下反应使得苯乙烯得到分解:
C6H5-CH=CH2+O→C8H8O (24)
C6H5-CH=CH2+OH→C6H5-CH•-CH2-OH
或→C6H5-CH-CH2•(-OH) (25)
在等离子体过程之后,苯乙烯气体被转化为气体混合物和气溶胶.经过实验可以发现,苯甲醛和苯乙醛是主要氧化副产物.此外,在样品中也观察到了苯乙酮,苯甲酸,苯甲酰甲酸,苯基乙二酮和苯乙酸.因此,在苯乙烯的去除过程中,主要的反应途径如图7所示.在第一步中,在OH、O和O3的作用下,分别生成了Ph-CH- (OH)-CH2.和Ph-CH.-CH2(OH)自由基,苯基环氧乙烷和臭氧化物,这些中间副产物化学活性很高,并且能够进一步通过一系列的氧化步骤,转化为苯甲酸,而这一系列反应也能够解释以上生成的所有副产物.
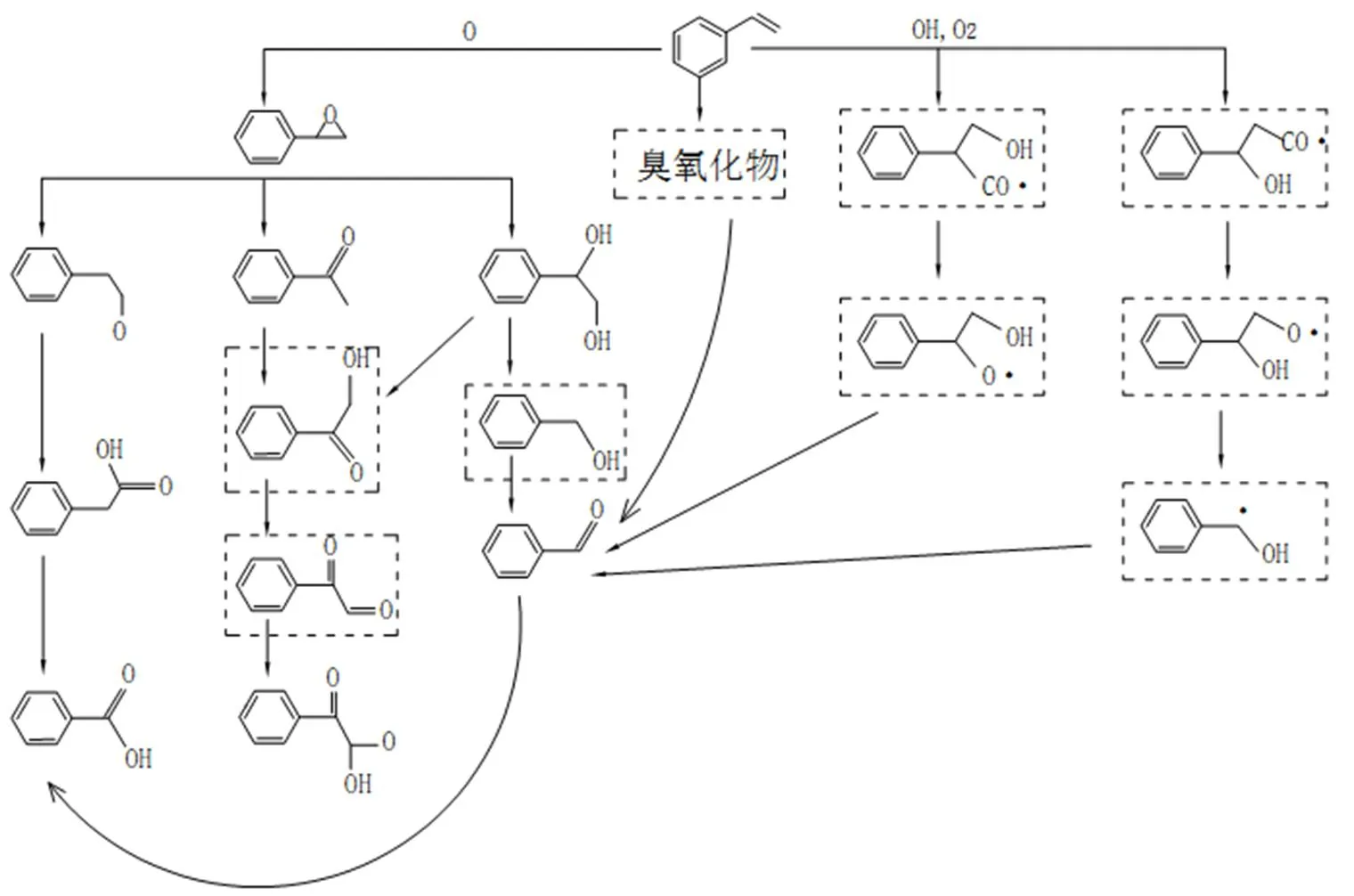
图7 苯乙烯的去除机理
4.6 副产物及无害化的讨论
许多研究者已经提出低温等离子体化学反应对于分解大多数的挥发性有机化合物是有效的.在等离子体技术处理苯系物的过程中,主要的产物为CO、CO2和O3.同时也会生成CH4、C2H6、C2H4、C2H2、N2O、NO和NO2,并且研究中还检测出了一定量的对苯二酚、庚酸、硝基邻苯二酚、苯酚和羟基二苯醚等残余物[89-92].
NO和O3的去除方法主要包括固体吸附法、液体吸收法、催化法:
(1)固体吸附法就是利用固体物质与气体之间不同的结合力,对NO和O3进行吸收,这些吸收法包括活性炭吸附法、分子筛吸附法、硅胶吸附法;

表3 反应器类型和放电类型参数
(2)液体吸收法即将NO或O3与药液反应,例如在吸收NO2的时候,常常采用碱液、酸吸收法(稀硝酸、浓硫酸);液相还原吸收法是利用还原剂将NO还原成N2,或将O3还原成O2,常用到的还原剂包括硫化物、亚硝酸盐、硫代硫酸盐等;
(3)催化还原法是在一定温度和催化剂作用下,利用还原剂将NO还原成N2;催化分解法是降解NO最有效的方法,例如在催化剂的作用下发生反应:将NO分解为N2,即2NO→N2+O2;或使O3分解成O2,即2O3→3O2.
此外,也可以采用生物法对NO或O3进行降解,因此在使用等离子体处理苯系物的同时,通常会使用多种方法联合等离子体对它们进行降解,如等离子体-吸附法、等离子体-氧化法、等离子体-催化法、等离子体-生物法等.
目前大部分等离子体降解苯系物的副产物分析仅仅停留在实验层面,对于产生副产物的机理大多数也是以化学公式为基础得来的,因此建议从几个角度考虑来讨论苯系物的无害化处理.
(1)综合选择最优的等离子体方式,检测等离子体处理苯系物的降解过程中的中间产物和终极产物的变化趋势,结合最终产物分析,从而制定出减少有毒副产物生成的方案.
(2)借鉴等离子体技术处理其它挥发性有机污染物的研究方法,改良等离子体反应器装置的结构,或者采用多级串联的方式与其它处理技术进行结合,对副产物进行二次处理,从而达到无害化的目的.
5 结语
目前,处理苯系物的技术主要包括焚烧、催化氧化、活性炭吸附、热分解、冷凝、液体吸收、生物过滤等,同时这些技术已经在大型排气源上得到了应用.然而,由于每一种技术都受到其缺点的限制.等离子体由于具有相对比较低的能量消耗以及高分解率,近年来,随着等离子体技术的发展,等离子体开始具备越来越多的工业潜力,低温等离子体技术和传统技术(例如催化氧化和热焚烧)相比,大气压条件下的低温等离子体技术能够在室温下进行,能够更有效地分解较低浓度的挥发性有机化合物.
低温离子体技术依然存在缺点,比如能量效率较低、对于二氧化碳和副产物生成的选择性较差.在等离子体处理苯系物的过程后,处理有害副产物(例如NO和CO)也需要较高的成本.
为了使等离子体技术能够更加成熟地在工业上得到应用,因此有必要从以下几个角度继续对该技术进行研究:
(1)对每种影响VOCs的分解率的因素进行综合考虑,并且结合经济成本,优化反应条件、提高分解率和能量效率;
(2)研制更多的新型催化剂材料,从而更加有效地处理VOCs;
(3)定性和定量地对降解过程中的中间产物及终极产物进行分析,更加细致地研究其降解机理,优化条件,达到使最终产物无害化的目的;
(4)现有的反应器形式比较单一,应该结合等离子体技术与多种处理技术联合使用,提高VOCs的分解率,并且这一研究方向也将成为未来研究的主要方向.
[1] Wang H, Li D, Wu Y, et al. Removal of four kinds of volatile organic compounds mixture in air using silent discharge reactor driven by bipolar pulsed power [J]. Journal of Electrostatics, 2009,67(4):547-553.
[2] Yan X F, Hu Z. Experiment and analysis on the treatment of gaseous benzene using pulsed corona discharge plasma [J]. Plasma Science & Technology, 2004,6(2):2241-2246.
[3] Huang H, Ye D, Leung D Y C, et al. Byproducts and pathways of toluene destruction via plasma-catalysis [J]. Journal of Molecular Catalysis A Chemical, 2011,336(1):87-93.
[4] Magureanu M, Mandache N B, Eloy P, et al. Plasma-assisted catalysis for volatile organic compounds abatement [J]. Applied Catalysis B Environmental, 2005,61(1):12-20.
[5] Trushkin A N, Kochetov I V. Simulation of toluene decomposition in a pulse-periodic discharge operating in a mixture of molecular nitrogen and oxygen [J]. Plasma Physics Reports, 2012,38(5):407-431.
[6] Novoselov Y N, Surkov Y S, Filatov I E. Streamer corona removes styrene vapor from air flow [J]. Technical Physics Letters, 2000,26(7):550-552.
[7] Hakoda T, Matsumoto K, Mizuno A, et al. Role of metals loaded on a TiO2surface in the oxidation of xylene in air using an electron beam irradiation/catalytic process [J]. Applied Catalysis A General, 2009,357(2):244-249.
[8] Kohno H, Tamura M, Honda S, et al. Generation of aerosol particles in the process of xylene, and TCE decomposition from air stream by a ferroelectric packed-bed barrier discharge reactor [J]. Journal of Aerosol Science, 1997,28(Suppl 1):413-414.
[9] Zhang H, Li K, Sun T, et al. The combination effect of dielectric barrier discharge (DBD) and TiO2catalytic process on styrene removal and the analysis of the by-products and intermediates [J]. Research on Chemical Intermediates, 2013,41(1):175-189.
[10] Kim H H, Ogata A, Futamura S. Oxygen partial pressure- dependent behavior of various catalysts for the total oxidation of VOCs using cycled system of adsorption and oxygen plasma [J]. Applied Catalysis B Environmental, 2008,79(4):356-367.
[11] Chen J, Xie Z, Tang J, et al. Oxidation of toluene by dielectric barrier discharge with photo-catalytic electrode [J]. Chemical Engineering Journal, 2016,284:166-173.
[12] Harling A M, Demidyuk V, Fischer S J, et al. Plasma-catalysis destruction of aromatics for environmental clean-up: Effect of temperature and configuration [J]. Applied Catalysis B Environmental, 2008,82(3):180-189.
[13] Magureanu M, Mandache N B, Gaigneaux E, et al. Toluene oxidation in a plasma-catalytic system [J]. Journal of Applied Physics, 2006,99(12):315.
[14] WU Zu-liang, GAO Xiang, LUO Zhong-yang, et al. Decomposition characteristics of toluene by a corona radical shower system [J]. Journal of Environmental Sciences, 2004, 16(4):543-547.
[15] 闫柯乐,张红星,邹 兵,等.含苯系物废气处理技术研究进展 [J]. 合成材料老化与应用, 2016,45(1):103-107.
[16] Guo Y F, Ye D Q, Chen K F, et al. Toluene decomposition using a wire-plate dielectric barrier discharge reactor with manganese oxide catalyst in situ [J]. Journal of Molecular Catalysis A Chemical, 2006,245(1):93-100.
[17] Ge H, Hu D, Li X, et al. Removal of low-concentration benzene in indoor air with plasma-MnO2catalysis system [J]. Journal of Electrostatics, 2015,76:216-221.
[18] Fan H Y, Shi C, Li X S, et al. High-efficiency plasma catalytic removal of dilute benzene from air [J]. Journal of Physics D Applied Physics, 2009,42(22):225105.
[19] Zhu T, Li J, Jin Y Q, et al. Gaseous phase benzene decomposition by non-thermal plasma coupled with nano titania catalyst [J]. International Journal of Environmental Science & Technology, 2009,6(1):141-148.
[20] Zhang Y, Li D, Wang H C. Removal of volatile organic compounds (VOCs) mixture by multi-pin-mesh corona discharge combined with pulsed high-voltage [J]. Plasma Science & Technology, 2010,12(6):702-707.
[21] Sekiguchi H, Ando M, Kojima H. Study of hydroxylation of benzene and toluene using a micro-DBD plasma reactor [J]. Journal of Physics D Applied Physics, 2005,38(38):1722.
[22] Guo Y F, Ye D Q, Tian Y F, et al. Humidity effect on toluene decomposition in a wire-plate dielectric barrier discharge reactor [J]. Plasma Chemistry & Plasma Processing, 2006,26(3):237-249.
[23] 李和平,于达仁,孙文廷,等.大气压放电等离子体研究进展综述 [J]. 高电压技术, 2016,42(12):3697-3727.
[24] Ye Z, Zhang Y, Li P, et al. Feasibility of destruction of gaseous benzene with dielectric barrier discharge [J]. Journal of Hazardous Materials, 2008,156(1):356-364.
[25] Xu N, Fu W, He C, et al. Benzene removal using non-thermal plasma with CuO/AC catalyst: reaction condition optimization and decomposition mechanism [J]. Plasma Chemistry & Plasma Processing, 2014,34(6):1387-1402.
[26] Van D J, Dewulf J, Sysmans W, et al. Abatement and degradation pathways of toluene in indoor air by positive corona discharge [J]. Chemosphere, 2007,68(10):1821-1829.
[27] Zhang X, Zhu J, Li X, et al. Characteristics of styrene removal with an AC/DC streamer corona plasma system [J]. IEEE Transactions on Plasma Science, 2011,39(6):1482-1488.
[28] Malik M A, Minamitani Y, Schoenbach KH. Comparison of catalytic activity of aluminum oxide and silica gel for decomposition of volatile organic compounds (VOCs) in a plasmacatalytic Reacto [J]. IEEE Transactions on Plasma Science, 2005,33(1):50-56.
[29] Schiorlin M, Marotta E, Rea M, et al. Comparison of toluene removal in air at atmospheric conditions by different corona discharges [J]. Environmental Science & Technology, 2009, 43(24):9386-9392.
[30] Kornev I, Preis S. Aqueous Benzene Oxidation in Low- Temperature Plasma of Pulsed Corona Discharge [J]. Journal of Advanced Oxidation Technologies, 2016,19(2):284-289.
[31] Zhang, Feng, Yu, et al. Comparison of styrene removal in air by positive and negative DC corona;discharges [J]. International Journal of Environmental Science & Technology, 2013,10(6):1377-1382.
[32] Huang Y, Dai S, Feng F, et al. A comparison study of toluene removal by two-stage DBD-catalyst systems loading with MnOx, CeMnOx, and CoMnOx: Hemisphere Pub [J]. Corp, 2015.
[33] Ye Z, Wang C, Shao Z, et al. A novel dielectric barrier discharge reactor with photocatalytic electrode based on sintered metal fibers for abatement of xylene [J]. Journal of Hazardous Materials, 2012,241-242(4):216-223.
[34] Liang W, Li J, Li J, et al. Abatement of toluene from gas streams via ferro-electric packed bed dielectric barrier discharge plasma [J]. Journal of Hazardous Materials, 2009,170(2):633-638.
[35] An H T Q, Huu T P, Van T L, et al. Application of atmospheric non thermal plasma-catalysis hybrid system for air pollution control: Toluene removal [J]. Catalysis Today, 2011,176(1):474-477.
[36] Dong C, Wang W, Li H. Atmospheric pressure air direct current glow discharge ionization source for ion mobility spectrometry [J]. Analytical Chemistry, 2008,80(10):3925-3930.
[37] Ognier S, Cavadias S, Amouroux J. Aromatic VOC removal by microparticles formation in pure nitrogen [J]. High Temperature Material Processes, 2009,13(1):107-119.
[38] Huang H, Ye D, Leung D Y C. Plasma-Driven catalysis process for toluene abatement: effect of water vapor [J]. IEEE Transactions on Plasma Science, 2011,39(1):576-580.
[39] Ye D Q, Huang H B, Chen W L, et al. Catalytic decomposition of toluene using various dielectric barrier discharge reactors [J]. Plasma Science & Technology, 2008,10(1):89-93.
[40] Subrahmanyam C. Catalytic non-thermal plasma reactor for total oxidation of volatile organic compounds [J]. Indian Journal of Chemistry, 2009,48(8):1062-1068.
[41] Wu J, Xia Q, Wang H, et al. Catalytic performance of plasma catalysis system with nickel oxide catalysts on different supports for toluene removal: Effect of water vapor [J]. Applied Catalysis B Environmental, 2014,156-157(9):265-272.
[42] Najafpoor A A, Jafari A J, Hosseinzadeh A, et al. Optimization of non-thermal plasma efficiency in the simultaneous elimination of benzene, toluene, ethyl-benzene, and xylene from polluted airstreams using response surface methodology [J]. Environmental Science & Pollution Research, 2017:1-9.
[43] Indarto A, Yang D R, Che H A, et al. Advanced VOCs decomposition method by gliding arc plasma [J]. Chemical Engineering Journal, 2007,131(1):337-341.
[44] Du C M, Yan J H, Cheron B. Decomposition of toluene in a gliding arc discharge plasma reactor [J]. Plasma Sources Science & Technology, 2007,16(4):791.
[45] Lu S Y, Sun X M, Li X D, et al. Decomposition of toluene in a rotating glidarc discharge reactor [J]. IEEE Transactions on Plasma Science, 2012,40(9):2151-2156.
[46] 杜长明.滑动弧放电等离子体降解气相及液相中有机污染物的研究 [D]. 杭州:浙江大学, 2006.
[47] Lee S, Chen H F, Peng J W. Investigation of soot deposition and composition in a radio frequency plasma of benzene [J]. Plasma Chemistry & Plasma Processing, 2007,27(3):256-266.
[48] Lee S, Liu S J, Liang R J. Optical emission study of radio- frequency excited toluene plasma [J]. Journal of Physical Chemistry A, 2008,112(51):13500.
[49] Grossmannova H, Neirynck D, Leys C. Atmospheric discharge combined with Cu-Mn/Al2O3catalyst unit for the removal of toluene [J]. Czechoslovak Journal of Physics, 2006,56(2):B1156-B1161.
[50] Trushkin A N, Grushin M E, Kochetov I V, et al. Decomposition of toluene in a steady-state atmospheric-pressure glow;discharge [J]. Plasma Physics Reports, 2013,39(2):167-182.
[51] Oh S M, Kim H H, Einaga H, et al. Zeolite-combined plasma reactor for decomposition of toluene [J]. Thin Solid Films, 2006,506(506):418-422.
[52] Kuroki T, Hirai K, Matsuoka S, et al. Bench-scale test of toluene decomposition using adsorption and surface discharge with gas circulation [J]. 2010:1-5.
[53] Karuppiah J, Sivachrandiran L, Karvembu R, et al. Catalytic plasma reactor for abatement of dilute nitrobenzene [J]. Chinese Journal of Catalysis, 2011,32(5):795-799.
[54] Wang J T, Cao X, Zhang R X, et al. Effect of water vapor on toluene removal in catalysis-DBD plasma reactors [J]. Plasma Science & Technology, 2016,18(4):370-375.
[55] Zhu T, Li J, Jin Y, et al. Decomposition of benzene by non-thermal plasma processing: Photocatalyst and ozone effect [J]. International Journal of Environmental Science & Technology, 2008,5(3):375-384.
[56] Ogata A, Shintani N, Mizuno K, et al. Decomposition of benzene using non-thermal plasma reactor packed with ferroelectric pellet [C]. In: Ias Meeting, Ias '97, Conference Record of the: 1997: 1975-1982vol.1973.
[57] Karuppiah J, Reddy E L, Reddy P M, et al. Abatement of mixture of volatile organic compounds (VOCs) in a catalytic non-thermal plasma reactor [J]. Journal of Hazardous Materials, 2012,237- 238(6):283-289.
[58] He C, Cao L, Liu X, et al. Catalytic behavior and synergistic effect of nonthermal plasma and CuO/AC catalyst for benzene destruction [J]. International Journal of Environmental Science & Technology, 2015,12(11):3531-3540.
[59] Shang K, Wang X, Zhou X, et al. Diagnosis of electron temperature in Ar/O mixed gas and destruction of toluene/ benzene by positive dc discharge plasma [J]. Journal of Electrostatics, 2009,67(5):746-750.
[60] Sun R B, Xi Z G, Chao F H, et al. Decomposition of low- concentration gas-phase toluene using plasma-driven photocatalyst reactor [J]. Atmospheric Environment, 2007,41(32): 6853-6859.
[61] Li D, Yakushiji D, Kanazawa S, et al. Decomposition of toluene by using a streamer discharge reactor combined with catalysts [C]. In: Industry Applications Conference, 2001 Thirty-Sixth Ias Meeting Conference Record of the: 2001:1077-1081vol.1072.
[62] Kim H H, Oh S M, Ogata A, et al. Decomposition of gas-phase benzene using plasma-driven catalyst (PDC) reactor packed with Ag/TiO catalyst [J]. Applied Catalysis B Environmental, 2005, 56(3):213-220.
[63] Jiang N, Li J, Shang K, et al. Enhanced degradation of benzene in surface/packed-bed hybrid discharge system: optimization of the reactor structure and electrical parameters [J]. IEEE Transactions on Plasma Science, 2016,44(4):657-664.
[64] Jiang N, Lu N, Li J, et al. Degradation of benzene by using a silent-packed bed hybrid discharge plasma reactor [J]. Plasma Science & Technology, 2012,14(2):140-146.
[65] Indarto A. Decomposition of dichlorobenzene in a dielectric barrier discharge [J]. Environmental Technology, 2012,33(6):663-666.
[66] Hakjoon K, Han B W, Hong W S, et al. A new combination system using biotrickling filtration and nonthermal plasma for the treatment of volatile organic compounds [J]. Environmental Engineering Science, 2009,26(8):1289-1297.
[67] Sekiguchi H. Catalysis assisted plasma decomposition of benzene using dielectric barrier discharge [J]. Canadian Journal of Chemical Engineering, 2010,79(4):512-516.
[68] Subrahmanyam C, Renken A, Kiwi-Minsker L. Catalytic abatement of volatile organic compounds assisted by non-thermal plasma : Part II. Optimized catalytic electrode and operating conditions [J]. Applied Catalysis B Environmental, 2006,65(1): 157-162.
[69] Delagrange S, Pinard L, Tatibouët J M. Combination of a non-thermal plasma and a catalyst for toluene removal from air: Manganese based oxide catalysts [J]. Applied Catalysis B Environmental, 2006,68(3):92-98.
[70] Son Y S, Kim K J, Kim J Y, et al. Comparison of the decomposition characteristics of aromatic VOCs using an electron beam hybrid system [J]. Radiation Physics & Chemistry, 2010, 79(12):1270-1274.
[71] Kim H H, Ogata A, Futamura S. Atmospheric plasma-driven catalysis for the low temperature decomposition of dilute aromatic compounds [J]. Journal of Physics D Applied Physics, 2005,38(8):1292.
[72] Kim H H, Kobara H, Ogata A, et al. Comparative assessment of different nonthermal plasma reactors on energy efficiency and aerosol formation from the decomposition of gas-phase benzene [J]. IEEE Transactions on Industry Applications, 2005,41(1):206-214.
[73] Ma T, Jiang H, Liu J, et al. Decomposition of benzene using a pulse-modulated DBD plasma [J]. Plasma Chemistry & Plasma Processing 2016,36(6):1-11.
[74] Karatum O, Deshusses M A. A comparative study of dilute VOCs treatment in a non-thermal plasma reactor [J]. Chemical Engineering Journal, 2016,294:308-315.
[75] Guo Y, Liao X, He J, et al. Effect of manganese oxide catalyst on the dielectric barrier discharge decomposition of toluene [J]. Catalysis Today, 2010,153(3):176-183.
[76] Kim H S, Lee E A, Lee J H, et al. Discharge photoelectrocatalytic system for the degradation of aromatics [J]. International Journal of Photoenergy, 2015,5(1):3-6.
[77] Jiang L, Nie G, Zhu R, et al. Efficient degradation of chlorobenzene in a non-thermal plasma catalytic reactor supported on CeO2/HZSM-5catalysts [J]. Journal of Environmental Sciences 2017,55(5):266.
[78] Zhu R, Mao Y, Jiang L, et al. Performance of chlorobenzene removal in a nonthermal plasma catalysis reactor and evaluation of its byproducts [J]. Chemical Engineering Journal 2015,279:463-471.
[79] Chavadej S, Kiatubolpaiboon W. A combined multistage corona discharge and catalytic system for gaseous benzene removal [J]. Journal of Molecular Catalysis A Chemical, 2007,263(1):128-136.
[80] Huang, Yixia, Xia, Qibin, Li, et al. Decomposition of toluene in a plasma catalysis system with NiO, MnO2, CeO2, Fe2O3, and CuO catalysts [J]. Plasma Chemistry & Plasma Processing, 2013,33(6): 1073-1082.
[81] Chang C L, Bai H, Lu S J. Destruction of styrene in an air stream by packed dielectric barrier discharge reactors [J]. Plasma Chemistry & Plasma Processing, 2005,25(6):641-657.
[82] Liang W J, Wang A, Ma L, et al. Combination of spontaneous polarization plasma and photocatalyst for toluene oxidation [J]. Journal of Electrostatics, 2015,75:27-34.
[83] Wang L, He H, Zhang C, et al. Effects of precursors for manganese-loaded γ-Al2O3catalysts on plasma-catalytic removal of o-xylene [J]. Chemical Engineering Journal, 2016,288: 406-413.
[84] Tianpeng M A, Zhao Q, Liu J, et al. Study of humidity effect on benzene decomposition by the dielectric barrier discharge nonthermal plasma reactor [J]. Plasma Science & Technology, 2016,18(6):686-692.
[85] Liu J, Wang J, Xu C, et al. Decomposition of gaseous toluene using a continuous flow discharge plasma reactor with new configurations [J]. Environmental Technology, 2015,36(24): 3084-3093.
[86] Kohno H, Berezin A A, Chang J S, et al. Destruction of volatile organic compounds used in a semiconductor industry by a capillary tube discharge reactor [J]. IEEE Transactions on Industry Applications, 1998,34(5):953-966.
[87] Lee H M, Chang M B. Abatement of gas-phase p -xylene via dielectric barrier discharges [J]. Plasma Chemistry & Plasma Processing, 2003,23(3):541-558.
[88] Jiang L, Zhu R, Mao Y, et al. Conversion characteristics and production evaluation of styrene/o-xylene mixtures removed by DBD pretreatment [J]. International Journal of Environmental Research & Public Health, 2015,12(2):1334.
[89] Ge H, Hu D, Li X, et al. Removal of low-concentration benzene in indoor air with plasma-MnO2catalysis system [J]. Journal of Electrostatics, 2015,76:216-221.
[90] 吴光前,张 鑫,惠 慧,等.氧等离子体改性竹活性炭对苯胺的吸附特性[J]. 中国环境科学, 2012,32(7):1188-1195.
[91] 欧阳杰宏,林俊敏,刘有发,等.用于碳烟燃烧的Cu0.05Ce0.95O催化剂活性氧物种的研究——等离子体的强化效应[J]. 中国环境科学, 2013,33(2):243-250.
[92] 王沛涛,何梦林,鲁美娟,等.吸附存储-间歇放电法氧化甲苯的反应过程研究[J]. 中国环境科学, 2014,34(12):3047-3055.
Decomposition of benzene series by plasma technology.
DU Chang-ming*, HUANG Ya-ni, GONG Xiang-jie
(School of Environmental Science and Engineering, Sun Yat-sen University, Guangzhou 510006, China)., 2018,38(3):871~892
Benzene series is a common industrial pollutant, which includes benzene, methylbenzene, xylene and styrene. The traditional methods of treating the pollutants include liquid absorption-stripping, adsorption, incineration, condensation method and biological treatment, whose advantages and disadvantages are analysed. A new method of plasma technology is then put forward, which enjoys the characteristics of fast reaction to environmental conditions, wide applications, compact system and easy operation, as well as the advantage of short residual time, thus the plasma technology is suitable to be applied to deal with the volatile organic compounds (VOCs). In this paper, experiment device of different types has been studied and analyzed, which is used to decompose benzene series, and the effects of related parameters have been analyzed, such as applied voltage, electric strength, specific dissipation energy, reactor type, reactor size, carrier gas, residual time and the kind of benzene series, for example, the catalyst could increase the decomposition efficiency and optimize reaction conditions. In addition, the decomposition mechanisms of benzene, xylene and styrene have been discussed and concluded. At last, the combination of plasma technology and traditional methods would be the main study direction of purifying VOCs in the future.
plasma;benzene series;influence parameters;decomposition mechanisms;purification
X701
A
1000-6923(2018)03-0871-22
杜长明(1978-),男,辽宁兴城人,副教授,博士,主要研究领域是固体废弃物与污染土壤处理处置、环境等离子体技术.发表论文90余篇.
2017-08-08
广东省公益研究与能力建设专项项目(2015A020215013);广东省自然科学基金(2016A030313221)
* 责任作者, 副教授, glidarc@163.com
