超高效液相色谱-串联质谱法测定食品接触塑料中3种苯并三唑类紫外吸收剂的特定迁移量
2018-03-23,2,2,2,2*
,2 ,2 ,2 , 2*
(1. 北京市理化分析测试中心,有机材料检测技术与质量评价北京市重点实验室,北京 100089;2.北京市食品安全分析测试工程技术研究中心,北京 100089)
苯并三唑类化合物(Benzotriazoles,BZTs)是一种常用的紫外吸收剂,广泛用于食品接触类塑料制品的工艺中。它可以吸收 280 ~400 nm 范围的紫外线变为激发态,将光能以热能的形式释放出来,减少塑料制品的光降解和老化,延长其使用寿命[1,2]。近年来研究表明,多种BZTs紫外吸收剂均具有一定的生理毒性,可以导致皮炎和皮肤过敏,且具有生物蓄积性,影响生物体的长度和重量,导致甲状腺系统和脂肪酸代谢失衡[3,4]。由于直接接触食品,塑料包装制品中残留的BZTs紫外吸收剂迁移到食品中,会直接危害人体健康[5,6]。我国国标GB9685-2008收录了多种BZTs紫外吸收剂,其中规定了UV-P、UV-234、UV-327的特定迁移量分别为30 mg/kg、1.5 mg/kg、30 mg/kg,而对允许添加的UV-328、UV-329、UV-360,未限定其最大残留量和特定迁移量。除此之外,我国没有检测食品接触类塑料中 BZTs 紫外吸收剂的相关标准。
目前,BZTs紫外吸收剂的检测方法主要有液相色谱法(LC)[7-8]、气相色谱-质谱联用法(GC - MS)[9-12]、液相色谱-串联质谱法(LC - MS /MS)[13-15]等。LC-MS/MS法具有灵敏度高,检出限低的特点,可以针对复杂基质进行多组分的定性定量检测。现有文献主要针对BZTs的残留量进行测定,而对食品接触塑料中BZTs的特定迁移量关注度较少。本文建立了检测食品接触塑料中UV-328、UV-329、UV-360特定迁移量的超高效液相色谱-串联质谱(UPLC -MS/MS)分析方法。该方法专属性强,快速简便,检测限低,可以用于食品接触塑料中 BZTs紫外吸收剂的检测。
1 实验部分
1.1 仪器与试剂
Acquity超高效液相色谱仪,XEVO TQ 串联质谱仪,Masslynx4.1 工作站(美国Waters 公司);超声波清洗器(KQ6000V,昆山超声仪器有限公司);N-EVAP-112氮吹仪(美国Organomation公司);Milli-Q 超纯水器(美国Millipore公司);CR22GⅢ 离心机(日本日立公司);HAAKE PolyLab OS 密炼机(美国Thermo 公司);平板硫化机(广东锡华公司)。
UV-328和UV-329(纯度均≥97%,上海安谱实验科技股份有限公司),UV-360(纯度≥98%,日本 TCI 公司);PP树脂(上海赛科石油化工公司);甲醇、乙醇、乙腈为色谱纯(美国Fisher公司);实验用水为经 Milli-Q 净化系统(0.22 μm滤膜)过滤的去离子水;醋酸、橄榄油等其它试剂均为分析纯,经检测均不含有上述3种目标物。
1.2 标准溶液配制
分别准确称取适量上述标准品,甲醇-二氯甲烷(4:1,v/v,下同)溶解定容,制得质量浓度均为1000 mg/L的单标储备液。准确移取各标准储备液,混于100 mL 容量瓶中,用甲醇定容,配制成1 mg/L 混合标准中间储备液。水基模拟物标准工作溶液分别用蒸馏水、3%(w/v)醋酸、10%(v/v)乙醇溶液、90% (v/v)乙醇溶液配置。橄榄油食品模拟物标准工作溶液的配制:分别称取橄榄油模拟物2 g(精确至0. 01 g)于50 mL 具盖玻璃离心管中,分别加入10 mL 正庚烷和适量混合标准中间储备液,混匀后再加入10 mL 甲醇,涡旋振荡2min,静置10min,用2 mL 注射器吸取下层甲醇溶液约1mL,过0. 22μm滤头,待测。
1.3 样品制备与处理
在PP 树脂中加入0%、0.1%、0.5%、2% 4种不同浓度梯度的3 种BZTs紫外吸收剂,通过HAAKE PolyLab OS 双螺杆塑料挤出机在190℃混合挤出造粒。称取一定量母粒,热压机190℃热压成膜,获得含有不同浓度的PP 塑料膜(膜厚约0. 1 mm)。
参照欧标浸泡通则和( EU) No 10 /2011 法规,选择合适的迁移实验条件。模拟浸泡液分别为蒸馏水、3%(w/v)醋酸、10%(v/v)乙醇溶液、90%(v/v)乙醇溶液和橄榄油。PP 膜样品剪成4 cm×3 cm 的长方形,每种PP 膜取2个平行样放入60 mL 封口玻璃瓶中,加入40 mL模拟液浸泡。将玻璃瓶放入烘箱(40℃)恒温加热10天。10天后将待测样品冷却至室温并混匀。水基食品模拟物直接过膜待测;橄榄油食品模拟物:称取橄榄油模拟物2 g于50mL 具盖玻璃离心管中,加入10 mL 正庚烷,混匀后再加入10 mL 甲醇,涡旋振荡2min,静置10min,用2 mL 注射器吸取下层乙腈溶液约1mL,过膜待测。
1.4 色谱和质谱条件
色谱柱:Waters ACQUITY UPLC BEH C18(100×2.1 mm,1.7 μm);流动相:A为0.1%甲酸水,B为甲醇溶液。流速0.3 mL/min,柱温35 ℃。梯度洗脱程序为0 ~ 6 min,90% ~ 94% B;6~ 7 min,94% ~ 99% B;7~ 12 min,99% B;12 ~12.5 min,99% ~90% B;12.5~ 14 min,90% B。
质谱条件:电喷雾电离正离子模式(ESI+);多反应监测(MRM);毛细管电压:3.0 kV;萃取电压:5.0 V;离子源温度:150 ℃;脱溶剂气温度:350 ℃;脱溶剂气流速: 650 L / h;锥孔气流速:20 L / h。
2 结果与分析
2.1 色谱条件的优化
考察了甲醇-水、甲醇-0.1%(v/v)甲酸水溶液、乙腈-0.1%(v/v)甲酸水溶液作为流动相体系对目标化合物分离效果的影响。结果显示,乙腈为有机相时响应值明显降低,以甲醇为有机相时,各待测物色谱峰形较好,且响应强度稳定。在流动相中加入甲酸,提高了目标化合物的离子化效率,获得了更高的灵敏度。缓冲体系进一步增加系统稳定性,提高了BZTs紫外吸收剂各组分在色谱柱中的分析效率。基于以上结果,本方法选择了甲醇-0.1%(v/v)甲酸水溶液体系作为流动相。图1为3 种BZTs紫外吸收剂的提取离子流色谱图。
2.2 质谱条件的优化
在 ESI 模式下,采用蠕动泵以10 μL /min的速度分别将3种 BZTs 的标准溶液单独注入质谱的离子源中,分别测定其在正离子(ESI+)、负离子(ESI-)模式下的质谱信号强度。实验结果表明,在ESI+模式下,3种 BZTs 均可获得较高丰度的[M+H]+准分子离子峰。确定母离子后,采用子离子扫描方式进行二级质谱分析,对子离子进行优化选择,以确定定量离子和定性离子。然后对离子源温度、去溶剂气温度及流量、锥孔气流量进行优化,使目标物质的离子化效率达到最佳。3种BZTs紫外吸收剂的质谱参数如表1所示。
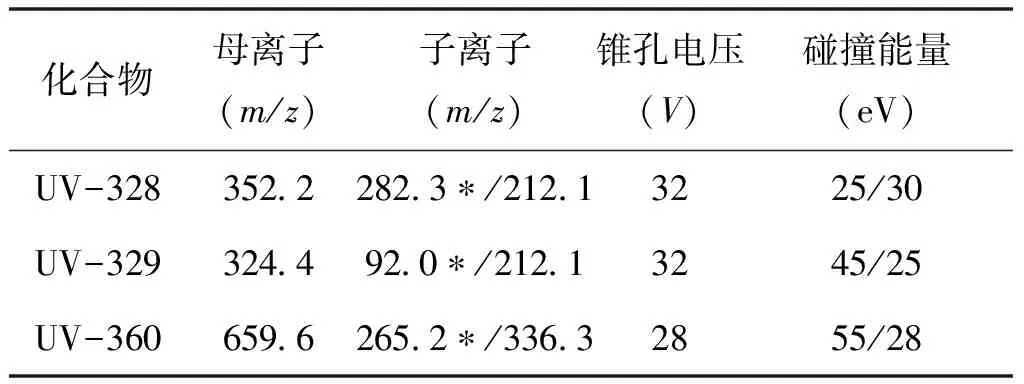
表1 3种BZTs紫外吸收剂的质谱参数
* :Quantitative tion

图1 3种BZTs紫外吸收剂提取离子流色谱图
2.3 橄榄油食品模拟物提取试剂的选择
比较了20%甲醇-水(v/v)、50% 甲醇-水(v/v)溶液、甲醇、乙腈对橄榄油中BZTs紫外吸收剂的提取情况。结果表明,20%甲醇-水(v/v)和50% 甲醇-水(v/v)溶液作为提取溶剂,回收率均不足50%。甲醇和乙腈作为提取溶剂,回收率均在67.8%~81.3%之间,甲醇的提取效果最佳,故采用甲醇进行提取。
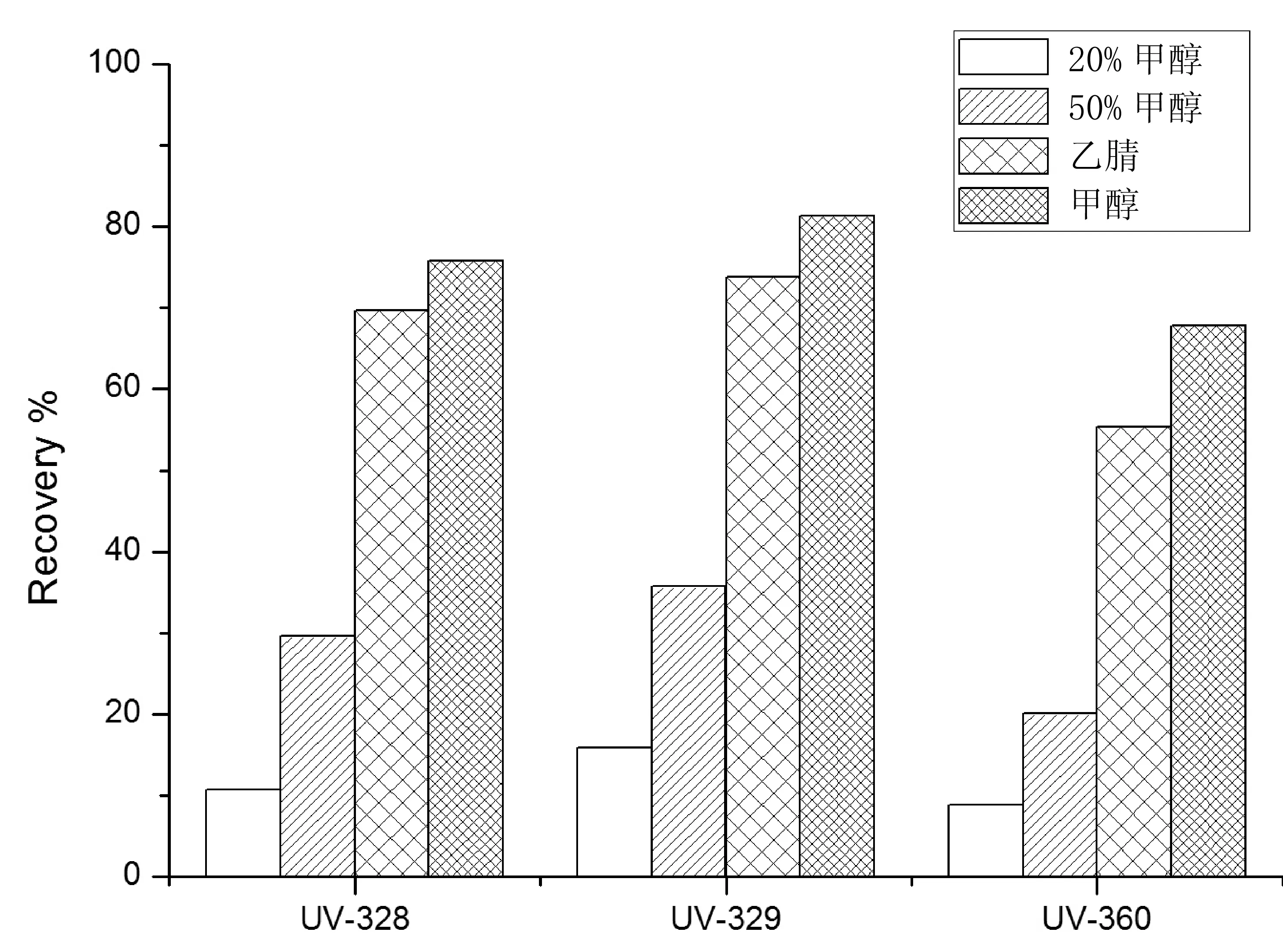
图2 不同提取溶剂对3 种BZTs紫外吸收剂回收率的影响
2.4 线性范围与定量限
由于基质效应的影响,共洗脱化合物的电离程度会增加或减小。为了避免此现象,以基质匹配的方法绘制标准曲线,以空白模拟物溶液配置3种BZTs紫外吸收剂标准溶液,精确配制2.0 ~ 200.0 μg/L和10.0 ~ 1000.0 μg /kg(仅橄榄油)的系列混合标准工作溶液,在选定的色谱条件和质谱条件下进行测定,依据特征离子色谱峰的 S/N ≥3为方法的检出限,S/N ≥10为方法的定量限。结果表明,3种BZTs紫外吸收剂在 2.0 ~ 200.0 μg/L 或 10.0 ~ 1000.0 μg /kg 范围内呈现良好的线性关系,线性相关系数均大于0. 991,结果见表2。

表2 BZTs紫外吸收剂的线性方程、相关系数、检出限和定量限
2.5 加标回收率和精密度
在0% PP 塑料膜中,按本文1.3前处理方法,分别取适量5种不同食品模拟物进行3 个水平的加标回收实验,6 次平行实验的结果见表7。结果表明,在添加浓度范围内,3种BZTs紫外吸收剂的平均回收率在65.2%~87.2%之间,相对标准偏差为1.2%~4.0%,说明该方法具有良好的回收率与精密度。
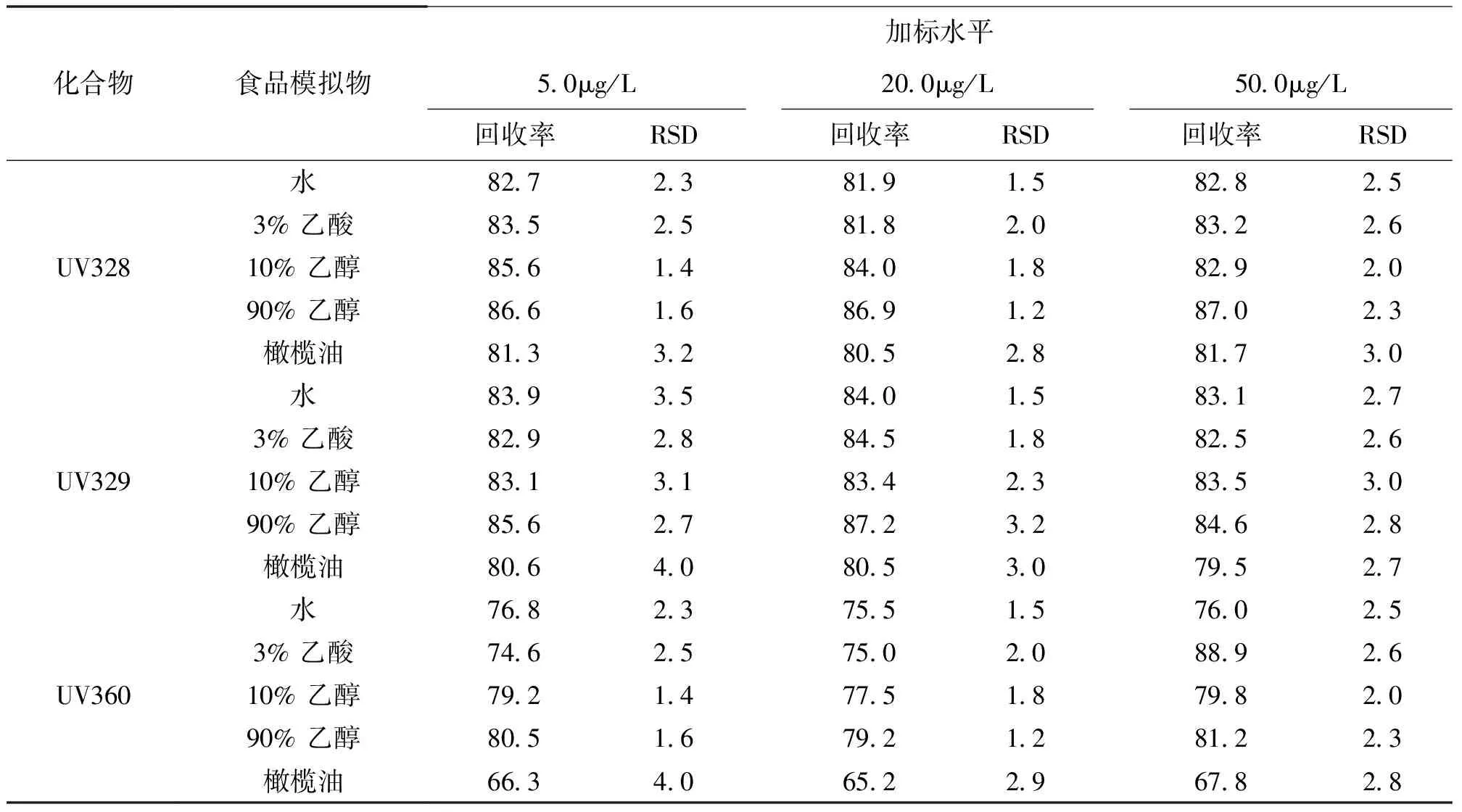
表3 回收率和精密度检测结果 %
2.6 样品分析
利用本方法对制备的4种不同梯度的PP塑料膜进行测定,结果表明,在橄榄油浸泡的添加量为2%塑料膜中检出UV329,含量为242.6 μg/kg。
3 结论
利用超高效液相色谱-串联质谱对食品接触塑料中3种BZTs紫外吸收剂进行检测。本方法简便、快速、可靠,专属性高,重现性良好,能满足食品接触塑料中3种BZTs紫外吸收剂的快速筛查与定量分析。
[1]Baran D, Balan A, Stubhan T, et al. Photovoltaic properties of benzotriazole containing alternating donor-acceptorcopolymers: Effect of alkyl chain length [J]. Synthetic Metals, 2012, 162: 2047-2051.
[2]Pei K, Cui Z H, Chen W G. An adduct of Cl-substituted benzotriazole and hydroxy benzophenone as a novel UVA/UVB absorber: Theory-guided design, synthesis, and calculations [J]. Journal of Molecular Structure, 2013, 1032: 100-104.
[3]Kin J W, Isobe T, Ramaswamy B R, et al. Contamination and bioaccumulation of benzotriazole ultraviolet stabilizers in fish from Manila Bay, the Philippines using an ultra-fast liquid chromatography-tandem mass spectrometry [J]. Chemosphere, 2011, 85: 751-758.
[4] Fent K, Chew G, Li J, et al. Benzotriazole UV-stabilizers and benzotriazole:Antiandrogenic activity in vitro and activation of aryl hydrocarbon receptor pathway in zebrafish eleuthero-embryos [J]. Science of the Total Environment, 2014, 482-483: 125-136.
[5] Kim J W, Ramaswamy B R, Chang K H, et al.Multiresidue analytical method for the determination of antimicrobials, preservatives, benzotriazole UV stabilizers, flame retardants and plasticizers in fish using ultra high performance liquid chromatography coupled with tandem mass spectrometry [J]. Journal of Chromatography A, 2011, 1218: 3511-3520.
[6] 李成发,李英,陈枝楠,等. 高效液相色谱法同时测定食品接触材料中抗氧化剂和紫外吸收剂的迁移量[J]. 色谱,2014, 32(6):616-622.
[7]李静,张居舟,邵栋梁,等. 高效液相色谱法对复合食品包装袋中三唑类光稳定剂含量的测定[J]. 分析测试学报,2011,30(4):435-438.
[8]黄雄风, 刘绿叶, 许群, 等. 高效液相色谱法同时测定化妆品中的11 种紫外吸收剂[J]. 分析化学, 2014, 42(12): 1846-1850.
[9] Carpinteiro I, Abuín B, Rodríguez I, et al. Pressurized solvent extraction followed by gas chromatography tandem mass spectrometry for the determination of benzotriazole light stabilizers in indoor dust[J]. Journal of Chromatography A, 2010, 1217: 3729-3735.
[10] Liu Y S, Ying G G, Shareef A, et al. Simultaneous determination of benzotriazoles and ultraviolet filters in ground water, effluent and biosolid samples using gas chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2011, 1218: 5328-5335.
[11 ]Casado J, Rodríguez I , Carpinteiro I, et al. Gas chromatography quadrupole time-of-flight mass spectrometry determination of benzotriazole ultraviolet stabilizers in sludge samples[J]. Journal of Chromatography A, 2013, 1293: 126-132.
[12]Casado J, Nescatelli R, Rodríguez I , et al. Determination of benzotriazoles in water samples by concurrentderivatization-dispersive liquid-liquid microextraction followedby gas chromatography-mass spectrometry [J]. Journal of Chromatography A, 2014, 1336: 1-9.
[13]欧玮辉,唐才明,王春维,等. 超高效液相色谱-串联质谱多目标分析沉积物中的微量有机紫外线吸收剂[J]. 分析化学,2015,43(5):734-741.
[14]Ou Weihui,Tang Caiming,Wang Chunwei,et al. Multi-target determination of trace organic ultraviolet absorbents in sediments using ultra-high performance liquid chromatography coupled with tandem mass spectrometry[J]. Chinese J Anal Chem,2015,43(5): 734-741.
[15] Liu R Z, Ruang T, Wang T, et al. Determination of nine benzotriazole UV stabilizers in environmental water samples by automated on-line solid phase extraction coupled with high-performance liquid chromatography-tandem mass spectrometry[J]. Talanta, 2014, 120: 158-166.
[16]勾新磊, 刘伟丽, 高峡 等. 超高效液相色谱-串联质谱法测定塑料包装果汁饮料中10种苯并三唑类紫外吸收剂[J]. 质谱学报, 2016, 37(3): 255-261.
[17]Gou Xinlei,Liu WeiLi, Gao Xia,et al. Simultaneous determination of ten benzotriazole ultraviolet stabilizers in plastic bottled fruit juices beverage by ultra performance liquid chromatography with tandem mass spectrometry[J]. Journal of Chinese Mass spectrometry Society,2016, 37(3): 255-261.
