便携式血糖仪对耐甲氧西林金黄色葡萄球菌mecA基因的灵敏检测方法研究
2018-03-23*
*
(1. 重庆医科大学临床检验诊断学教育部重点实验室,重庆 400016;2. 重庆医科大学附属第一医院体检中心,重庆 400016)
1 引言
耐甲氧西林金黄色葡萄球菌 ( methicillin-resistantStaphylococcusaureus, MRSA) 是引起院内感染的重要病原菌[1]。除对甲氧西林耐药外,MRSA对常用的抗生素如β内酰胺类抗生素、氨基糖甙类抗生素、大环内酯类抗生素等均具有抗性,并可引起败血症、坏死性肺炎和中毒性休克综合征等危及生命的感染性疾病[2-4]。因此,MRSA菌株的可靠检测对于指导感染早期阶段的有效治疗至关重要[5]。迄今为止,MRSA鉴定的检测方法主要是基于培养的标准微生物学方法和实时聚合酶链反应(polymerase chain reaction, PCR)。然而,基于培养MRSA的微生物检测方法存在灵敏度低,操作复杂且耗时(24~72小时)等不足[6]。虽基于PCR的基因检测方法因其高灵敏度和高时效而被认为是“金标准”,但仍然存在仪器设备昂贵和标本易交叉污染等缺点[7]。因此,开发一种方便且敏感检测MRSA的新方法依然很有必要。
DNA检测已普遍用于病原体分析、遗传疾病诊断和法医检测[8]。mecA(methicillin determinant A) 是染色体上编码青霉素结合蛋白的基因,其与MRSA耐药性密切相关,因而成为MRSA识别的“金标准”[9]。在本研究中,将编码青霉素结合蛋白基因mecA作为检测目标(Target)。
纳米技术的出现为通过信号放大策略检测生物分子开辟了新的途径[10]。金纳米粒子(AuNPs)是一种稳定的纳米材料,拥有很好的生物相容性,它可以与很多生物分子共轭结合并且不改变这些分子的性质和活性。为了提高金纳米粒子表面生物分子的结合率,Esumi K等[11]合成了以PAMAM dendrimers 聚合物作为载体的纳米金功能化的树状大分子,Qiu等[12]基于纳米金功能化的树状大分子,将多个辣根过氧化物酶通过金硫键与金氨键固定在聚树状大分子上,从而实现了对环境中汞离子的灵敏检测。鉴于此,该研究工作欲引入纳米金功能化树状大分子以提高酶性分子载量,实现信号放大。
血糖仪由于其便携性,快速测定,低成本和操作简单等特点而受到了广泛关注[13]。目前,基于个人血糖仪已经实现了多种目标物的检测。Yu Xiang和Yi Lu[14]利用个人血糖仪结合功能DNA传感器实现了对铀离子、腺嘌呤核苷三磷酸(ATP)、可卡因、干扰素-γ等分析物的检测。Qing Wang 等[15]使用适体和商业化的血糖仪对心脏生物标志物肌红蛋白进行灵敏监测。
本工作将血糖仪与纳米金功能化树状大分子二者优势有机结合,利用血糖仪建立了一种基于蔗糖酶修饰的纳米金功能化树状大分子对mecA基因的灵敏检测方法,如图1所示。将单链核酸DNA(MG1)通过亲和素-生物素作用固定于链酶亲和素修饰的磁珠表面,DNA(MG2)通过碱基互补配对与MG1部分结合,形成带有toehold的DNA双链。蔗糖酶通过其半胱氨酸以及赖氨酸残基,而DNA(MG3)通过其巯基基团分别与金纳米粒子相互作用,共同结合在纳米金功能化树状大分子(Au-PAMAM)表面,形成蔗糖酶修饰的纳米金功能化树状大分子(Invertase-labeling gold-dendrimer)。蔗糖酶修饰的纳米金功能化树状大分子通过信号核酸探针MG3与核酸MG2的toehold杂交结合,从而把修饰有蔗糖酶的纳米金功能化树状大分子固定在磁珠表面。当检测靶基因存在的条件下,其与捕获核酸探针MG2特异性结合,将蔗糖酶修饰的纳米金功能化树状大分子置换下来,经磁场分离后,上清液中存在的蔗糖酶催化底物蔗糖产生可直接检测的葡萄糖信号,实现血糖仪对mecA基因的定量检测。
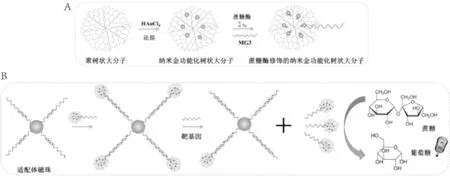
图1 基于蔗糖酶修饰的纳米金功能化树枝状分子对mecA 基因检测原理图
2 实验部分
2.1 试剂与仪器
链酶亲和素修饰的磁珠(平均直径1 μm),美国纽英伦生物技术有限公司;聚树状大分子(乙二胺核,5.0代,甲醇中含量5 wt%),四氯代氢金合四水化物(HAuCl4.4H2O),酵母蔗糖酶(Grade Ⅶ invertase from baker’s yeast),NaBH4,美国西格玛公司;Tris-HCl 缓冲液(1 M, pH 7.4) ,PBS缓冲液(0.01 M, pH 7.2-7.4),纤维素透析袋(分子量截留值为12,000-14,000),北京索莱宝科技有限公司;三氯乙基磷酸酯(TCEP),核酸,上海生工生物工程有限公司。
Target: 5′-ATT GGG ATC ATA GCG TCA TTA-3′;
磁珠结合的核酸MG1:5′-TCA CAG ATG AGT AAA AAA AAA AAA-biotin- 3′;
捕获核酸探针MG2:5′-TTT TTT ACT CAT CTG TGA TAA TGA CGC TAT GAT CCC AAT-3′;
信号核酸探针MG3:5′-HS-AAA AAA AAA AAA ATC ATA GCG TCA TTA-3′;
活力型血糖仪:ACCU-CHEK Active,罗氏公司;紫外可见吸收光谱仪:NANO-DROP1000,美国赛默飞世尔科技公司;透射电子显微镜:H600,日本日立公司;电化学工作站:CHI660D,上海辰华仪器有限公司;电泳仪:DYY-6C,北京市六一仪器厂;成像仪:美国伯乐公司。
2.2 纳米金树枝状分子(Au-PAMAM)的制备
Au-PAMAM根据基于聚树状大分子为模板的原位还原法制备[16]。首先,将新鲜制备的HAuCl4溶液(10 mL, 20 mM)与2 mL超纯水加入12.5 mLPAMAM溶液中,同时混合溶液搅拌1 h。然后将新鲜制备并储存于4 ℃中的NaBH4迅速加入到上述溶液中,并搅拌反应30 min。当溶液的颜色从浅黄色变为红褐色时说明Au-PAMAM已经形成。在这个过程中,吸附于PAMAM树状大分子上的Au(Ⅲ)被还原为零化合价的Au0。随后,透析除去杂质和游离的金纳米颗粒。最后将以上制备的Au-PAMAM复合物分散于5 mL超纯水中,并置于棕色瓶中4℃ 储存。
2.3 蔗糖酶与DNA修饰的纳米金功能化树状大分子的制备
利用蔗糖酶上的半胱氨酸或赖氨酸残基与金纳米粒子间的相互作用,以及DNA上的巯基基团与金纳米粒子间的相互作用制备得到蔗糖酶与DNA修饰的纳米金功能化树状大分子[16]。首先,将蔗糖酶(40 μL , 1.0 mg/mL)加入到200 μLAu-PAMAM与200 μLPBS(0.01 M, pH 7.4)共400μL的混合液中,并于4 ℃条件下孵育30 min。随后10 μL 的1.0 μM信号核酸MG3(溶液含有10 mM Tris-HCl,10 mM TCEP, 0.1 M NaCl,pH 7.4)加入到上述混合液中,并于同样的条件下孵育4 h(注意:在MG3修饰在金纳米粒子表面之前,巯基化的MG3需要经过TCEP于室温条件下预处理1 h,以还原形成的二硫化物)。
2.4 适配体磁珠(MG2-MB)的制备
取30 μL 4 mg/mL的链霉亲和素磁珠溶液,用PBS缓冲液洗3次。然后将4 μL100uM(终浓度3.2 μM)的MG1加至30 μL磁珠溶液中,于37 ℃下孵育30 min,然后磁分离,洗去过量的MG1;紧接着4 μL100 μM的适配体核酸MG2加入磁珠中,并在37℃下反应30 min,磁分离,除去过量的MG2。最终将制备的MG2-MB分散于120 μLPBS溶液中。
2.5 蔗糖酶修饰的磁珠复合物(I-MB)的制备
120μL的磁珠溶液去除缓冲液后,60 μL的Au-PAMAM复合物溶液加入其中,混合液于37 ℃下反应1 h。经磁场分离后去除未结合的Au-PAMAM复合物(用PBS缓冲液清洗3次),最后将制备好的I-MB分散于60 μL的PBS溶液中,并储存于4 ℃备用。
2.6 基于金功能化树状大分子的血糖仪对靶基因的检测
取10 μL 的I-MB,经磁场分离后加入10 μL不同浓度的靶基因,并于37 ℃孵育1 h。磁场分离后,取5 μL的上清液与1.7 μL的蔗糖(2 M)混合,并于37 ℃孵育16 h。最终取2 μL反应后的混合液用于血糖仪检测。
3 结果与讨论
3.1 Au-PAMAM的表征
采用透射电镜(TEM)、电化学阻抗谱(EIS)和紫外可见吸收光谱(UV-vis)对Au-PAMAM 进行形态学表征。如图2A所示,Au-PAMAM 的透射结果显示,其平均尺寸约3 nm。采用EIS对合成的Au-PAMAM 进行表征,可见裸金电极其电荷转移值(charge transfer resistance, Rct)比较大(图2B曲线c);当裸金电极上修饰PAMAM后,由于PAMAM具有很强的电子传递能力,其Rct几乎成一条直线(曲线a);而当Au-PAMAM固定在裸金电极上时,其Rct稍有增加,位于单纯的PAMAM与裸金电极之间(曲线b)。同时,采用紫外可见吸收光谱对PAMAM与Au-PAMAM进行表征(图2C)。单纯的PAMAM特征性吸收峰在283 nm处,当金纳米粒子原位还原在PAMAM上形成Au-PAMAM后,其特征性吸收峰由单峰变成了双峰,分别是286 nm与520 nm。结果与之前报道的相一致[15-16]。这些结果都表明金纳米粒子在PAMAM上已经还原成功。
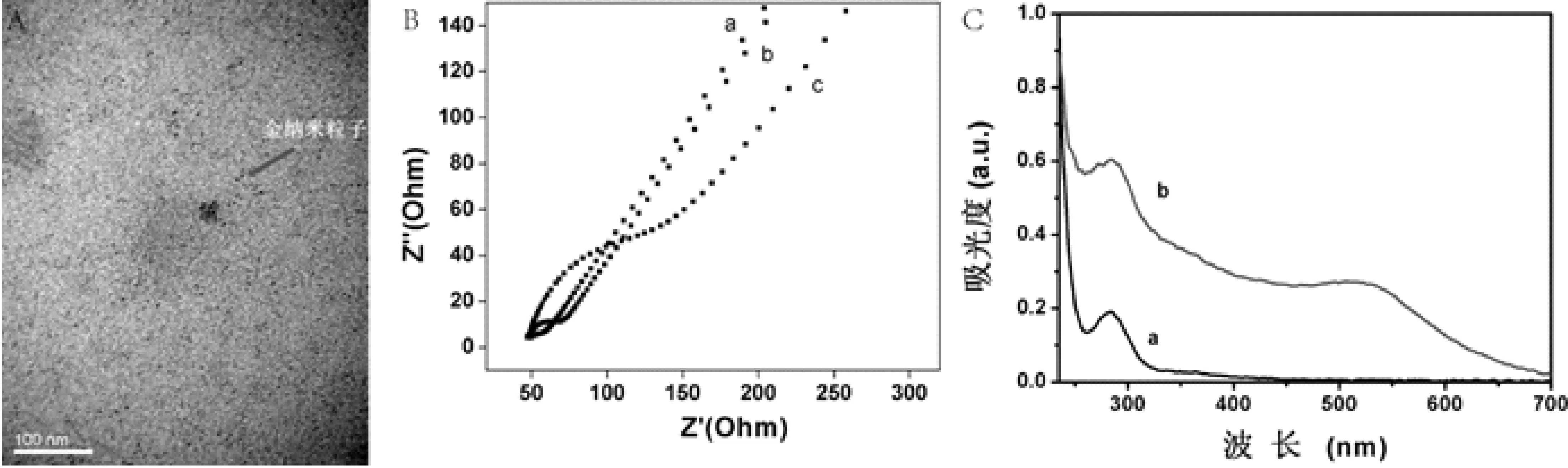
图2 Au-PAMAM的光学与电化学表征A.Au-PAMAM的透射电镜图;B. EIS电化学表征图:(a)PAMAM,(b) Au-PAMAM,(c)裸金;C. 紫外吸收光谱图:(a) PAMAM,(b)Au-PAMAM
3.2 核酸杂交的琼脂糖凝胶电泳表征
琼脂糖凝胶电泳用以证实Target与MG2的杂交并释放出MG3(图3)。图中条带1到4分别表示Target,MG1,MG2和MG3。当MG1与MG2杂交后产生了新的条带5,此产物进一步与MG3杂交后产生新的条带6,条带6中的杂交产物与靶DNA反应,产生新的条带7。电泳结果显示Target能与MG1、MG2和MG3形成的杂交产物反应。实验中所用到的单链DNA浓度都是4 μM,双链DNA浓度都是2 μM。

图3 核酸杂交的电泳表征1.Target;2. MG1;3. MG2;4. MG3;5. MG1+MG2;6. MG1+MG2+MG3;7. MG1+MG2+Target
3.3 Target与链酶亲和素修饰的磁珠上的捕获核酸探针MG2杂交
为了进一步证明Target能够与捕获核酸探针MG2杂交并具有置换出修饰有蔗糖酶的单链信号核酸探针MG3的能力,制备了3种样品。样品A加入不含捕获核酸探针的磁珠中进行血糖检测,而含有不同浓度靶基因的样品B(0.001 nM)与C(1 nM)加入含有捕获核酸探针的磁珠中进行血糖检测。正如图4所示,以上样品观察到不同的血糖信号,这证明了该方法具有检测靶基因的能力。

图4 检测方法可行性分析
3.4 实验条件优化
为了使该检测方法达到最佳的分析性能,实验对DNA与蔗糖酶的比例、Au-PAMAM的浓度、Target的孵育时间以及实验用的蔗糖浓度进行了优化。DNA与蔗糖酶的比例在该方法的检测性能方面起着重要的作用,因为DNA浓度过高,结合的蔗糖酶量就会很少,相应的产生信号就比较低,而如果DNA浓度过低,结合在磁珠上的信号核酸比较少,检测的血糖信号同样也会较低,因此对DNA与蔗糖酶的比例进行研究尤为必要。如图5A所示,随着DNA与蔗糖酶浓度的比例增加,血糖信号急剧增加,在比例为1∶3时信号最大,超过此比例血糖信号下降,因此1∶3为最佳DNA与蔗糖酶浓度的比例。由于Au-PAMAM的浓度决定了其表面结合蔗糖酶的量,因此研究了其在稀释5倍至100倍浓度下的检测能力。如图5B所示,当其稀释倍数约为15倍时,达到最大的血糖信号,因此稀释15倍的Au-PAMAM为其最佳浓度。Target的孵育时间对该检测方法的最终结果也有很大的影响,如图5C所示,孵育90 min时有一个最大峰,因此90 min作为我们的Target孵育时间。最后我们也研究了蔗糖浓度对血糖信号的影响(图5D),蔗糖浓度在0.2-0.6 M时,血糖信号增加,而蔗糖浓度过高时基本不变,因此,0.6 M作为蔗糖的最佳浓度。
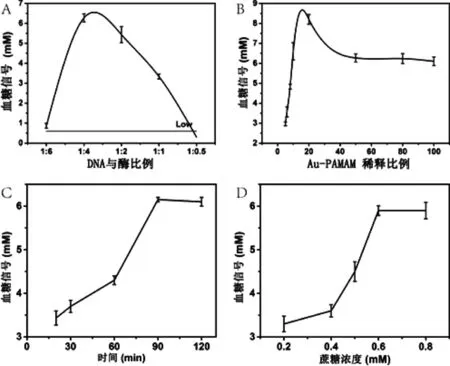
图5 实验条件优化1.DNA与酶比例的优化影响;B. Au-PAMAM浓度的影响;C. Target孵育时间的影响;D. 蔗糖浓度的影响
4 检测方法的分析性能评估
为了评估该检测方法对靶基因的分析性能,实验用一系列不同浓度的靶基因对本方法进行了研究。根据0.1 pM到10 nM不同浓度的Target检测到的结果显示在图6。从图中可以看出,随着Target浓度的增加,信号也跟着增加。当Target浓度在0.5 pM至1 nM范围时,信号的增加与Target浓度的对数有比较好的线性关系,其回归方程为Y(mM)=12.012+2.056logC(nM),相关系数为0.995,检测限为0.26 pM(S/N=3),Y代表血糖信号,C代表靶DNA的浓度。
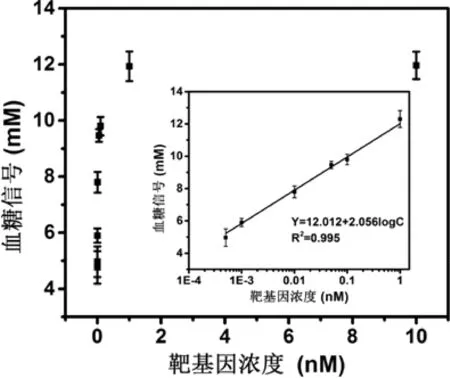
图6 检测结果的线性相关曲线图
5 结论
本实验利用血糖仪建立了一种基于蔗糖酶修饰的纳米金树状大分子对MRSA mecA基因检测新方法。利用纳米金树状大分子上可以结合更多酶性分子这一特点,实现了酶性放大。本方法检测便携、灵敏度高,拥有低的检测限0.26 pM和宽的检测范围0.5 pM到1 nM。同时,我们提出的这种检测策略,只需要改变捕获核酸如适配体核酸,就可以实现其他生物分子的检测。结果表明,该方法在疾病诊断方面具有潜在的应用价值。
[1]Bpharm W K, Jaruratanasirikul S, Pattharachayakul S, et al.Initial dosage regimen of vancomycin for septic shock patients:a pharmacokinetic study and Monte Carlo simulation.J Med Assoc Thai, 2014,97(11):1209-1219.
[2]Grundmann H, Aires-de-Sousa M, Boyce J, Tiemersma E. Emergence and resurgence of meticillin-resistant Staphylococcus aureus as a public-health threat, Lancet 2006,368:874-885.
[3]DeLeo F R, Otto M, Kreiswirth B N, Chambers H F, Community-associated meticillin-resistant Staphylococcus aureus, Lancet 2010,375:1557-1568.
[4]David M Z, Daum R S. Community-associated methicillin-resistant Staphylococcus aureus: epidemiology and clinical consequences of an emerging epidemic, Clin Microbiol Rev 2010,23: 616-687.
[5]Guk K, Keem J O, Hwang S G, et al. A facile, rapid and sensitive detection of MRSA using a CRISPR-mediated DNA FISH method, antibody-like dCas9/sgRNA complex. Biosensors and Bioelectronics, 2017,95: 67-71.
[6]Stamper P D, Cai M, Howard T, Speser S, Carroll K C. Clinical validation of the molecular BD GeneOhm StaphSR assay for direct detection of Staphylococcus aureus and methicillin-resistant Staphylococcus aureus in positive blood cultures. J Clin Microbiol, 2007,45: 2191-2196.
[7]Wang T, Zhang Z, Li Y, et al. Amplified electrochemical detection of mecA gene in methicillin-resistant Staphylococcus aureus based on target recycling amplification and isothermal strand-displacement polymerization reaction. Sensors and Actuators B: Chemical, 2015, 221: 148-154.
[8]Xiang Y, Lu Y. Using commercially available personal glucose meters for portable quantification of DNA. Analytical chemistry, 2012, 84(4): 1975-1980.
[9]Cao Y, Hao Y, Yang D, et al. Fluorescent PCR detection of mecA in drug resistant MRSA: a methodological study. British Journal of Biomedical Science, 2017,74(3): 152-155.
[10]Mathwig K, Albrecht T, Goluch E D, et al. Challenges of biomolecular detection at the nanoscale: nanopores and microelectrodes. Analytical chemistry, 2015, 87(11): 5470-5475.
[11]Esumi K, Akiyama S, Yoshimura T. Multilayer formation using oppositely charged gold-and silver-dendrimer nanocomposites. Langmuir, 2003, 19(18): 7679-7681.
[12]Qiu Z, Tang D, Shu J, et al. Enzyme-triggered formation of enzyme-tyramine concatamers on nanogold-functionalized dendrimer for impedimetric detection of Hg (II) with sensitivity enhancement. Biosensors and Bioelectronics, 2016, 75: 108-115.
[13]McLaughlin A C, Rogers W A, Fisk A D. Age-related glucometer design and selection: Tools and principles for optimal solutions. Diabetes technology & therapeutics, 2004, 6(3): 319-325.
[14]Xiang Y, Lu Y. Using personal glucose meters and functional DNA sensors to quantify a variety of analytical targets. Nature chemistry, 2011, 3(9): 697-703.
[15]Wang Q, Liu F, Yang X, et al. Sensitive point-of-care monitoring of cardiac biomarker myoglobin using aptamer and ubiquitous personal glucose meter. Biosensors and Bioelectronics, 2015, 64: 161-164.
[16]Qiu Z, Shu J, Jin G, et al. Invertase-labeling gold-dendrimer for in situ amplified detection mercury (II) with glucometer readout and thymine-Hg2+-thymine coordination chemistry. Biosensors and Bioelectronics, 2016, 77: 681-686.
