高效液相色谱在多肽分离分析中的应用
2018-03-23,2,2*
,2 ,2*
(1.青岛大学生物医用材料与工程研究院,青岛大学化学化工学院, 青岛 266071;2.纤维新材料与现代纺织国家重点实验室培育基地,青岛大学材料科学与工程学院,青岛 266071)
随着生物化学技术的不断发展,多肽因其独特而又高效的吸收机制和非常强的生物活性,而成为生化专家们所关注和研究的热门材料。由于多肽具有相对低的细胞毒性,具有特异性强、生理活性高和生物功能明确等优势,且具有信号识别、分子转导、细胞分化等生理功能[1, 2],在药品领域表现出了极其高的应用价值和前景。例如,研究学者通过水解卵黏蛋白从而得到多肽片段,该片段可以用来抑制血细胞的凝集作用;玉米多肽具有防止高血压,降低胆固醇以及抗疲劳的作用。为了研究多肽的生物活性、物化性质以及医药功能,需要高纯度的多肽样品,但是产物的成分一般比较复杂,一般是一个以目标多肽为主的几种结构类似的多肽混合物,因此多肽的分析、分离和提纯就会显得尤为重要。
而采用何种方法对多肽进行分离分析,是由被测定多肽的性质进行选择的。目前多肽分离分析常用的方法有:高效液相色谱法、毛细管电泳、核磁共振、飞行时间质谱、盐析和超滤等。而随着生物化学技术的发展,传统的多肽分析分离手段已经不能满足对大量样品进行高精确度的分离分析的要求。目前来看,分离效果最好的两种方法是毛细管电泳法和液相色谱法,而高效液相色谱以其极高的分离效率和良好的选择性已经成为实验室以及工业分离分析生物大分子最有效和常用的方法。本文主要介绍了高效液相色谱(HPLC)以及一些新型色谱在多肽分离分析中的应用。
1 高效液相色谱在多肽分析分离中的应用
采用何种方法对所提取的组织或材料进行分离分析,是由所要提取的物质的性质所选择的。而采用何种方法对多肽进行分离分析,则是由被测定多肽的性质进行选择的。目前多肽分离分析常用的高效液相色谱的方法有:反相高效液相色谱法、离子交换色谱、体积排挤色谱、疏水作用色谱、亲和色谱、多维高效液相色谱、液相色谱与质谱联用法等。
1.1 反相高效液相色谱
反相高效液相色谱(RP-HPLC)的固定相为表面非极性载体,而流动相为比固定相极性强的溶剂,可以用来分离大多数的可溶于极性溶剂中的有机物,图1所示为肽链与固定相表面疏水基团结合的情况[3]。高杨等[4]采用了C18柱,以0.1%TEA/水和0.1%TEA/乙腈分作为流动相A和B,通过梯度淋洗的方式在反相HPLC模式下对人工合成的布舍瑞林进行了纯化,反复纯化后使其纯度达到98%,纯化总收率为50.6%。白泉等[5]采用RP-HPLC对21肽进行了纯化,使其纯度到达98.6%,并对对样品组分更为复杂的32肽进行了二次纯化,使其纯度达到96.4%,并且分别制备了100mg的32肽和21肽。马安德等[6]优化了RPLC对蛇毒蛋白的分离条件,一次性快速分离蛇毒粗毒组分,并使从蛇毒中分离出来的16组组分的纯度都达到了95%以上,其中PLA2的同源物的纯度为97.2%。陈兵等[7]采用了凝胶色谱-RPLC-质谱联用技术对乳酸杆菌代谢出来的混合肽进行了氨基酸序列的测定,对比并验证了其与Nisin氨基酸序列的不同。吕艳等[8]比较了用于多肽中18种氨基酸的定量分析的最常用的两种衍生方法,结果表明,步骤简单的方法有3种氨基酸无法测定,步骤复杂的方法18种氨基酸都可以测定,且分离效果很好。

图1 RP-HPLC中肽链与硅胶烷基组成的疏水固定相的结合情况[3]
1.2 离子交换色谱
离子交换色谱(IEXC)是通过多肽或者蛋白质在溶液中所带电荷的正负,通过不同的阴、阳离子柱产生的静电作用来实现对多肽的分离。阴离子交换色谱法(anion-exchange,AEC)[9, 10]和阳离子交换色谱法(cation-exchange,CEC)[9]是分离多肽混合物的重要手段。IEXC最为明显的优势在于它的分离条件最接近生物的生理环境,对生物分子有一定的兼容性,以便于保存多肽的生物活性。王贤纯等[11]利用IEXC与RP-HPLC结合的方法,研究了固相合成出来的虎纹捕鸟蛛毒素-I (HWTX-I)和其对应的天然产物的结构的差异。刘标等[12]利用IEXC-RPHPLC脱除了胸腺肽α-1中的有机盐,使胸腺肽的纯度达到99.2%,收率为92.0%。王璐等[13]利用强阳离子交换色谱,实现了对酵母全蛋白中的胰蛋白酶的酶切产物最佳分离,并优化了分离条件。齐楠等[14]以AA、AMPS作为功能单体,采用Bis为交联剂,1,4-丁二醇、正十二醇为致孔剂,DMSO,AIBN为引发剂制备了强阳离子交换整体柱,并使用该柱成功分离了5种多肽。
1.3 体积排挤色谱
体积排挤色谱(SEC)又称凝胶排挤色谱或者尺寸排挤色谱,主要应用于多肽的相对分子质量的分级分析以及相对分子质量分布的测试。目前,一种较适宜分离多肽的体积排阻色谱柱(Superdex Peptide,Pharmacia,Piscataway,NJ)问世,其分离范围为100~7000 Da,很大程度上提高了该种方法在纯化合成肽时的分离效率。体积排阻色谱是最早应用于分离纯化混合肽的方法[15, 16]。相比于其他测定相对分子质量的方法如质谱法、凝胶电泳法、超滤法等,SEC分离方法简单,速度快捷,且产物不容易变性。汪冰等[17]以β-淀粉酶和胰岛素作为相对分子质量标记物,采用SEC对阿胶中蛋白质和多肽的相对分子质量进行了分析,研究发现其相对分子质量为6×10∧3~2×10∧5。姜宁等[18]利用SEC分离并纯化了一种新的马鹿茸多肽CAP。张政[31]等将凝胶色谱与离子色谱两种模式结合,实现了对蛋白质的全二维分析,其中酵母蛋白质的第一维馏分切割17次时的色谱图如图2所示。
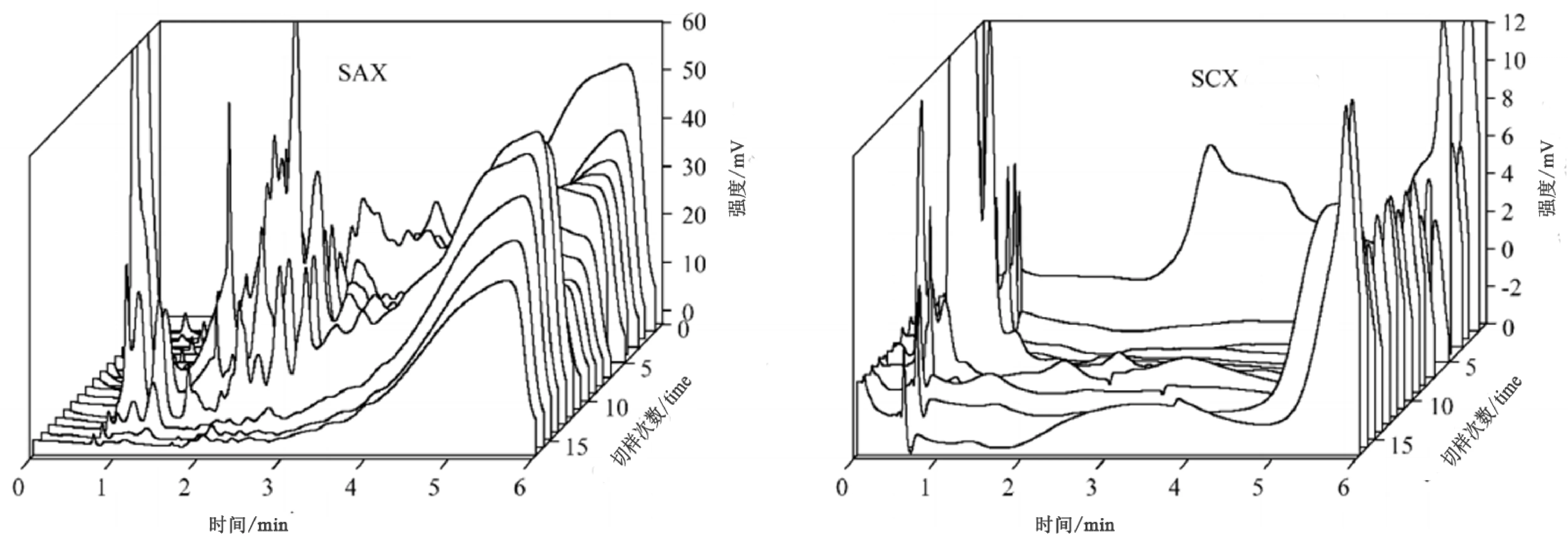
图2 第一维馏分切割17次时酵母蛋白质的色谱图[31]
1.4 疏水作用色谱
疏水作用色谱(HIC)的作用原理与RP-HPLC的相似,只是固相柱的疏水性相对较弱,一般用于蛋白质的分离和纯化。郭立安等[19]利用高效疏水色谱,直接从大肠杆菌表达的基因重组人干扰素-α包涵体的裂解液中纯化了rhIFN-α,并大大简化了操作步骤。
1.5 亲和色谱
亲和色谱(AC)也称亲和层析,是一种利用固定相与物质的特异性结合来实现分离和纯化目的的方法。杨杪等[20]利用二磷酸腺苷琼脂糖亲和层析的方法成功从小鼠肝脏的肿瘤组织中分离和纯化热休克蛋白(HSP)70多肽复合物。
1.6 多维高效液相色谱
多维高效液相色谱(MD-HPLC)是指将两种或两种以上的不同的分离模式的色谱柱通过特殊的方式组合起来,这样就可以发挥不同色谱技术各自所特有的分离技术,从而能够将具有复杂成分的混合物中的几种组分进行快速的分离。杨丽佳,武梅等[21]采用多维高效液相色谱技术从厚壳贻贝血清的抗菌肽中分离纯化出了五种抑菌活性比较明显的组分,在厚壳贻贝血细胞的抗菌肽中分离纯化出了六种抑菌活性比较明显的组分。刘少华,杨林等[22]采用多维高效液相色谱从舟山黄海葵粗毒中分离出了7个组分,其分离结果如图2所示。随后与动物实验结合,验证了这七种组分是具有强杀虫活性以及低哺乳动物活性的杀虫,质谱结果表明,这7个多肽分子量在2~5kDa之间,经动物毒性检测,收集7个活性组分。
1.7 液相色谱与质谱联用
质谱分析(MS)已经广泛应用于多肽分离纯化后的分析。而且MS具有高灵敏性和快速性等特点,与液相色谱联用之后称液质联用(LC-MS),特别适合于多肽及蛋白质的分析。李萌等[23]运用LC-ESI-MS技术对重组抗肿瘤抗病毒蛋白乐复能进行了分析,测得该蛋白质的相对分子质量为19.31163kD。李灿等[24]利用高效液相色谱-质谱法,采用正离子模式进行对于僵蚕蛋白酶解多肽进行了氨基酸种类的分析,其分离色谱柱为Hola C18色谱柱(100 mm×2.1 mm,2.7μm),其流动相为0.05%甲酸水溶液和0.05%甲酸-乙腈溶液,其样品的多肽类色谱分布峰如图3所示,其样品的总质谱图如图4所示。王传现等[25]利用高效液相色谱与质谱的联用检测了10种化妆品中的糖皮质激素类违禁药物。
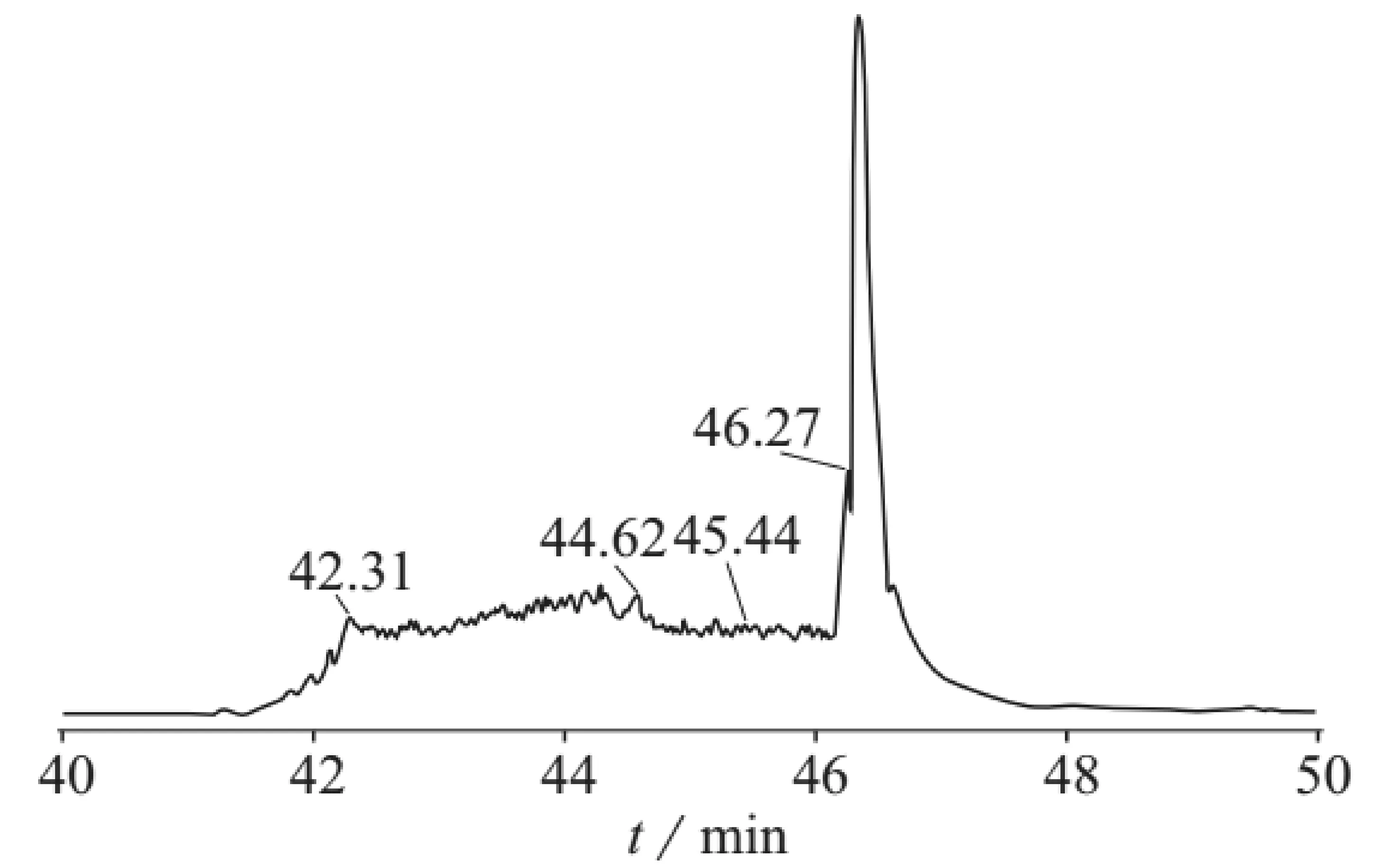
图3 样品总离子流色谱图[24]
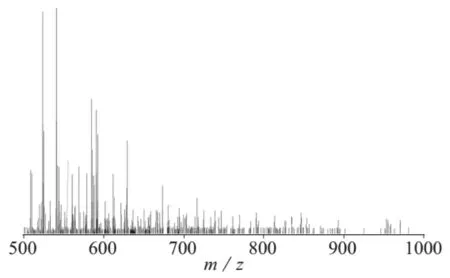
图4 样品的总质谱图[24]
2 其他新型色谱在多肽分析中的应用
2.1 超临界流体色谱
超临界流体色谱(SFC)是指以接近或超过临界的温度和压力的高压流体为流动相,以固体吸附剂或键合到载体上的高聚物为固定相的色谱技术。超临界流体(Supercriticalfluid,SCF)的高扩散性和低粘性使得混合物中不同组分的分离速度加快。SFC拆分药物一般来说可分为直接分离法和间接分离法,而对于氨基酸、多肽类等物质的分离一般是采用直接分离法中的手性固定相(CSPs)[26]。Antony J. Berry等[27]采用一氯二氟甲烷-10% 甲醇 (0.5% TFA) (110°C, 30MPa)作为流动相,通过超临界流体色谱从不纯的马尿酰-L-组氨酰-L-亮氨酸水合物中分离出来一种血管紧张素转换酶的底物(含3个氨基酸的小肽)。
2.2 径向色谱
径向色谱(Radial-flow chromatography)是对复杂的样品进行快速分离尤其实在生物复杂样品的分离等方面的一种新型色谱技术。与传统色谱技术相比,径向色谱技术具有速度快,容易放大生产,成本低、使用寿命长[28]。Kikumoto等[29]采用径向色谱技术分离出了白细胞介素-1。
2.3 毛细管电色谱
毛细管电色谱(CEC)是指以电渗流或压力流与电渗流相结合为流动相的一种新型的微柱分离技术。CEC技术具有快速分离,高选择性等特点。Samuel Karenga和Ziad El Rassii[30]利用CEC技术分析了溶菌酶中的胰蛋白酶的水解肽段,其中主要的肽段都在较短的时间内检出。
3 总结及展望
随着生命科学的发展,多肽在生化领域的地位也愈发重要,而对于多肽的分离纯化的要求也是愈发的高。为了得到所需要的目标多肽,可以利用上述几种方法对于目标产物进行分离分析和提纯。每种测试方法的侧重点不同,单一的分离分析方法在一定程度上并不能满足对于多肽分离、分析、纯化的实验要求,而多种液相色谱法的联合使用,既可以高效地对多肽进行分离分析,又提高了实验结果的准确性。比如,将几种色谱方法结合起来使用,建立一个多维的色谱研究方法;又或者将毛细管电泳以及高效液相色谱两者的优势结合起来的分析方法,以及高效液相色谱与质谱的联用技术。这些技术的联用将会在多肽的分离纯化分析中发挥着极其显著且重要的作用。
[1]单春乔, 赵红岩, 崔丽,等. 生物活性肽生理作用及功能研究[J]. 粮食与油脂, 2011, (4): 15-17.
[2]刘俊华, 葛庆华. 生物基质中蛋白质多肽类化合物的LC-MS法定量测定[J]. 中国医药工业杂志, 2013, 44(10): 1054-1060.
[3]潘宇, 朱学军, 牟颖. 高效液相色谱法分析纯化合成肽[J]. 生命科学仪器, 2008, 6(9): 13-18.
[4]高杨, 赵红玲, 王良友,等. 反相高效液相色谱法分离纯化固相化学合成布舍瑞林[N]. 承德医学院学报, 2016, 33(2): 143-144.
[5]白泉, 葛小娟, 耿信笃. 反相液相色谱对多肽的分离、纯化与制备[J]. 分析化学, 2002, 30(9): 1126-1129.
[6]马安德, 吴少瑜, 张嘉杰. 一种新的蝮蛇蛇毒磷脂酶A2同源物的分离纯化及其氨基酸序列分析[J]. 中药材, 2006, 29(2): 132-134.
[7]陈兵, 王雅珍, 黄微薇,等. 反相高效液相色谱-质谱联用法测定抑菌肽功能单元的氨基酸序列[J]. 食品与生物技术学报, 2014, 33(5): 522-527.
[8]吕艳, 冯凤琴. 反相高效液相色谱定量分析多肽中的氨基酸组成[N]. 浙江农业科学, 2006, 1(2): 211-214.
[9]Mant C T , Hodges R S. High-performance liquid chromatography of peptides and proteins : separation, analysis, and conformation[J]. Wiley-VCH Verlag GmbH & Co. KGaA,1991, 24 (1) :769-776.
[10]Andrews P C, Ion-exchange HPLC for peptide purification[J]. Peptide Research, 1988, 1(2): 93-99.
[11]王贤纯, 梁宋平. 化学合成虎纹捕鸟蛛毒素-Ⅰ的色谱行为及分离纯化[J]. 色谱, 2001, 19(2): 101-104.
[12]刘标,陈阿娜. 离子交换-反相色谱法脱除胸腺肽α1盐离子[J]. 安徽工程大学学报, 2014, 29(2): 42-45.
[13]王璐, 周兰兰, 钱小红,等. 强阳离子交换色谱分离多肽混合物的条件优化[J]. 色谱, 2010, 28(4): 368-373.
[14]齐楠, 崔瑞红, 尤慧艳. 强阳离子交换整体柱的研制及其在电色谱多肽分离中的应用[J]. 色谱, 2011, 29(9): 881-884.
[15]Mant C T, Hodges R S. [1] Analysis of peptides by high-performance liquid chromatography[J]. Methods in Enzymology, 1996, 271: 3-50.
[16]Mant C T, Zhou N E, Hodges R S. Correlation of protein retention times in reversed-phase chromatography with polypeptide chain length and hydrophobicity[J]. Journal of Chromatography, 1989, 476(6): 363-375.
[17]汪冰, 肖新月, 程显隆. 凝胶排阻色谱法研究阿胶中蛋白质及多肽相对分子质量分布规律[J]. 药物分析杂志, 2009, (11): 1886-1891.
[18]姜宁, 张双健, 朱静. 一种新型马鹿茸多肽纯化、鉴定及体外降血糖活性[J]. 中国药科大学学报, 2016, 47(3): 363-367.
[19]郭立安. 疏水作用色谱法同时纯化及复性基因重组人干扰素- α[J]. 色谱, 2001, 19(4): 301-303.
[20]杨杪, 黄畦, 王瑞波,等. 二磷酸腺苷琼脂糖亲和层析法纯化HSP70多肽复合物[J]. 华中科技大学学报(医学版), 2002, 31(3): 245-247.
[21]杨丽佳, 武梅, 王信超,等. 厚壳贻贝血细胞及血清抗茵肽的分析[J]. 中国农学通报, 2011, 27(23): 58-64.
[22]刘少华, 杨林, 章晨,等. 舟山黄海葵杀虫活性多肽的初步研究[J]. 浙江海洋学院学报(自然科学版), 2010, 29(6): 566-571.
[23]李萌, 裴德宁, 陶磊,等. 液质联用法分析重组抗肿瘤抗病毒蛋白的一级结构[J]. 中国生物制品学杂志, 2011, 24(12): 1473-1476.
[24]李灿, 侯林, 于瑞雪,等. 高效液相色谱-质谱法分析僵蚕蛋白酶解多肽[J]. 化学分析计量, 2017, 26(2): 11-15.
[25]王传现, 刘罡一, 倪昕路,等. 高效液相色谱-串联质谱法检测化妆品中糖皮质激素类违禁药物[J]. 分析仪器, 2008, (6): 23-28.
[26]吴夏青, 齐建平, 王欣然,等超临界流体色谱分离手性药物研究进展[J]. 分析仪器, 2014, (3): 1-6.
[27]Berry A J, Ramsey E D, Newby M, et at. Applications of Packed-Column SFC Using Light-Scattering Detection[J]. Journal of Chromatographic Science, 1996, 34(5): 245-253.
[28]张拥军, 蒋家新, 杜琪珍.径向色谱及其在生物大分子快速分离中的应用[J]. 食品科技, 2008, (10): 101-104.
[29]Yoshikazu Kikumoto, Yeong-Man Hong, Tsutomu Ni-shida, et a1. Purification and characterization of recombinant human interleukin-1β produced in Escherichia coli[J]. Biochemical and Biophysical Research Communications, 1987, 147(I): 315-321.
[30]Karenga Samuel, E l Rassi Ziad. Neutral octadecyl monolith for reversed phase capillaryelectrochromatography of a wide range of solutes[J]. Journal of Separation Science, 2008, 3l: 2677.
[31]张政, 唐涛, 杨三东,等. 凝胶过滤/离子交换全二维液相色谱系统的构建与评价[J]. 色谱, 2017, 35(5):526-532.
