IL-17D调控肺脏NK细胞募集及黄芪的促进作用①
2018-03-23兰红云郑晓丹郭钰琪孙晓艳吕衍民姚成芳
兰红云 郑晓丹 郭钰琪 安 磊 孙晓艳 吕衍民 王 丽 姚成芳
(济南大学 山东省医学科学院医学与生命科学学院,济南 250200)
肺脏是气体交换的主要部位,时刻受到外源性病原微生物、过敏原及微粒状污染物的威胁,是各种病原体入侵的主要门户,因此,需要有效的免疫防御机制来保护其免受有害物质的损伤,维持正常功能。肺组织自身的黏膜免疫屏障功能既可抵抗外界病原体的入侵,又可促进其降解[1],天然免疫系统在这一过程中起主导作用,其中,NK细胞因其强大的抗肿瘤、抗病毒效应在维持肺脏免疫内环境稳定中扮演了重要角色[2]。
NK细胞是机体抗感染的第一道防线,受组织局部CXCL9、CXCL10等不同趋化因子的调控,在不同组织器官分布状态不同[3,4]。肺脏是NK细胞大量分布的重要器官之一,肺脏NK细胞通过快速、大量分泌IFN-γ、穿孔素和颗粒酶等效应因子,在免疫监视和免疫清除过程中发挥重要作用[5]。因此,NK细胞在肺脏局域免疫中起着关键作用。肺脏局部NK细胞的趋化和募集能力是体现肺脏抗肿瘤免疫的重要保障,但肺脏局部调控NK细胞募集的关键调控节点尚待明确。
有学者研究发现,IL-17家族对细胞的迁移和趋化有很强的调控作用:IL-17 家族成员可通过调控多种趋化因子招募嗜中性粒细胞和其他先天免疫细胞局部募集[6]。IL-17D属于IL-17家族,与肿瘤的侵袭密切相关[7]。但是IL-17D对肺脏NK细胞的募集有怎样的调控作用尚无人报道。本研究旨在探讨IL-17D调控肺脏NK细胞募集的分子机制及黄芪的作用。
黄芪(Astragalus membranaceus,AG)是经典的补益肺气中药[8],味甘性温,归肺脾二经,通过益气固表、养心通脉等功效,保护肺气的充实和稳定[9]。但黄芪调控肺脏NK细胞的募集及其药理机制尚无报道。我们研究发现,黄芪补益肺气的关键作用机理之一是上调肺脏IL-17D的表达和NK细胞含量,促进肺脏抗肿瘤效应。
1 材料与方法
1.1实验材料
1.1.1实验动物 本实验采用SPF级雌性C57BL/6小鼠,周龄6~7周,体重(18.29±1.41)g,购于济南朋悦实验动物繁育中心。饲养于室温 22~26℃,相对湿度45%~55%的IVC动物层流柜。
1.1.2药物 中药黄芪购自山东省人民药业有限公司(批号160909),经该公司鉴定为豆科植物黄芪的干燥根部切片。称取适量的黄芪生品,常规法水煎、醇沉、回收乙醇,制成含黄芪生药0.0625 g/ml原液,灭菌后储存于4℃冰箱,用于小鼠常规饮用给药。
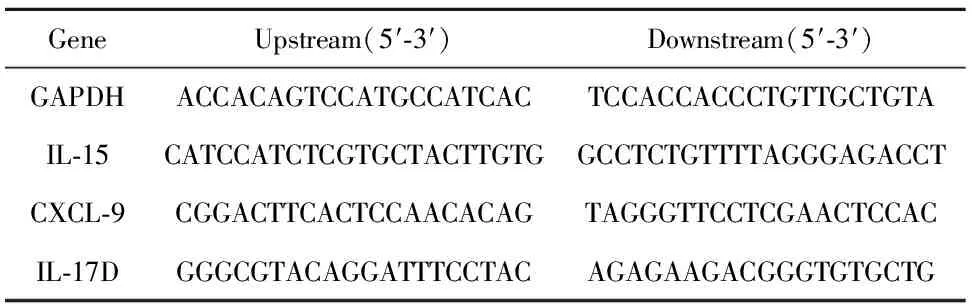
1.1.3主要试剂与仪器 RNA提取所用试剂:总RNA提取试剂Trizol Reagent(LOT03877/10125)购自北京康为世纪生物科技有限公司;DEPC水(LJ0113B2011T)购自AMRESCO公司。无水乙醇、异丙醇、氯仿等试剂购自天津市鑫达医药化工试剂有限公司。Reverse Transcription PCR(RT-PCR)所用试剂:M-MLV购于Fermentas公司;Oligo dT购于Thermo Scientific公司;RNA酶抑制剂、dNTP、2×Taq Master DNA聚合酶等试剂均购于北京康为世纪生物科技有限公司;内参磷酸甘油醛脱氢酶(GAPDH)、CXCL-9、IL-15等引物(见表1)均由上海铂尚生物技术有限公司合成。佛波酯(Phorbol myristate acetate,PMA)、离子霉素(Ionomycin)和蛋白转录抑制剂(BFA)均购自Sigma 公司。PE-Cy5-CD3、PE-NK1.1、PE-IL-17D等大鼠抗小鼠抗体均购自美国BD公司。FACS verse流式细胞仪购自美国BD公司。
表1引物序列
Tab.1Primersequence
GeneUpstream(5′⁃3′)Downstream(5′⁃3′)GAPDHACCACAGTCCATGCCATCACTCCACCACCCTGTTGCTGTAIL⁃15CATCCATCTCGTGCTACTTGTGGCCTCTGTTTTAGGGAGACCTCXCL⁃9CGGACTTCACTCCAACACAGTAGGGTTCCTCGAACTCCACIL⁃17DGGGCGTACAGGATTTCCTACAGAGAAGACGGGTGTGCTG
1.2实验方法
1.2.1实验分组及模型建立 将C57BL/6雌性小鼠随机分为4组,即正常对照组、B16模型组、B16模型+IL-17D滴鼻实验组、B16模型+黄芪组,每组6只。正常对照组自由饮水摄食。B16肺癌模型给予B16细胞2×105个/300 μl/只尾静脉注射。1周后,B16注射+IL-17D滴鼻实验组给予IL-17D制剂40 μl/只滴鼻,连续一周,B16模型+黄芪组给予黄芪制剂常规饮用至实验结束,剂量为0.062 5 g/(kg·d)。
1.2.2胞内外染色法检测IL-17D、NK细胞含量 实验结束后,无菌冲洗并分离小鼠肺脏,经研磨过滤制成肺组织单细胞悬液,RPMI1640重悬细胞并调整浓度至5×106个/ml,接种于24孔板,根据经典方法检测IL-17D、NK细胞含量[10]。主要步骤:PMA等刺激培养5 h后,收集细胞,1×PBS洗涤,封闭Fc受体,加入适量荧光抗体(PE-Cy5-CD3、PE-NK1.1),4℃避光孵育30 min,洗涤后,采用BD固定穿膜试剂盒穿膜固定,加入适量PE-IL-17D抗体,4℃避光孵育1 h,经穿膜缓冲液及PBS洗涤后,用流式细胞仪检测并分析NK细胞(CD3-NK1.1+)及IL-17D(IL-17D+)的比例和数量。
1.2.3RT-PCR法检测各细胞因子mRNA表达水平 根据TRIZOL201法提取肺组织总RNA;经ND-1000分光光度仪检测RNA的纯度与含量,调整RNA浓度进行RT反应;采用25 μl总反应体系经预变性、变性、退火、延伸等过程完成PCR反应;PCR扩增结束后采用1.5%琼脂糖凝胶(EB染色)水平电泳;使用Alpha凝胶成像系统显影:以GAPDH为内参照,计算目的基因片段相对表达量。
2 结果
2.1肺脏肿瘤诱导局部IL-17D及其NK细胞含量显著下降 在小鼠B16肺癌转移模型中,RT-PCR和流式细胞分析结果显示肺脏局部IL-17D基因转录水平和蛋白表达水平较野生型小鼠显著降低(P<0.01),结果见图1A~C。同时,小鼠肺肿瘤组织中NK细胞比例较正常对照小鼠明显减少(P<0.01),见图2A、B。
2.2IL-17D上调肺肿瘤组织NK细胞含量抑制肿瘤克隆形成 在小鼠肺癌模型中我们观察到IL-17D表达水平与NK细胞含量降低发生同步改变,为进一步证明肿瘤组织中IL-17D表达变化与NK细胞含量降低的直接关系,本研究采用IL-17D经鼻回补方法,在小鼠肺癌模型中,进一步观察IL-17D对肺脏NK细胞含量的影响及其肿瘤克隆的形成状态。结果显示:B16模型小鼠经IL-17D制剂滴鼻处理后,肺肿瘤克隆数较B16模型组明显减少(P<0.01),见图3A、B,同时,肺脏NK细胞含量显著升高(P<0.01),见图3C。由此我们推断,IL-17D是影响肺脏局部NK细胞含量的重要细胞因子,是肺脏NK细胞发挥抗肿瘤作用的重要分子基础。

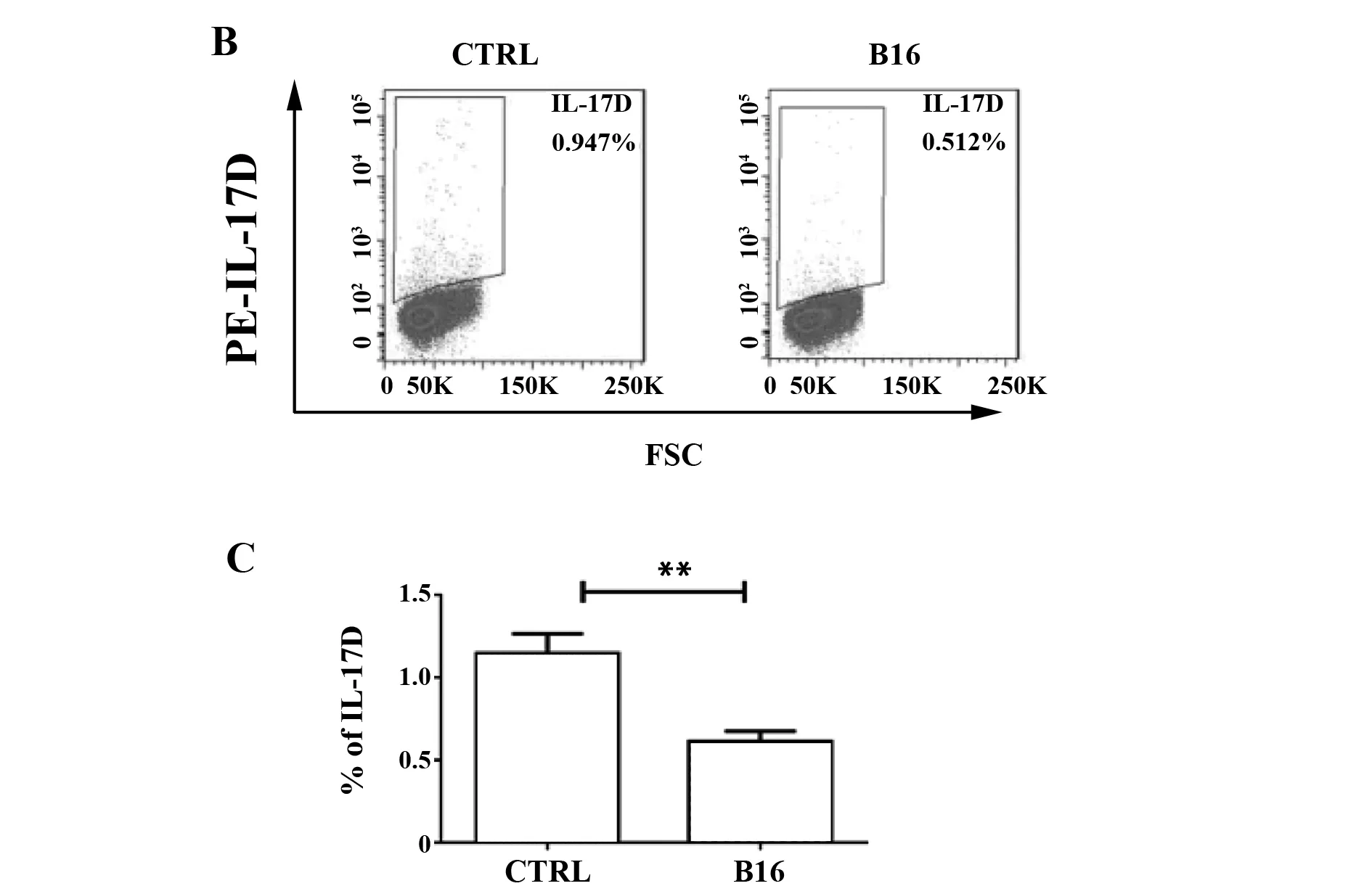
图1 B16肺转移模型中IL-17D表达下降 Fig.1 Reduction of IL-17D in lung with B16 melano-ma metastasisNote: **.P<0.01
2.3IL-17D上调肺脏CXCL9和IL-15表达 RT-PCR结果显示,IL-17D处理后,可显著提高肺癌组织中CXCL9、IL-15等NK细胞募集功能相关因子的表达水平(P<0.05),见图4。
2.4黄芪上调肺脏IL-17D表达和NK细胞含量和抑制肿瘤肺脏转移 流式细胞术结果显示,黄芪给药处理后,实验组小鼠较肿瘤模型对照组小鼠肺组织中的IL-17D及NK细胞数量明显增多(P<0.05),图5A、B,肺脏B16黑色素瘤转移灶的形成受到明显抑制(P<0.01),见图5C、D。
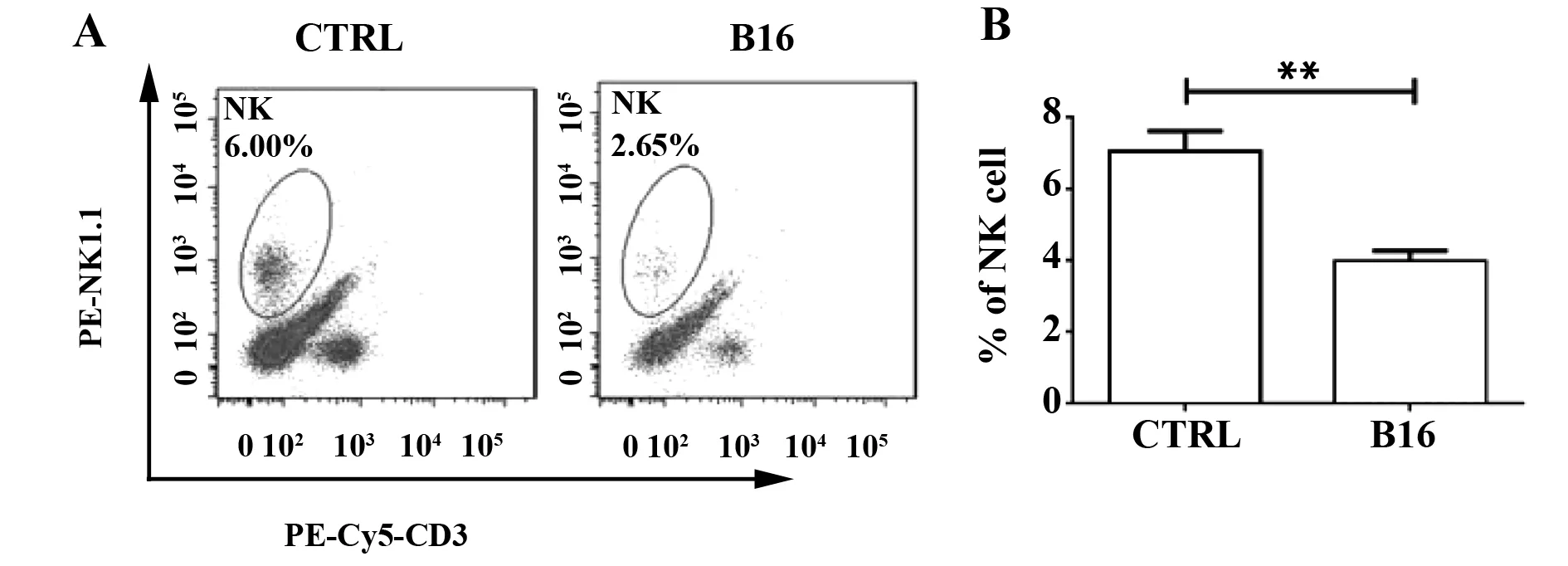
图2 B16肺转移模型中肺脏NK细胞含量显著下降Fig.2 Decreased lung resident NK cells in lung with B16 melanoma metastasisNote: **.P<0.01.
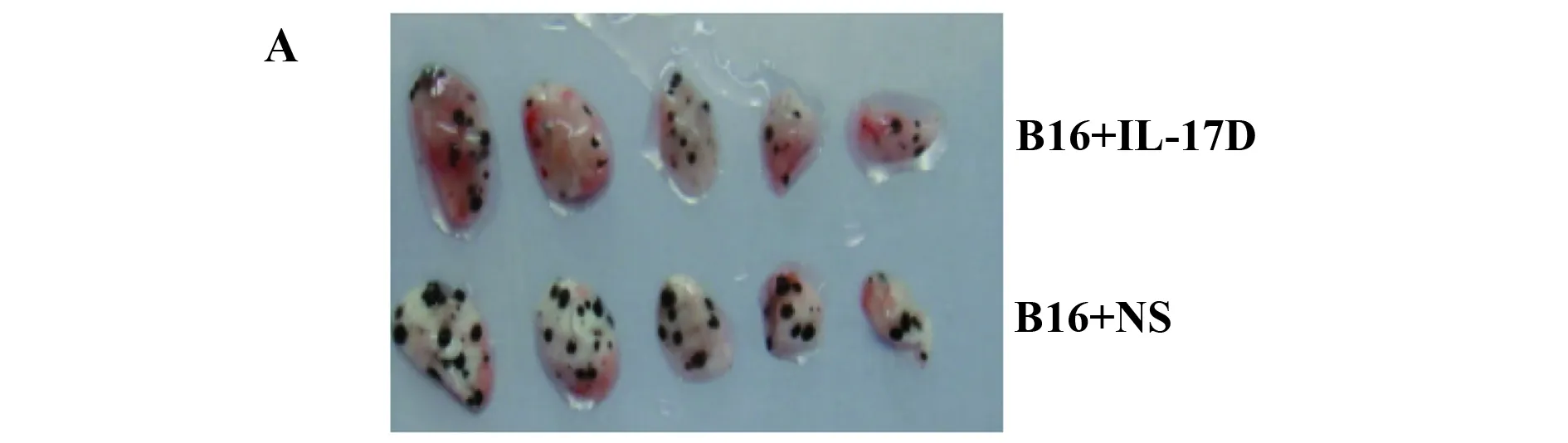

图3 IL-17D可增加肺脏NK细胞含量减少B16肺转移克隆形成Fig.3 Up-regulation of lung resident NK cells and reduction of lung tumor foci after IL-17D nasal-treatment in B16 melanoma metasta-sis modelNote: **.P<0.01.
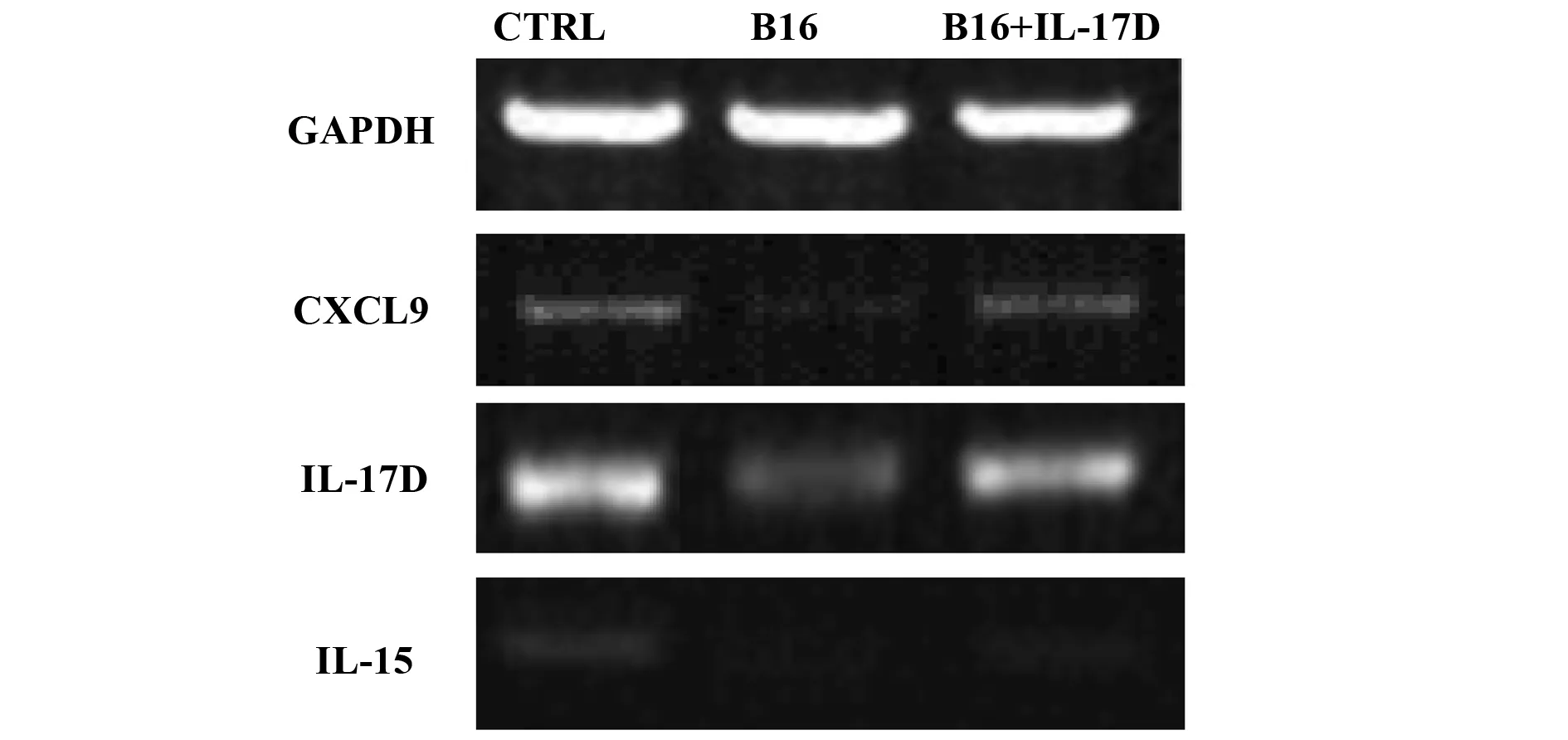
图4 IL-17D上调肺脏CXCL9和IL-15的表达Fig.4 IL-17D promotes CXCL9 and IL-15 production in lung


图5 中药黄芪对肺脏IL-17D、NK细胞和B16肺转移克隆形成的影响Fig.5 Effects of Astragalus (AG) on lung IL-17D production,proportion of NK cells and lung tumor fociNote: *.P<0.05,**.P<0.01.
3 讨论
NK细胞具有免疫清除和免疫监视的功能,可快速杀伤病毒感染细胞及肿瘤细胞,是机体天然免疫系统的重要组成部分之一。NK细胞通过分泌IFN-γ、穿孔素、颗粒酶等细胞因子发挥强大的抗肿瘤效应,并通过分泌多种细胞因子启动获得性免疫反应,发挥多种抗感染免疫协同作用。NK细胞在体内不同组织器官分布状态不同,多依据局部组织中细胞因子或趋化因子微环境不同而不同。肺脏因常常应对外界危险物质的威胁,包括病原微生物、毒素、过敏原和尘埃的反复刺激,同时,又面临突变细胞的转移等各种危险,因此,需要大量的NK细胞发挥其抗炎抗肿瘤作用,主导或参与维持局部微环境的稳定,这也使肺脏成为了NK细胞大量聚集的重要器官之一。NK细胞在肺脏免疫内环境的稳定中起着关键作用,也成为肺脏拮抗肿瘤转移的主力细胞群体。肺脏局部驻留NK细胞的多少,直接决定肺脏免疫微环境的稳定,特别是影响肺脏抗肿瘤形成的能力。肺脏局部NK细胞表型不同且功能各异[11]。具有抗肿瘤效应的肺脏NK细胞高表达CXCR3,可与组织局部CXCL9、CXCL10、CXCL11等趋化因子相互作用,控制NK细胞肺脏驻留。同时,微环境中IL-15等细胞因子可维持NK细胞在局部募集并生存。这些细胞因子和趋化因子成为肺脏对NK细胞募集能力的重要标志,是肺脏NK细胞驻留的重要分子基础,针对这些细胞因子,寻找调控他们并且与他们发生同步变化的细胞因子,可以获得调控NK细胞肺脏募集能力的关键调控节点,同时也将为改善并促进肺脏NK细胞抗炎抗肿瘤能力提供新的重要策略。
IL-17家族作为黏膜组织最敏感的感受器,其家族成员能趋化多种免疫细胞至炎症灶或癌巢发挥抗炎、抗肿瘤效应,IL-17家族作为多种细胞趋化的关键,其中多个家族成员的功能目前已被广泛研究。但是关于IL-17D的功能调控,目前研究较少。已知IL-17D在肺脏和骨骼肌高表达,肿瘤细胞自身分泌的IL-17D可刺激肿瘤内皮细胞招募NK细胞到肿瘤组织,并促进M1巨噬细胞的发育和抗肿瘤的适应性免疫反应[12],但肺脏IL-17D对局部NK细胞募集能力的影响尚未见报道。
我们研究发现,肺脏局部IL-17D表达水平与肺脏NK细胞含量密切相关。在小鼠B16黑色素瘤肺转移模型中,IL-17D表达骤降,并且NK细胞含量显著降低;进一步研究发现,在肺肿瘤中缺失的NK细胞,通过IL-17D经鼻回补处理又回归肺脏,并显著抑制了肺转移肿瘤克隆的形成,这一结果证明了IL-17D可以调控NK细胞在肺脏的募集。同时,黄芪上调肺脏IL-17D表达和NK细胞含量这一实验也进一步证实了以上结论。
通过实验,我们进一步证明了IL-17D可明显上调CXCL9和IL-15表达,从而为NK细胞的肺脏募集创造了适宜的细胞因子微环境,从而使肺脏拥有足够的NK细胞发挥抗肿瘤作用。IL-17D通过调控什么信号来左右趋化因子的表达从而影响NK细胞的募集和驻留,这一问题尚需进一步研究。
中医中药作为我国传统智慧的结晶,成为抗肿瘤治疗的关注焦点。近年来,许多学者在中医药与肿瘤免疫方面进行了广泛而深入的研究,许多中药材可通过增强或恢复癌症患者免疫功能以达到抗肿瘤的目的。大量研究已证实:黄芪作为一味补益良药具有补肺健脾、益肾脱毒之功效。研究表明黄芪及其有效成分可通过多种途径调节机体免疫功能,同时具有抗病毒感染、抗肿瘤等作用[13,14]。现代药理学研究表明,黄芪中含量最多的有效成分黄芪多糖能促T淋巴细胞转化、刺激 NK 细胞的细胞毒活性反应[15],同时还有抗衰老辐射、抗氧化应激等作用[16]。研究表明黄芪单独应用具有一定的抗肿瘤作用,当与化疗药联合用药时具有增效解毒之益处[17]。
我们研究发现中药黄芪补益肺气的免疫药理基础之一就是提高肺脏局部组织IL-17D的表达,从而提高肺脏NK细胞的募集能力,进而抑制肿瘤的形成,从分子和细胞以及整体动物层面,明确了黄芪补益肺气的组织特异性药理药效的免疫学基础。同时也佐证了黄芪补肺气的关键之一是上调IL-17D的表达,从而改变肺脏NK细胞的募集,发挥抗肿瘤作用。由此,围绕IL-17D和NK细胞,我们明确了黄芪补益肺气的部分免疫药理学作用机制,拓展了传统中药黄芪的免疫调节及抗肿瘤药用价值,再次确认了IL-17D在肺脏NK细胞募集效应中的主导地位,也为肿瘤的中药免疫治疗提供了新的思路。
[1] Brandtzaeg P,Pabst R.Let′s go mucosal:communication on slippery ground [J].Trends Immunol,2004,25(11):570-577.
[2] 陈力川,汪思亮,余苏云,等.NK细胞在肿瘤免疫治疗中的研究进展[J].肿瘤,2017,37(1):101-106.
Chen LC,Wang SL,Yu SY,etal.Progress in natural killer cells for tumor immunotherapy[J].Tumor,2017,37(1):101-106.
[3] Gregoire C,Chasson L,Luci C,etal.The trafficking of natural killer cells[J].Immunol Rev,2007,220:169-182.
[4] Thapa M,Kuziel WA,Carr DJ.Susceptibility of CCR5-deficient mice to genital herpes simplex virus type 2 is linked to NK cell mobilization [J].J Virol,2007,81(8):3704-3713.
[5] Wang J,Li F,Zheng M,etal.Lung natural killer cells in mice:phenotype and response to respiratory infection[J].Immunology, 2012,137:37-47.
[6] Pappu R,Ramirez-Carrozzi V,Sambandam A.The interleukin-17 cytokine family:critical players in host defence and inflammatory diseases[J].Immunology,2011,134(1):8-16.
[7] Statues T,Broxmeyer HE,Robertson MJ,etal.Cutting edge:IL-17 D.a novel member of the IL-17 family.stimulates cytokine production and inhibits hemopoiesis [J].J Immunol,2002,169(2):642-646.
[8] 李淑芳.中药黄芪药理作用研究进展[J].湖北中医杂志,2013,35(6):73-75.
Li SF.Research progress on pharmacological action of astragalus[J].Hubei J Traditional Chin Med,2013,35(6):73-75.
[9] 颜 婕,周思敏,田怀军,等.黄芪对缺氧小鼠抗运动疲劳作用的效果研究[J].现代生物医学进展,2013,13(15):2809-2812.
Yan J,Zhou SM,Tian HJ,etal.Study of astragalus on the anti-fatigue effect in hypoxic mice[J].Progress Modern Biomed,2013,13(15):2809-2812.
[10] 郑晓丹,郭钰琪,张洪海,等.辐射损伤后T细胞亚群的免疫重建特点及中药山茱萸的调节作用[J].中国免疫学杂志,2015,31(6):769-773.
Zheng XD,Guo YQ,Zhang HH,etal.The characteristic of immunological reconstitution of T cell subsets after irradiation and the immunoregulatory activity of Chinese medicinal herb cornus[J].Chin J Immunol,2015,31(6):769-773.
[11] Wang J,Li F,Zheng M,etal.Lung natural killer cells in mice:phenotype and response to respiratory infection [J].Immunology,2012,137(1):37-47.
[12] O′Sullivan T,Saddawikonefka R,Gross E,etal.Interleukin-17D mediates tumor rejection through recruitment of natural killer cells [J].Cell Rep,2014,7(4):989.
[13] 张 蔷,高文远,满淑丽.黄芪中有效成分药理活性的研究进展[J].中国中药杂志,2012,37(21):3203-3207.
Zhang Q,Gao WY,Man SL.Chemical composition and pharmacological activities of Astragali Radix[J].China J Chin Materia Med,2012,37(21):3203-3207.
[14] 朱燕辉,严奉祥.黄芪甲苷及其生物学活性[J].现代生物医学进展,2008,8(4):781-783.
Zhu YH,Yan FX.Astragaloside IV and Its Biological Activity[J].Progress Modern Biomed,2008,8(4):781-783.
[15] 王永海,邢建群,寇丽春,等.黄芪多糖对非小细胞肺癌放疗患者免疫功能的影响[J].长春中医药大学学报2015,31 (3):554-555.
Wang YH,Xing JQ,Kou LH,etal.Effects of astragalus polysaccharides on immune function of patients with radiotherapy for non-small cell lung cancer[J].J Changchun University Traditional Chin Med,2015,31(3):554-555.
[16] 左 军,张文钊,胡晓阳,等.黄芪现代药理及临床研究进展[J].中医药信息,2014,31(1):111-112.
Zuo J,Zhang WZ,Hu XY,etal.Modern pharmacology and clinical research progress of astragalus[J].Information on Traditional Chin Med,2014,31(1):111-112.
[17] Luo T,Qin J,Liu M,etal.Astragalus polysaccharide attenuates lipopolysaccharide-induced inflammatory responses in microglial cells:regulation of protein kinase B and nuclear factor-κB signaling.[J].Inflammation Res,2015,64(3-4):205-212.